Роль рецепторов PD-1 и PD-l1 в развитии системного воспалительного ответа и методы иммуноадъювантной терапии
Автор: Ханова Марьям Юрисовна, Григорьев Е.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Обзоры
Статья в выпуске: 3 т.23, 2019 года.
Бесплатный доступ
Методы поддерживающей терапии позволяют пациентам с травмой или сепсисом преодолеть начальную гипервоспалительную стадию, за которой следует иммуносупрессия. Критичность индуцированной системным воспалительным ответом иммуносупрессии заключается в повышенной восприимчивости пациента к вторичным нозокомиальным инфекциям и высокой вероятности прогрессирования в полиорганную недостаточность. Активно исследуется роль рецептора PD-1 в формировании индуцированной иммуносупрессии при системном воспалительном ответе. Одним из механизмов иммуносупрессии является истощение Т-клеток, опосредованное ингибирующим рецептором PD-1. Путь PD-1/PD-L1 выполняет регуляцию аутоиммунитета, опухолевого иммунитета, трансплантационного иммунитета, аллергии, иммунопатологии. В работе обобщены результаты экспериментальных работ, демонстрирующие, что блокирование взаимодействия PD-1 с его лигандом PD-L1 устраняет дисфункцию Т-клеток и улучшает выживаемость при сепсисе на животных моделях. Описан один клинический случай применения ан-TO-PD-1-терапии для лечения критического пациента с зафиксированным улучшением на фоне терапии. Также оцениваются нежелательные побочные эффекты такой терапии. Тем временем в клинику введены ингибиторы иммунных контрольных точек для лечения некоторых форм рака. Тенденции увеличения экспрессии рецептора PD-1 при системном воспалительном ответе рассматриваются как возможный прогностический маркер. Цель обзора - оценить состояние проблемы лечения и выживания пациентов с индуцированной системным воспалительным ответом иммуносупрессией с позиции иммунотерапии блокирования контрольных точек PD-1/PD-L1. Для обзора использованы соответствующие тематике статьи, найденные в базах данных PubMed, PMC по ключевым словам: PD-1; anti-programmed cell death-1; immunosuppressive; system inflammatory response, sepsis.
Индуцированная иммуносупрессия, истощение т-лимфоцитов, системный воспалительный ответ, анти-pd-1-терапия
Короткий адрес: https://sciup.org/142230707
IDR: 142230707 | DOI: 10.21688/1681-3472-2019-3-76-83
Текст научной статьи Роль рецепторов PD-1 и PD-l1 в развитии системного воспалительного ответа и методы иммуноадъювантной терапии
Ханова М.Ю., Григорьев Е.В. Роль рецепторов PD-1 и PD-L1 в развитии системного воспалительного ответа и методы иммуноадъювантной терапии. Патология кровообращения и кардиохирургия. 2019; 23(3):76-83. http://
Актуальность
Гипотеза течения системного воспалительного ответа, предложенная R.C. Bone [1], включает в себя одновременное развитие разнонаправленных про- и противовоспалительных реакций. Благодаря современным методам поддерживающей терапии большинству пациентов с травмой или сепсисом удается пережить доминирующую на ранних этапах гипервоспалительную фазу и перейти в длитель- ную стадию иммуносупрессии, которая проявляется как неспособность иммунной системы формировать полноценный иммунный ответ [2, 3].
Одним из механизмов индуцированной иммуносупрессии является истощение Т-лимфоцитов, опосредованное сверхэкспрессией молекулы PD-1 [4–6]. Истощенные Т-лимфоциты — клетки, не способные пролиферировать, продуцировать цитокины и вызывать цитотоксическую гибель клеток- мишеней [5, 7]. Это состояние дисфункции клеток подтверждается несостоятельностью бактериального клиренса в отношении первичной инфекции и высоким риском реактивации латентного вируса, а также повышенной восприимчивостью пациентов к вторичным нозокомиальным инфекциям, которые часто индуцируются условно патогенными микроорганизмами [8, 9].
Цель обзора — оценить состояние проблемы лечения и выживания пациентов с индуцированной системным воспалительным ответом иммуносупрессией с позиции иммунотерапии блокирования контрольных точек PD-1/PD-L1.
Для обзора использованы соответствующие тематике статьи, найденные в базах данных PubMed, PMC по ключевым словам: PD-1; anti-programmed cell death-1; immunosuppressive; system inflammatory response, sepsis.
Общая характеристика рецепторов системы PD-1
Система негативной регуляции Т-клеточных ответов состоит из коингибирующих рецепторов — белка запрограммированной гибели клеток PD-1 (Programmed cell death-1 или CD279) и двух его лигандов PD-L1 (B7-H1) и PD-L2 (B7-DC). Все эти молекулы относятся к семейству рецепторов B7:CD28, которое характеризуется наличием ингибирующей ITIM-последовательности в составе внутриклеточного домена [10].
Лигирование PD-1 ингибирует пролиферацию Т-лимфоцитов, выживаемость и эффекторные функции (цитотоксичность, секреция цитокинов), индуцирует апоптоз Т-клеток, способствует дифференцировке наивных CD4+ Т-клеток в FOXP3+ регуляторные Т-клетки, которые вносят вклад в формирование иммуносупрессивной среды [3, 11].
Путь PD-1/PD-L1 выполняет регуляцию аутоиммунитета, опухолевого иммунитета, трансплантационного иммунитета, аллергии, иммунопатологии [5].
Одним из механизмов ингибирования Т-лимфоцитов является конкуренция PD-L1 с CD28 за взаимодействие с лигандом СD80, которое обеспечивает ко-стимулирующий сигнал, необходимый для активации [12]. Связывание PD-1 и PD-L1/PD-L2 индуцирует фосфорилирование молекул ITIM и ITSM с последующим рекрутированием фосфотаз SHP-1 и SHP-2, которые ингибируют сигнальный путь T-кле- точного рецептора (TCR) через молекулы, участвующие в активации и пролиферации Т-лимфоцитов, такие как PI3K, Akt, ZAP-70 и PKC-θ [7, 13] (рисунок).
Рецептор PD-1 экспрессируется на В-клетках, моноцитах, естественных киллерах (NKs), дендритных клетках (DCs) [5, 14, 15] и активированных CD4+ и CD8+ Т-лимфоцитах [16]. Экспрессия PD-1 на Т-клет-ках может быть индуцирована как TCR-опосредованной активацией, то есть антиген-специфически, так и неспецифически — посредством γ-цепных цитокинов IL-2, IL-7, IL-15 и IL-21 [17]. PD-L1 экспрессируется на В-клетках, DCs, макрофагах, культурах тучных клеток, полученных из костного мозга, и Т-клетках [16, 18]. Экспрессия PD-L2 ограничена относительно небольшим количеством клеток и тканей, в основном DCs и макрофагами [16, 18]. IL-10 способен индуцировать экспрессию PD-L1 на моноцитах, в то время как экспрессию PD-L2 на DCs стимулируют IL-4 и GM-CSF [19].
Роль системы PD-1 в сепсисе, возможность применения в качестве прогностического маркера
Сепсис, как состояние постоянной антигенной стимуляции, может привести к повышенной экспрессии ингибирующих рецепторов, таких как PD-1, CTLA-4, LAG-3 [3, 7]. Роль молекулы PD-1 на клинически значимой модели сепсиса впервые описана X. Huang и коллегами. Так, у мышей, нокаутных по PD-1, продемонстрированы увеличение выживаемости на 7-й день после сепсиса, улучшение бактериального клиренса и умеренное повреждение органов в сравнении с мышами дикого типа. Причем за первые 4 сут. ни одна из PD-1-/-мышей не умерла, что подтверждает, что дефицит PD-1 может эффективно защитить мышей от ранней смерти при сепсисе [20].
Подобный эффект, такой как улучшение выживаемости, при сепсисе также наблюдалось у мышей, дефицитных по PD-L1. Данное исследование продемонстрировало, что воспалительный ответ на сепсис у мышей с дефицитом B7-H1 менее выражен, чем у мышей дикого типа. Однако бактериальная нагрузка у двух групп не отличалась [21].
За исследованием X. Huang и коллег появились работы, в которых показали повышенную экспрессию молекулы PD-1 и его лигандов, взаимосвязь с исходами, с целью применения этих молекул как прогностического маркера.
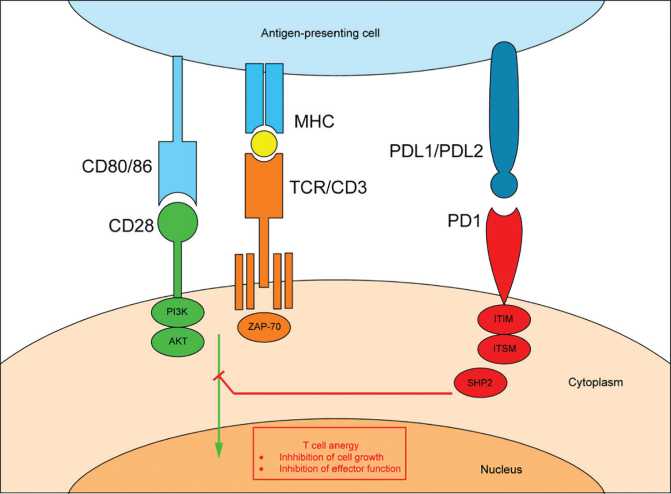
Схема взаимодействия PD-1 и PD-L1. Лигирование PD-1 индуцирует фосфорилирование молекул ITIM и ITSM с последующим рекрутированием фосфотаз SHP-1 и SHP-2, которые в конечном итоге дефосфорилируют передачу сигналов через путь PI3K и нисходящие сигналы через Akt
Примечание. MHC — главный комплекс гистосовместимости; TCR — Т-клеточный рецептор; CD28 — кости-мулирующий рецептор Т-клеток; CD80/86 — рецептор антигенпрезентирующих клеток, осуществляет ко-стиму-лирующий сигнал; PD-1 — белок запрограммированной гибели клеток (Programmed cell death 1), PD-L1/PD-L2 — лиганды PD-1; ITIM – иммунорецепторный ингибиторный мотив на основе тирозина; ITSM — иммунорецептор-ный мотив переключения на основе тирозина; SHP-1 и SHP-2 цитоплазматические протеинтирозинфосфатазы; Akt — протеинкиназа; PI3K — фосфоинозитид-3-киназа; ZAP-70 — протеинкиназа 70, связанная с дзета-цепью, является частью TCR
Роль PD-1 в системном воспалительном ответе меняется в зависимости от стадии развития этого патологического процесса. На ранней гипервоспалительной стадии увеличение экспрессии ингибирующих молекул позволяет предположить их благоприятное влияние на ограничение аутологичного повреждения вследствие чрезмерной воспалительной реакции [20]. При переходе пациента на последующую противовоспалительную стадию сверхэкспрессия PD-1 может внести вклад в ингибирование иммунного ответа, что ведет к иммуносупрессии [8].
У септических пациентов наблюдается увеличение уровня экспрессии PD-1 CD4+ и CD8+ Т-клетка-ми и PD-L1 моноцитами [4, 21–28]. Также увеличивается процент T-лимфоцитов, экспрессирующих PD-1, и моноцитов, экспрессирующих PD-L1, по сравнению с группой SIRS и группой здоровых добровольцев [28].
Так, A. Tomino с соавт. наблюдали значительную лимфопению, повышение экспрессии PD-1 CD4+ Т-клетками и уменьшение разнообразия TCR у пациентов с септическим шоком на ранних стадиях развития системного воспалительного ответа по сравнению со здоровыми добровольцами. На 7-й день отмечена нормализация данных показателей, за исключением пациентов с летальным исходом [22].
У пациентов на раннем этапе септического шока увеличение уровня экспрессии PD-L1 на моноцитах связано с увеличением числа вторичных внутрибольничных инфекций и смертностью после септического шока, а также с увеличением концентрации циркулирующего IL-10 и снижением мито- ген-индуцированной пролиферации лимфоцитов [28]. Также экспрессия PD-L1 увеличивается на нейтрофилах в дополнение к моноцитам на животных моделях сепсиса [21].
R. Shao и соавт. в исследовании подчеркнули значение моноцитов в системе PD-1. Действительно, для прогнозирования смертности выявлена корреляция не с PD-1 на лимфоцитах, а с экспрессией PD-L1 на моноцитах, которая служила независимым предиктором 28-дневной смертности в многомерном анализе у пациентов с септическим шоком. Лучшим фактором для прогнозирования была комбинированная оценка, включающая балл SAPS II и экспрессию PD-L1, что иллюстрирует значимость начальной тяжести и иммуносупрессии при сепсисе [23].
Анти-PD-1-терапия в экспериментальных моделях сепсиса
С учетом того что дисбаланс иммунной системы, в частности истощение Т-лимфоцитов, в патогенезе системного воспалительного ответа может лишь частично объяснить высокую заболеваемость и смертность, предполагается, что обращение истощенных Т-клеток путем блокирования пути PD-1/ PD-L1 может повысить выживаемость.
В модели полимикробного сепсиса у мышей продемонстрированно значительное увеличение экспрессии PD-1 на CD4+ и CD8+ селезеночных Т-лимфоцитах через 48 ч после сепсиса. Блокирование молекулы PD-1 предотвратило потерю жизнеспособных иммунных клеток селезенки путем ингибирования апоптоза лимфоцитов, улучшило продукцию IL-6 спленоцитами и увеличило 7-дневную выживаемость при внутрибрюшном сепсисе. Интересно, что отсроченное введение анти-PD-1-антител через 24 ч после индукции сепсиса, что является терапевтическим преимуществом, улучшило иммунную функцию и выживаемость [29].
В клинически значимой модели сепсиса у мышей, у которых развилась вторичная внутрибольничная грибковая инфекция, подтверждена эффективность анти-PD-L1-терапии на основе пептида короткого действия (соединение 8 — пептид, состоящий из 29 аминокислот, который блокирует передачу сигналов PD-L1). Через 4 дня после грибковой инфекции экспрессия PD-1 и PD-L1 заметно повышена на CD4+ Т-клетках, NK и NKT у мышей с сепсисом и у ложноо-перированных мышей. Введение соединения 8 увеличило выживаемость в два раза, по сравнению с группой, которой вводили неактивный пептид [30]. Эта работа продемонстрировала, что анти-PD-L1-те-рапия значительно улучшает выживаемость в модели сепсиса с двумя ударами, хорошо имитирующей возникновение внутрибольничной инфекции.
K. Chang с соавт. на моделях первичного и вторичного, возникающего после сублетальной перевязки и пункции слепой кишки, грибкового сепсиса исследовали влияние иммуноадъювантной анти-PD-1 и анти-PD-L1-терапии на выживаемость.
При вторичной внутрибольничной инфекции введение анти-PD-1 и анти-PD-L1-антител вызывало приблизительно двукратное улучшение 14-дневной выживаемости при грибковом сепсисе по сравнению с контрольной группой, получавшей физиологический раствор. При этом не выявлено разницы при введении этих двух антител. При первичном грибковом сепсисе также продемонстрировано улучшение выживаемости по сравнению с контрольными животными. Однако ингибирование пути PD-1/PD-L1 показало двукратное увеличение выживаемости по сравнению с блокадой еще одной ингибирующей молекулы CTLA-4.
Одним из потенциальных механизмов защитного действия анти-PD-1 и анти-PD-L1-антител является увеличение продукции спленоцитами IFN-γ, а также увеличение процента IFN-γ положительных CD4+ и CD8+ Т-клеток.
Также выявлено, что введение анти-PD-1-антител стимулирует выработку провоспалительного цитокина IL-6 и иммуносупрессивного цитокина IL-10. Увели- чение спленоцитами производства IL-10 было менее значительно по сравнению с выраженным влиянием анти-PD-1-антител на продукции IFN-γ.
Уменьшение экспрессии MHCII на дендритных клетках, которое произошло при грибковом сепсисе, обращено как при анти-PD-1, так и анти-PD-L1-тера-пии, однако значительное увеличение экспрессии MHCII наблюдалась при анти-PD-L1-терапии. Подобный эффект на макрофаги оказала только анти-PD-L1-терапия [31].
Подтверждение получила комбинированная терапия, которая, помимо таргетного воздействия на ингибирующие контрольные точки, предполагает поддержание эффекторного звена для осуществления иммунного надзора.
Y. Shindo с соавт. на клинически значимой модели сепсиса у мышей продемонстрировали более высокую 9-дневную выживаемость при комбинированной терапии IL-7 и анти-PD-1, по сравнению с монотерапией, лечением IL-7 и анти-PD-1, а также мышами, получавшими физиологический раствор. Комбинация иммуноадъювантов оказывает различное влияние на ключевые иммунологические медиаторы и функции клеток, такие как экспрессия CD28, MHCII, LFA-1 и VLA-4 (молекулы адгезии на Т-клетках), пролиферация Т-лимфоцитов и продукция IFN-γ. Эти результаты предполагают потенциальное применение комбинированной терапии с использованием IL-7 и анти-PD-1 в лечении сепсиса [32].
Сочетание лечения IL-2 с блокадой пути ингибирования PD-1 имело значительные синергетические эффекты в усилении вирус-специфических ответов CD8+ T-клеток и снижении вирусной нагрузки. Интересно, что снижение вирусной нагрузки произошло, несмотря на увеличение количества регуляторных Т-клеток. Эти результаты позволяют предположить, что комбинированная терапия IL-2 и блокада PD-L1 заслуживают рассмотрения в качестве схемы лечения хронических инфекций и онкологических процессов [33].
Среди лигандов PD-1 более обширной распространенностью обладает PD-L1, что и делает его основным регуляторным контррецептором для ингибирующей функции PD-1, поэтому в качестве терапевтической мишени предложена анти-PD-L1-терапия. Введение анти-PD-L1-антител предотвращало вызванное сепсисом истощение лимфоцитов, уменьшало апоптоз лимфоцитов в селезенке и тимусе у септических мышей in situ и значительно улучшило выживаемость. Также наблюдалось увеличение лимфоцитов, продукции фактора некроза опухолей (TNF-α) и IL-6, уменьшение продукции IL-10 и улучшение бактериального клиренса [24].
Многочисленные независимые исследователи сообщают, что блокада пути PD-1/PD-L1 восстанавливает эффекторную функцию Т-клеток, увеличивает продукцию IFN-γ, предотвращает апоптоз и улучшает выживаемость при различных патологических моделях сепсиса.
С течением времени у пациентов с сепсисом экспрессия PD-1 на CD8+ Т-клетках увеличивалась, в то время как экспрессия PD-L1 снижалась в период пребывания в отделении интенсивной терапии. Введение анти-PD-1 или анти-PD-L1-антител показало значительное снижение сепсис-индуцирован-ного апоптоза лимфоцитов in vitro . Инкубация лимфоцитов с анти-PD-1/PD-L1-антителами увеличила продукцию IFN-γ и IL-2, нарушенную сепсисом [25].
В эксперименте ex vivo CD4+ и CD8+ Т-клетки пациентов с сепсисом, вызванным бактериями с множественной лекарственной устойчивостью, анти-PD-L1-терапия увеличила продукцию IFN-γ [27].
Клинические испытания
Путь PD-1/PD-L1 играет важную роль при индуцированной СВО иммуносупрессии. Следовательно, таргетное воздействие на эти рецепторы является перспективным подходом для восстановления баланса иммунных реакций. Антитела, нацеленные на ингибирующие рецепторы, блокирующие взаимодействие с их лигандами, получили название ингибиторов иммунных контрольных точек. Некоторые ингибиторы пути PD-1/PD-L1 одобрены для клинического применения в терапии рака Управлением по контролю за продуктами и лекарствами США (FDA). Эффективные терапевтические результаты этих препаратов дают задуматься о возможности транслировать опыт в другие сферы.
Ниволумаб и пембролизумаб, ингибиторы PD-1, применяются для лечения немелкоклеточного рака легкого, метастатической меланомы, почечноклеточного рака, рецидивирующей или рефрактерной лимфоме Ходжкина [34-36], атезолизумаб, ингибитор PD-L1, — для лечения немелкоклеточного рака легкого [27]. Использование анти-PD-1-те-рапии в лечении сепсиса описано в единичных случаях. Так, использован ниволумаб, который представляет собой полностью человеческое мо- ноклональное антитело IgG4, которое избирательно блокирует связывание PD-1 с его лигандами PD-L1 и PD-L2, обладает высокой эффективностью [36].
D. Grimaldi и соавт. использовали иммуноадъю-вантную терапию IFN-γ в сочетании с ниволумабом (однократная доза) для лечения 30-летней пациентки с множественными травмами, инвазивным мукорми-козом, засвидетельствованной иммуносупрессией (низкий абсолютный уровень лимфоцитов, низкий уровень экспрессии HLA-DR моноцитами, повышенная экспрессия PD-1 Т-клетками), не реагирующей на традиционную терапию. На фоне терапии отмечено улучшение. Выписка пациента из отделения интенсивной терапии состоялась на 80-й день [26].
R.S. Hotchkiss и соавт. провели проспективное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование анти-PD-L1-терапии (BMS-936559) у септических пациентов с иммуносупрессией, задокументированной по абсолютному количеству лимфоцитов — не более 1 100 клеток/мкл. Целью исследования было оценить безопасность и переносимость в течение 90 дней однократной инфузии анти-PD-L1-антител (дозировка 10, 30, 100, 300, 900 мг) пациентами, а также фармокинетику антител и их влияние на иммунную функцию с оценкой динамики таких биомаркеров иммуносупрессии, как занятость рецепторов RO и уровень экспрессии HLADR моноцитами. В исследование включено 25 пациентов, 14 прошли 90-дневное наблюдение. В результате рандомизации опытная группа оказалась старше и имела большее количество дисфункций органов. Общая смертность составила 25% и не была связана с использованием антител. На фоне терапии у всех пациентов выявлены сыпь, гипотиреоз и диарея: у 75% — легкой и средней тяжести, у 17% — тяжелой. В одном случае отмечено увеличение ферментов поджелудочной железы. Развития вторичного цитокинового шторма в ответ на иммунотерапию не выявлено. Средний период полувыведения анти-PD-L1-антител варьировался от 29 (10 мг) до 189 ч (300 мг). Полная занятость рецептора поддерживалась до 8-го (10, 30, 100 мг) и 29-го дня (300, 900 мг). При двух самых высоких дозах наблюдалось явное увеличение экспрессии моноцитами HLA-DR, которое сохранялось в течение 28 дней. В целом ингибирование пути PD-1/PD-L1 у пациентов с сепсис-ассоциированной иммуносупрессией сопровождалось хорошей переносимостью [38].
Исследования на мышах после обнаружения PD-1 показали, что дефицит PD-1 вызывает повышенную частоту аутоиммунных заболеваний, приводящих к различным патологиям, таким как волчанка, диабет 1-го типа de novo , дилатационная кардиомиопатия и другие [39, 40]. Обычно такие побочные эффекты возникают при длительной блокаде пути PD-1/PD-L1.
Нежелательные явления, связанные с иммунитетом, дозозависимы и часты; они встречались у 90% пациентов, получавших антитела против CTLA-4 [4], и у 70% пациентов, получавших антитела против PD-1/ PD-L1 [41]. Большинство из этих нежелательных явлений можно контролировать путем противодействия активации лимфоцитов стероидами [42]. Однако необходимы дальнейшие исследования для определения безопасности анти-PD-1-терапии.
Заключение
Иммунное состояние пациентов отделений интенсивной терапии гетерогенное, достаточно сложное, изменчивое и нуждается в персонализации, что делает ведение таких пациентов непростой задачей. При этом сверхэкспрессия PD-1 и его лигандов является узнаваемой картиной, следовательно, ингибирование пути PD-1/PD-L1 может предотвратить истощение Т-лимфоцитов и повысить выживаемость пациентов. Для подтверждения этой гипотезы необходим анализ большого количества данных, а клинические исследования следует проводить с осторожностью и строгим контролем пациентов.
Несмотря на то что в лечении рака иммуномодулирующие препараты, такие как ингибиторы иммунных контрольных точек, получили одобрение для клинического применения, в лечении сепсиса эти препараты только на этапе клинических испытаний, поэтому исследователям предстоит ответить на ряд важных вопросов. На какой стадии сепсиса должна использоваться иммуномодулирующая терапия? На основании каких показателей иммунного статуса целесообразно назначать индивидуальную иммунотерапию? Как определять эффективность терапии и ее относительную безопасность? Вопрос применения анти-PD-1-терапии должен быть строго рассмотрен в клинических испытаниях для пациентов с опасным для жизни сепсисом, у которых есть очевидная иммуносупрессия.
Список литературы Роль рецепторов PD-1 и PD-l1 в развитии системного воспалительного ответа и методы иммуноадъювантной терапии
- Bone R.C. Immunologic dissonance: a continuing evolution in our understanding of the systemic inflammatory response syndrome (SIRS) and the multiple organ dysfunction syndrome (MODS). Ann Intern Med. 1996;125(8):680-7. DOI: 10.7326/0003-4819-125-8-199610150-00009 PMID: 8849154
- Григорьев Е.В., Шукевич Д.Л., Плотников Г.П., Кудрявцев А.Н., Радивилко А.С. Неудачи интенсивного лечения полиорганной недостаточности: патофизиология и потребность в персонификации (обзор литературы). Вестник интенсивной терапии имени А.И. Салтанова. 2019;2:48-57. https:// DOI: 10.21320/1818-474X-2019-2-48-57
- Григорьев Е.В., Матвеева В.Г., Шукевич Д.Л., Радивилко А.С., Великанова Е.А., Ханова М.Ю. Индуцированная иммуносупрессия в критических состояниях: диагностические возможности в клинической практике. Бюллетень сибирской медицины. 2019;18( 1 ):18-29. https:// DOI: 10.20538/1682-0363-2019-1-18-29
- Boomer J.S., To K., Chang K.C., Takasu O., Osborne D.F., Walton A.H., Bricker T.L., Jarman S.D. 2nd, Kreisel D., Krupnick A.S., Srivastava A., Swanson P.E., Green J.M., Hotchkiss R.S. Immunosuppression in patients who die of sepsis and multiple organ failure. JAMA. 2011;306(23):2594-2605. 10.1001/ JAMA.2011.1829 DOI: 10.1001/jama.2011.1829 PMID: 22187279
- Keir M.E., Butte M.J., Freeman G.J., Sharpe A.H. PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol. 2008;26:677-704. https://doi.om/ DOI: 10.1146/annurev.immunoL26.021607.090331 PMID: 18173375


