Роль температурного фактора в морфогенезе генеративных органов лиственницы сибирской (Larix sibirica)
Автор: Иванова А.Н., Голованова Т.И., Новоселова Н.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
В ходе исследования выявлено, что на морфогенез генеративных органов лиственницы сибирской оказывают влияние факторы внешней среды: низкие положительные температуры стимулируют воздействие на скорость прохождения материнскими клетками процесса мейоза.
Морфогенез, лиственница сибирская (larix sibirica), низкие положительные температуры, микроспороциты, мейоз
Короткий адрес: https://sciup.org/14083623
IDR: 14083623 | УДК: 57.085.23
Текст научной статьи Роль температурного фактора в морфогенезе генеративных органов лиственницы сибирской (Larix sibirica)
Способность молодых микроспор растений воспроизводить в условиях in vitro целостный организм открывает большие возможности экспериментального получения гаплоидных растений. Гаплоиды являются уникальным и перспективным объектом для клеточной селекции и генетической инженерии растений. Этой проблеме посвящено множество экспериментальных работ и обзорных статей [5, 8, 13, 14].
К настоящему времени накоплен значительный фактический материал по различным аспектам изучения этого явления у представителей различных семейств покрытосеменных растений. Однако не разработана эффективная система массового получения гаплоидов при культивировании мужских генеративных органов, не решены проблемы индукции и регенерации. Остаются неясными механизмы, обусловливающие смену программы развития микроспор с нормального пути созревания на вегетативный путь развития, через эмбриоидо- и каллусогенез в гаплоидное растение. Крайне мало данных по изучению морфогенеза мужских генеративных органов голосеменных.
Ряд исследователей отмечают, что непосредственными причинами морфогенеза являются физиолого-биохимические процессы, происходящие в индивидуальном развитии организма в определенных условиях внешней среды [1– 3, 5– 9, 11, 16, 17].
Одним из важнейших абиотических факторов, определяющих этапность онтогенеза и влияющих на фенотипическое проявление конкретного генотипа растения, являются низкие положительные температуры. Имеются данные о влиянии температурного фактора на становление полярности растительного организма, данный фактор используют как стрессор индукции андроклинии у покрытосеменных растений [8, 14].
Цель работы . Рассмотреть действие низких положительных температур как важный фактор культивирования мужских генеративных органов, при котором происходит высокий выход эмбриоидов.
Объекты и методы. В качестве объектов исследования использовали 30–35-летние деревья лиственницы сибирской, произрастающие на территории экспериментальной базы Института леса «Погорельский бор».
У опытных деревьев Larix sibirica собирали мужские гаметофиты (микростробиллы) с сентября 2003 по май 2004 г. Экспериментальные деревья были разделены на две группы по фенотипическим и морфологическим данным. В первую группу вошли деревья, пораженные лиственничной почковой галлицей, которые отличались от здоровых замедленным ростом и изреженной кроной (рис.1, а). У таких деревьев, как было показано И.Н. Третьяковой [10], идет нарушение мужской сексуализации, то есть превалируют женские шишки. Во вторую группу вошли деревья, не пораженные лиственничной почковой галлицей (рис. 1, б).

а б
Рис. 1. Лиственница сибирская (Larix sibirica Ledeb.): а – не пораженная лиственничной почковой галлицей; б – пораженная лиственничной почковой галлицей
Собранные мужские генеративные органы помещали на модифицированную среду Мурасиге-Скуга [16].
В ходе работы снимали показатели: время прорастания микроспор, размеры пыльцевой трубки; время прохождения мейоза; морфологические особенности материнских клеток микроспор на каждой стадии развития.
Эксперимент проводился в двух вариантах:
-
1. Часть мужских генеративных органов, собранных с поврежденных и неповрежденных деревьев, помещали в холодильник на трое суток, где температура поддерживалась в пределах + 4 Со, после чего переносили на среду MS.
-
2. Другую часть мужских генеративных органов, собранных с поврежденных и неповрежденных деревьев, сразу же помещали на модифицированную среду MS.
Схема проведения эксперимента представлена на рисунке 2.
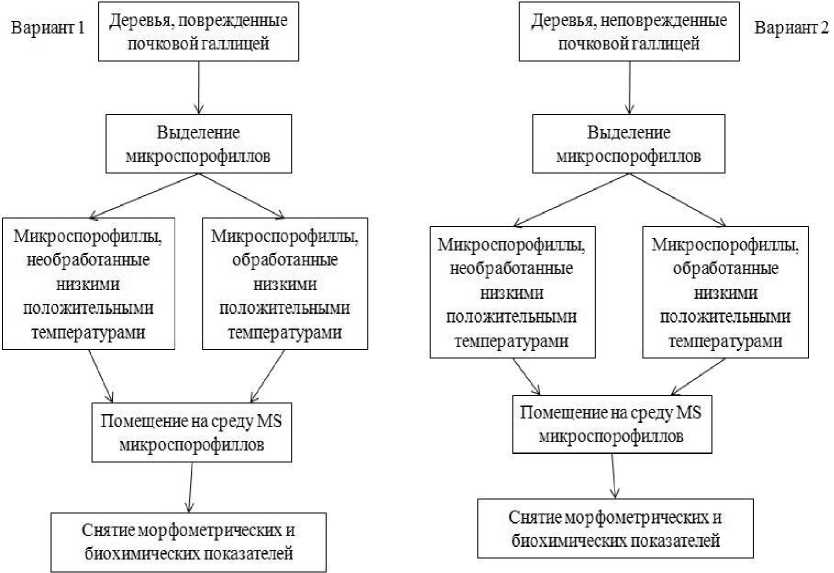
Рис. 2. Схема проведения эксперимента
Результаты и обсуждение. Данные по влиянию температурного фактора на развитие микроспороцитов Larix sibirica in vitro представлены в таблице 1. Необходимо отметить, что для анализа использовали материнские клетки микроспор, которые находились на различных стадиях развития: в осенне-зимний период – на стадии профазы I, в весенний период в микроспороцитах обнаруживалась сильная асинхронность прохождения мейоза (табл. 1), что характерно для хвойных.
Таблица 1
Влияние низких положительных температур на развитие микроспороцитов in vitro , собранных в разные периоды развития микростробил Larix sibirica
|
Дерево |
Месяц |
Сутки |
Метафаза I |
Анафаза I |
Телофаза I |
Интерфаза |
Тетрады |
Микроспоры |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Микростробилы, не обработанные низкими положительными температурами +4 Сo |
||||||||
|
нП |
Октябрь |
3 |
11,2 |
78,2 |
10,6 |
|||
|
5 |
0,1 |
99,9 |
||||||
|
7 |
0,1 |
10,2 |
89,7 |
|||||
|
Декабрь |
3 |
62,4 |
37,6 |
|||||
|
5 |
0,7 |
52,1 |
47,1 |
0,1 |
||||
|
7 |
0,3 |
21,9 |
77,8 |
|||||
|
14 |
0,1 |
99,9 |
||||||
|
Апрель |
3 |
100 |
||||||
Окончание табл. 1
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
П |
Октябрь |
3 |
35,6 |
64,4 |
||||
|
5 |
0,7 |
52,1 |
47,1 |
0,1 |
||||
|
7 |
0,3 |
21,9 |
77,8 |
|||||
|
14 |
0,1 |
99,9 |
||||||
|
Декабрь |
3 |
78,2 |
11,2 |
10,6 |
||||
|
5 |
0,1 |
75,3 |
24,6 |
|||||
|
7 |
10,3 |
89,7 |
||||||
|
14 |
100 |
|||||||
|
Апрель |
3 |
100 |
||||||
|
Микростробилы, об |
работанные низкими положительными температурами +4 Сo |
|||||||
|
нП |
Октябрь |
3 |
9,6 |
67,3 |
23,1 |
|||
|
5 |
89,2 |
10,8 |
||||||
|
7 |
10,3 |
89,7 |
||||||
|
Декабрь |
3 |
8,4 |
67,3 |
24,3 |
||||
|
5 |
81,3 |
18,7 |
||||||
|
7 |
19,1 |
80,9 |
||||||
|
Апрель |
3 |
100 |
||||||
|
П |
Октябрь |
3 |
9,1 |
67,7 |
23,2 |
|||
|
5 |
99,9 |
0,1 |
||||||
|
7 |
2,9 |
97,1 |
||||||
|
Декабрь |
3 |
7,2 |
92 |
0,8 |
||||
|
5 |
0,2 |
87,7 |
12,1 |
|||||
|
7 |
14,7 |
85,3 |
||||||
|
Апрель |
3 |
100 |
||||||
В культуре in vitro в октябре месяце у непораженных деревьев большое количество материнских клеток микроспор находилось в анафазе I, а на 7-е сутки культивирования появляются тетрады, на долю которых приходится около 90 %. В декабре, когда лиственница сибирская находилась в состоянии физиологического покоя, распределение микроспороцитов по фазам несколько иное. На 3-и сутки большее количество микроспороцитов находилось на стадии метафазы I, однако на 14-е сутки было обнаружено 100 %-е образование микроспор, покрытых тонкой экзиной. У растений, пораженных лиственничной почковой галлицей, было отмечено в осенне-зимний период неравномерное распределение микроспороцитов по отдельным фазам мейоза, и образование микроспор проходило медленнее (табл. 1).
В весенние сроки культивирования у не пораженных и пораженных деревьев лиственничной почковой галлицей у микроспороцитов происходило быстрое завершение мейоза.
Большой интерес представляют данные по обработке микростробил низкими положительными температурами. В литературе встречаются исследования, где низкие положительные температуры способствовали получению высокого выхода андрогенных культур у пшеницы [5]. В.Ю. Горбуновой впервые обнаружено: «… дифференциальная эксперессия транскриптов, накапливающихся в микроспорах в ответ на воздействие пониженных положительных температур на пыльники яровой мягкой пшеницы поздней стадии микроспорогенеза. Эта спорофитная генетическая информация реализуется в перестройке веретена деления первого митоза и появлении микроспор с двумя равными ядрами, что характеризует начало прямого андрогенеза in vitro » [4].
В наших исследованиях показано, что пониженные положительные температуры оказывали стимулирующее воздействие на прохождение клетками процесса мейоза, микростробилы которых были собраны в осенне-зимний и весенний периоды. Следует отметить, что у микростробил, собранных в данный период, уже на 3-е сутки культивирования микроспороциты находились в анафазе I в отличие от клеток, микростробилы которых не были обработаны низкими положительными температурами.
Несмотря на то, что на 7-е сутки образованы микроспоры как у непораженных, так и у пораженных деревьев, в их размерах были отмечены существенные различия (табл. 2).
Таблица 2
|
Дерево Месяцп Сутки in vivo 1 Метафаза I1 Анафаза Iп Телофаза Iп Интерфаза Тетрадып Микроспоры |
|||||||||
|
Микростробилы, не обработанные низкими положительными темпе |
ратурами +4 Сo |
||||||||
|
нП |
Октябрь |
3 |
37,76 ±0,22 |
39,17±0,17 |
56,06 ±0,24 |
76,01±0,21 |
|||
|
5 |
54,01±0,21 |
75,31± 0,18 |
|||||||
|
7 |
76,13±0,19 |
84,21±0,31 |
91,52 ±0,21 |
||||||
|
Декабрь |
3 |
37,92 ±0,20 |
38,19±0,17 |
54,6±0,33 |
|||||
|
5 |
38,92±0,24 |
56,40±0,59 |
75,68±0,18 |
85,53±0,16 |
|||||
|
7 |
85,43±0,19 |
92,01±0,26 |
101,3±0,15 |
||||||
|
Апрель |
3 |
51,27 ±0,16 |
91,59±0,21 |
||||||
|
5 |
101,08±0,15 |
||||||||
|
7 |
115,1±0,31 |
||||||||
|
П |
Октябрь |
3 |
34,48 ±0,17 |
37,76 ± 0,2 |
41,36±0,21 |
52,28±0,33 |
|||
|
5 |
50,21±0,29 |
60,01±0,36 |
75,61±0,23 |
89,75±0,27 |
|||||
|
7 |
76,12±0,12 |
90,20±0,31 |
99,89±0,21 |
||||||
|
Декабрь |
3 |
35,76 ±0,19 |
38,4±0,19 |
39,63±0,25 |
60,3±0,59 |
||||
|
5 |
54,7±0,27 |
73,47±0,18 |
76,09±0,18 |
||||||
|
7 |
90,56±0,26 |
91,60±0,38 |
|||||||
|
Апрель |
3 |
49,92 ±0,12 |
89,79±0,23 |
||||||
|
5 |
98,09±0,38 |
||||||||
|
7 |
102,12±0,26 |
||||||||
|
Микростробилы, обработанные низкими положительными температурами +4 Сo |
|||||||||
|
нП |
Октябрь |
3 |
37,76 ±0,22 |
69,82±0,23 |
85,46±0,36 |
90,06±0,28 |
|||
|
5 |
91,87±0,21 |
95,3 ± 0,12 |
|||||||
|
7 |
96,89±0,27 |
110,63±0,27 |
|||||||
|
Декабрь |
3 |
37,92 ±0,20 |
65,78±0,34 |
78,26±0,18 |
89,61±0,18 |
||||
|
5 |
95,41±0,21 |
109,56±0,31 |
|||||||
|
7 |
19,1 |
120,31±0,15 |
|||||||
|
Апрель |
3 |
51,27 ±0,16 |
93,76±0,28 |
||||||
|
5 |
101,31±0,21 |
||||||||
|
7 |
124,3±0,15 |
||||||||
|
П |
Октябрь |
3 |
34,48 ±0,17 |
50,43±0,19 |
74,89±0,29 |
80,91±0,21 |
|||
|
5 |
76,5±0,31 |
82,84±0,20 |
89,03±0,25 |
||||||
|
7 |
90,95±0,21 |
100,8±0,33 |
|||||||
|
Декабрь |
3 |
35,76 ±0,19 |
60,11±0,33 |
77,23±0,59 |
80,59±0,25 |
||||
|
5 |
80,65±0,21 |
85,36±0.23 |
100,15±0,24 |
||||||
|
7 |
85,95±0,29 |
100,23±0,38 |
|||||||
|
Апрель |
3 |
49,92 ±0,12 |
90,12±0,33 |
||||||
|
5 |
99,89±0,59 |
||||||||
|
7 |
106,39±0,38 |
||||||||
Размеры микроспороцитов и микроспор
Размеры микроспороцитов, образованных от микростробил не обработанных низкими положительными температурами деревьев, не пораженных лиственничной почковой галлицей, в метафазе I на 3-е сутки отличались от размеров микроспороцитов пораженных деревьев. Существенную разницу наблюдали у непораженных и пораженных деревьев на 5-е и 7-е сутки культивирования. Особенно значительные отличия проявились в анафазе I и телофазе I (табл. 2). Образованные микроспоры имели тонкую экзину и к 14-м суткам культивирования образовывали двухклеточное пыльцевое зерно, которое прорастало с образованием пыльцевой трубки.
Наиболее существенную разницу в размерах микроспороцитов наблюдали у деревьев, обработанных низкими положительными температурами: в осенне-зимний и весенний периоды на 3-е сутки культивирования их размеры составили: у деревьев, не пораженных лиственничной почковой, – 69,82 мкм, а у пораженных – 60,11 мкм. Такая же закономерность наблюдается и на 5- и на 7-е сутки культивирования. У микроспор, полученных таким путем, наблюдаются тонкая экзина и деполяризация клетки.
Таким образом, низкие положительные температуры оказывают положительное влияние не только на прохождение мейоза, но и на размер образованных микроспор.
У микроспор, образованных в осенне-зимний период, наблюдается образование одноклеточного пыльцевого зерна, которое образует пыльцевую трубку на 14-е сутки культивирования (рис. 3, а), а в дальнейшем – ценоцит (рис. 3, б).
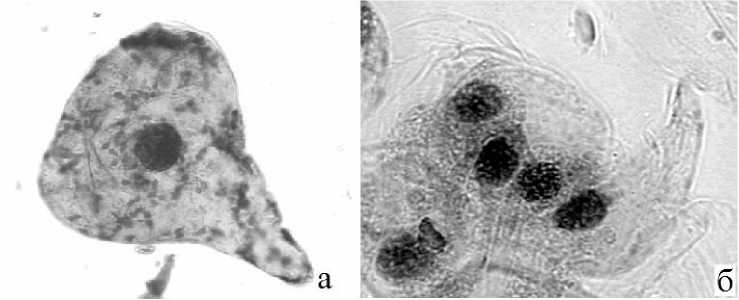
Рис. 3. Образование пыльцевой трубки на 14-е сутки культивирования и на 21-е сутки ценоцита
У микроспор, полученных в апреле месяце, на 14-е сутки от момента инокуляции микроспорофиллов на среду in vitro в образованных микроспорах отмечены равные митотические деления с образованием сначала двух равных ядер, а затем двух равных клеток (рис. 4).
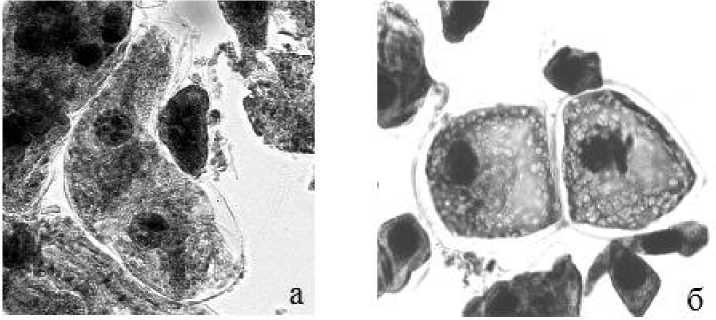
Рис. 4. Митотическое деление микроспоры in vitro
Следовательно, низкие положительные температуры оказывают положительное влияние не только на прохождение мейоза, но и на переход от гаметофитного пути на спорофитный. Это объясняется тем, что в результате действия температур подавляется процесс гаметофитной программы развития и запускается тем самым спорофитная программа.


