Роль высокого и низкого уровня тестостерона в развитии сердечно-сосудистой патологии (на примере клинических случаев)
Автор: Тимофеев Е.В., Петрова Е.А., Реева С.В., Парфенова Н.Н.
Журнал: Juvenis scientia @jscientia
Рубрика: Клинические случаи
Статья в выпуске: 3 т.11, 2025 года.
Бесплатный доступ
Снижение и повышение уровня тестостерона у мужчин до андропаузы сопровождается рядом метаболических, функциональных и органических изменений со стороны различных систем, в первую очередь — сердечно-сосудистой. Для таких мужчин характерно развитие дислипидемии и повышение сердечно-сосудистого риска. Гипогонадизм ассоциирован также с ожирением, нарушениями углеводного обмена, развитием атеросклероза. Неконтролируемое введение анаболических стероидных гормонов в отсутствие медицинских показаний для этого приводит к нарушению реологии крови, развитию жизнеугрожащих нарушений сердечного ритма, тяжёлой сердечной недостаточности, внутрисосудистому тромбообразованию. Представлено два клинических случая: мужчина молодого возраста с аритмическим вариантом кардиомиопатии, развившейся вследствие приёма анаболических стероидов, и мужчина среднего возраста с длительно существующим гипогонадизмом. Показаны клинические проявления этих состояний, темпы их развития и прогрессирования, реакция на проводимую специфическую (в случае гипогонадизма — гормонзаместительную) и неспецифическую терапию. Особенностями обоих случаев является недооценка самими пациентами тяжести изменений и своего состояния, отказ от коррекции терапии. Несмотря на очевидность и простоту терапии таких состояний и обратимость большинства изменений, низкая приверженность лечению значительно увеличивает сердечно-сосудистый риск и риск внезапной смерти.
Тестостерон, мужской гипогонадизм, дислипидемия, кардиомиопатия, анаболические стероиды, трепетание предсердий, нарушения ритма сердца, мужчины, сердечно-сосудистый риск
Короткий адрес: https://sciup.org/14133225
IDR: 14133225 | DOI: 10.32415/jscientia_2025_11_3_48-62
Текст научной статьи Роль высокого и низкого уровня тестостерона в развитии сердечно-сосудистой патологии (на примере клинических случаев)
Значительное изменение уровня тестостерона у мужчин до андропаузы сопровождается рядом метаболических, функциональных и органических изменений со стороны различных систем, в первую очередь — сердечно-сосудистой. Для таких мужчин характерно развитие дислипидемии и повышение сердечно-сосудистого риска независимо от характера изменений (снижение или повышение) уровня тестостерона. При этом гипогонадизм (дефицит тестостерона) ассоциирован также с ожирением, нарушениями углеводного обмена, развитием атеросклероза. Гипогонадизм у мужчин — это клинико-биохимический синдром, связанный с низким уровнем тестостерона, а также нечувствительностью рецепторного аппарата к андрогенам, который может оказывать негативное воздействие на различные органы и системы, ухудшая качество жизни и жизненный прогноз [1].
Классифицируют гипогонадизм в зависимости от уровня нарушений — выделяют первичный (на уровне половых желёз), вторичный (патология на уровне гипоталамуса и гипофиза), а также смешанный (при сочетании обоих вариантов) [2].
Основными признаками гипогонадизма считают: снижение либидо и сексуальной активности, снижение числа утренних эрекций, снижение адекватных эрекций [3–5]. Между тем, отмечается, что клинические проявления обычно неспецифичны и без определения уровня тестостерона сыворотки не могут быть идентифицированы. Наиболее частыми поводами для лабораторного обследования являются [из 6 с сокр.]:
— Гипоплазия яичек
— Сексуальная дисфункция
— Бесплодие
— Ожирение
— Гинекомастия
-
— Хронические сердечно-сосудистые заболевания
— Дислипидемия
-
— Метаболический синдром
При гипогонадизме часто развиваются многие из компонентов метаболического синдрома: ожирение, артериальная гипертензия, нарушения углеводного обмена — сахарный диабет 2 типа, нарушение толерантности к глюкозе, инсулино-резистентность и дислипидемия, проявляющаяся повышением уровня триглицеридов и липопротеидов низкой плотности, а также снижением уровня липопротеидов высокой плотности [7]. Сочетание гипогонадизма с ожирением значимо уменьшает продолжительность жизни мужчин [8].
Пути воздействия андрогенов на липидный обмен на сегодняшний день изучены не до конца. Предполагается, что тестостерон реализует свои эффекты на метаболизм липидов через экспрессию двух генов, участвующих в катаболизме липопротеидов, — печёночной липазы и скэвенджер-рецептора SR-B1, активируя их [9]. Печёночная липаза осуществляет гидролиз триглицеридов и фосфолипидов, что ведёт к усиленному распаду ЛПВП. Скэвенджер-рецептор SR-B1 способствует избирательному захвату холестерина гепатоцитами, клетками Сертоли и Лейдига, что обеспечивает стероидогенез, вызывая тем самым отток липидов из периферических тканей. Тестостерон оказывает непосредственное влияние на метаболизм и обладает анаболическим и липолитическим эффектами [10]. Эндогенный тестостерон стимулирует развитие миоцитов, тормозит развитие адипоцитов, снижает синтез свободных жирных кислот, ингибирует ферменты, отвечающие за накопление триглицеридов жировой ткани [11]. Андрогенный дефицит ослабляет данные эффекты, что приводит к нарушению липидного профиля и способствует развитию ожирения [12]. Описанные модели наиболее изучены у мужчин среднего и пожилого возраста в андропаузу [13].
Диагностика гипогонадизма заключается в оценке клинических симптомов, ассоциированных с дефицитом андрогенов, и выявлении стойкого снижения уровня тестостерона (как минимум двукратное подтверждение) надёжным лабораторным методом. Для верификации первичного гипогонадизма оценивают размер тестикул [2].
Первичный гипергонадотропный, вторичный гипогонадотропный, а также смешанный гипогонадизм являются необратимыми, таким пациентам в случае отсутствия необходимости в сохранении репродуктивной функции рекомендуется назначение препаратов тестостерона (уровень доказа- тельности 1А). Рекомендуется назначение трансдермального препарата тестостерона мужчинам с гипогонадизмом, обусловленным нарушением отрицательной обратной связи гипофиз–гонады, при невозможности добиться целевых показателей терапии основного заболевания с целью повышения эффективности лечения основного заболевания и минимизации негативного воздействия на гонадотропную функцию гипофиза (уровень доказательности 5С) [14].
С другой стороны, известно, что тестостерон и его синтетические аналоги или анаболические стероиды (АС) обладают одновременно анаболическим и андрогенизирующим действием. Основной эффект применения АС заключается в стимуляции синтеза белка за счёт воздействия на рецепторы к андрогенам, что в результате приводит к росту всех органов, потенциально способных увеличиваться [15]. АС назначаются не только для коррекции андрогенного дефицита, о чем уже говорилось, но и для стимуляции эритропоэза при недостаточности костного мозга; также АС широко используются для увеличения мышечной массы и достижения спортивных результатов. Описаны и другие положительные эффекты заместительной гормонотерапии [16, 17]. Однако за последние несколько десятилетий использование АС значительно возросло не только среди спортсменов, но и среди населения в целом. Такая тенденция к немедицинскому применению АС является серьёзной проблемой здравоохранения из-за рисков развития побочных эффектов. Такими нежелательными эффектами являются бесплодие, гепатотоксичность, психические нарушения и гинекомастия, а также различные сердечно-сосудистые осложнения, одним из которых является кардиомиопатия [18].
Кардиомиопатия, вызванная АС, характеризуется структурными и функциональными изменениями в сердце, которые проявляются гипертрофией левого желудочка, нарушением систолической и диастолической функции и в тяжёлых случаях сердечной недостаточностью. При этом кардио-токсические эффекты, особенно вследствие неправильного использования АС, включают прямое повреждение миокарда, фиброз и дисфункцию эндотелия. Эти механизмы способствуют развитию структурных изменений, выявляемых при визуализации, таких как диффузная гипокинезия миокарда и кардиомегалия. Симптомы кардиомиопатии, вызванной АС, часто неспецифичны и варьируют от одышки до серьёзных сердечных осложнений, таких как желудочковая тахикардия и кардиогенный шок.
По мнению многих исследователей, применение АС связано со значительным повышением риска сердечно-сосудистых заболеваний в целом. Так, по результатам 11-летнего наблюдения установлено, что у лиц, получавших АС (n = 1189), регистрировалась значительно более высокая частота сердечно-сосудистых осложнений по сравнению с контрольной группой (n = 59450) [19]. Авторами показано, что применение АС связано с повышенным риском острого инфаркта миокарда, чрескожного коронарного вмешательства или аортокоронарного шунтирования, венозной тромбоэмболии, аритмии, кардиомиопатии и сердечной недостаточности.
Несмотря на имеющиеся доказательства связи АС с неблагоприятными сердечно-сосудистыми исходами, распространённость кардиомиопатии, вызванной АС, остаётся неизвестной. Это обусловлено с одной стороны сложностью диагностики этого состояния, поскольку оно может не иметь чётких клинических проявлений и протекать ма-лосимптомно, а с другой — трудностью получения данных о применении АС, поскольку пациенты зачастую скрывают этот факт или дают неполную информацию о продолжительности приёма и дозах используемых препаратов [20]. В настоящее время в литературе встречаются в основном описания отдельных клинических случаев повреждения сердечно-сосудистой системы при применении АС [21, 22].
В метаанализе 2025 года обобщены результаты 29 исследований, в ходе которых были изучены 32 клинических случая применения АС — преимущественно мужчины (n = 31) в возрасте от 22 до 73 лет (средний возраст 38,3 года) [23]. Наиболее частым симптомом среди пациентов была одышка, также были выявлены отёки нижних конечностей, ортопноэ и учащенное сердцебие- ние. Тахикардия была наиболее частым физикальным проявлением (56,3%), синусовая тахикардия — наиболее частой ЭКГ-находкой. У четверых обследованных выявлена фибрилляция предсердий, также были зарегистрированы эпизоды предсердной и желудочковой тахикардии. Рентгенография грудной клетки выявила кардиомегалию в 15 случаях, у 8 пациентов были отмечены признаки застоя в лёгких и двусторонний плевральный выпот. ЭхоКГ в большинстве случаев продемонстрировала диффузную гипокинезию и дилатацию левого желудочка, при этом фракция выброса левого желудочка определялась в диапазоне от менее 10% до 45%. Тяжёлая митральная регургитация была выявлена у шести пациентов, трикуспидальная регургитация — в двух случаях. У 11 пациентов была проведена коронарография, которая выявила нормальные коронарные артерии, что позволяет расценивать клинические проявления именно как признак АС-индуцированной кардиомиопатии [23]. Следует отметить, что в литературе описаны также и противоположные изменения коронарных артерий у лиц, получающих АС, — применение нефизиологических доз ассоциировано с ускоренным развитием коронарного атеросклероза. Потенциальным механизмом развития ишемии миокарда, связанной с применением АС, также является полицитемия и увеличение образования тромбоксана А2 и снижение синтеза простациклина [20]. Применение АС предположительно связано с развитием дислипидемии, проявляющейся снижением концентрации липопротеинов высокой плотности и увеличением концентрации липопротеинов низкой плотности, что также может способствовать прогрессированию коронарного атеросклероза [19, 24, 25]. Таким образом, нерациональное использование АС создаёт условия для развития нежелательных эффектов их применения со стороны сердечно-сосудистой системы, которые могут проявляться самой разнообразной патологией.
КЛИНИЧЕСКИЙ СЛУЧАЙ ПАЦИЕНТАС ГИПОГОНАДИЗМОМ
На плановый профосмотр явился мужчина 47 лет, жалоб при осмотре не предъявляет. Работает инженером; не курит; отягощённую наслед- ственность по сердечно-сосудистой и эндокринной патологии отрицает; имеет двух детей школьного возраста; с детства отмечает избыточную массу тела, с периода пубертата диагностировалась гинекомастия, по поводу которой проведено оперативное лечение. Объективно состояние удовлетворительное, питание избыточное. Рост 179 см, масса тела 135 кг, ИМТ 41 кг/м2. Пульс симметричный, ритмичный, ЧСС 67 в мин., АД — 140/90 мм рт. ст. Живот увеличен за счёт подкожной жировой клетчатки, печень не увеличена. Окружность талии 133 см, окружность бёдер 123 см, индекс талия/ бедра 1,08.
С 2017 г. знает о гиперхолестеринемии: общий холестерин (ОХ) до 16,3 ммоль/л. Тогда же был выявлен первичный гипогонадизм: значительно
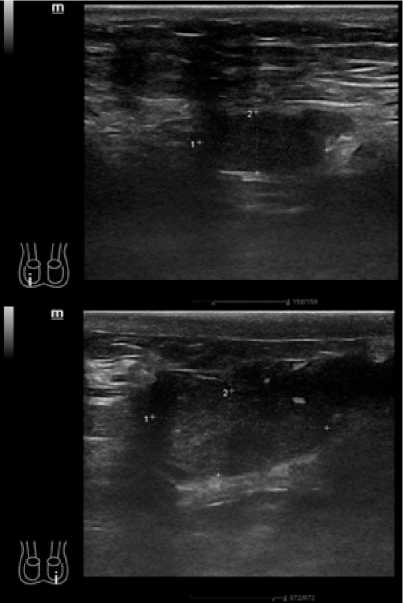
Рисунок 1. УЗИ яичек мужчины с гипогонадизмом — уменьшение обеих тестикул
Figure 1. Testicular ultrasound of a man with hypogonadism—reduction in size of both testicles
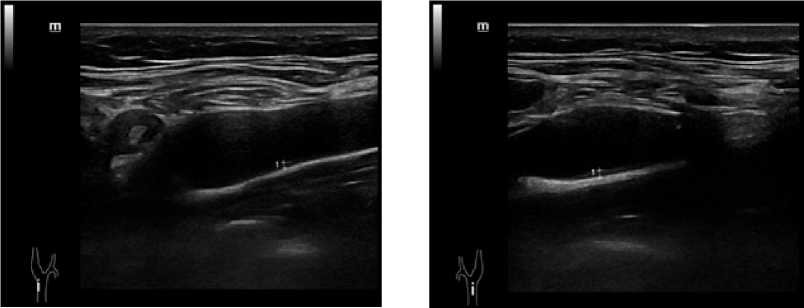
Рисунок 2. УЗДГ брахиоцефальных сосудов — отсутствие признаков атеросклеротического поражения сонных артерий
Figure 2. Doppler ultrasound of the brachiocephalic vessels—no signs of atherosclerotic lesions in the carotid arteries
снижен уровень тестостерона крови, уровень эстрадиола — на нижней границе нормы, в 3,5 раза повышен уровень фолликулостимулирующего гормона (ФСГ), несколько повышен лютеинизирующий гормон (ЛГ), пролактин — на верхней границе нормы (табл. 1). Для оценки состояния половых желёз выполнено УЗИ, согласно заключению — оба яичка в мошонке, отмечается гипоплазия обоих яичек: правое 1,5 × 0,8 см, левое 2,1 × 1,1 см (рис. 1). Выявлена также пограничная гипергликемия натощак (6,31 ммоль/л), при нормальном уровне гликированного гемоглобина (5,6%). На УЗДГ брахиоцефальных и бедренных артерий признаков атеросклеротического поражения не выявлено, толщина КИМ в пределах нормы — до 0,9 мм (рис. 2). Риск по шкале SCORE2 — 15%.
По результатам обследования назначена терапия: «Омнадрен» по 250 мг 1 раз в две недели, фе-нофибрат, розувастатин. На фоне терапии отмечена положительная лабораторная динамика в виде
Таблица 1 / Table 1
Исходный уровень половых гормонов пациента с гипогонадизмом /
Baseline levels of sex hormones in a patient with hypogonadism
|
Гормон / Hormone |
Уровень до начала заместительной гормональной терапии (2017) / Level before the start of hormone replacement therapy (2017) |
|
ЛГ, мМе/мл (0,57–12,07) LH, mIU/mL (0.57–12.07) |
13,47 |
|
ФСГ, мМе/мл (1,5–12,4) FSH, mIU/mL (1.5–12.4) |
42,23 |
|
Пролактин, мМЕ/л (72,66–407,4) Prolactin, mIU/L (72.66–407.4) |
401,28 |
|
Эстрадиол, нг/мл (11–44) Estradiol, ng/mL (11–44) |
11 |
|
Тестостерон, нг/мл (2,4–8,7) Testosterone, ng/mL (2.4–8.7) |
1,36 |
Таблица 2 / Table 2
Динамика липидного спектра, уровня глюкозы и тестостерона у пациента с гипогонадизмом Dynamics of the lipid profile, glucose, and testosterone levels in a patient with hypogonadism
|
Показатель |
2017 |
2018 |
2019 |
2022 |
2024 |
2025 |
|
Тестостерон, нг/мл (2,4–8,7) |
1,36 |
2,34 |
3,01 |
1,0 |
0,228 |
1,08 |
|
Testosterone, ng/mL (2.4–8.7) |
||||||
|
ОХ, ммоль/л (3,91–6,94) |
16,3 |
11,3 |
3,97 |
5,18 |
7,8 |
11,8 |
|
Total cholesterol, mmol/L (3.91–6.94) |
||||||
|
ТГ, ммоль/л (0,62–3,61) |
13,38 |
13,43 |
1,77 |
5,41 |
10,6 |
16,8 |
|
Triglycerides, mmol/L (0.62–3.61) |
||||||
|
ЛПНП, ммоль/л (2,25–4,82) |
9,11 |
4,34 |
2,12 |
2,54 |
3,9 |
5,4 |
|
LDL, mmol/L (2.25–4.82) |
||||||
|
ЛПОНП, ммоль/л (0,26–1,04), |
6,14 |
6,16 |
0,81 |
1,48 |
4,8 |
7,7 |
|
VLDL, mmol/L (0.26–1.04) |
||||||
|
ЛПВП, ммоль/л (0,7–1,73) |
1,11 |
0,8 |
1,04 |
0,86 |
0,87 |
1,7 |
|
HDL, mmol/L (0.7–1.73) |
||||||
|
Глюкоза натощак, ммоль/л (3,4–6,1) |
6,31 |
не определялась / not measured |
7,8 |
4,73 |
6,8 |
не определялась / not measured |
|
Fasting glucose, mmol/L (3.4–6.1) |
Примечание: / Note:
2017 — До терапии / Before therapy
2018 — Инициация ГЗТ и гиполипидемической терапии / Initiation of TRT and lipid-lowering therapy
2019 — Регулярная ГЗТ и гиполипидемическая терапия / On regular TRT and lipid-lowering therapy
2022 — Нерегулярная ГЗТ + гиполипидемическая терапия / On lipid-lowering therapy and irregular TRT
2024 — Отмена ГЗТ, гиполипидемическая терапия* / On lipid-lowering therapy only, after TRT withdrawal*
2025 — Отмена ГЗТ, гиполипидемическая терапия* / On lipid-lowering therapy only, after TRT withdrawal*
* розувастатин 40 мг + эзетимиб 10 мг. ГЗТ — гормонозаместительная терапия, ОХ — общий холестерин, ТГ — триглицериды, ЛПНП — липопротеиды низкой плотности, ЛПОНП — липопротеиды очень низкой плотности, ЛПВП — липопротеиды высокой плотности.
* rosuvastatin 40 mg + ezetimibe 10 mg. TRT – testosterone replacement therapy, TC – total cholesterol, TG – triglycerides, LDL – low-density lipoproteins, VLDL – very-low-density lipoproteins, HDL – high-density lipoproteins.
снижения уровня общего холестерина, тенденция к повышению тестостерона. Затем несколько лет в связи с длительными командировками «Омнад-рен» вводил нерегулярно, но приём гиполипиде-мических препаратов не прекращал. Несмотря на приём статинов, отмечается рост уровня липидов при сохранении выраженного андрогенного дефицита (табл. 2). На момент визита получал метформин 1000 мг в сутки, розувастатин 40 мг + эзетимиб 10 мг в сутки, инъекции препарата тестостерона прекратил.
Несмотря на значительные изменения лабораторных показателей и отсутствие эффекта от гипо-липидемической терапии, пациент считает себя практически здоровым, в связи с чем нацеленности на повышение приверженности терапии у мужчины нет.
КЛИНИЧЕСКИЙ СЛУЧАЙ ПАЦИЕНТА
С РАЗВИТИЕМ КАРДИОМИОПАТИИ ВСЛЕДСТВИЕ ДЛИТЕЛЬНОГО ПРИМЕНЕНИЯ АНАБОЛИЧЕСКИХ СТЕРОИДОВ
Мужчина 38 лет, поступил в кардиологическое отделение городского стационара с жалобами на боль в области сердца, ощущение сердцебиения и перебоев в работе сердца, повышение АД до 150/80 мм рт. ст. в течение 2 дней.
Из анамнеза: ранее считал себя здоровым; занимался фитнесом много лет, избыточной массы тела не было никогда, имеет двух детей дошкольного возраста. Актёр, блогер. Последние 2 года интенсивно занимался пауэрлифтингом (5 раз в неделю) и, по рекомендации спортивного тренера, получал в/м тестостерон («Сустанон») 500 мг и нандроло-на фенилпропионат; кроме того, в больших дозах принимал аминокислоты, витамины группы B и D, предпочитал высокоуглеводную диету для набора массы тела.
В 2024 г. в связи с жалобами на периодические сердцебиения выполнено холтеровское мониторирование (ХМ) ЭКГ: выявлена желудочковая экстрасистолия 5-й градации по Ryan, эпизоды неустойчивых пароксизмов желудочковой тахикардии.
На ЭКГ — выраженное отклонение электрической оси влево, блокада передне-верхнего разветвления левой ножки пучка Гиса, признаки увеличения правого желудочка (рис. 3).
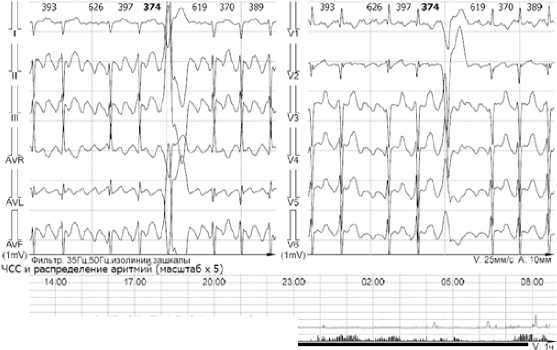
При поступлении на ЭКГ пароксизм трепетания предсердий с нерегулярным проведением с частотой желудочковых сокращений 160 в 1 мин. При ХМ ЭКГ — выраженная тахикардия в течение всего времени наблюдения за счёт трепетания предсердий с АВ-проведением 2:1 (ЧСС днём средняя 114, мин. 89, макс. 181 в 1 минуту; ЧСС ночью средняя 94, мин. 90, макс. 137 в 1 минуту) (рис. 4, 5); циркадный индекс в пределах нормы (121%). На фоне трепетания предсердий регистрируется полиморфная желудочковая эктопическая активность (рис. 6–8), длительные паузы за счёт замедления АВ-проведения (рис. 9); удлинения QT-интервала не зарегистрировано.
При проведении эхокардиографии (ЭхоКГ): аорта на уровне синусов Вальсальвы 32 мм, восходящая аорта 30 мм; левое предсердие 34 мм; левый желудочек: КДР 49 мм, КСР 40 мм, КДО 133 мл, КСО 73 мл, МЖП 12 мм, ЗС 10 мм, ФВ по Симпсону 45% (оценена на фоне тахисистолии); локальная сократимость не нарушена; правый желудочек не расширен (в 4-камерной позиции 32 мм), правое
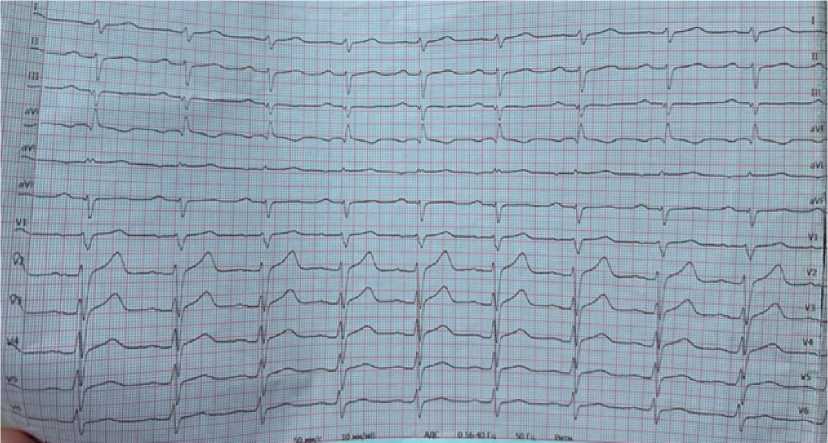
Рисунок 3. ЭКГ пациента, снятая в 2024 году
Figure 3. Patient’s ECG recorded in 2024
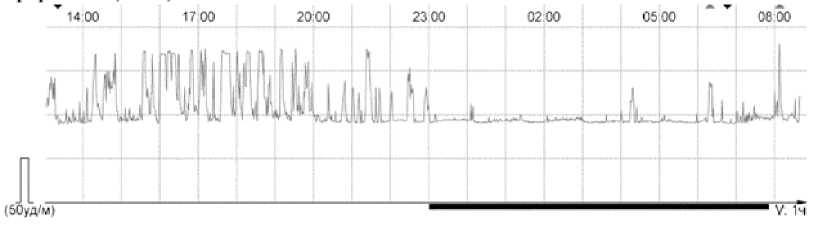
Рисунок 4. Фрагмент ХМ. График ЧСС (оценка за 1 мин.)
Figure 4. Fragment of Holter monitoring. Heart rate graph (per-minute assessment)
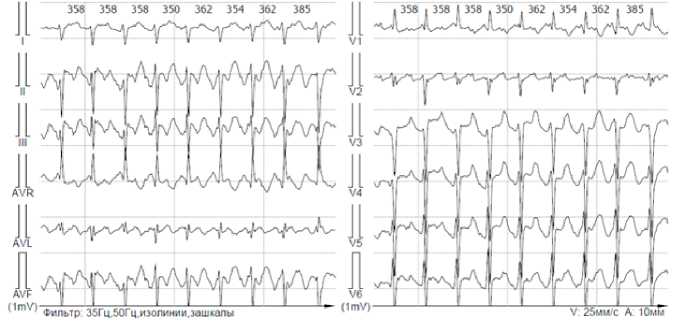
Рисунок 5. Фрагмент ХМ. Трепетание предсердий 2:1
Figure 5. Fragment of Holter monitoring. Atrial flutter 2:1
а^фгй|^й₽^^
(Я>ий “1~“ * * '“
Рисунок 6. Фрагмент ХМ. Одиночная желудочковая экстрасистолия 1-го типа на фоне трепетания предсердий, всего 1257 (63 в час), днём: 279 (25 в час), ночью: 978 (111 в час)
Figure 6. Fragment of Holter monitoring. Single type 1 ventricular extrasystole against the background of atrial flutter, total: 1257 (63 per hour), daytime: 279 (25 per hour), nighttime: 978 (111 per hour)
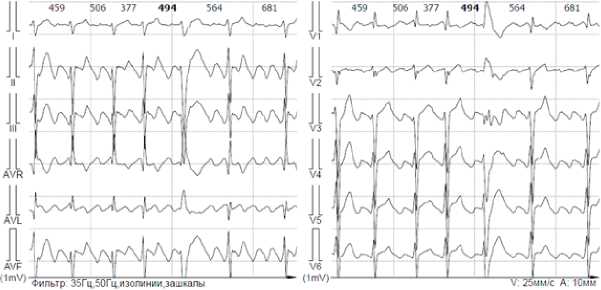
Рисунок 7. Фрагмент ХМ. Одиночная желудочковая экстрасистолия 2-го типа на фоне трепетания предсердий, всего: 10 (1 в час), днём: 8 (1 в час). ночью: 2 (менее 1 в час)
Figure 7. Fragment of Holter monitoring. Single type 2 ventricular extrasystole against the background of atrial flutter, total: 10 (1 per hour), daytime: 8 (1 per hour), nighttime: 2 (less than 1 per hour)
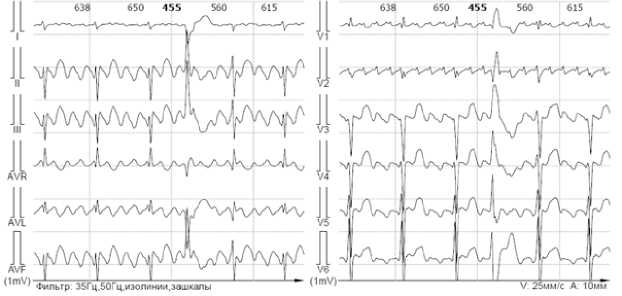
Рисунок 8. Фрагмент ХМ. Одиночная желудочковая экстрасистолия 3-го типа на фоне трепетания предсердий, всего: 1, днем: 1
Figure 8. Fragment of Holter monitoring. Single type 3 ventricular extrasystole against the background of atrial flutter, total: 1, daytime: 1

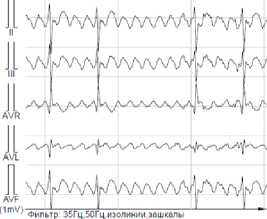
Рисунок 9. Фрагмент ХМ. Длительные паузы на фоне трепетания предсердий
Figure 9. Fragment of Holter monitoring. Prolonged pauses against the background of atrial flutter
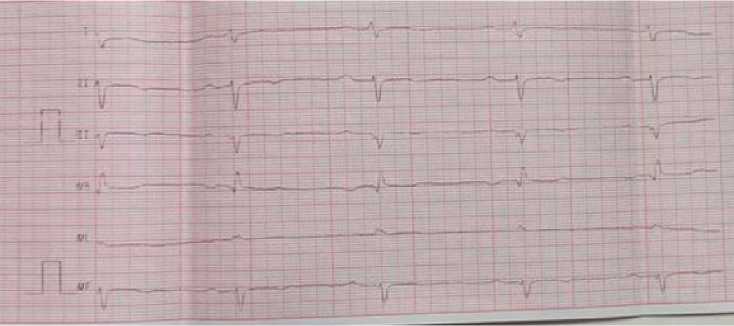
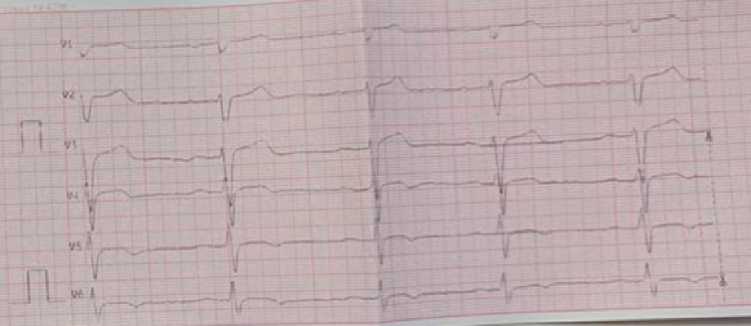
Рисунок 10. ЭКГ пациента с восстановленным синусовым ритмом (2025 г.) Figure 10. Patient’s ECG with restored sinus rhythm (2025)
предсердие не расширено (объем 56 мл); лёгочная артерия не расширена (22 мм), расчётное давление в лёгочной артерии 23 мм рт. ст.; изменений со стороны клапанного аппарата не выявлено. Выполнена чреспищеводная ЭхоКГ — в полости левого предсердия отмечается эффект спонтанного контрастирования, в полости ушка лоцируется гиперэхогенное включение без УЗ-признаков флотации, размером 6 мм; прокрашивание в режиме цветного допплеровского картирования ушка неполное.
Лабораторно в клиническом анализе крови выявлен абсолютный эритроцитоз 7,44 × 1012/л и гипергемоглобинемия до 204 г/л. В биохимическом анализе — повышение уровня общего холестерина до 5,59 ммоль/л, ЛПВП 0,69 ммоль/л, ЛПНП 3,8 ммоль/л, ЛПОНП 1,1 ммоль/л, триглице- ридов 2,43 ммоль/л, при этом кардиоспецифичные маркеры (тропонин, КФК-МВ, трансаминазы) без виража. Выписан с трепетанием предсердий, нор-мосистолией (ЧСС 88 в мин.), с рекомендациями приёма ривароксабана, бисопролола, комбинаций периндоприла с индапамидом и розувастатина с эзетимибом.
Через 10 дней на контрольной ЭКГ: восстановление (спонтанное) синусового ритма с ЧСС 67 в мин., блокада передне-верхнего разветвления левой ножки пучка Гиса (те же изменения были в 2024 году), появились нарушения процессов реполяризации (рис. 10). Чреспищеводная ЭхоКГ в динамике — тромб не лоцируется, прокрашивание в режиме цветного допплеровского картирования ушка полное.
Пациент несколько снизил интенсивность физических нагрузок, однако продолжает вводить тестостерон в/м, спустя 3 месяца после госпитализации чувствует себя хорошо.
ОБСУЖДЕНИЕ
Первичный гипогонадизм у представленного мужчины среднего возраста существует, вероятно, в течение всей жизни. Особенностью случая является сохранение репродуктивной функции с возможностью зачатия двух детей. Основным проявлением гипогонадизма является тяжёлая дислипидемия, не корригируемая приёмом интенсивной гиполипидемической терапии. Улучшение и нормализацию липидограммы удалось достичь только при адекватной гормонзаместительной терапии, после прекращении которой уровень общего холестерина вновь превышает норму в 2 раза. В то же время изменений сосудов, характерных для атеросклеротического их поражения, у пациента в настоящее время не обнаружено. Пациенту показана длительная заместительная терапия препаратами тестостерона, с контролем уровня гормонов, липидов, гликированного гемоглобина. При отсутствии эффективной гиполипидемической терапии и отказе пациента от гормонотерапии прогноз серьёзный.
Второй случай представляет развитие комплекса нежелательных эффектов у изначально здорового мужчины молодого возраста с бесконтрольным и немотивированным с клинической точки зрения применением анаболических стероидов с целью увеличения скелетной мышечной массы. Неполные два года введения препаратов тестостерона привели к развитию изменений периферической крови, изменению липидного статуса и кардиомиопатии, проявляющейся полиморфной желудочковой экстрасистолией и трепетанием предсердий, осложнённым образованием внутрисердечного тромба. Кроме того, создаётся реальная угроза сохранению репродуктивной функции — вполне вероятна атрофия яичек и снижение эндогенного синтеза тестостерона. Можно ожидать, что отмена АС у такого пациента может привести к снижению сердечно-сосудистого риска, однако пациент воспринимает себя практически здоровым и прекращать введение препарата тестостерона не намерен. Кроме того, в силу своей профессиональной деятельности (актёр и блогер) пациент формирует сомнительное представление о здоровье и цели физических тренировок не только у себя, но и у своих возможных последователей. Таким образом, проблема имеет не только медицинские, но и социальные последствия.
ЗАКЛЮЧЕНИЕ
Известно, что роль половых гормонов не сводится только к сохранению репродуктивной функции мужчины, а проявляется во влиянии на все виды обмена — жировой, углеводный, белковый. Длительно существующий низкий, как и высокий уровень тестостерона оказывает патологическое влияние на здоровье мужчины в целом, вызывая ряд изменений со стороны различных органов и систем, обратимость которых в настоящее время не доказана. В качестве иллюстрации приведено два клинических случая, показывающих роль эндогенного дефицита половых гормонов и их экзогенного избытка в развитии функциональных и структурных изменений со стороны сердечнососудистой системы. Несмотря на полярность гормонального статуса и существенные различия фенотипов у обоих пациентов формируются в чем-то схожие лабораторные изменения липидного статуса, повышающие риск сердечно-сосудистых катастроф, развития ишемической болезни сердца, цереброваскулярной патологии, а также риск снижения качества жизни, в том числе угнетение половой функции и либидо.
Финансирование: Авторы заявляют об отсутствии финансирования.


