Российская тест-система РСА3: первые результаты
Автор: Сидоренков А.В., Говоров А.В., Пушкарь Д.Ю., Павлов К.А., Шкопоров А.Н., Хохлова Е.В., Корчагина А.А., Григорьев М.Э., Чехонин В.П.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 2, 2014 года.
Бесплатный доступ
Рак предстательной железы, биомаркер, от-пцр, пцр в режиме реального времени
Короткий адрес: https://sciup.org/142188377
IDR: 142188377
Текст статьи Российская тест-система РСА3: первые результаты
Widely used detection of the prostatic specific antigen (PSA) to the growth of the prostate biopsies being performed; introduction of the age-related normal values of PSA led to growth of the number of unjustified biopsies. As a result of this the constant need in the new prostate cancer biomarkers is obvious. PCA3 – is a non-coding mRNA, which is expressed exclusively by the prostate cells. The aim of this work was to develop a diagnostic system for early non-invasive diagnostics of the prostate cancer, based on the quantitative detection of the PCA3-gene mRNA in the urine sediment using the reverse transcription polymerase chain reaction (PCR). As the consequence a laboratory exemplar of the PCR-based test system was created and tested out. The data to the specificity and sensitivity of the new method were received. The ability of the diagnostic system to identify the substantial increase in the proportion of PCA3/KLK3 was shown in the material from the patients with prostate cancer in comparison with healthy individuals. Relatively high sensitivity, specificity and negative predictive value were received for the early non-invasive diagnostics of the prostate cancer.
А.В. Сидоренков1, А.В. Говоров1, Д.Ю. Пушкарь1, К.А. Павлов3, А.Н. Шкопоров2, Е.В. Хохлова2, А.А. Корчагина2, М.Э. Григорьев2, В.П. Чехонин3
-
1Московский государственный медико-стоматологический университет им. А.И. Евдокимова (кафедра урологии)
-
2Российский национальный исследовательский медицинский университет им. Н.И. Пирогова (кафедра медицинских нанобиотехнологий медикобиологического факультета)
-
3Государственный научный центр социальной и судебной психиатрии им. В.П. Сербского (отдел фундаментальной и прикладной нейробиологии), Москва
ак предстательной железы (РПЖ) является одним из наиболее распространенных онкологических заболеваний у мужчин. На сегодняшний день РПЖ занимает второе место среди причин смерти от злокачественных заболеваний у мужчин в Европе и в Северной Америке. В России отмечается неуклонный рост числа больных с впервые установленным диагнозом РПЖ: за последние 10 лет заболеваемость РПЖ на 100 000 населения возросла на 120,5% [1]. В последние годы в результате активного внедрения в клиническую практику определения уровня простатического специфического антигена (ПСА), новых методов диагностики и скрининга РПЖ наблюдается тенденция к успешному лечению и мониторированию РПЖ. В свою очередь, средний возраст больных с впервые выявленным заболеванием существенно снизился, что повлекло за собой увеличение процента выявления ранних форм РПЖ (Т1-2) [2, 3].
К базовым методам диагностики и скрининга рака предстательной железы относится, прежде всего, пальцевое ректальное исследование (ПРИ), определение в сыворотке крови уровня ПСА, трансректальное ультразвуковое исследование (ТРУЗИ) с последующим выполнением биопсии предстательной железы (ПЖ) [4, 5].
С началом «эры ПСА» этот метод зарекомендовал себя как наиболее точный в диагностике, стадировании и осуществления динамического мониторинга РПЖ. Многими исследованиями показано, что у мужчин с уровнем ПСА от 4 до 10 нг/мл РПЖ диагностируется только у каждого четвертого, а частота негативных биопсий составляет 70-80%. Известно также, что ПСА – это не раковоспецифический маркер, а всего лишь органоспецифический, и его повышение может быть обусловлено другими заболеваниями ПЖ (доброкачественная гиперплазия предстательной железы, острый или хронический простатит) или различными манипуляциями на ПЖ (ПРИ, массаж, ТРУЗИ, эякуляция, острая задержка мочи, недавно перенесенная биопсия или другая операция на ПЖ и др.) [3, 6].
«Золотым стандартом» диагностики РПЖ в настоящее время является мультифокальная биопсия ПЖ под ультразвуковым контролем. Показаниями к биопсии являются повышенный уровень ПСА, данные ПРИ и обнаружение гипоэхогенных зон в ткани ПЖ по данным ТРУЗИ [7]. В 1989 г. Hodge K. разработана и предложена ставшая в дальнейшем общепринятой методика выполнения биопсии ПЖ из 6 точек (так называемая «секстантная» биопсия), которая показала улучшение вы-являемости РПЖ [8]. При этом число ложно-отрицательных биопсий составляло по разным данным от 31,5% до 45%) [7, 9, 10]. Guichard G. et al. сообщили, что частота обнаружения рака при 21-, 18-, 12- и 6-точечной биопсии составляет 42,5%, 41,5%, 38,7% и 31,7% соответ-ственно[11]. Наиболее сложной задачей сегодня является определение показаний для выполнения повторной биопсии ПЖ при первичной «негативной». Оптимальный срок проведения повторной биопсии не установлен. Его определяют на основании результатов патоморфологи-ческого исследования первичной биопсии с учетом риска выявления РПЖ (высокий или быстро растущий уровень ПСА, изменения по данным ПРИ, отягощенный семейный анамнез) [12].
С каждым годом появляется все больше новых онкомаркеров, в том числе и биомаркеров РПЖ. Это обусловлено, прежде всего, развитием науки, нанотехнологий, молекулярной биологии и генетики. К наиболее многообещающим и изученным маркерам относятся [-2] proPSA (незрелая форма ПСА или предшественник), PSCA (антиген простатических стволовых клеток), PSP 94 (секретируемый белок предстательной железы 94), ECPA и ECPA-2 (ранние антигены РПЖ), uPA/uPAR (рецепторы активатора плазминогена урокиназы), GSTP1 (глутатион-S-трансфераза Р1), TM-PRESS2:ERG (химерный белок, образующийся при хромосомной мутации со слиянием генов TMPRESS2 и ERG), РСА3 (специфический антиген рака ПЖ 3) [13].
Одним из наиболее перспективных среди предложенных методов ранней неинвазивной диагностики РПЖ являются тест-системы, основанные на количественном анализе РНК-продукта гена PCA3, овер-экспрессия которого наблюдается при малигнизации тканей предстательной железы. Ген PCA3 был открыт в конце 1990-х гг. в ходе сравнения транскриптомов нормальных и злокачественных тканей предстательной железы. Дальнейшие исследования показали, что высокий уровень экспрессии PCA3 строго специфичен для злокачественных опухолей ПЖ и её метастазов, но не для любых нормальных тканей, а также доброкачественных или злокачественных опухолей другого генеза. На основании этих данных было высказано предположение о возможности использования уровня экcпрес-сии гена PCA3 в качестве биомаркера РПЖ [14]. PCA3 был открыт в конце 1990-х годов в ходе совместной работы двух исследовательских групп из Университета Рэдбаунд и госпиталя Джона Хопкинса. Сравнив транскриптомы нормальных и злокачественных тканей предстательной железы с помощью дифференциального дисплея (DD), они обнаружили мРНК, уровень экспрессии которой в раковых клетках ПЖ более чем в 60 раз превышал уровень экспрессии в нормальных клетках предстательной железы. мРНК получила название DD3 (от англ. differential display clone 3), а позже PCA3 (от англ. prostate cancer antigen 3). Marion Bussemakers считается основоположником и первооткрывателем гена DD3 [14]. На сегодняшний день предложено 3 поколения таких систем диагностики, основанных на определении содержания мРНК гена PCA3 в моче или её клеточном осадке. Полученное значение нормируют на число клеток ПЖ в анализируемом образце, определяемое, в свою очередь, по количеству мРНК гена KLK3, кодирующего белок ПСА и экспрессирующегося исключительно в тканях предстательной железы [15, 16]. Существующие системы диагностики РПЖ, основанные на количественном анализе уровня экспрессии PCA3, различаются по типу исследуемого материала и по способу оценки количества мРНК PCA3. В первой предложенной тест-системе суммарную клеточную РНК выделяют из клеточного осадка мочи, собранного центрифугированием. Полученную РНК используют для реакции обратной транскрипции и последующей полимеразной цепной реакции (ОТ-ПЦР).
Затем количество мРНК гена PCA3 и ПСА определяют методом гибридизации продуктов ОТ-ПЦР на специальных микрочипах. Эта система диагностики была апробирована в Голландии в ходе исследования, в котором приняло участие 108 пациентов. Одновременно с анализом экспрессии РСА3 в данной группе обследованных проводили гистологическое исследование биоптатов ПЖ. Исследование показало, что высокий уровень PCA3 в клеточном осадке мочи коррелирует с высоким риском обнаружения РПЖ результатам биопсии [17]. Метод диагностики рака предстательной железы, разработанный компанией DiagnoCure Inc. (Канада) в 2004 году, основан на определении уровня экспрессии PCA3 и ПСА в клеточном осадке с помощью ОТ-ПЦР в режиме реального времени (ОТ-ПЦР-РВ). В ходе проведенного мультицентрового исследования 517 пациентов было показано, что выявление высокого уровня РСА3 в моче пациента коррелирует с ростом вероятности обнаружения рака предстательной железы; показана высокая специфичность и чувствительность теста [18, 19].
В ноябре 2003 компания GenProbe Inc.(Сан-Диего) получила от DiagnoCure эксклюзивные права на диагностику PСA3 по всему миру. Gen-Probe вскоре разработала количественный анализ PCA3 третьего поколения – Progensa®. Отличительной чертой данного теста является определение уровня экспрессии гена PCA3 не в клеточном осадке, а непосредственно в первой порции мочи после массажа ПЖ. Все дальнейшие биохимические процессы также проводятся в той же пробирке, куда первоначально собиралась исследуемая моча. В ходе проведенных в 20062008 гг. мультицентровых исследований у 1343 пациентов, Deras IL. et al., Groskopf J. et al., Haese A. et al. и Marks LS. et al. [20, 21, 22, 23] установили достаточно убедительную корреляцию между оверэкспрессией РСА3 и РПЖ с чувствительностью теста 57% и специфичностью 74,52%. Эта система диагностики в 2007 г. была также □ апробирована в Голландии, в ходе исследования, в котором приняли участие 534 пациента c уровнем ПСА 3-15 нг/мл. Одновременно с определением уровня экспрессии мРНК гена РСА3 проводили гистологическое исследование ткани ПЖ. Исследование показало, что высокий уровень PCA3 в клеточном осадке мочи коррелирует с высоким риском обнаружения РПЖ по результатам биопсии [24].
Достоверно установлено, что уровень РСА3 является предиктором обнаружения злокачественной опухоли ПЖ при первичной, либо повторной биопсии [20, 22]. РСА3 показал способность быть независимым предиктором РПЖ, использование которого возможно в комплексе с другими факторами риска РПЖ (возраст, уровень общего ПСА, данные ПРИ, объем ПЖ, результаты патогистологического заключения и т.д.). Van Gils MP. et al. в 2008 году высказали предположение, что значение индекса РСА3 может быть ассоциировано с более агрессивным раком. Эта теория предполагает, что клетки агрессивных форм РПЖ изначально более инвазивны и могут легко проходить в просвет канальцев желез, особенно после пальцевого ректального исследования [25]. В некоторых публикациях авторы также описывают корреляцию между уровнем индекса РСА3 и баллами по системе градации Глисона [22], что, в свою очередь, противоречит данным других публикаций, в которых говорится об отсутствии таких закономерностей [25]. Auprich M. et al. описали клиническую ценность РСА3 как предиктора агрессивности РПЖ, что может иметь значение при планировании радикальной простатэктомии. Некоторыми авторами сделаны выводы о корреляции между уровнем РСА3 и объемом опухолевого поражения ПЖ по данным патогистологического исследования после радикальной простатэктомии, прогностической ценности корреляции баллов РСА3 и клинически незначимого РПЖ [22, 26]. Van Poppel H. et al. в 2012 году в своей публикации описали значительное превышение РСА3 в группе больных со стадией T3a-T3b по сравнению с группой больных, перенесших РПЭ, со стадией T2a-T2c [27]. Существующие данные различных публикаций о ценности уровня РСА3 в прогнозировании экстра-капсулярного распространения опухоли противоречивы [22, 26].
Учитывая тот факт, что PCA3 является важным независимым предиктором результатов биопсии, РСА3 был включен в современные предоперационные номограммы. На сегодня доступно в последних публикациях 5 подобных номограмм, в двух из которых номограммы построены без учета анамнеза предшествующих биопсий ПЖ – это PCPT (Prostate Cancer Prevention Trial) калькулятор риска и графические номограммы, опубликованные в 2009 году Chun F.K. et al. [28]. Wu AK. et al. в 2012 году в своей номограмме определили показания для повторной биопсии ПЖ для пациентов с одной «негативной» биопсией в анамнезе [29]. Кроме РСА3 в номограмме учитывается уровень общего ПСА, PSAD (плотность ПСА), данные ПРИ и ТРУЗИ. В 2013 г. Hansen J. et al. опубликовали данные своего исследования с построением номограммы для первичной биопсии, которая превосходила клинические модели без PCA3 (р<0,001). Диагностическая точность увеличилась на 4,5-7,1%, что было связанно с включением PCA3. Авторы сделали вывод, что данная номограмма позволит избежать до 55% так называе-мых«ненужных» биопсий предстательной железы [30]. Ruffion А. et al. создали номограмму на основании РСА3 для определения показаний к первичной биопсии ПЖ. У пациентов с индексом PCA3≥35 отмечался более высокий риск положительных биопсий: 66% против 31% (р<0,001); аналогично, риск был значительно выше при использовании порогового значения индекса РСА3 в 21 балл: 62% против 22% (р<0,001)[31].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Разработать отечественную диагностическую тест-систему PCA3 с низкой затратной стоимостью для ранней неинвазивной диагностики РПЖ, основанной на количественной детекции мРНК гена PCA3 методом обратной транскрипции полимеразно-цепной реакции в режиме реального времени (ОТ-ПЦР-РВ), а также разработать рекомендации по применению и использованию теста PCA3 в клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
В клинике урологии МГМСУ имени А.И. Евдокимова в 2012 и 2013 гг. проведён набор биоматериала у 169 пациентов, которые проходили лечение. Из всего собранного материала 49 образцов были исследованы. Пациенты были разделены на 3 группы в соответствии с поставленным диагнозом. Группа с верифицированным РПЖ составила 28 пациентов в возрасте 51–81 года с клинической стадией болезни рT2аN0M0–T3вN1M0. Стадирова-ние выполнялось по результатам па-тогистологического исследования после радикальной простатэктомии. Группа сравнения включала 13 пациентов с ДГПЖ в возрасте 56–82 лет. В контрольную группу вошли 8 условно здоровых индивидуумов в возрасте 29–54 лет. Помимо определения уровня PCA3 у пациентов с РПЖ и ДГПЖ проводили исследование содержания общего ПСА в сыворотке крови с использованием стандартных методов. После массажа ПЖ производился сбор 20–40 мл первой порции мочи. Исследуемая моча (10 мл) подвергалась центрифугированию с добавлением к клеточному осадку лизирующего буфера. Дизайн ДНК-олигонуклеоти-дов для применения в качестве праймеров и зондов в реакциях ПЦР проводился с использованием программ «PerlPrimer v. 1.1.19» и «CLC DNA Workbench 6». Уникальность ПЦР-праймеров проверяли посредством поиска их последовательно-

стей в базе данных «GenBank» при помощи алгоритма «BlastN». Выделение тотальной РНК из биоптатов (около 25 мг ткани ПЖ) и осадков мочи (полученных при центрифугировании 10 мл мочи) производили с применением набора «RNeasy mini kit» (Qiagen, Голландия) в соответствии с рекомендациями изготовителя. ОТ тотальной РНК осуществляли при помощи набора «RevertAid™ Premium First Strand cDNA Synthesis» (Fermentas, Литва) в соответствии с протоколом изготовителя. В качестве праймеров для ОТ использовали смесь олигонуклеотидов KLK3-R1 и PCA3-R3 в концентрации каждого 1 мкМ. Постановку ОТ-ПЦР-РВ осуществляли с использованием 2,5Х ПЦР-смесей (Синтол, Россия). Для анализа кривых плавления ПЦР-продуктов, полученных с использованием праймеров под PCA3 и KLK3, применяли реакционную смесь того же производителя с добавлением интеркалирующего красителя EvaGreen. В реакционные смеси объемом 20 мкл добавляли 1 мкл препарата кДНК и смесь 4 праймеров и 2 зондов (PCA3 и KLK3) до финальной концентрации каждого 0,2 мкМ. ПЦР проводили в приборе «C1000» c оптическим модулем «CFX96» (BioRad, США) согласно следующей программе:
-
• первичная денатурация — 95°С, 5 мин;
-
• денатурация — 94°С, 15 с;
-
• отжиг и элонгация — 60°С, 60 с. Длительность программы составила 45 циклов. Калибровочные кривые для значений порогового цикла Ct строили с использованием серийных 10-кратных разведений ДНК-матриц (кДНК или плазмид-ных ДНК). Расчеты относительных уровней мРНК осуществляли в программе «Microsoft Excel».
Клонирование полученных ПЦР-продуктов производили с применением вектора pAL-TA (Евроген, Россия) при помощи стандартных методов молекулярного клонирования.
Анализ результатов проводили с использованием методов описательной статистики и коэффициента корреляции R2 в программном пакете «LibreOffice Calc», «Microsoft Excel 2010». Количественные данные представлены в формате: среднее (M) ± стандартная ошибка среднего (m). Построение диаграмм проводили в приложении «SciDAVis».
РЕЗУЛЬТАТЫ
В ходе настоящего исследования была разработана тест-система для проведения ОТ-ПЦР-РВ, предназначенная для одновременной детекции в одной пробирке мРНК-продуктов двух генов — PCA3 и KLK3 (ген, кодирующий белок ПСА). Определение относительного уровня экспрессии мРНК гена PCA3 с помощью созданной тест-системы осуществляется путем сравнения значения порогового цикла амплификации PCA3 со значением порогового цикла для мРНК гена KLK3, являющегося конститутивно экспрессирующимся РНК-маркером клеток ПЖ. Таким образом, уровень экспрессии мРНК PCA3 выражается как отношение PCA3/KLK3. Превышение данного параметра над референсными значениями будет указывать на малигнизацию клеток предстательной железы. В качестве мишени для амплификации на матрице кДНК гена PCA3 был выбран участок экзон-экзонного соединения между экзонами 2 и 3. Таким образом, была снижена вероятность амплификации на матрице остаточных количеств геномной ДНК, присутствующей в препаратах РНК и кДНК из ПЖ и мочи. Мишенью для амплификации на матрице гена KLK3 был избран участок соединения экзонов 1 и 2. Данный район присутствует во всех изоформах мРНК, синтезирующихся с гена KLK3 (рис. 1).
ал _______ WHK ______ i№. ______ I ЛЯО l ______ іЙДЖ mu* Lfl*

Рис.1. Структура генов PCA3 (А) и KLK3 (Б).
Примечание. Экзоны обозначены прямоугольниками, интроны — стрелками. Для гена KLK3 приведены 4 альтернативные формы мРНК
Для изучения специфичности и чувствительности тест-системы, состоящей из 2 пар праймеров и 2 Taqman-зондов, комплементарных мРНК генов PCA3 и KLK3 человека, были проведены испытания на 6 модельных образцах биоматериала, представляющих собой биоптаты предстательной железы, полученные от больных с верифицированным диагнозом РПЖ. Образцы комплементарной дезоксирибонуклеиновой кислоты (кДНК), выделенные из перечисленных образцов, были использованы для приготовления серийных 10-кратных разведений в диапазоне 100–10–4 и протестированы с использованием созданной тест-системы. Для определения достоверности количественной детекции и эффективности амплификации целевых фрагментов кДНК построены калибровочные графики зависимости порогового цикла Ct от относительной концентрации кДНК. Было показано, что коэффициент корреляции R2 для генов PCA3 и KLK3 превышает 0,99, а эффективность амплификации во всех случаях близка к 100% (рис. 2).
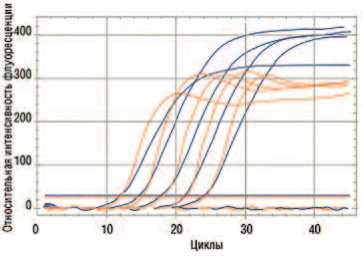
Рис.2. Кривые амплификации, полученные с использованием созданной тест-системы и набора из 5 разведений кДНК из рака ПЖ.
Примечание. Синие кривые — KLK3, оранжевые кривые — PCA3
Для изучения специфичности ПЦР-амплификации фрагментов кДНК генов PCA3 и KLK3 выполнили анализ кривых плавления и провели электрофорез полученных ПЦР-про-дуктов. Результаты эксперимента представлены на рисунке 3. Как видно, оба ПЦР-продукта (PCA3 и KLK3) представляют собой гомогенные фрагменты ДНК с ожидаемой молекулярной массой и температурой плавления (87,5 и 86 °С), соответствующей □
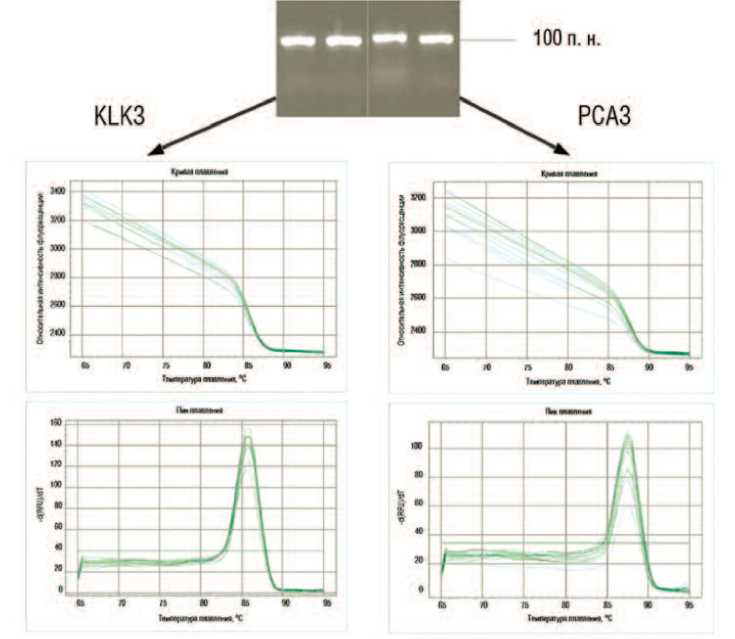
Рис.3. Электрофорез и анализ кривых плавления ПЦР-продуктов генов PCA3 и KLK3, полученных на матрице образца кДНК из биопсии рака ПЖ с использованием разработанной тест-системы.
Примечание. П.н. — пар нуклеотидов
расчетной (рассчитана по последовательности фрагментов с использованием программы «PerlPrimer»).
Среднее значение индекса PCA3 у группы пациентов с РПЖ составило 135,55±31,02, у пациентов с ДГПЖ — 41,89±17,72, а у лиц контрольной группы — 3,17±3,12 (табл. 1). Медианы индексов PCA3 были равны 82,3;
Таблица1. Корреляция индекса РСА3 с другими показателями пациентов
|
Параметры |
Группы пациентов |
||
|
РПЖ |
ДГПЖ |
Условно здоровые |
|
|
Возраст |
51-81 |
56-82 |
36-58 |
|
Объем ПЖ, см3 |
20 - 87 (41,5) |
35 - 138 (78) |
13- 35 (23) |
|
Общий ПСА,нг/мл |
4,41 - 25,0 (10,2) |
1,7 - 6,94 (4,5) |
0,4 - 2,7 (0,9) |
|
Индекс РСА3 |
1,62-652,19 (135,72) |
0,1-231,87 (41,9) |
0,07-13,0 (3,9) |
|
Количество пациентов |
28 |
13 |
8 |
|
Сумма Глисона |
Индекс РСА3 |
||
|
3+3=6 |
7 пациентов |
1,62 – 177,36 (59,15) |
|
|
3+4=7 |
13 пациентов |
4,77 – 652,19 (139,12) |
|
|
4+3=7 |
7 пациентов |
7,6 – 628,91 (164,89) |
|
|
4+4=8 |
0 пациентов |
------------------------ |
|
|
4+5=9 |
0 пациентов |
------------------------ |
|
|
патоморфоз |
1 пациент |
282,94 |
|
|
Стадия после РПЭ |
|||
|
Т2аN0М0 |
1 пациент |
2,86 |
|
|
Т2вN0М0 |
1 пациент |
177,17 |
|
|
Т2сN0М0 |
13 пациентов |
1,62 – 652,19 (131,008) |
|
|
Т3аN0М0- Т3вN0М0 |
13 пациентов |
4,77 – 628, 91 (147,021) |
|
20,56 и 0,11 соответственно в 1-й, 2-й и 3-й группах. Средние значения концентрации ПСА в сыворотке, определенные у групп пациентов с РПЖ и ДГПЖ, составили 4,4±0,53 и 9,86±1,3 нг/мл, соответственно (рис. 4).
При анализе результатов индекса РСА3 различных групп паци-
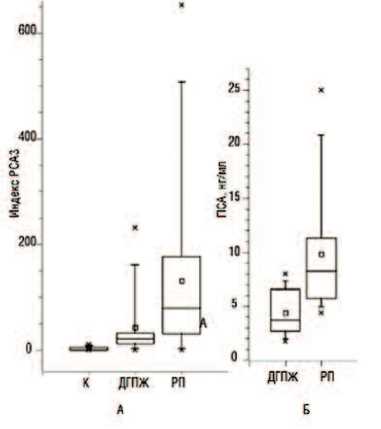
Рис.4. «Ящичковые» диаграммы распределения значений индекса PCA3 (А) и сывороточных концентраций ПСА (Б) в обследуемых группах пациентов. Примечание. К — контрольная группа; ДГПЖ — группа пациентов с ДГПЖ; РП — группа пациентов с раком ПЖ. «Ящички» соответствуют диапазонам значений в 25–75-м центилях, «усы» — в 5–95-м центилях, крестиками отмечены крайние значения. Средние обозначены квадратами, медианы — перекладинами
ентов получена статистически достоверная разница уровня баллов РСА3 между группами РПЖ и ДГПЖ (р<0,01), РПЖ и контрольной группой (р<0,0001). Уверенной статистически достоверной разницы индекса РСА3 между группой ДГПЖ и контрольной группой не получено (р=0,059). Выраженной корреляции между значениями индекса PCA3 и сывороточными концентрациями ПСА также обнаружено не было (р=0,18). Не получено корреляций и между уровнем индекса РСА3 группы РПЖ и баллами гистологического материала по системе градации Глисона (р=0,337), не получено убедительной корреляции между индексом РСА3 и стадией заболевания (р=0,0568), процентом пораженной ткани ПЖ (р=0,069). Исходя из полученных данных, было выбрано пороговое значение индекса PCA3, равное 50. Превышение индекса PCA3 над пороговым значением (диагностическая чувствительность теста) было обнаружено у 75% больных с верифицированным диагнозом РПЖ. В то же время специфичность теста составила 87,5%. Для сравнения, специфичность теста ПСА (с пороговым значением 4 нг/мл) в данной когорте больных оказалась равной лишь 68,75%. Негативная предсказательная ценность теста PCA3 составила 67%. Среди пациентов группы РПЖ и индексом PCA3 ниже порогового значения 5 больных имели очень низкие значения индекса PCA3 (1,52–7,6), а еще двое — значения, приближающиеся к 50 (29,75 и 32,37). В группе больных с ДГПЖ большинство пациентов имели значения индекса PCA3 в интервале от 10 до 40. В то же время в 2 образцах были выявлены высокие значения индекса (114,61 и 231,87), что может быть связано с наличием не-диагностированной злокачественной опухоли. Значения индекса PCA3 в группе пациентов, не имеющих РПЖ или ДГПЖ, находились в диапазоне от 0 до 9,4.
ОБСУЖДЕНИЕ
Несмотря на существующее многообразие новых неинвазивных методов ранней диагностики РПЖ, определение общего ПСА с %fPSA, ПРИ, ТРУЗИ с последующей трансректальной биопсией ПЖ остаются основными методами в повседневной практике уролога. Рутинное измерение уровня простат-специфи-ческого антигена привело к увеличению количества выполняемых биопсий ПЖ. Снижение порога возрастных норм ПСА привело, в свою очередь, к увеличению числа т.н. «ненужных» биопсий (к гипердиагностике клинически незначимого РПЖ). В настоящее время только у 35% пациентов с уровнем общего ПСА 4-10 нг/мл удается при биопсии выявлять РПЖ, а у 20-25% мужчин имеет место “ПСА-негативный” РПЖ. Очевидно, что простат-специфический антиген, как самостоятельный маркер, имеет ограниченные диагностические возможности. В этой связи очевидна необходимость в поиске новых чувствительных, специфичных и неинвазивных методов, позволяющих проводить диагностику РПЖ на ранних стадиях развития заболевания, необходимость в увеличении процента позитивных биоп- сий и сокращении количества т.н. «ненужных» биопсий, дифференцировке «клинически значимого» от «клинически незначимого» РПЖ, необходимость в сокращении количества пациентов, которым показано активное лечение.
По разным литературным данным, чувствительность тест-систем ПСА достаточно высока – 68,494,0%, а специфичность является низкой и составляет не более 4457,9%. При апробации в 2002 году тест-системы РСА3 первого поколения в Голландии в исследовании приняло участие 108 пациентов, при этом чувствительность теста PCA3 составила 67%, а специфичность – 83%, что позволило сделать вывод о клинической перспективности нового диагностического теста [16]. Schilling D. et al. в 2010 году опубликовали данные своего исследования, в котором при чувствительности тест-системы РСА3 в 90% специфичность составила 36%, негативная предсказательная ценность 83% [32]. Диагностическая чувствительность нашего теста составила предварительно 75% , в то же время специфичность – 87,5%. Негативная предсказательная ценность теста на PCA3 составила 67%.
В настоящее время индекс в 35 баллов является установленным пороговым значением современных тест-систем РСА3 [20, 21, 22, 23]. Haese А. et al. в 2008 году опубликовали результаты большого популяционного исследования, проведенного в Европе на большой когорте больных, перенесших повторную биопсию ПЖ. В этом исследовании в 39% случаев с индексом РСА3≥35 был выявлен РПЖ, по данным гистологического заключения, и только в 22% – с индексом РСА3<35 (р=0,001)[22]. Galasso F. et al. в 2010 году опубликовали результаты итальянского мультицентрового исследования, в котором у 445 пациентов был выявлено значения индекса РСА3 ≥35 (48,2%), у 472 пациентов – <35 (51,58%). Из 443 больных 105 пациентам была выполнена биопсия ПЖ или повторная биопсия ПЖ. Иссле- дователи обнаружили, что у 27 пациентов (25,71%) РПЖ не выявлен, у 37 (35,24%) выявлен ASAP либо высокий ПИН, а у 41 больного (39,05%) выявлена аденокарцинома ПЖ. Среднее значение индекса РСА3 в группе негативных биопсий составило 54,9 баллов, в группе диагностированного РПЖ – 141,6 баллов, а в группе ASAP и ПИН значение индекса было промежуточным и составило 79,6 баллов. Пороговым значением индекса РСА3 было выбрано (подтверждено) 35 баллов [33].
Вместе с тем, оптимальный пороговый уровень до последнего времени остается дискутабельным. Некоторые публикации свидетельствуют, что пороговое значение 20-25 баллов может быть более предпочтительным, позволяющее улучшить диагностику РПЖ. Ruffion A. et al. и Hansen J. et al. в 2013 году включили в построение своих номограмм индекс РСА3 с пороговым значением 21 и 35 баллов [30, 31].
Выбранный порог в 50 баллов в нашем исследовании предварительный, обусловленный, в первую очередь, небольшим количеством материала и особенностями отечественной тест-системы.
ВЫВОДЫ
Создан образец диагностической тест-системы для ранней неинвазивной диагностики рака предстательной железы, основанной на количественной детекции мРНК гена PCA3 в осадке мочи методом ОТ-ПЦР-РВ. Отработана методика его применения совместно с детектирующим термоциклером «CFX96» (BioRad, США). Установлена высокая аналитическая специфичность и чувствительность разработанного метода по выявлению специфических фрагментов мРНК. Показана возможность использования разработанной тест-системы для обнаружения мРНК гена PCA3 в осадках мочи и способность тест-системы выявлять значительное превышение параметра PCA3/KLK3 в образцах биоматериала, полученных в от больных РПЖ, по сравнению с образцами от здоровых людей. В ходе проведенных исследований обнаружены достаточно высокие показатели диагностической чувствительности, специфичности и негативной предсказательной ценности для раннего неинвазивного скринингового выявления РПЖ. На основании полученных данных можно сделать вывод о целесообразности выполнения дальнейших лабораторных исследований, направленных на совершенствование тест-системы, уточнение ее аналитических характеристик и диагностической ценности, а также проведения клинических испытаний полученной тест-системы на расширенном контингенте пациентов.
Применение РСА3 в повседневной практике может способствовать увеличению специфичности диагностики РПЖ и уменьшить количество «ненужных» биопсий ПЖ. Несмотря на значительное число печатных работ, посвященных данной проблеме, их количество продолжает увеличиваться, но четких руководств к действию в этой области пока не существует, и решение по каждому конкретному случаю принимается индивидуально. Не определены оп- тимальные сроки к определению индекса РСА3 после первичной биопсии ПЖ, оптимальные сроки и показания к определению индекса РСА3 в рамках активного наблюдения группы клинически незначимого РПЖ. Не изучена возможность использования РСА3, вместе с индивидуальными данными обследования пациента, с индексом PHI или %-2proPSA, а также многие другие нюансы. Необходимо отметить, что существующие в Европе тест-системы PCA3 являются дорогостоящими и в Российской Федерации не представлены. □
Резюме:
Список литературы Российская тест-система РСА3: первые результаты
- Говоров А.В. Оптимизация трансректальной биопсии простаты в диагностике рака предстательной железы: Автореф. дис.. канд. мед. наук. М., 2002. 17 с.
- Hodge K.K., McNeal J.E., Terris M.K., Stamey T.A. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate.//J Urol. 1989. Vol. 142. P. 71-75.
- Hammerer P., Huland H. Systemic sextant biopsies in 651 patients referred for prostate evaluation.//J Urol. 1994. Vol. 151, N 1. P. 99-102.
- Svetec D., McCabe K., Peretsman S., Klein E., Levin H., Optenberg S., Thompson I. Prostate rebiopsy is a poor surrogate of treatment efficacy in localized prostate cancer.//J Urol. 1998. Vol. 159, N 5. P. 1606-1608.
- Guichard G., Larré S., Gallina A., Lazar A., Faucon H., Chemama S., Allory Y., Patard J.J., Vordos D., Hoznek A., Yiou R., Salomon L., Abbou C.C., de la Taille A. Extended 21-sample needle biopsy protocol for diagnosis of prostate cancer in 1000 consecutive patients.//Eur Urol. 2007. Vol. 52. P 430-435.
- Singh H., Canto E.I., Shariat S.F., Kadmon D., Miles B.J., Wheeler T.M., Slawin K.M. Predictors of prostate cancer after initial negative systematic 12 core biopsy.//J Urol. 2004. Vol. 171. P. 1850-1854.
- Olivier C., Bernard М. Biomarkers of Aggressiveness in Prostate Cancer.//in book “Prostate Cancer -Diagnostic and Therapeutic Advances” [Ed. Dr. Philippe E. Spiess]. 2011. P. 3-20.
- Bussemakers M.J., van Bokhoven A., Verhaegh G.W., Smit F.P., Karthaus H.F., Schalken J.A., Debruyne F.M., Ru N., Isaacs W.B. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer.//Cancer Res. 1999. Vol. 59, N 23. P. 5975-5979.
- Bourdoumis A., Papatsoris A.G., Chrisofos M., Efstathiou E., Skolarikos A., Deliveliotis C. The novel prostate cancer antigen 3 (PCA3) biomarker.//Int Braz J Urol. 2010. Vol. 36, N 6. P. 665-668.
- Day J.R., Jost M., Reynolds M.A., Groskopf J., Rittenhouse H. PCA3: from basic molecular science to the clinical lab.//Cancer Lett. 2011. Vol. 301, N 1. P. 1-6.
- de Kok J.B., Verhaegh G.W., Roelofs R.W., Hessels D., Kiemeney L.A., Aalders T.W., Swinkels D.W., Schalken J.A. DD3 (PCA3), a very sensitive and specific marker to detect prostate tumors.//Cancer Res. 2002. Vol. 62, N 9. P. 2695-2698.
- Fradet Y., Saad F., Aprikian A., Dessureault J., Elhilali M., Trudel C., Mâsse B., Piché L., Chypre C. uPM3, a new molecular urine test for the detection of prostate cancer.//Urology. 2004. Vol. 64, N 2. P. 311-315.
- Tinzl M., Marberger M., Horvath S., Chypre C. DD3 PCA3 RNA analysis in urine-a new perspective for detecting prostate cancer.//Eur Urol. 2004. Vol. 46, N 2. P. 182-186.
- Deras I.L., Aubin S.M., Blase A., Day J.R., Koo S., Partin A.W., Ellis W.J., Marks L.S., Fradet Y., Rittenhouse H., Groskopf J. PCA3: a molecular urine assay for predicting prostate biopsy outcome.//J Urol. 2008. Vol. 179, N 4. P 1587-1592.
- Groskopf J., Aubin S.M., Deras I.L., Blase A., Bodrug S., Clark C., Brentano S., Mathis J., Pham J., Meyer T., Cass M., Hodge P., Macairan M.L., Marks L.S., Rittenhouse H. APTIMA PCA3 molecular urine test: development of a method to aid in the diagnosis of prostate cancer.//Clin Chem. 2006. Vol. 52, N 6. P 1089-1095.
- Haese A., de la Taille A., van Poppel H., Marberger M., Stenzl A., Mulders P.F., Huland H., Abbou C.C., Remzi M., Tinzl M., Feyerabend S., Stillebroer A.B., van Gils M.P., Schalken J.A. Clinical utility of the PCA3 urine assay in European men scheduled for repeat biopsy.//Eur Urol. 2008. Vol. 54, N 5. P 1081-1088.
- Marks L.S., Bostwick D.G. Prostate Cancer Specificity of PCA3 Gene Testing: Examples from Clinical Practice.//Rev Urol. 2008. Vol. 10, N 3. P. 175-181.
- van Gils M.P., Hessels D., van Hooij O., Jannink S.A., Peelen W.P., Hanssen S.L., Witjes J.A., Cornel E.B., Karthaus H.F., Smits G.A., Dijkman G.A., Mulders P.F., Schalken J.A. The time-resolved fluorescence-based PCA3 test on urinary sediments after digital rectal examination; a Dutch multicenter validation of the diagnostic performance.//Clin Cancer Res. 2007. Vol. 13, N 3. P 939-943.
- van Gils M.P., Hessels D., Hulsbergen-van de Kaa C.A., Witjes J.A., Jansen C.F., Mulders P.F., Rittenhouse H.G., Schalken J.A. Detailed analysis of histopathological parameters in radical prostatectomy specimens and PCA3 urine test results.//Prostate. 2008. Vol. 68. P 1215-1222.
- Auprich M., Chun F.K., Ward J.F., Pummer K., Babaian R., Augustin H., Luger F., Gutschi S., Budäus L., Fisch M., Huland H., Graefen M., Haese A. Critical assessment of preoperative urinary prostate cancer antigen 3 on the accuracy of prostate cancer staging.//Eur Urol. 2011. Vol. 59. P 96-105.
- van Poppel H., Haese A., Graefen M., de la Taille A., Irani J., de Reijke T., Remzi M., Marberger M. The relationship between Prostate CAncer gene 3 (PCA3) and prostate cancer significance.//BJU Int. 2012. Vol. 109, N 3. P. 360-366.
- Chun F.K., de la Taille A., van Poppel H., Marberger M., Stenzl A., Mulders P.F., Huland H., Abbou C.C., Stillebroer A.B., van Gils M.P., Schalken J.A., Fradet Y., Marks L.S., Ellis W., Partin A.W., Haese A. Prostate cancer gene 3 (PCA3): Development and internal validation of a novel biopsy nomogram.//Eur Urol. 2009. Vol. 56. P. 659-668.
- Wu A.K., Reese A.C., Cooperberg M.R., Sadetsky N., Shinohara K. Utility of PCA3 in patients undergoing repeat biopsy for prostate cancer.//Prostate Cancer Prostatic Dis. 2012. Vol. 15. P 100-105.
- Hansen J., Auprich M., Ahyai S.A., de la Taille A., van Poppel H, Marberger M., Stenzl A., Mulders P.F., Huland H., Fisch M. Initial prostate biopsy: Development and internal validation of a biopsy-specific nomogram based on the prostate cancer antigen 3 assay.//Eur Urol. 2013. Vol. 63. P 201-209.
- Ruffion A., Devonec M., Champetier D., Decaussin-Petrucci M., Rodriguez-Lafrasse C., Paparel P., Perrin P., Vlaeminck-Guillem V. PCA3 and PCA3-Based nomograms improve diagnostic accuracy in patients undergoing first prostate biopsy.//Int J Mol Sci. 2013. Vol. 14, N 9. P. 17767-17780.
- Schilling D., Hennenlotter J., Munz M., Bökeler U., Sievert K.D., Stenzl A. Interpretation of the prostate cancer gene 3 in reference to the individual clinical background: implications for daily practice.//Urol Int. 2010. Vol. 85, N 2. P. 159-165.
- Galasso F., Giannella R., Bruni P., Giulivo R., Barbini V.R., Disanto V., Leonardi R., Pansadoro V., Sepe G. PCA3: a new tool to diagnose prostate cancer (PCa) and a guidance in biopsy decisions. Preliminary report of the UrOP study.//Arch Ital Urol Androl. 2010. Vol. 82, N 1. P. 5-9.


