Санитарно-гигиеническая характеристика риска и клиническая оценка причиненного вреда здоровью населения геохимической провинции при длительном поступлении мышьяка с питьевой водой
Автор: Устинова О.Ю., Шур П.З., Носов А.Е.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 4 (28), 2019 года.
Бесплатный доступ
В России геохимические провинции мышьяка расположены в Якутии, Сибири, Забайкалье, Приморье, на Урале и Чукотке. Цель исследования - санитарно-гигиеническая характеристика риска и клиническая оценка причиненного вреда здоровью населения геохимической провинции при длительном поступлении мышьяка с питьевой водой. Исследование проводилось на селитебной территории, характеризующейся повышенным содержанием мышьяка в питьевой воде системы централизованного водоснабжения. Особенности питьевой воды обусловлены составом глубоких подземных слоев земной коры. Использован комплекс санитарно-гигиенических методов, проведено клиническое обследование 147 жителей геохимической провинции. Установлено присутствие мышьяка в питьевой воде централизованного водоснабжения на уровне 50-86 ПДК, в то время как в воде децентрализованных источников его содержание не превышало 1 ПДК. Выявлено, что хроническое потребление воды с содержанием мышьяка на уровне 2,5 мг/дм3 и выше формирует неприемлемый канцерогенный (до 4,09·10-2) и неканцерогенный (HQ до 494,4) риск для здоровья населения...
Геохимическая провинция, мышьяк, питьевая вода, риск здоровью, вред здоровью, заболеваемость населения, мышьяковый меланоз, мышьяковая полинейропатия, онкологические процессы
Короткий адрес: https://sciup.org/142223300
IDR: 142223300 | УДК: 613.2: | DOI: 10.21668/health.risk/2019.4.16
Текст научной статьи Санитарно-гигиеническая характеристика риска и клиническая оценка причиненного вреда здоровью населения геохимической провинции при длительном поступлении мышьяка с питьевой водой
Хроническому воздействию повышенных концентраций мышьяка, обусловленному геохимическими особенностями территории проживания, подвержены миллионы людей по всему миру. В настоя- щее время крупные провинции медно-мышьяковых руд обнаружены в Италии, США, Швеции, Норвегии, Японии, Грузии и Казахстане; мышьяковокобальтовых – в Канаде; мышьяково-оловянных – в Боливии, Чили и Англии; золото-мышьяковых – в США и Франции. В России геохимические провинции мышьяка обнаружены в Якутии, Сибири, Забайкалье, Приморье, на Урале и Чукотке [1].
Согласно результатам научных исследований [2–5], в геохимических провинциях основным путем поступления мышьяка в организм человека является питьевая вода, а загрязнение источников питьевого водоснабжения мышьяком – ведущей гигиенической проблемой данных территорий. В настоящее время в мире наиболее сложная ситуация с качеством питьевой воды по содержанию мышьяка сложилась в Бангладеш и Восточной Бенгалии (Индия), где его концентрации в питьевой воде достигают 50 мкг/л и более, в то время как рекомендуемая ВОЗ концентрация составляет только 10 мкг/л. Согласно официальной статистике, более 20 % смертей в сельских районах Бангладеш вызвано последствиями потребления питьевой воды с высоким содержанием мышьяка [6]. Не менее сложная ситуация складывается и в отдельных районах Дагестана, где содержание мышьяка в питьевой воде достигает 222,0–504,1 мкг/дм3 [7]. В Канаде регламентированная допустимая концентрация не превышает 25 мкг/л, а в России и США – 10 мкг/л [8, 9].
Данные клинических исследований, проведенных в различных регионах Российской Федерации, свидетельствуют о том, что на территориях геохимических провинций мышьяка уровень заболеваемости населения болезнями эндокринной, мочеполовой, нервной, сердечно-сосудистой систем, желудочно-кишечного тракта и кожи в 1,3–3,8 раза выше среднероссийских показателей, а смертность в связи с онкологической патологией – в 1,2–4,7 раза [10]. Установлена достоверная связь повышенных концентраций мышьяка в питьевой воде с развитием у населения заболеваний кожи, иммунной системы и сердечно-сосудистой патологии [11].
Поступая в организм, мышьяк дезинтегриру-ет/дестабилизирует более 200 ферментов, участвующих в различных видах обмена клетки и синтезе ДНК, активирует процессы пероксидации, связывает тиольные или сульфгидрильные группы в тканевых белках, что приводит к мультисистемным поражениям с вовлечением сердечно-сосудистой и нервной систем, печени, легких, почек, селезенки, желудочно- кишечного тракта, кожи, наиболее серьезным последствием которых является канцерогенез [12, 13].
В то же время анализ отечественной и зарубежной научной литературы свидетельствует о недостаточном объеме комплексных гигиенических и клинических исследований, характеризующих связь нарушений здоровья населения геохимических провинций с длительным потреблением повышенных концентраций мышьяка с питьевой водой [13].
Целью настоящего исследования являлась санитарно-гигиеническая характеристика риска и клиническая оценка причиненного вреда здоровью населения геохимической провинции, обусловленного длительным поступлением мышьяка с питьевой водой.
Материалы и методы. Исследование проводилось на территории геохимической провинции Забайкалья (поселок городского типа), характеризующейся повышенным содержанием мышьяка в питьевой воде централизованного водоснабжения и его нормативными значениями1 в воде децентрализованных источников. Глубина скважины для централизованного водоснабжения населенного пункта составляла 100–120 м; глубина децентрализованных подземных источников водоснабжения (колодцы, придомовые скважины) не превышала 10–20 м. Качество питьевой воды системы централизованного водоснабжения и децентрализованных источников оценивалось по данным мониторинговых исследований, предоставленных территориальным ФБУЗ «Центр гигиены и эпидемиологии», а также по результатам натурных исследований, выполненных в аккредитованных лабораториях ФБУН «ФНЦ медико-профилактических технологий управления риском здоровью населения» на лицензированном оборудовании. Определение мышьяка в пробах питьевой воды, продуктах местного производства и биосредах населения (кровь) проводилось методом масс-спектрометрии с индуктивно связанной плазмой по стандартной методике с использование масс-спектрометра ICP-MS.
Оценка потенциального канцерогенного и неканцерогенного рисков здоровью населения, связанных с повышенным содержанием мышьяка в воде системы централизованного водоснабжения, выполнялась по стандартной методике в соответствии с Р 2.1.10.1920-042.
Для сравнительной оценки структуры и особенностей заболеваемости населения (в виде причиненного вреда здоровью), потребляющего питьевую воду с различным содержанием мышьяка, была сформирована группа наблюдения – 115 человек, проживающих в домах с централизованным водоснабжением и повышенным содержанием мышьяка в питьевой воде. Группу сравнения составили 32 человека, проживающих в домах с децентрализованными источниками питьевой воды и нормативным содержанием мышьяка в воде.
80,9 % обследованных группы наблюдения составляло взрослое население в возрасте от 16 лет до 81 года (средний возраст – 51,8 ± 3,6 г.); доля детей (5–15 лет) достигала 19,1 % (средний возраст – 8,3 ± 1,2 г.). В группе сравнения доля взрослого населения (16–57 лет) не превышала 46,9 % (средний возраст – 40,7 ± 7,5 г.; р = 0,67 к группе наблюдения); доля детей (5–11 лет) достигала 53,1 % (средний возраст – 7,2 ± 0,7 г.; р = 0,71 к группе наблюдения).
Время проживания взрослого населения в домах с централизованным водоснабжением составляло от 6 месяцев до 47 лет (в среднем – 22,0 ± 3,1 г.), при этом у 70,8 % обследованных – более 10 лет. Длительность проживания детей группы наблюдения колебалась от 9 месяцев до 13 лет (в среднем 6,6 ± 1,5 г.), при этом более пяти лет по указанным адресам жили 73,3 % из них. Взрослое население группы сравнения проживало по месту прописки от года до 57 лет (в среднем 21,1 ± 6,6 г.; р = 0,54 к группе наблюдения), при этом 83,3 % жили более 10 лет. Длительность проживания детского населения группы сравнения составляла от 3 до 15 лет (в среднем 6,3 ± 1,5 г.; р = 0,83 к группе наблюдения), 76,5 % из них – более пяти лет.
По социально-экономической и гендерной характеристике, этническому составу и доступности медицинской помощи обе исследуемые группы не имели достоверных различий ( р = 0,01–0,03).
Среднее суточное потребление воды взрослым населением обеих групп колебалось от 1 до 5 литров и не имело существенных различий, составляя в среднем около 2 литров (в группе наблюдения: 1,9 ± 0,2 л; в группе сравнения – 1,9 ± 0,4 л; р = 1,0); суточное водопотребление у детей в зависимости от возраста составляло от 1 до 2 литров и не имело межгрупповых различий (группа наблюдения: 1,3 ± 0,2 л; группа сравнения: 1,2 ± 0,3 л; р = 1,0).
Клинико-функциональное обследование пациентов обеих групп (клинический осмотр терапевта, педиатра, невролога и онколога, тонометрия, ЭКГ) проводилось по стандартным методикам в соответствие с правилами ICH GCP3 и с соблюдением этических норм, изложенных в Хельсинкской декларации (редакция 2008 г.).
Информация оценивалась с использованием вариационно-частотного анализа с учетом критерия Пирсона; достоверность численных значений – по критериям Фишера, Стьюдента.
Результаты и их обсуждение. Анализ мониторинговых данных о качестве воды системы централизованного водоснабжения изучаемого населенного пункта показал постоянное присутствие мышьяка в концентрациях от 0,002 до 4,3 мг/дм3 (до 86 ПДК). В воде децентрализованных источников его содержание не превышало 1 ПДК. Результаты натурных исследований подтвердили присутствие в воде системы централизованного водоснабжения повышенных концентраций мышьяка на уровне 2,5 мг/дм3 (50 ПДК) и его нормативное содержание в воде децентрализованных источников (менее 0,05 мг/дм3). В ходе исследования пищевых продуктов местного производства было установлено соответствие содержания мышьяка уровню гигиенических нормативов: морковь – 0,0042 ± 0,0003 мг/кг; картофель – не обнаружено; свекла – не обнаружено (максимальный допустимый уровень (МДУ) для овощей – менее 0,2 мг/кг); рыба местных водоемов – не обнаружено (МДУ для пресноводной рыбы – менее 1,0 мг/кг).
Оценка пожизненного канцерогенного риска, обусловленного потреблением питьевой воды с повышенным содержанием мышьяка, показала, что его уровень в группе наблюдения являлся неприемлемым и составлял для взрослых 4,09·10–2, а для детей – 1,91·10–2. В отношении неканцерогенных рисков установлено существенное превышение допустимого значения коэффициентов опасности мышьяка как для взрослых, так и для детей ( HQ = 494,4 и HQ = 211,9 соответственно), свидетельствующих о риске развития у населения заболеваний кожи, сердечно-сосудистой, нервной, иммунной систем и желудочно-кишечного тракта.
Оценка риска здоровью представителей группы сравнения позволила установить, что уровень канцерогенного риска как для взрослого, так и для детского населения находился в интервале от пренебрежимо малого до предельно допустимого (1·10–6< CR < 1·10–4), однако у детского населения коэффициент опасности развития неканцерогенных эффектов превышал допустимый ( HQ = 1,1), что свидетельствовало о риске развития болезней кожи ( HI = 1,66), иммунной, нервной, сердечно-сосудистой ( HI = 1,14–1,66) систем ( HI = 1,10) и желудочнокишечного тракта ( HI = 1,1).
Для выявления случаев причинения вреда здоровью жителям исследуемого населенного пункта, обусловленного хронической пероральной экспозицией мышьяка, выполнен сравнительный анализ результатов химико-аналитического и клинического обследования представителей группы наблюдения и сравнения.
Результаты химико-аналитического исследования сыворотки крови показали, что медиана содержания мышьяка у взрослого населения группы наблюдения составляла 0,0065 мг/л, а у детей – 0,0049 мг/л, что соответствовало среднероссийскому уровню (0,0017–0,0154 мг/л)4. В то же время у 7,9 % взрослых и 18,8 % детей группы наблюдения индивидуальные показатели содержания мышьяка в сыворотке крови превышали верхнюю границу критерия сравнения и составляли у взрослого населения от 0,0171 до 0,0636 мг/л, а у детей – от 0,0162 до 0,0377 мг/л. В группе сравнения только у одного взрослого пациента содержание мышьяка в сыворотке крови превышало среднероссийский показатель и достигало 0,0162 мг/л; у всех обследованных детей группы сравнения индивидуальные показатели были в 4,7–15,0 раза ниже верхней границы среднего содержания мышьяка в плазме крови человека.
Изучение анамнеза показало наличие у каждого пятого обследованного (в группе наблюдения – 18,3 %; в группе сравнения – 18,8 %; р = 0,88) семейной отягощенности по онкопатологии у родственников I и II линии. В обеих группах наиболее частой локализацией онкологического процесса являлись: молочная железа, органы пищеварения, легкие, однако ни одного случая рака кожи в семейном анамнезе не было установлено.
Ретроспективный анализ данных о перенесенных заболеваниях позволил установить, что в группе наблюдения у 6,1 % пациентов ранее были диагностированы онкологические процессы (базалиома и меланома кожи, рак матки, почки, молочной железы); в группе сравнения только у одной пациентки
(3,1 %; р = 0,72) ранее была диагностирована база-лиома. В целом реализация онкологических процессов в группе наблюдения происходила в 2,0 раза чаще, чем в группе сравнения ( OR = 2,12; р = 0,04).
Наиболее частой жалобой пациентов группы наблюдения являлось изменение цвета кожных покровов: появление дискретно/тотально расположенных очагов гиперпигментации (0,2–0,7 см) или депигментации (0,3–0,4 см – чаще у детей); интенсивная пигментация сосков у женщин, вплоть до черного или темно-коричневого цвета; пигментация и огрубение подмышечных и паховых складок; появление на лице, шее, груди, затылочной области пигментированных, реже гиперемированных, пятен до 5,0 см в диаметре. У взрослого населения дерматологические симптомы в каждом третьем случае сочетались с гиперкератозом ладоней и/или стоп. Из 115 человек группы наблюдения у 44,4 % пациентов (9 детей и 42 взрослых) на момент осмотра имелись клинические признаки арсеникоза кожи в виде пойкилодермии или мышьякового ме-ланоза/лейкомеланоза (рисунок).
Большинство пациентов отмечали, что первые признаки изменения кожи появились за 3–5 лет до настоящего исследования. В ходе клинического осмотра у 9,6 % пациентов группы наблюдения были выявлены симптомы полинейропатии, при этом у 2/3 пациентов клинические проявления полинейропатии сочетались с симптомами поражения кожи. В группе сравнения жалоб на пигментацию/депиг-ментацию кожи не предъявлял ни один из осмотренных пациентов; кроме того, в ходе клинического обследования убедительных данных за наличие ар-сеникоза кожи и/или полинейропатии не было установлено ни у одного пациента.
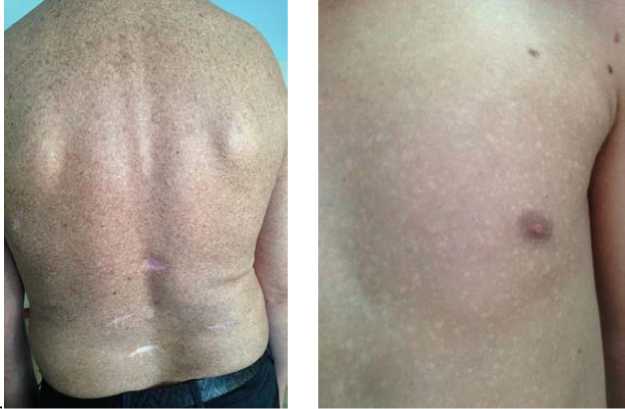
а б
Рис. Арсеникоз кожи в виде пойкилодермии ( а ) и лейкомеланоза ( б )
Для уточнения распространенности коморбид-ной арсеникозу кожи патологии было проведено клинико-анамнестическое и функциональное обследование пациентов. Данные обследования показали, что повышенное АД (выше 140/90 мм рт. ст.) было зафиксировано у 44,9 % пациентов группы наблюдения, гипотония (ниже 100/60 мм рт. ст.) – у 8,2 %. Диагнозы хронических заболеваний сердечнососудистой системы (гипертоническая болезнь, ишемическая болезнь сердца) были установлены у 15,7 % пациентов. Вариант физиологической нормы электрокардиограммы имел место только у 43,3 % обследованных детей, в то время как у 56,7 % зафиксированы различные нарушения синусового ритма. У взрослого населения нормальный вариант ЭКГ встречался не более чем у 27 % обследованных. Доминирующей формой патологии являлись дисме-таболические и рубцовые изменения миокарда (39,9 %), у 18,6 % имело место нарушение функции синусового узла, у 14,4 % – патология проводящей системы. В группе сравнения повышенное АД было зафиксировано только у 21,9 % пациентов, гипотония – у 3,1 %, что в 2–3 раза реже, чем в группе наблюдения ( р = 0,02). Диагнозы хронических заболеваний сердечно-сосудистой системы были установлены у 12,5 % пациентов, что не отличалось от группы наблюдения ( р = 0,78). По данным ЭКГ-исследования у 55,0 % детей этой группы имел место физиологический вариант электрокардиограммы ( р = 0,69 к группе наблюдения); однако основной формой патологии (40,0 %) являлись только различные нарушения синусового ритма ( р = 0,38). У взрослого населения нормальный вариант ЭКГ встречался в 2,7 раза чаще (у 71,0 %), чем в группе наблюдения, а дисметаболические и рубцовые изменения миокарда регистрировались в два раза реже (19,4 %; р = 0,04), при этом нарушение функции синусового узла (у 3,2 %) и патология проводящей системы (6,4 %) встречались как исключение ( р = 0,02–0,03). В целом артериальная гипертензия развивалась у пациентов группы наблюдения в два раза чаще, чем в группе сравнения ( OR = 2,14; р = 0,03), а поражения миокарда – в девять раз ( OR = 9,23; р = 0,01).
В целом причиненный вред здоровью в 44,4 % случаев оценен как тяжелый (онкологические процессы, полинейропатия, мышьяковый меланоз), в 46,3 % – как средний (мышьяковая дисхромия), в 9,3 % – как легкий (вегетососудистая дистония, функциональные расстройства нервной системы).
Результаты исследования показали, что в изучаемой геохимической провинции население, потребляющее воду из глубоких скважин, подвергается большей экспозиции мышьяка, чем те, кто использует воду из неглубоких колодцев. Это связано, по-видимому, с залежами мышьяковой руды на большей глубине. Аналогичные сведения приводят и другие авторы, изучавшие особенности геохимических провинций в Индии и Чили [3, 4]. Согласно полученным результатам, в воде, поднятой с глубины 100 м и более, содержание мышьяка достигает 50–86 ПДК, в то время как с глубины 10–20 м – соответствует гигиеническим нормативам. Подтверждением опасности глубоких подземных вод исследованной геохимической провинции являются и результаты оценки продуктов местного производства: в овощах, для полива которых население использует воду поверхностных водоемов и неглубоких скважин, а также в рыбе местных пресноводных водоемов содержание мышьяка соответствует требованиям безопасности.
Данные химико-аналитического исследования показали, что концентрации мышьяка в средах быстрого реагирования (сыворотка крови) у населения, длительное время потребляющего питьевую воду системы централизованного водоснабжения с повышенным содержанием мышьяка, достоверно превышают аналогичные у лиц, проживающих в домах с децентрализованной подачей воды. Кроме того, установлено, что у каждого четвертого обследованного группы наблюдения (26,7 %) содержание мышьяка в сыворотке крови существенно превышает среднероссийский показатель.
Выполненная оценка потенциального риска здоровью, связанного с повышенным содержанием мышьяка в воде системы централизованного водоснабжения исследуемого населенного пункта, показала неприемлемый уровень канцерогенного (до 4,09·10–2) и неканцерогенного ( HQ до 494,4) риска. В отношении неканцерогенного риска установлено существенное превышение допустимого значения коэффициентов опасности мышьяка как для взрослых, так и для детей ( HQ = 494,4 и HQ = 211,9 соответственно), свидетельствующих о повышенной вероятности развития у населения заболеваний кожи, сердечно-сосудистой, нервной, иммунной систем и желудочно-кишечного тракта. Следует подчеркнуть, что для лиц, потребляющих воду из децентрализованных источников, величина канцерогенного риска не превышала предельно допустимый уровень, а коэффициент опасности был равен 1,1 ( HQ = 1,1).
Хроническая интоксикация мышьяком, по данным литературы, имеет многообразную клиническую картину, обусловленную системным поражением организма человека [13]. Согласно данным литературы, клинические проявления арсеникоза манифестируют, как правило, при длительной экспозиции [14–16]. Латентный период после воздейст- вия может длиться до 60 лет [17]. В ходе настоящего исследования было установлено, что средняя продолжительность экспозиции мышьяком составляла у взрослого населения изучаемой геохимической провинции более 20 лет, а у детей – около семи лет, при этом первые признаки заболевания манифестировали у взрослых через 15–17 лет, а у детей – через четыре года.
Дерматологические признаки арсеникоза и полинейропатия являются наиболее частыми проявлениями заболевания [14, 16]. В нашем исследовании у 44,4 % лиц, потреблявших воду сети централизованного водоснабжения, выявлен симптомоком-плекс арсеникоза кожи: наличие дискретно/тотально расположенных очагов гиперпигментации или депигментации; интенсивная пигментация сосков у женщин; пигментация и огрубение подмышечных и паховых складок; появление на лице, шее, груди, затылочной области пигментированных, реже ги-перемированных, пятен; у 9,6 % – имелись признаки полинейропатии. Следует подчеркнуть, что у лиц, потреблявших воду из децентрализованных источников, признаков арсеникоза кожи или случаев полинейропатии не было установлено. Таким образом, у лиц, потребляющих воду с содержанием мышьяка на уровне 50 ПДК и выше, в каждом втором случае реализуется дерматологическая или неврологическая форма арсеникоза.
По данным литературы [21–23], хроническое воздействие повышенных концентраций мышьяка сопровождается ростом патологии сердечно-сосудистой системы. Исследованиями, проведенными в «арсеникозно-гиперэндемических деревнях» Тайваня, была установлена связь между случаями диагностированной у населения ишемической болезни сердца и длительным воздействием мышьяка [24]. Результаты клинических и патоморфологических исследований свидетельствуют о том, что мышьяк вызывает прямое повреждение миокарда, нарушения сердечного ритма, кардиомиопатию [25, 26]. В ходе настоящего исследования получены аналогичные данные: установлено, что у взрослого и детского населения, потребляющего длительное время воду с повышенным содержанием мышьяка, частота развития артериальной гипертензии, дисметаболических изменений миокарда, нарушений функции синусового узла и проводимости возрастает в 2–9 раз.
Одним из наиболее серьезных последствий хронического воздействия больших доз мышьяка является канцерогенный эффект [27]. В Бангладеш и Индии мышьяк ассоциирован с раком кожи, легких, печени, почек и мочевого пузыря [28, 29]. Аналогичные данные получены в странах Южной Америки, Центральной Африки, Европы [30]. Механизмы арсе-никозного канцерогенеза, хотя и не полностью определены, возможно, обусловливают неблагоприятное влияние на репарацию и метилирование ДНК, стимулируют образование свободных радикалов и активацию протоонкогена c-myc, выступают в качестве соканцерогена, промотора опухоли или прогрессирующего опухолевого процесса [31]. Результаты настоящего исследования показали, что при хронической экспозиции мышьяка реализация онкологических процессов наступает в 2,0 раза чаще, чем у лиц, потребляющих воду с нормативным его содержанием.
Обобщая результаты настоящего исследования, следует отметить, что в геохимических провинциях пожизненный канцерогенный риск, обусловленный потреблением питьевой воды с повышенным содержанием мышьяка (50–86 ПДК), достигает 4,09·10–2 и реализуется в два раза чаще относительно лиц, потребляющих воду, соответствующую гигиеническим нормативам, в виде онкологических заболеваний взрослого населения различной локализации. Риск развития неканцерогенных эффектов в этих условиях является неприемлемым ( HQ = 211,9 – дети; HQ = 494,4 – взрослое население) и в 2–3 раза чаще манифестирует заболеваниями нервной, сердечнососудистой системы и неканцерогенной патологией кожи. В целом причиненный вред здоровью в 44,4 % случае характеризуется как тяжелый, в 46,3 % – как средний, в 9,3 % – как легкий.
Выводы:
-
1. В геохимических провинциях Забайкалья содержание мышьяка в воде глубинных скважин (100 м и более) может достигать 50–86 ПДК.
-
2. Хроническое потребление питьевой воды с содержанием мышьяка на уровне 2,5 мг/дм3 формирует неприемлемый уровень канцерогенного (до 4,09×10–2) и неканцерогенного ( HQ до 494,4) риска для здоровья населения.
-
3. Пожизненный канцерогенный риск, обусловленный потреблением питьевой воды с содержанием мышьяка на уровне 50–86 ПДК, в два раза чаще реализуется у взрослого населения в виде онкологических заболеваний различной локализации.
-
4. Риск развития неканцерогенных эффектов в этих условиях является неприемлемым и в 2–3 раза чаще манифестирует заболеваниями нервной, сердечно-сосудистой системы и неканцерогенной патологией кожи.
-
5. Причиненный вред здоровью при экспозиции детского населения в течение четырех лет, а взрослого – 15–17 лет в 44,4 % случаев оценивается как тяжелый (онкологические процессы, по-
- линейропатия, мышьяковый меланоз), в 46,3 % – как средний (мышьяковая дисхромия), в 9,3 % – как легкий (вегетососудистая дистония, функциональные расстройства нервной системы).
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Санитарно-гигиеническая характеристика риска и клиническая оценка причиненного вреда здоровью населения геохимической провинции при длительном поступлении мышьяка с питьевой водой
- Оценка риска нарушений здоровья, связанных с качеством питьевой воды, в городских округах Арктической зоны Российской Федерации / А.А. Ковшов, Ю.А. Новикова, В.Н. Федоров, Н.А. Тихонова // Вестник уральской медицинской академической науки. - 2019. - Т. 16, № 2. - С. 215-222.
- Ratnaike R.N. Acute and chronic arsenic toxicity // Postgrad med journal. - 2003. - Vol. 79, № 933. - P. 391-396. DOI: 10.1136/pmj.79.933.391
- Matschullat J. Arsenic in the geosphere - a review // The Science of the Total Environment. - 2000. - Vol. 17, № 249. - P. 297-312. 10.1016/s0048-9697 (99) 00524-0 DOI: 10.1016/s0048-9697(99)00524-0
- Gebel T. Confounding variables in the environmental Toxicology of arsenic // Toxicology. - 2000. - Vol. 144, № 1-3. - P. 155-162. 10.1016/s0300-483x (99) 00202-4 DOI: 10.1016/s0300-483x(99)00202-4
- Zaw M., Emett M.T. Arsenic removal from water using advanced oxidation processes // Toxicol. Lett. - 2002. - Vol. 133, № 1. - P. 113-118. 10.1016/s0378-4274 (02) 00081-4 DOI: 10.1016/s0378-4274(02)00081-4
- Королик В.В., Аль Сабунчи А.А. Санитарно-гигиеническая оценка питьевой воды и здоровья населения в странах Азии // Здоровье населения и среда обитания. - 2013. - Т. 239, № 2. - С. 24-26.
- Аликберов М.Х. О риске здоровью населения при потреблении воды из источников хозяйственно-питьевого водоснабжения в республике Дагестан // Фундаментальные и прикладные аспекты анализа риска здоровью населения: материалы всерос. науч.-практ. интернет-конф. молодых ученых и специалистов Роспотребнадзора / под ред. А.Ю. Поповой, Н.В. Зайцевой. - Пермь, 2017. - С. 14-19.
- Groundwater arsenic contamination in Bangladesh and West Bengal, India / U.K. Chowdhury, B.K. Biswas, T.R. Chowdhury, G. Samanta, B.K. Mandal, G.C. Basu, C.R. Chanda, D. Lodh [et al.] // Environ Health Perspect. - 2000. - Vol. 108, № 5. - P. 393-397.
- DOI: 10.1289/ehp.00108393
- Human health effects from chronic arsenic poisoning - a review / S. Kapaj, H. Peterson, K. Liber, P. Bhattacharya // J. Environ. Sci. Health A. Tox. Hazard. Subst. Environ Eng. - 2006. - Vol. 41, № 10. - P. 2399-2428.
- DOI: 10.1080/10934520600873571
- Дорманчева Е.И. Оценка заболеваемости и онкосмертности населения, проживающего на территории с аномальным содержанием мышьяка в почве // Вятский медицинский вестник. - 2000. - № 1. - С. 68-70.
- Богданова В.Д., Кислицина Л.В., Кику П.Ф. Санитарно-гигиеническая оценка качества питьевой воды в Хасанском районе Приморского края // Фундаментальная дальневосточная наука - медицине: материалы науч.-практ. конф. - Владивосток, 2017. - С. 124-126.
- Cobo J.M., Castineira M. Oxidative stress, mitochondrial respiration, and glycemic control: clues from chronic supplementation with Cr3+ or As3+ to male Wistar rats // Nutrition. - 1997. - Vol. 13, № 11-12. - P. 965-970. 10.1016/s0899-9007 (97) 00338-9
- DOI: 10.1016/s0899-9007(97)00338-9
- Hong Y.S., Song K.H., Chung J.Y. Health effects of chronic arsenic exposure // J. Prev. Med. Public. Health. - 2014. - Vol. 47, № 5. - P. 245-252.
- DOI: 10.3961/jpmph.14.035
- Arsenic levels in drinking water and the prevalence of skin lesions in West Bengal, India / D.N. Guha Mazumder, R. Haque, N. Ghosh, B.K. De, A. Santra, D. Chakraborty, A.H. Smith // Int. J. Epidemiol. - 1998. - Vol. 27, № 5. - P. 871-877.
- DOI: 10.1093/ije/27.5.871
- Merkel cell carcinoma and chronic arsenicism / H.C. Lien, T.F. Tsai, Y.Y. Lee, C.H. Hsiao // J. Am. Acad. Dermatol. - 1999. - Vol. 41, № 4. - P. 641-643.
- Chronic arsenic toxicity in West Bengal-the worse calamity in the world / D.N. Mazumder, J. Das Gupta, A. Santra, A. Pal, A. Ghose, S. Sarkar // J. Indian. Med. Assoc. - 1998. - Vol. 96, № 1. - P. 4-7.
- Arsenic: health effects, mechanisms of actions, and research issues / C.O. Abernathy, Y.P. Liu, D. Longfellow, H.V. Aposhian, B. Beck, B. Fowler, R. Goyer, R. Menzer [et al.] // Environ Health Perspect. - 1999. - Vol. 107, № 7. - P. 593-597.
- DOI: 10.1289/ehp.99107593
- Poklis A., Saady J.J. Arsenic poisoning: acute or chronic? Suicide or murder? // Am. J. Forensic. Med. Pathol. - 1990. - Vol. 11, № 3. - P. 226-232.
- Hepatic manifestations in chronic arsenic toxicity / A. Santra, J. Das Gupta, B.K. De, B. Roy, D.N. Guha Mazumder // Indian J Gastroenterol. - 1999. - Vol. 18, № 4. - P. 152-155.
- Clinical aspects of incomplete septal cirrhosis in comparison with macronodular cirrhosis / F. Nevens, D. Staessen, R. Sciot, B. Van Damme, V. Desmet, J. Fevery, J. De Groote, W. Van Steenbergen // Gastroenterology. - 1994. - Vol. 106, № 2. - P. 459-463. 10.1016/0016-5085 (94) 90605-x
- DOI: 10.1016/0016-5085(94)90605-x
- Arsenic exposure and mortality: a case-referent study from a Swedish copper smelter / O. Axelson, E. Dahlgren, C.D. Jansson, S.O. Rehnlund // Br. J. Ind. Med. - 1978. - Vol. 35, № 1. - P. 8-15.
- DOI: 10.1136/oem.35.1.8
- Lee-Feldstein A. A comparison of several measures of exposure to arsenic. Matched case-control study of copper smelter employees // Am. J. Epidemiol. - 1989. - Vol. 129, № 1. - P. 112-124.
- DOI: 10.1093/oxfordjournals.aje.a115100
- Drinking water arsenic in Utah: a cohort mortality study / D.R. Lewis, J.W. Southwick, R. Ouellet-Hellstrom, J. Rench, R.L. Calderon // Environ Health Perspect. - 1999. - Vol. 107, № 5. - P. 359-365.
- DOI: 10.1289/ehp.99107359
- Tsai S.M., Wang T.N., Ko Y.C. Mortality for certain diseases in areas with high levels of arsenic in drinking water // Arch. Environ Health. - 1999. - Vol. 54, № 3. - P. 186-193.
- DOI: 10.1080/00039899909602258
- Benowitz N.L. Cardiotoxicity in the workplace // Occup. Med. - 1992. - Vol. 7, № 3. - P. 465-478.
- Goldsmith S., From H. Arsenic-induced atypical ventricular tachycardia // N. Engl. J. Med. - 1980. - Vol. 303, № 19. - 1096-1098.
- DOI: 10.1056/NEJM198011063031905
- Everall J.D., Dowd P.M. Influence of environmental factors excluding ultra violet radiation on the incidence of skin cancer // Bull Cancer. - 1978. - Vol. 65, № 3. - P. 241-247.
- Arsenic in drinking water and incidence of urinary cancers / H.R. Guo, H.S. Chiang, H. Hu, S.R. Lipsitz, R.R. Monson // Epidemiology. - 1997. - Vol. 8, № 5. - P. 545-550.
- DOI: 10.1097/00001648-199709000-00012
- Hood R.D., Vedel-Macrander G.C. Evaluation of the effect of BAL (2,3-dimercaptopropanol) on arsenite-induced teratogenesis in mice // Toxicol. Appl. Pharmacol. - 1984. - Vol. 73, № 1. - P. 1-7. 10.1016/0041-008x (84) 90045-0
- DOI: 10.1016/0041-008x(84)90045-0
- Arsenic-induced skin lesions among Atacameno people in northern Chile despite good nutrition and centuries of exposure / A.H. Smith, A.P. Arroyo, D.N. Mazumder, M.J. Kosnett, A.L. Hernandez, M. Beeris, M.M. Smith, L.E. Moore // Environ Health Perspect. - 2000. - Vol. 108, № 7. - P. 617-620.
- DOI: 10.1289/ehp.00108617
- Chronic arsenic toxicity in Bangladesh and West Bengal, India - a review and commentary / M.M. Rahman, U.K. Chowdhury, S.C. Mukherjee, B.K. Mondal, K. Paul, D. Lodh, B.K. Biswas, C.R. Chanda [et al.] // J. Toxicol. Clin. Toxicol. - 2001. - Vol. 39, № 7. - P. 683-700.
- DOI: 10.1081/clt-100108509


