SARS-COV-2, бактериальные ко-инфекции и резистентность к противомикробным препаратам: смертельное трио при COVID-19?
Автор: Бенгоэчеа Х.А., Бэмфорд К. дЖ. дЖ.
Журнал: Juvenis scientia @jscientia
Рубрика: Переводные статьи
Статья в выпуске: 5 т.6, 2020 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14121383
IDR: 14121383
Текст обзорной статьи SARS-COV-2, бактериальные ко-инфекции и резистентность к противомикробным препаратам: смертельное трио при COVID-19?
Translated article
SARS-CoV-2, BACTERIAL CO-INFECTIONS, AND AMR: THE DEADLY TRIO IN COVID-19?
J. A. Bengoechea , C. G. G. Bamford
Wellcome-Wolfson Institute for Experimental Medicine, School of Medicine, Dentistry and Biomedical Sciences, Queen’s University Belfast
Belfast, UK
Funding: 1) UK Research and Innovation | Biotechnology and Biological Sciences Research Council (BBSRC). Grant Numbers: BB/P020194/1, BB/T001976/1. 2) UK Research and Innovation | MRC | Medical Research Foundation. Grant Number: MR/R005893/1. 3) Wellcome Trust (WT)
Original article: Bengoechea JA, Bamford CG. SARS-CoV-2, bacterial co-infections, and AMR: the deadly trio in COVID-19? EMBO Mol Med. 2020 ;12(7):e12560. DOI: 10.15252/emmm.202012560
The article was translated into Russian and published under the terms of the Creative Commons Attribution 4.0 license.
Translators: A. M. Zhavadi Far & A. P. Cherniakova , Saint Petersburg State University
Editor: I. Yu. Pchelin , Saint Petersburg State University
В конце декабря 2019 года государственные органы здравоохранения Китая сообщили о вспышке пневмонии неизвестной этиологии в городе Ухань – центре провинции Хубэй. Вскоре после этого китайские ученые идентифицировали вероятный возбудитель – не описанный ранее бета-коронавирус. Это заболевание теперь известно как коронавирусная инфекция 2019 года (COVID-19), а вирус – как коронавирус тяжелого острого респираторного синдрома 2 типа (SARS-CoV-2). Начиная с 31 декабря 2019 года, по состоянию на 25 мая 2020 года во всем мире было зарегистрировано 5432512 случаев инфицирования COVID-19 (в соответствии с используемыми критериями и стратегиями тестирования в затронутых пандемией странах) и 345 467 летальных исходов. Эти цифры, скорее всего, значительно недооценивают истинный уровень заболеваемости COVID-19 во всем мире. На сегодняшний день не существует ни зарегистрированных методов терапии, ни вакцин для лечения или профилактики инфекции, вызванной SARS-CoV-2. Как и пандемия гриппа H1N1 1918 года, пандемия COVID-19 иллюстрирует разрушительное воздействие нового зоонозного патогена на восприимчивую “наивную” популяцию.
У значительного числа людей инфицирование SARS-CoV-2 вызывает легкое заболевание верхних дыхательных путей или даже бессимптомную, субклиническую форму инфекции. Однако, опубликованные данные говорят о том, что уровень госпитализации превышает 8% и может достигать 20% в группе наиболее высокого риска (средний возраст – 72 года [7]). Значительная доля госпитализированных пациентов нуждается в лечении в отделении интенсивной терапии, причем среди пациентов, которым проводится искусственная вентиляция легких, летальность достигает 50%. Складывается представление, что мужской пол, пожилой возраст и/или наличие сопутствующих заболеваний, таких как диабет, заболевания сердечно-сосудистой и дыхательной систем, ассоциированы с более высокой вероятностью летального исхода при тяжелом течении COVID-19 [7], хотя следует отметить, что примерно у 50% госпитализированных пациентов нет указаний на наличие сопутствующей патологии.
Несколько удивляет то, что ко-инфекции невирусной природы и суперинфекции при COVID-19 упоминаются достаточно редко. Этот пробел вызывает недоумение, учитывая наличие большого объема клинических данных и подтверждающих их фундаментальных исследований на животных, которые демонстрируют, что респираторные вирусные инфекции предрасполагают пациентов к бактериальным ко-инфекциям и суперинфекциям. Так, бо́льшая часть случаев смерти во время пандемии гриппа 1918 года действительно была связана с присоединением бактериальной инфекции, и аналогичные наблюдения были сделаны во время последующих трех пандемий гриппа: H2N2 в 1957 г., H3N2 в 1968-1969 гг. и H1N1 в 2009-2010 гг. [12].
Целесообразно ли изучать ко-инфекции при COVID-19? Мы глубоко убеждены, что ко-инфекции играют значительную роль в течении COVID-19. Во-первых, следует отметить, что хроническая обструктивная болезнь легких (ХОБЛ) является одним из тех вариантов коморбидности, которые предрасполагают к тяжелому течению COVID-19 [7]. У пациентов с ХОБЛ колонизация патогенными бактериями присутствует даже в стабильной фазе заболевания, и при этом развитие инфекции, вызванной SARS-CoV-2, происходит, вероятно, на фоне наличия в организме очагов бактериальной инфекции. Во-вторых, весьма высока вероятность того, что пациенты с тяжелым течением COVID-19 могут в то же время или впоследствии подвергаться инфицированию бактериями. Средняя продолжительность госпитализации пациентов с COVID-19 составляет 7 дней, но может достигать 14 дней и более [7], а риск возникновения внутрибольничной пневмонии значительно возрастает по мере увеличения сроков госпитализации. Кроме того, более чем 90% пациентов с госпитальными пневмониями нуждаются в искусственной вентиляции легких. Данное инвазивное вмешательство стало одним из методов лечения пациентов с COVID-19, поступающих в отделение интенсивной терапии. Неудивительно, что бактериальные ко-инфекции были зарегистрированы и у пациентов с MERS-CoV, получавших интенсивную терапию [11]. На необходимость изучения ко-инфекций при COVID-19 указывают и результаты первых исследований, в которых показано наличие вторичных бактериальных инфекций у 50% умерших пациентов [18], а также бактериальных и грибковых инфекций у пациентов с тяжелым течением COVID-19 [6]. Однако, недавнее клиническое исследование, оценившее особенности течения COVID-19 у более чем 16000 госпитализированных пациентов в Великобритании [7], не содержит информации о вторичных инфекциях несмотря на то, что соответствующий вопрос включен в протокол ISARIC Всемирной организации здравоохранения, используемый исследователями. Данная ситуация отражает тот факт, что ко-инфекциям, в основном, не придают большого значения во время любой крупной инфекционной эпидемии, когда все внимание направлено на вызывающий ее патоген и выявление коморбидности для определения групп пациентов высокого риска.
Какое влияние на течение COVID-19 оказывают ко-инфекции? Мы предполагаем три не исключающих друг друга сценария взаимодействия ко-инфекций и SARS-CoV-2:
-
1) заражение SARS-CoV-2 после инфициро-вания/колонизации бактериями; 2) комбинированная вирусно-бактериальная пневмония; 3) вторичная бактериальная суперинфекция после инфицирования SARS-CoV-2 (рис. 1). Лежащие в основе этих процессов механизмы сильно зависят от сопутствующих обстоятельств и временного фактора, а также включают сложные взаимодействия между тремя различными существами (вирус, макроорганизм и бактерии). Хотя ясно, что иммунный ответ на SARS-CoV-2 при комбинированной вирусно-бактериальной пневмонии, скорее
всего, будет отличаться, в целом, мы можем считать, что в конечном итоге любой из вышеперечисленных сценариев ухудшит клинический исход и усугубит тяжесть течения COVID-19.
SARS-CoV-2 может способствовать распространению и адгезии бактерий к тканям инфицированного человека, а комбинация инфекций – усилению деструкции тканей и утяжелению патологического процесса. Дисфункция дыхательных путей, патология на клеточном уровне и разрушение тканей, вызванные инфицированием SARS-CoV-2 или бактериальной ко-инфекцией, могут приводить к системному распространению вируса и/или бактериальных ко-патогенов, резко повышая риск гемоинфекций и сепсиса. Опосредованное вирусом ухудшение течения бактериальной инфекции не представляет собой какое-то новое явление. Инфекции, вызванные риновирусами и вирусами гриппа, усиливают способность респираторных патогенов проникать в эпителий дыхательных путей [3].
Хотя появляющиеся данные наводят на мысль о наличии дисфункции местных и системных механизмов противовирусного ответа и воспалительных реакций при инфицировании SARS-CoV-2, отсутствие полного представления о патогенезе данной инфекции и влиянии вируса на сигнальные системы иммунитета не позволяет нам строить дальнейшие предположения [15]. Вместе с тем, исследования весьма близкого новому патогену вируса SARS-CoV установили, что его многочисленные структурные и неструктурные белки являются антагонистами интерферонов [17]. Снижение уровня интерферонов I типа ассоциировано с повышенной восприимчивостью к вторичным бактериальным инфекциям [14]. Предполагается, что SARS-CoV-2 также оказывает воздействие на многие белки, такие как NSP1, ORF6 и N, нарушая продукцию интерферонов и препятствуя активации соответствующих сигнальных путей.
Бактериальные ко-инфекции могут ослаблять способность организма человека
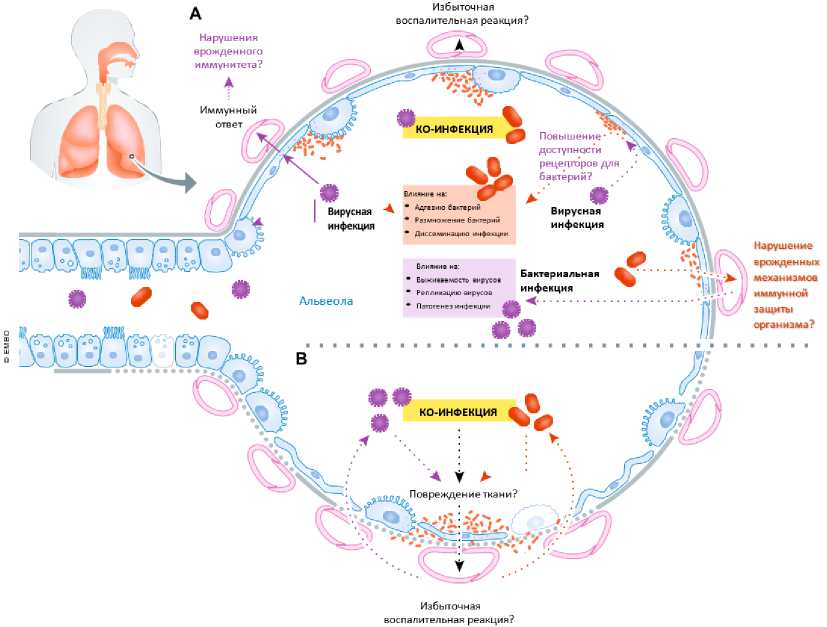
Рисунок 1. Взаимодействие между SARS-CoV-2, бактериями и организмом человека при ко-инфекциях.
-
(А) Факторы вирулентности SARS-CoV-2 взаимодействуют с легочной тканью и активируют иммунный ответ. Эти взаимодействия могут вызвать нарушения врожденного иммунитета на нескольких уровнях, что приводит к усилению адгезии, роста и распространения бактерий. Вирусная инфекция может повышать доступность рецепторов бактерий, что способствует их прикреплению. Ко-инфекция может привести к избыточной воспалительной реакции. Вполне вероятно также, что тип иммунного ответа, индуцированный SARS-CoV-2, способствует стремительному развитию бактериальной инфекции в легких. С другой стороны, колонизация бактериями может предрасполагать к инфицированию SARS-CoV-2, поскольку врожденные защитные механизмы организма могут быть подавлены, и это способствует выживанию и размножению вируса, а также последующему развитию патологического процесса. (B) Ко-инфекция может усугубить повреждение тканей, а избыточная воспалительная реакция — способствовать распространению поражения легких, инициированного SARS-CoV-2.
к активации защитных механизмов, следствием чего может быть повышение восприимчивости к инфицированию SARS-CoV-2 и последующему развитию патологического процесса. Например, респираторные патогены, включая Klebsiella pneumoniae, ограни- чивают активацию реакций, опосредованных NF-κB, которые также являются частью противовирусной защиты организма [1]. Кроме того, интерфероны I и III типов, продуцируемые в ответ на бактериальную инфекцию, могут способствовать заражению SARS-CoV-2, поскольку используемый вирусом рецептор АПФ2 (АСЕ2) кодируется геном, экспрессия которого стимулируется интерферонами [9]. Однако, до сих пор неизвестно, способствует ли опосредованное интерфероном увеличение количества рецепторов AПФ2 проникновению вируса в клетки и развитию инфекции.
Следует также рассмотреть вопрос о том, может ли инфицирование SARS-CoV-2 нарушать гомеостаз кишечника, способствуя тем самым развитию респираторной бактериальной инфекции. Хороша известна роль оси «кишечник-легкие», которая важна для противодействия развитию бактериальной пневмонии [8]. Интересно, что гастроинтестинальные симптомы являются довольно распространенным явлением среди пациентов с COVID-19 [7]. Кроме того, было показано, что SARS-CoV-2 поражает энтероциты in vitro и вызывает при этом иммунный ответ [10]. Поэтому мы считаем весьма вероятным, что у пациентов с тяжелым течением COVID-19 нарушен состав микробиоты кишечника, и это, как минимум, может повлиять на исходы заболевания, в том числе и на предрасположенность к вторичным бактериальным инфекциям легких.
Лечение COVID-19 и бактериальные ко-инфекции. Отсутствие эффективных зарегистрированных методов лечения пациентов с тяжелым течением COVID-19, непосредственно действующих на SARS-CoV-2, побудило клиницистов рассмотреть и испытать препараты, действие которых основано на модуляции иммунного ответа. К таким препаратам относятся противовоспалительные средства, уменьшающие выраженность воспаления, а также биологические препараты, нацеленные на некоторые цитокины, продукция которых, по данным литературы, у пациентов повышена: интерлейкин-1β, интерлейкин-6 и фактор некроза опухолей α [15]. Мы ни в коем случае не ставим под сомнение применение такой терапии, но хотели бы сделать предостережение, поскольку эти иммуномодулирующие вмешательства могут также увеличить риск потенциально смертельных вторичных бактериальных инфекций дыхательной системы. Например, у пациентов с ХОБЛ, получающих глюкокортикоиды, наблюдается значительное увеличение количества случаев бактериальной пневмонии [5]. Клинические данные свидетельствуют о том, что высокие дозы глюкокортикоидов повышают риск вторичных бактериальных инфекций у пациентов с острым респираторным дистресс-синдромом (ОРДС) [2]. Нарушения регуляции продукции и сигнальных путей цитокинов семейства интерлейкина-1, обнаруженные у пациентов с COVID-19 [15], может усугублять повреждение тканей в процессе развития инфекции, что делает их потенциально привлекательными мишенями для лечения тяжелой формы COVID-19. Однако следует отметить, что эти цитокины и связанные с ними сигнальные пути играют ключевую роль в защите организма от бактериальных респираторных патогенов. Поэтому вполне закономерными являются результаты клинических исследований, согласно которым использование блокаторов интерлейкина-1 хотя и не приводит к повышению риска вторичных инфекций, но в то же время увеличивает частоту инфекций с летальным исходом [4]. В совокупности эти данные подчеркивают необходимость рассмотрения влияния любого вмешательства, имеющего своей целью подавление воспалительных реакций, на вторичные инфекции, что требует анализа сроков и дозировок при применении таких препаратов. Кроме того, следует тщательно взвешивать возможность применения рекомбинантных цитокинов, таких как интерфероны I или III типа, которые могут способствовать развитию бактериальной суперинфекции и связанной с ней патологии.
COVID-19 и резистентность к противо-микробным препаратам. Одним из аспектов, который, по нашему мнению, не получил должного внимания, является влияние COVID-19 на резистентность к противоми-кробным препаратам. Во всем мире панде- мия коронавирусной инфекции накладывается на продолжающуюся пандемию инфекций, вызванных полирезистентными бактериями. В Великобритании, согласно руководству Национального института охраны здоровья и совершенствования медицинской помощи (NICE), для лечения тяжелой пневмонии вне зависимости от ее этиологии пациенты будут получать антибиотики широкого спектра действия, такие как доксициклин или, в качестве альтернативного варианта, амоксициллин. В большинстве европейских стран 15-50% штаммов бактерий устойчивы по крайней мере к одному антибактериальному препарату, и сочетание резистентности к нескольким группам препаратов также представляет собой частое явление. Исходя из этого, вероятно, эмпирическое использование антибиотиков широкого спектра окажет слабый эффект при госпитальных инфекциях. В этом случае почти все пациенты с тяжелым течением COVID-19 будут получать лечение антибиотиками, имеющими ограниченную эффективность. Вызывают беспокойство клинические данные, свидетельствующие о том, что такое нерациональное эмпирическое применение антибиотиков широкого спектра действия может быть ассоциировано с более высокой летальностью, по крайней мере, в случае сепсиса [13]. К сожалению, по мере продолжения пандемии мы ожидаем значительный рост антибиотикорезистентности из-за массированного применения антибиотиков у пациентов с COVID-19. Даже при нормальном сценарии развития событий отделения интенсивной терапии будут оставаться эпицентром развития антибиотикорезистентности. Это может иметь катастрофические последствия в тех больницах, где уже наблюдается высокая частота выявления штаммов с множественной лекарственной устойчивостью. Очевидно, что в стационарах происходит распространение как SARS-CoV-2, так и бактерий с множественной лекарственной устойчивостью, что приводит к увеличению числа летальных исходов вследствие ограниченности арсена- ла антибиотиков для лечения внутрибольничных инфекций. Это может поставить под угрозу лечение пациентов после операций, трансплантаций или химиотерапии. Помимо непосредственных последствий для работы медицинских учреждений, не следует забывать и о возможности распространения ан-тибиотикорезистентности во внебольничной среде. Например, повышение содержания антимикробных препаратов в сточных водах больниц изменит их концентрацию в окружающей среде. Это, в свою очередь, приведет к повышению вероятности антибиотикорези-стентности микроорганизмов у животных (диких и домашних), а также в сельском хозяйстве и естественных экосистемах. В целом, мы считаем, что принципы контроля за использованием антибиотиков нельзя ослаблять даже в такое непростое время, как сейчас. Антибактериальная терапия должна оперативно оцениваться с точки зрения ее необходимости и отменяться в случае нецелесообразности. Мы не рекомендуем ее профилактическое назначение. В идеальной ситуации, если антибиотики необходимы, микробиологическая лаборатория должна сообщить, какие из них являются наиболее подходящими с учетом выявленного микроорганизма и данных о его резистентности.
Последний аспект, который следует рассмотреть, – это широкое использование дезинфицирующих средств для рук и антибактериального мыла в качестве мер защиты от SARS-CoV-2. Мы не выступаем против данных мер, однако следует отметить, что некоторые из таких средств могут содержать вспомогательные химические вещества, которые практически не улучшают их дезинфицирующую функцию, но, напротив, могут провоцировать развитие устойчивости бактерий к противо-микробным средствам. За счет эффлюксных белков-транспортеров бактерии могут становиться устойчивыми к дезинфицирующим средствам, и эти же самые молекулы вносят свой вклад в развитие резистентности к антибиотикам. В любом случае важно придер- живаться инструкций производителя по надлежащему использованию дезинфектантов, чтобы избежать селекции бактерий с повышенной переносимостью противомикробных средств или резистентностью к ним.
Направления дальнейших исследований. В этой быстро развивающейся области знаний по-прежнему существует острая необходимость идентификации и описания характеристик бактериальных ко-инфекций при COVID-19. Возникновение ОРДС является одной из хорошо известных особенностей патофизиологии COVID-19, при этом повышение риска развития внутрибольничной пневмонии при ОРДС является общепризнанным фактом. Кроме того, посмертное исследование легочной ткани пациентов, умерших от тяжелой формы COVID-19, показало, что гистологические изменения в некоторых случаях соответствуют присоединению бактериальной пневмонии [16]. Ранняя и быстрая диагностика с использованием метагеномных подходов, основанных на технологии NGS (секвенировании нового поколения), позволит выявить широкий спектр патогенов и определить их профили резистентности к противомикробным средствам, что, несомненно, поспособствует увеличению эффективности использования антибиотиков. Тем не менее, мы также счита-
ЛИТЕРАТУРА ем, что необходимо стремиться к пониманию причин и последствий бактериальных ко-инфекций при COVID-19 на молекулярном уровне, что будет содействовать разработке новых терапевтических подходов, высокоэффективно и безопасно влияющих на свои мишени в условиях ко-инфекции. В соответствующих исследованиях должны использоваться хорошо известные экспериментальные модели, такие как высокодифференцированный эпителий дыхательных путей и культуры иммунных клеток, а также культуры охарактеризованных патогенных вирусов и бактерий. Таким образом, крайне важно избегать недооценки ко-инфекций, борьба с которыми должна быть частью комплексного и целостного плана, направленного на снижение во всем мире заболеваемости и смертности во время пандемии, вызванной SARS-CoV-2, и после нее. Мы надеемся, что изучение роли ко-инфекций, вызванных бактериальными патогенами и SARS-CoV-2, приведет как к улучшению результатов лечения пациентов с COVID-19, так и к появлению новых важных данных о биологии трехсторонних взаимодействий между представителями различных царств живых организмов – вирусными и бактериальными патогенами в слизистой оболочке дыхательных путей организма человека.
-
1. Bengoechea JA, Sa Pessoa J. Klebsiella pneumoniae infection biology: living to counteract host defences . FEMS Microbiol Rev. 2019 ;43(2):123-144. DOI: 10.1093/femsre/fuy043.
-
2. Bernard GR, Luce JM, Sprung CL, et al. High-dose corticosteroids in patients with the adult respiratory distress syndrome . N Engl J Med. 1987 ;317(25):1565-1570. DOI: 10.1056/NEJM198712173172504
-
3. Bosch AA, Biesbroek G, Trzcinski K, et al. Viral and bacterial interactions in the upper respiratory tract . PLoS Pathog. 2013 ;9(1):e1003057. DOI: 10.1371/journal.ppat.1003057
-
4. Buckley LF, Abbate A. Interleukin-1 blockade in cardiovascular diseases: a clinical update . Eur Heart J. 2018 ;39(22):2063-2069. DOI: 10.1093/eurheartj/ehy128
-
5. Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease . N Engl J Med. 2007 ;356(8):775-789. DOI: 10.1056/NEJMoa063070
-
6. Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study . Lancet. 2020 ;395(10223):507-513. DOI: 10.1016/S0140-6736(20)30211-7
-
7. Docherty AB, Harrison EM, Green CA, et al. Features of 16,749 hospitalised UK patients with COVID-19 using
the ISARIC WHO Clinical Characterisation Protocol . medRxiv. 2020 . DOI: 10.1101/2020.04.23.20076042v1 [PREPRINT]
-
8. Dumas A, Bernard L, Poquet Y, Lugo-Villarino G, Neyrolles O. The role of the lung microbiota and the gut-lung axis in respiratory infectious diseases . Cell Microbiol. 2018 ;20(12):e12966. DOI: 10.1111/cmi.12966
-
9. Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor . Cell. 2020 ;181(2):271-280.e8. DOI: 10.1016/j. cell.2020.02.052
-
10. Lamers MM, Beumer J, van der Vaart J, et al. SARS-CoV-2 productively infects human gut enterocytes . Science. 2020 . DOI: 10.1126/science.abc1669
-
11. Memish ZA, Perlman S, Van Kerkhove MD, Zumla A. Middle East respiratory syndrome. Lancet. 2020 ;395(10229):1063-1077. DOI: 10.1016/S0140-6736(19)33221-0
-
12. Morris DE, Cleary DW, Clarke SC. Secondary Bacterial Infections Associated with Influenza Pandemics . Front Microbiol. 2017 ;8:1041. Published 2017 Jun 23. DOI: 10.3389/fmicb.2017.01041
-
13. Rhee C, Kadri SS, Dekker JP, et al. Prevalence of Antibiotic-Resistant Pathogens in Culture-Proven Sepsis and Outcomes Associated With Inadequate and Broad-Spectrum Empiric Antibiotic Use . JAMA Netw Open. 2020 ;3(4):e202899. Published 2020 Apr 1. DOI: 10.1001/jamanetworkopen.2020.2899
-
14. Rynda-Apple A, Robinson KM, Alcorn JF. Influenza and Bacterial Superinfection: Illuminating the Immunologic Mechanisms of Disease . Infect Immun. 2015 ;83(10):3764-3770. DOI: 10.1128/IAI.00298-15
-
15. Tay MZ, Poh CM, Rénia L, et al. The trinity of COVID-19: immunity, inflammation and intervention . Nat Rev Immunol. 2020 ;20(6):363-374. DOI: 10.1038/s41577-020-0311-8
-
16. Tian S, Xiong Y, Liu H, et al. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmortem core biopsies . Mod Pathol. 2020 ;14:1-8
-
17. Versteeg GA, Bredenbeek PJ, van den Worm SH, Spaan WJ. Group 2 coronaviruses prevent immediate early interferon induction by protection of viral RNA from host cell recognition . Virology. 2007 ;361(1):18-26. DOI: 10.1016/j.virol.2007.01.020
-
18. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study [published correction appears in Lancet. 2020 Mar 28;395(10229):1038] [published correction appears in Lancet. 2020 Mar 28;395(10229):1038]. Lancet. 2020 ;395(10229):1054-1062. DOI: 10.1016/S0140-6736(20)30566-3
Перевод поступил в редакцию: 21.10.2020
Список литературы SARS-COV-2, бактериальные ко-инфекции и резистентность к противомикробным препаратам: смертельное трио при COVID-19?
- Bengoechea JA, Sa Pessoa J. Klebsiella pneumoniae infection biology: living to counteract host defences. FEMS Microbiol Rev. 2019;43(2):123-144. DOI: 10.1093/femsre/fuy043.
- Bernard GR, Luce JM, Sprung CL, et al. High-dose corticosteroids in patients with the adult respiratory distress syndrome. N Engl J Med. 1987;317(25):1565-1570. DOI: 10.1056/NEJM198712173172504
- Bosch AA, Biesbroek G, Trzcinski K, et al. Viral and bacterial interactions in the upper respiratory tract. PLoS Pathog. 2013;9(1):e1003057. DOI: 10.1371/journal.ppat.1003057
- Buckley LF, Abbate A. Interleukin-1 blockade in cardiovascular diseases: a clinical update. Eur Heart J. 2018;39(22):2063-2069. DOI: 10.1093/eurheartj/ehy128
- Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med. 2007;356(8):775-789. DOI: 10.1056/NEJMoa063070
- Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223):507-513. DOI: 10.1016/S0140-6736(20)30211-7
- Docherty AB, Harrison EM, Green CA, et al. Features of 16,749 hospitalised UK patients with COVID-19 using the ISARIC WHO Clinical Characterisation Protocol. medRxiv. 2020. DOI: 10.1101/2020.04.23.20076042v1 [PREPRINT]
- Dumas A, Bernard L, Poquet Y, Lugo-Villarino G, Neyrolles O. The role of the lung microbiota and the gut-lung axis in respiratory infectious diseases. Cell Microbiol. 2018;20(12):e12966. DOI: 10.1111/cmi.12966
- Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271-280.e8. DOI: 10.1016/j. cell.2020.02.052
- Lamers MM, Beumer J, van der Vaart J, et al. SARS‐CoV‐2 productively infects human gut enterocytes. Science. 2020. DOI: 10.1126/science.abc1669
- Memish ZA, Perlman S, Van Kerkhove MD, Zumla A. Middle East respiratory syndrome. Lancet. 2020;395(10229):1063-1077. DOI: 10.1016/S0140-6736(19)33221-0
- Morris DE, Cleary DW, Clarke SC. Secondary Bacterial Infections Associated with Influenza Pandemics. Front Microbiol. 2017;8:1041. Published 2017 Jun 23. DOI: 10.3389/fmicb.2017.01041
- Rhee C, Kadri SS, Dekker JP, et al. Prevalence of Antibiotic-Resistant Pathogens in Culture-Proven Sepsis and Outcomes Associated With Inadequate and Broad-Spectrum Empiric Antibiotic Use. JAMA Netw Open. 2020;3(4):e202899. Published 2020 Apr 1. DOI: 10.1001/jamanetworkopen.2020.2899
- Rynda-Apple A, Robinson KM, Alcorn JF. Influenza and Bacterial Superinfection: Illuminating the Immunologic Mechanisms of Disease. Infect Immun. 2015;83(10):3764-3770. DOI: 10.1128/IAI.00298-15
- Tay MZ, Poh CM, Rénia L, et al. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020;20(6):363-374. DOI: 10.1038/s41577-020-0311-8
- Tian S, Xiong Y, Liu H, et al. Pathological study of the 2019 novel coronavirus disease (COVID‐19) through postmortem core biopsies. Mod Pathol. 2020;14:1-8
- Versteeg GA, Bredenbeek PJ, van den Worm SH, Spaan WJ. Group 2 coronaviruses prevent immediate earlyinterferon induction by protection of viral RNA from host cell recognition. Virology. 2007;361(1):18-26. DOI: 10.1016/j.virol.2007.01.020
- Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study [published correction appears in Lancet. 2020 Mar 28;395(10229):1038] [published correction appears in Lancet. 2020 Mar 28;395(10229):1038]. Lancet. 2020;395(10229):1054-1062. DOI: 10.1016/S0140-6736(20)30566-3


