Селекция активных продуцентов катионного пептида варнерина под действием ультрафиолета
Автор: Полюдова Т.В., Лемкина Л.М., Коробов В.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Обоснована возможность значительного повышения уровня продукции антибактериального пептида варнерина при помощи ультрафиолетового облучения клеток штамма-продуцента Staphylococcus warneri IEGM KL-1. Показана вероятность хромосомной локализации генов синтеза, модификации и секреции пептида семейства лантибиотиков варнерина.
Ультрафиолет, антибактериальные катионные пептиды
Короткий адрес: https://sciup.org/147204649
IDR: 147204649 | УДК: 579.234
Текст научной статьи Селекция активных продуцентов катионного пептида варнерина под действием ультрафиолета
Растущий интерес исследователей к классу низкомолекулярных катионных антибактериальных пептидов отражает чрезвычайно важную роль этих соединений в биологических системах и перспективы их практического использования. Широкое распространение в природе позволяет рассматривать антибактериальные пептиды как особый вид защиты, проявляющийся в многочисленных реакциях антагонизма на всех уровнях организации жизни [Hancoсk, Falla Brown, 1995]. Грамположительные бактерии продуцируют антибактериальные пептидные соединения – бактериоцины – широкого спектра действия [Nishe Nagao, Sonomoto, 2012]. Пептиды имеют небольшой размер (20Н50 аминокислотных остатков), обычно обладают одновременно катионными и гидрофобными свойствами, что обеспечивает амфифильность их молекул и высокое сродство к мембранным структурам. Значительное количество бактериоцинов являются объектами уникальных внерибосомных событий. В результате посттрансляционной модификации они приобретают необычные структурные свойства за счёт появления в их составе наряду с прочими модифицированными остатками аминокислот, остатков тиоэфирных аминокислот лантионина, метиллан-тионина и лабионина [Bierbaum, Sahl, 2009]. Гены ответственные за продукцию антибактериальных пептидов грампозитивных бактерий, расположены в оперон-подобных структурах и находятся как на хромосоме [Willey, van der Donk, 2007], так и на плазмидах [Booth et al., 1996]. Помимо структурных генов бактериоцина, оперон несет информацию о белках ответственных за посттрансляционную модификацию и экспорт бактериоцина из клетки, а также гены кодирующие иммунные белки, необходимые для аутозащиты продуцента от секретируемого антибактериального фактора [Hancock, Chapple, 1999, Willey van der Donk, 2007].
Известно, что различные стрессовые воздействия на бактерии приводят к существенным сдвигам в метаболизме бактериальных клеток и, особенно, регуляции биосинтетических процессов [Sanders, Venema, 1999]. Так, в результате УФ облучения в ДНК бактериальной клетки возникают различные повреждения: образование пиримидиновых димеров, гидратация цитозина и урацила разрыв водородных связей, появление органических перекисей и др., что может приводить к летальному эффекту [Riley , Nardell, 1989]. Индуцированный ультрафиолетовым облучением мутационный процесс у многих видов бактерий контролируется рядом индуцибельных генов, экспрессия которых осуществляется в ходе SOS-репарации клеточной ДНК [Ушаков, 2010]. Накопленные к настоящему времени данные свидетельствуют о том что SOS-ответ сопряжен с другими системами обеспечивающими адаптацию бактерий к воздействию различных стрессовых факторов [Васильева, Стрельцова, 2011].
Staphylococcus warneri IEGM KL-1 – продуцент низкомолекулярного катионного пептида варнери-на, обладающего высокой антибактериальной активностью в отношении многих грамположитель-ных бактерий [Коробов и др., 2010].
Целью работы явилось исследование клонов клеток штамма S. warneri IEGM KL-1, сохранивших свою жизнеспособность после УФ-воздействия, на предмет их способности продуцировать антибактериальный пептид варнерин.
Материалы и методы
В работе использовали штамм Staphylococcus warneri IEGM KL-1 из коллекции Лаборатории биохимии развития микроорганизмов Института экологии и генетики микроорганизмов УрО РАН. Штамм депонирован в коллекции ГНИИСКМБП им. Л.А. Тарасевича под номером 260 как продуцент низкомолекулярного пептидного антибактериального фактора [Коробов, Лемкина, Акименко 2003]. Спектр антибактериальной активности супернатантов культуры S. warneri IEGM KL-1 определяли на бактериях индикаторного штамма S. epidermidis 33, полученного из ГНИИСКМБП им. Л.А. Тарасевича, Москва.
Бактерии выращивали на среде Luria-Bertani Н LB. Среда LB содержала 1% триптона ("Sigma") 0.5% дрожжевого экстракта ("Difco") и 0.64% NaCl ("Реахим"), pH 7.1 Н 7.2. Тестирование антибактериальной активности проводили с использованием среды LB, не содержащей NaCl. Для получения плотной среды LB к указанным компонентам добавляли 1.4% агара ("Difco").
Тест-культуры микроорганизмов выращивали на шейкере в колбах на 100 мл и объёмом среды 20 мл, с аэрацией (150 об/мин) при температуре 37оС до логарифмической фазы роста.
Количественное определение уровня антибактериальной активности (АБА) проводили на жидкой среде LB с использованием планшетов для иммунологических реакций. В лунки планшета помещали по 100 мкл бессолевой среды LB. Затем в первую лунку ряда вносили 100 мкл исследуемого стерилизованного мембранной фильтрацией, супернатанта среды культивирования S. warneri IEGM KL-1 и готовили ряд последовательных двукратных разведений, после чего в каждую лунку добавляли 10 мкл суспензии клеток S. epidermidis , содержащей 1.5-2×106 КОЕ/мл. Планшеты инкубировали в термостате в течение 16 Н 18 ч при 37оС. За условную единицу активности (ЕА) варнерина принимали обратную величину максимального разведения при котором наблюдалось полное торможение роста тест-бактерий.
Эксперименты по УФ-облучению продуцента варнерина проводили на культуре клеток S. warneri IEGM KL-1, находящейся в начале log -фазы роста (ОD 600 =0.3-0.4). Клетки отделяли от среды культивирования центрифугированием при 10000 об/мин и 4ºС в течение 5 мин, отмывали 0.14М раствором NaCl и суспендировали в 0.1М растворе MgSO 4 до OD 600 =0.05, что соответствовало 108
КОЕ/мл [Миллер, 1976]. УФ-облучение для построения кривой выживаемости проводили в открытых чашках Петри, содержащих 5 мл суспензии бактериальных клеток. В качестве источника излучения использовали бактерицидную лампу ОКН-11-М, располагая ее на расстоянии 50 см от чашки Петри. В процессе облучения суспензии клеток чашки Петри непрерывно перемешивали покачиванием. Доза облучения определялась длительностью облучения, которое проводили в течение 10, 20, 30, 40, 50 и 60 сек., после чего облученные клетки высевали на LB-агар и определяли количество колониеобразующих единиц микрометодом точечных высевов [Веслополова, 1995], десятичные разведения аликвот облученных культур подбирали для каждой дозы УФ-облучения.
На основании оценки чувствительности клеток S. warneri IEGM KL-1 к действию ультрафиолета в экспериментальных сериях использовали три дозы облучения, создаваемые экспозицией под лампой в течение 20–30 сек. Облучение и первые двое суток культивирования производили в темноте.
Колонии клеток, подвергшихся УФ-облучению и колонии клеток контрольной культуры переносили микробиологической петлей на жидкую среду LB и выращивали на роторном шейкере Sartorius (“Certomac”, Германия) при 160 об/мин и температуре 37^С в течение 6 Н 8 ч., после чего делали пересев клеток на свежую среду LB до конечной концентрации 107КОЕ/мл и культивировали в тех же условиях в течение 8–10 ч. В последние 3 ч роста ежечасно отбирали пробы для измерения оптической плотности и оценки антибактериальной активности супернатанта каждой из культур.
Выделение плазмидной ДНК и анализ плазмидного спектра
Изучение состава плазмидной ДНК исходного штамма S. warneri IEGM KL-1 и штаммов, полученных после ультрафиолетового облучения и обладающих различной способностью к продукции антибактериального пептида, проводили методом электрофореза в агарозном блоке. Для этого плаз-мидную ДНК выделяли методом щелочного лизиса [Birnboim, Doli, 1979]. Бактерии культивировали при 37ºС и перемешивании 150 об/мин до середины логарифмической фазы (OD=1.5–2.0), отбирали пробы объемом 3 мл. Клетки осаждали центрифугированием при 6000 об/мин в течение 20 мин. при 4ºС (Centrifuge 5415 R "Eppendorf"), осадок промывали TS-буфером (50мМ трис, 10мМ ЭДТА, 0.14М NaCl с рН 8.0) и ресуспендировали в 1.5 мл растворе 25 мМ ЭДТА в 30%-ной сахарозе. В полученную суспензию добавляли лизостафин ("Sigma") до конечной концентрации 0.5 мкг/мл. После инкубации в течение 1 ч. при 37ºС для окончательного лизиса клеток и гидролиза хромосомной ДНК добавляли 400 мкл раствора, содержащего 0.2М
NaOH и 1% SDS. Смесь выдерживали при комнатной температуре в течение 30 мин. Для осаждения клеточного дебриса и фрагментов бактериальной хромосомы в пробы вносили 300 мкл 3М ацетата натрия рН 4.8, и помещали на лед на 60 мин. до образования творожистого осадка, который отделяли центрифугированием при 4ºС в течение 15 мин. при 13000 об/мин. Супернатант смешивали с изопропанолом в объемном соотношении 3:2, выдерживали 20 мин. при комнатной температуре и центрифугировали при 13000 об/мин в течение 10 мин. при 4ºС. Надосадочную жидкость удаляли, а осадок высушивали на воздухе и растворяли в 200 мкл ТЕ Н буфера (50 мМ ЭДТА, 50 мМ Трис, рН 8.0). Для получения более чистого препарата выделенную плазмидную ДНК переосаждали раствором 10М LiCl, pH 8.0 в течение 15 мин. Полученный осадок отделяли центрифугированием в тех же условиях. К супернатанту добавляли равный объем 70%-ного этанола и выдерживали 20 мин. при комнатной температуре. Плазмидную ДНК осаждали центрифугированием в указанных выше условиях. Осадок сушили на концентраторе (Concentrator 5301, "Eppendorf") в течение 30 Н 40 мин., а затем растворяли в 200 мкл ТЕ-буфера. Готовые препараты плазмидной ДНК хранили в замороженном виде при -18оС. Выделенную плаз-мидную ДНК исследовали методом горизонтального электрофореза в 0.9%-ном агарозном геле. Электрофорез проводили в ТВЕ Н буфере (89 мМ Трис, 89 мМ борная кислота, 2мМ ЭДТА, рН 8.0) при напряжении 100 В/см в течение 3 Н 4 ч. при комнатной температуре. В качестве метчика использовали плазмиду-маркер pUC 19 размером 2.7 т.п.н. ("ICN"). После завершения электрофореза гель окрашивали водным раствором бромистого этидия (5 мкг/мл) и фотографировали в проходящем ультрафиолетовом свете на приборе MacroVue UV-25 ("Hoefer").
Исследование липидного спектра
Экстракцию липидов из мембран клеток проводили по модифицированной для микроорганизмов методике Блайя и Дайэра [Кейтс, 1975]. Культуры клеток S. warneri IEGM KL-1 – исходный штамм, а также варианты штамма S. warneri IEGM KL-1, полученные в результате УФ-облучения, инкубировали в течение ночи при 37ºС при перемешивании 150 об/мин. Затем клетки осаждали центрифугированием при 5000 об/мин в течение 15 мин., после чего дважды отмывали физиологическим раствором. Осадки, представляющие собой влажную пасту, содержащие около 400Н500 мг клеток (влажный вес), ресуспендировали в 1 мл физиологического раствора. Суспензию помещали в стеклянную центрифужную пробирку с пробкой, добавляли 4.5 мл смеси хлороформНметанол (1:2) и концентрированную соляную кислоту до конечной концентрации в смеси 0.25%. Смесь выдерживали в течение 1 ч. при комнатной температуре при периодическом встряхивании. Затем клетки осаждали центрифугированием при 3000 об/мин. 40Н45 мин. при комнатной температуре. Супернатант переносили в другую пробирку; осадок клеток ре-суспендировали в смеси хлороформНметанолНвода (1:2:0.8 по объему), к смеси добавляли HClконц до конечной концентрации 0.25%. Инкубировали 30 мин при комнатной температуре и центрифугировали, как указано выше. К объединенным супернатантам добавляли 3 мл хлороформа, 3 мл воды смесь перемешивали до получения однородной эмульсии, а затем проводили разделение хлороформного и водноНметанольного слоев центрифугированием при 3000 об/мин. в течение 15Н20 мин. ВодноНметанольный слой переносили в чистую пробирку с 3 мл хлороформа, эмульгировали и центрифугировали вновь при 3000 об/мин в течение 15Н20 мин для полной очистки экстракта липидных компонентов. Нижние хлороформные фазы объединяли и выпаривали на концентраторе в течение 20 мин. После этого осадок липидов растворяли в смеси хлороформНметанол (1:1). Разделение и идентификацию экстрактов липидов проводили методом тонкослойной хроматографии на пластинках с полимерной подложкой, покрытых силикагелем типа СТХН1ВЭ, размером 5 г 10 см («Sorbfil», Россия). Количество наносимого экстракта определяли по суммарному содержанию фосфора в пробе, определяемому фотометрическим методом [Mess, Den, 1975].
Пластинки с нанесенными экстрактами хроматографировали в стеклянной камере с притертой крышкой, насыщенной парами растворителя, восходящим способом при комнатной температуре. В качестве системы растворителей использовали смесь хлороформ Н метанол Н вода (65:25:4). После хроматографирования пластинку сушили на воздухе. Окрашивание тотального препарата липидов проводили реактивом, содержащим 9% Н 3 РО 4 и 3% ацетата меди. Краситель наносили с помощью пульверизатора; пластинку сушили на воздухе, а затем прокаливали в сухожаровом шкафу при температуре 140ºС до проявления пятен.
Результаты и их обсуждение
Дозированное облучение ультрафиолетом оказывает существенное влияние на функционирование генома микроорганизмов [Woodgate, 2001] что продемонстрировано при селекции различных промышленных штаммов микроорганизмов, в частности, продуцентов пенициллина и стрептомицина [Петров, 1975].
С целью получения высокоактивных вариантов штамма S. warneri IEGM KL-1 нами была проведе- на серия экспериментов с воздействием на бактерии ультрафиолетовым светом.
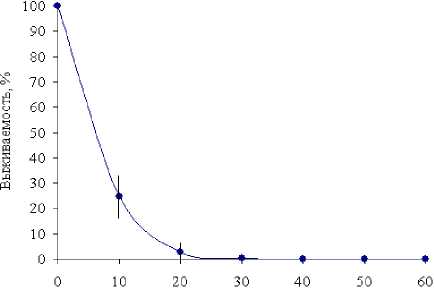
На первом этапе, используя известные методические приемы [Миллер, 1976], исследовали чувствительность клеток-продуцентов к ультрафиолету путем оценки выживаемости при различных дозах облучения. Кривая зависимости выживаемости бактерий S. warneri от продолжительности облучения при постоянной мощности представлена на рис. 1.
Время, с
Рис. 1 . Выживаемость клеток S.warneri
IEGM KL-1 при УФ-облучении
Из рис. 1 видно, что резкое падение числа выживших клеток происходит в первые 20 с. облучения, а при увеличении периода УФ-воздействия до 60 с. количество выживших клеток имеет значение, близкое к нулю.
Исходя из полученных данных, нами была определена доза УФ-облучения, соответствующая 0.2–2% выживаемости клеток исходной культуры наблюдаемой при облучении в течение 20 с.
Выросшие после УФ-облучения колонии были дифференцированы по размерам и исследованы на продукцию антибактериального пептида варнерина при росте формирующих их клеток на жидкой питательной среде LB. В результате воздействия ультрафиолетом были выделены 3 типа колоний: мелкие – до 2 мм в диаметре, средние 2–3 мм и крупные – более 3 мм (рис. 2).
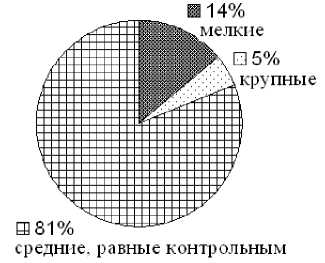
Рис. 2. Дифференциация колоний по размеру после 20 с облучения S.warneri IEGM KL-1
После переноса колоний в жидкую среду LB и культивирования было обнаружено, что внутри каждой группы имеются различия в уровне антибактериальной активности (таблица).
В результате проведенных экспериментов были выявлены штаммы бактерий со значительно повышенным уровнем секреции варнерина, а также с резко сниженной АБА, либо полностью потерявшие способность к продукции пептида. Часть полученных при воздействии УФ колоний характеризовались секрецией пептида на уровне исходного штамма.
Антибактериальная активность культур выращенных из разных колоний, полученных после UV-воздействия
|
Размер колонии |
АБА, ЕА |
|
Средняя (исходная) |
256 |
|
Мелкая |
512 |
|
Мелкая |
0 |
|
Мелкая |
256 |
|
Средняя |
64 |
|
Средняя |
1024 |
|
Средняя |
64 |
|
Крупная |
256 |
|
Крупная |
256 |
|
Крупная |
123 |
|
Крупная |
123 |
Дальнейшие исследования проводили на штаммах, АБА которых была в 4 раза выше, чем у исходной культуры, а также потерявших способность к продукции антибактериального пептида.
Учитывая данные литературы, касающиеся плазмидной локализации генетической информации о бактериоцинах некоторых видов стафилококков [Ersfeld-Dressen, Sahl, Brandis, 1984], сопоставление плазмидного состава полученных штаммов S. warneri IEGM KL-1 могло быть решающим в определении локализации генов, ответственных за продукцию варнерина.
Сравнение состава плазмидных ДНК, полученных в результате воздействия УФ высокоактивного штамма и штамма, не обладающего АБА, с плазмидным спектром клеток исходного штамма позволяет сделать вывод о том, что синтез и секреция катионного антибактериального пептида вар-нерина, по-видимому, не связаны с наличием плазмид. Из электрофоретических данных, представленных на рис. 3, видно, что различий в составе плазмид штаммов, полученных УФ-облучением, и исходного штамма не наблюдается.
Все исследованные варианты бактериальных штаммов обладали одинаковой плазмидной ДНК которая включала в себя около 2.7 т.п.н., и отличались только копийностью этой плазмиды. Важно отметить, что штамм, обладающий повышенной продукцией, как и штамм, потерявший эту способ- ность, характеризуются резким снижением содержания плазмиды, по сравнению с родительским штаммом.
Полученные данные допускают вероятность расположения информации о продукции АБФ в бактериальной хромосоме, как это установлено для других низкомолекулярных антибактериальных пептидов класса лантибиотиков [Schnell, Entian Gotz, 1989].

Рис. 3. Плазмидная ДНК исследуемых вариантов S. warneri :
1 – маркер – плазмида pUC19, 2.7 т.п.н.; 2 – клетки исходного штамма; 3 – клетки модифицированного штамма с повышенной АБА; 4 – клетки модифицированного штамма без АБА
Другим предполагаемым путем увеличения или снижения продукции антибактериального фактора могут быть изменения в структуре клеточной стенки и мембраны клеток, т.к. изменение уровня продукции антибактериального катионного пептида обусловлено, возможно, усилением или нарушением транспортных функций клетки.
Сравнение липидного состава мембран производили у клеток штамма с высоким уровнем продукции варнерина и клеток штамма, лишенных АБА с липидным составом клеток S. warneri IEGM KL1.
С помощью тонкослойной хроматографии было обнаружено некоторое отличие в качественном составе липидов для продуцирующих и непродуцирующих варнерин штаммов стафилококков. В частности, отсутствие фракции лизилфосфатидилглицеро-ла (ЛФГ) и гликолипидов у бактерий, утративших способность к продукции варнерина (рис. 4).
Известно, что ЛФГ значительно снижает проникновение катионов в клетки благодаря увеличению массива диссоциирующих катионных группировок на поверхности цитоплазматической мембраны [Fischer, Leopold, 1999; Peschel et al., 2001]. Таким образом, повышение уровня ЛФГ в составе мембран, продуцирующих поликатионный пептид бактериальных клеток, может рассматриваться как необходимое условие для формирования индифферентности клеток к выделяемому антибактериальному пептиду.
Известно, что для экспорта и созревания ланти-биотиков используются трансмембранные ферментные комплексы [De Vos et al., 1995]. Мембранные ферменты функционируют в составе мембран в виде сложных надмолекулярных ансамблей, что и приводит к проявлению ими особых свойств, не реализующихся в других условиях [Гринштейн, Кост 2001]. Отсутствие ЛФГ в билипидном слое мембран, возможно, приводит к нарушению транспорта и процессинга молекул варнерина. Возможно, что для активной работы ферментов экспорта варнери-на необходимо их связывание и закрепление в мембране клеток посредством ЛФГ.
нейтральные лпппды
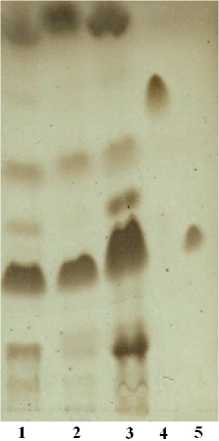
кардиолипин гликолипиды фосфатидилглицерины лпшлфосфатпднлглпцерпны лизофосфолипиды не идентифицированная фракция
Рис. 4. Хроматографическое разделение липидных фракций бактерий S. warneri :
1 Н клетки модифицированного штамма с повышенной АБА; 2 – клетки модифицированного штамма без АБА; 3 – клетки исходного штамма; 4 – кардиолипин; 5 – фосфатидилглицерин
Полученные в результате УФ-облучения варианты штамма S. warneri IEGM KL-1, обладающие повышенной продукцией АБП, сохраняли это свойство при хранении в течение 3 месяцев на скошенном LB-агаре при 42JC. Однако при пассировании клеток на жидкой питательной среде LB, как в темноте, так и на свету антибактериальная активность супернатантов снижалась до уровня исходной культуры уже на 3–4 пассаже. Восстановление свойств, присущих исходному штамму, наблюдалось и для бактерий, утративших антибактериальную активность после УФ воздействия. Так, при пересевах на жидкой среде LB полное восстановление антибактериальных свойств происходило также после 3–4 пассажа.
Результаты проведенных исследований позволяют сделать вывод, что обнаруженные после воздействия на клетки ультрафиолетовым светом изменения в биологии штамма S. warneri IEGM KL-1 носят временный характер, а значит, не являются следствием перестройки генома бактерий. Наблю- даемые фенотипические особенности, проявляющиеся в изменении антибактериальной активности полученных штаммов, вероятно, связаны с ответом микробных клеток на стресс, вызванный ультрафиолетом. Первоначальный ответ бактерий на любой стресс направлен на обеспечение своего выживания. В большинстве случаев первичный ответ основан на уже действующих биохимических процессах, которые на некотором уровне экспрессируются и в отсутствии явного стресса. Поскольку продукцию бактериоцинов можно рассматривать как одну из адаптивных реакций микроорганизмов к окружающим условиям, вполне вероятно, что стрессовые условия приводят к её усилению.
Изменения в экспрессии генов, вызванные одним стрессом, могут происходить и в случае какого-либо другого стрессового воздействия, поскольку процессы, происходящие в клетках, индуцируемые при различных стрессовых условиях, в значительной степени перекрываются. Так, ранее нами было показано, что при воздействии на клетки S. warneri IEGM KL-1 повышенной температуры низких рН и высокой осмолярности среды также происходило усиление их антибактериальной активности [Полюдова, 2004].
Таким образом, кратковременное ультрафиолетовое облучение клеток-продуцентов антибактериального катионного пептида варнерина приводит к гибели большей части популяции. Выжившие после такого воздействия бактерии отличаются гетерогенностью по размеру формируемых ими колоний. Важно отметить, что среди выживших бактерий обнаруживаются штаммы с резким увеличением антибактериальной активности по сравнению с исходным штаммом S. warneri IEGM KL-1, которые могут быть использованы для быстрой наработки значительных количеств антибактериального пептида варнерина.
Работа выполнена при финансовой поддержке РФФИ № 11-04-96025-р_урал_а; 12-04-01431-а; президиума РАН «Молекулярная и клеточная биология» № 12-П-4-1002; Министерства образования Пермского края по программе «Международных исследовательских групп» № С-26/632.
Список литературы Селекция активных продуцентов катионного пептида варнерина под действием ультрафиолета
- Васильева С.В., Стрельцова Д.А. ДНК-репарационный SOS-ответ и генетическая нестабильность клеток в условиях гипоксии//Радиационная биология. Радиоэкология. 2011. Т. 51, № 3. С. 321-327.
- Веслополова Е.Ф. Микрометод определения численности колониеобразующих микроорганизмов//Микробиология. 1995. Т. 64, № 2. С. 279-284.
- Гринштейн С.В., Кост О.А. Структурно-функциональные особенности мембранных белков//Успехи биол. химии. 2001. Т. 41. С. 77-104.
- Кейтс М. Техника липидологии. М.: Мир, 1975. 322 с.
- Коробов В.П., Лемкина Л.М., Акименко В.К. Штамм Staphylococcus warneri IEGM KL-1 -продуцент низкомолекулярного пептидного соединения, ингибирующего рост клеток грампозитивных бактерий. Приоритет от 01.12.2001. Зарег. в Госреестре изобр. 12.01.2001. Патент Рос. Федерации № 2200195. 2003.
- Коробов В.П. и др. Выделение и характеристика нового низкомолекулярного антибактериального пептида семейства лантибиотиков//Микробиология. 2010. T. 79, № 2. С. 228-238.
- Миллер Дж. Эксперименты в молекулярной генетике. М.: Мир, 1976. 436 с.
- Петров Д.Ф. Новые методы селекции микроорганизмов и использование их для решения некоторых прикладных задач//Генетика и селекция микроорганизмов. Новосибирск, 1975. С. 6-12.
- Полюдова Т.В. Изучение феномена продукции низкомолекулярного антибактериального пептидного фактора культурой Staphylococcus warneri IEGM KL-1: дис.. канд. биол. наук: 03.00.07. Пермь, 2004. 128 с.
- Ушаков В.Ю. SOS-система репарации ДНК у бактерий//Вестник Пермского университета. Серия: Биология. 2010. Вып. 2. С. 19-30.
- Bierbaum G, Sahl H.G. Lantibiotics: mode of action, biosynthesis and bioengineering//Curr. Pharm. Biotechnol. 2009. Vol. 10, № 1. P. 2-18.
- Birnboim H.C., Doly J.A. A rapid alkaline extraction procedure for screening recombinant plasmid DNA//Nicleic Acids Res. 1979. Vol. 7. P. 1513.
- Booth M.C. et al. Structural analysis and proteolytical activation of Enterococcus faecalis cytolysin, a novel lantibiotic//Mol. Microbiol. 1996. Vol. 21, № 6. P. 1175-1184.
- De Vos W.M. et al. Maturation pathway of nisin and other lantibiotics: post-translationally modified antimicrobial peptides exported by gram-positive bacteria//Mol. Microbiol. 1995. Vol. 17, № 3. Р. 427-437.
- Ersfeld-Dressen H., Sahl H.G., Brandis H. Plasmid involvement in production of and immunity to the staphylococcin-like peptide Pep5//J. Gen. Microbiol. 1984.Vol. 130. P. 3029-3035.
- Fischer W., Leopold K. Polar lipids of four listeria species containing L-lysylcardiolipin, a novel lipid structure, and other unique phospholipids//Int. J. Systematic Bacteriology. 1999. Vol. 49. P. 653-662.
- Hancock R., Falla T., Brown M. Cationic bactericidal peptides//Adv. Microb. Physiol. 1995. № 37. P. 135-175.
- Hancock R., Chapple D. Peptide antibiotics//Antimicrobial Agents Chemother. 1999. Vol. 43, № 6. P. 1317-1323.
- Mess H.H., Den S.E. The Definition of atomic phosphorus//Anal. Biochem. 1975. Vol. 63, № 2. Р. 607-613.
- Nishe M., Nagao J., Sonomoto K. Antibacterial peptides "bacteriocins": an overview of their diverse characteristics and applications//Biocontrol Sci. 2012. Vol. 17, № 1. P. 1-16.
- Peschel A. et al. Staphylococcus aureus resistance to human defensins and evasion of neutrophil killing via the novel virulence factor Mprf is based on modification of membrane lipids with L-lysine//J. Exp. Med. 2001. Vol. 193, № 9. Р. 1067-1076.
- Riley R.L., Nardell E.A. Clearing the air. The theory and application of ultraviolet air disinfection//AmRev Respir Dis. 1989. Vol. 139, № 5. P. 1286-1294.
- Sanders J.W., Venema G., Kok J. Environmental stress responses in Lactococcus lactis//FEMS Microbiol. Rev. 1999. Vol. 23. P. 483-501.
- Schnell N., Entian K.D., Gotz F. Structural gene isolation and prepeptide sequence of gallidermin, a new lantionin containing antibiotic//FEMS Microbiol. Lett. 1998. Vol. 49, № 2-3. P. 263-267.
- Willey, van der Donk. Lantibiotics: Peptides of Diverse Structure and Function//Annu. Rev. Microbiol. 2007. Vol. 61. P. 477-501.
- Woodgate R. Evolution of the two-step model for UV-mutagenesis//Muta. Res. 2001. Vol. 485, № 1. Р. 83-92.


