Селективный синтез 1-бензилхиназолин-2,4(1 н,3н)-диона
Автор: Озеров А.А., Новиков М.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология. Токсикология
Статья в выпуске: 1 (61), 2019 года.
Бесплатный доступ
Взаимодействие 1,3-дибензоилхиназолин-2,4(1Н,3Н)-диона с карбонатом калия в среде безводного ДМФА при комнатной температуре приводит к образованию калиевой соли 3-бензоилхиназолин-2,4(1Н,3Н)-диона, алкилирование которой in situ бензилхлоридом дает 1-бензил-3-бензоилхиназолин-2,4(1Н,3Н)-дион. Разработан одностадийный способ получения N1-монозамещенных производных хиназолин-2,4(1Н,3Н)-диона. Изучено влияние природы щелочного реагента на выход и соотношение продуктов дебензоилирования.
Хиназолиндион, дебензоилирование, селективное алкилирование, 3-бензоилхиназолиндион
Короткий адрес: https://sciup.org/142224311
IDR: 142224311 | УДК: 547.856.1
Текст научной статьи Селективный синтез 1-бензилхиназолин-2,4(1 н,3н)-диона
N-Замещенные производные хиназолин-2,4(1 Н ,3 Н )-диона демонстрируют широкий спектр фармакологической активности [2].
Особый интерес представляют в этом ряду N-бензилпроизводные хиназолин-2,4(1 Н ,3 Н )-диона, обладающие способностью подавлять репродукцию ВИЧ-1, респираторно-синцитиального вируса и цитомегаловируса человека in vitro [3-5]. Непосредственное N1-алкилирование хиназолин-2,4(1 Н ,3 Н )-диона алкилгалогенидами в полярной апротонной среде в присутствии оснований, так же как и в случае производных урацила, имеющих заместители в положении 6 пиримидиновой системы, протекает с невысоким выходом и осложняется образованием N1,N3-дизамещенных производных, в связи с чем для селективного введения заместителей к атому азота N1 используют либо N3-бензоилиро-ванный хиназолин-2,4(1 Н ,3 Н )-дион, либо формируют уже N1-замещенную хиназолиновую систему на основе реакций циклизации [1].
Ранее нами был разработан высокоселективный метод синтеза N1-замещенных произ- водных 6-метилурацила, заключающийся в непосредственном алкилировании 1,3-дибензоил-6-метилурацила алкилгалогенидами или толу-олсульфонатами первичных спиртов в среде безводного ДМФА в присутствии калия карбоната [6]. В настоящей статье описано использование этого подхода для селективного получения N1-замещенных производных хиназо-лин-2,4(1Н,3Н)-диона.
ЦЕЛЬ РАБОТЫ
Разработка препаративного метода селективного N1-алкилирования хиназолин-2,4(1 Н ,3 Н )-диона алкилгалогенидами бензильного типа.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР регистрировали на спектрометре Bruker Avance 600 (600 МГц для 1H и 150 МГц для 13C) в ДМСО- d 6 . Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США). Элементный анализ выполнен на приборе Vario EL Cube.
1,3-Дибензоилхиназолин-2,4(1 Н ,3 Н )-дион (1). К перемешиваемой суспензии 10,0 г (0,062 моль) хиназолин-2,4(1 Н ,3 Н )-диона в 25 мл (0,309 моль) безводного пиридина и 100 мл ацетонитрила добавляют в один прием 25 мл (0,215 моль) бензоилхлорида и перемешивают при комнатной температуре в течение 48 ч. Реакционную массу упаривают в вакууме при температуре бани не выше 60–65 оС, остаток охлаждают, распределяют между 200 мл хлороформа и 200 мл воды, органическую фазу сушат сульфатом натрия, фильтруют, фильтрат упаривают в вакууме, остаток растирают с 50 мл диэтилового эфира, выдерживают при температуре 0–5 оС в течение суток, образовавшийся осадок отфильтровывают, промывают диэтиловым эфиром, сушат на воздухе и получают 20,8 г (91 %) продукта-сырца, Т. пл. 145–150 оС. Перекристаллизация из 100 мл этилацетата дает 17,2 г (75 %) белого кристаллического вещества, Т. пл. 155,5–157 оС (159–160 оС [1]). Найдено, %: C 71,02; H 3,89; N 7,68. C 22 H 14 N 2 O 4 . Вычислено, %: C 71,35; H 3,81; N 7,56.
Спектр ЯМР 1Н (600 МГц, ДМСО- d 6 ), δ, м. д. ( J , Гц): 7,11 (1Н, д, 8,4 Гц, Н-8); 7,44 (1Н, т, 7,6 Гц, Н-6); 7,58–7,64 (4Н, м, ароматические Н); 7,73–7,82 (3Н, м, Н-7, ароматические Н); 8,16 (1Н, д, 7,9 Гц, Н-5); 8,23–8,28 (4Н, м, ароматические Н).
Спектр ЯМР 13C (150 МГц, ДМСО- d 6 ), δ, м. д.: 118,39; 118,61; 127,93; 131,53; 132,88; 133,03; 134,20; 134,40; 134,49; 134,83; 139,15; 139,44; 139,56; 141,83; 151,13; 164,39; 172,00; 172,88.
1-Бензилхиназолин-2,4(1 Н ,3 Н )-дион (5). К раствору 2,5 г (6,8 ммоль) 1,3-дибензоил-хиназолин-2,4(1 Н ,3 Н )-диона в 25 мл безводного ДМФА добавляют 2,5 г (18,0 ммоль) тонко измельченного безводного калия карбоната, 1,0 мл (8,7 ммоль) бензилхлорида и перемешивают при комнатной температуре в течение 48 ч. Фильтруют, фильтрат упаривают в вакууме, остаток распределяют между 50 мл хлороформа и 50 мл 1%-го раствора едкого кали, органический слой сушат сульфатом натрия, фильтруют и упаривают в вакууме. Остаток растворяют при кипячении в 20 мл 95 % этилового спирта, к горячему раствору добавляют 2 мл концентрированного гидроксида аммония, кипятят 5 мин, выдерживают сначала при комнатной температуре в течение суток, затем при температуре 0–5 оС в течение суток, образовавшийся осадок отфильтровывают, промывают холодным 95 % этиловым спиртом, диэтиловым эфиром, сушат на воздухе, перекристаллизовывают из 75 мл этилацетата и получают 1,05 г (62 %) светло-желтого игольчатого кристаллического вещества, Т. пл. 217–219 оС. Найдено, %: C 71,22;
H 4,67; N 10,40. C 15 H 12 N 2 O 2 . Вычислено, %: C 71,42; H 4,79; N 11,10.
Спектр ЯМР 1Н (600 МГц, ДМСО- d 6 ), δ, м. д. ( J , Гц): 5,30 (2Н, с, СН 2 ); 7,19-7,33 (3Н, м, Н-8, ароматические Н); 7,25–7,33 (4Н, м, Н-6, ароматические Н); 7,60 (1Н, т, 7,8 Гц, Н-7); 8,01 (1Н, д, 7,7 Гц, Н-5); 11,76 (1Н, с, NH).
Спектр ЯМР 13C (150 МГц, ДМСО- d 6 ), δ, м. д.: 48,50; 118,48; 119,27; 126,03; 129,80; 130,57; 130,96; 132,06; 138,53; 139,75; 144,21; 154,09; 165,19.
1-Бензил-3-бензоилхиназолин-2,4(1 Н ,3 Н )-дион (4) получают аналогично, но остаток после упаривания раствора в хлороформе не подвергают аммонолизу, а растирают с 20 мл диэтилового эфира, выдерживают при температуре 0–5 оС в течение суток, образовавшийся осадок отфильтровывают, сушат на воздухе, перекристаллизовывают из 10 мл смеси аце-тон-гексан (1:1) и получают 1,10 г (46 %) белого кристаллического вещества, Т. пл. 130-132 оС (разл.). Найдено, %: C 73,89; H 4,61; N 8,17. C 22 H 16 N 2 O 3 . Вычислено, %: C 74,15; H 4,53; N 7,86.
Спектр ЯМР 1Н (600 МГц, ДМСО- d 6 ), δ, м. д. ( J , Гц): 5,39 (2Н, с, СН 2 ); 7,25–7,43 (7Н, м, Н-8, ароматические Н); 7,59–7,63 (2Н, м, ароматические Н); 7,73–7,79 (2Н, Н-6, Н-7); 8,10 (1Н, д, 7,2 Гц, Н-5); 8,14-8,17 (2Н, м, ароматические Н).
Спектр ЯМР 13C (150 МГц, ДМСО- d 6 ), δ, м. д.: 46,35; 115,82; 116,06; 123,89; 126,95; 127,82; 128,33; 129,20; 129,91; 131,00; 131,76; 135,92; 136,25; 136,54; 140,99; 149,88; 161,30; 169,73.
3-Бензоилхиназолин-2,4(1 Н ,3 Н )-дион (6) . К раствору 5,00 г (13,5 ммоль) 1,3-дибензоил-хиназолин-2,4(1 Н ,3 Н )-диона в 100 мл безводного ДМФА добавляют 3,75 г (27,1 ммоль) тонко измельченного безводного калия карбоната и перемешивают в течение 24 ч при комнатной температуре. Фильтруют, осадок на фильтре промывают 2 раза по 10 мл ДМФА, фильтрат упаривают в вакууме при температуре бани 85– 90 оС, остаток распределяют между 100 мл хлороформа и 100 мл 5%-го раствора едкого кали.
Органическую фазу сушат сульфатом натрия, фильтруют и упаривают в вакууме. Остаток охлаждают, растирают с 10 мл диэтилового эфира, охлаждают в течение суток при температуре 0–5 оС, образовавшийся осадок отфильтровывают, промывают диэтиловым эфиром, сушат на воздухе, перекристаллизовывают из 10 мл этилацетата и получают 0,67 г (13 %) не вступившего в реакцию 1,3-дибен-зоилхиназолин-2,4(1 Н ,3 Н )-диона, Т. пл. 155– 157 оС.
Водную фазу подкисляют ледяной уксусной кислотой, охлаждают в течение суток при температуре 0–5 оС, образовавшийся осадок отфильтровывают, промывают водой, сушат на воздухе и трижды экстрагируют по 20 мл кипящего ацетона. Не растворившийся осадок сушат на воздухе, перекристаллизовывают из 5 мл ледяной уксусной кислоты и получают 0,56 г (26 %) хиназолин-2,4(1Н,3Н)-диона, Т. пл. > 330 оС.
Экстракт упаривают досуха, остаток перекристаллизовывают из 20 мл ацетона и получают 1,90 г (53 %) 3-бензоилхиназолин-2,4(1 Н ,3 Н )-диона в виде белого кристаллического волокнистого вещества, Т. пл. 219–222 оС (разл.) (209– 211 оС [1]). Найдено, %: C 67,43; H 3,66; N 10,83. C 15 H 10 N 2 O 3 . Вычислено, %: C 67,67; H 3,79; N 10,52.
Спектр ЯМР 1Н (600 МГц, ДМСО- d 6 ), δ, м. д. ( J , Гц): 7,25–7,31 (2Н, м, Н-8, ароматические Н); 7,58 (2Н, т, 7,7 Гц, ароматические Н); 7,73–7,80 (2Н, м, Н-6, Н–7); 7,93 (1Н, д, 7,2 Гц, Н-5); 7,79 (2Н, д, 7,8 Гц, ароматические Н); 11,86 (1Н, с, NH).
Спектр ЯМР 13C (150 МГц, ДМСО- d 6 ), δ, м. д.: 117,21; 119,27; 126,50; 130,61; 132,83; 133,87; 134,84; 138,82; 139,32; 143,78; 152,21; 165,19; 173,26.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Взаимодействие 1,3-дибензоилпроизводного хиназолин-2,4(1 Н ,3 Н )-диона ( 1 ) с карбонатом калия в среде безводного ДМФА при комнатной температуре сопровождается выделением углекислоты с образованием хорошо растворимой калиевой соли 3-бензоилхиназолин-2,4(1 Н ,3 Н )-диона ( 2 ) и мало растворимого калия бензоата.
В отличие от дибензоилпроизводного 6-метилурацила [6], N1-дебензоилирование 1,3-дибензоилпроизводного хиназолин-2,4(1 Н ,3 Н )-диона ( 1 ) в указанных условиях протекает менее селективно и частично приводит, помимо целевого 3-бензоилхиназолин-2,4(1 Н ,3 Н )-диона, к продукту полного дебензоилирования – хиназолин-2,4(1 Н ,3 Н )-диону ( 3 ). В присутствии в реакционной массе алкилирующего агента, в частности, бензилхлорида, образовавшаяся in situ калиевая соль 3-бензоилхиназолин-2,4(1 Н ,3 Н )-диона ( 2 ) дает соответствующий продукт N1-алкилирования ( 4 ), который далее легко деблокируется при нагревании в водно-спиртовом растворе аммония гидроксида:
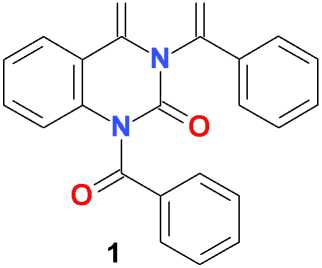
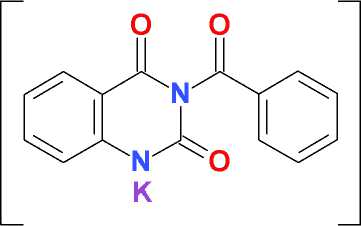
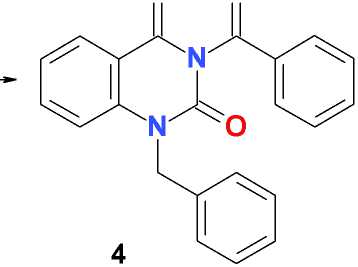
iii
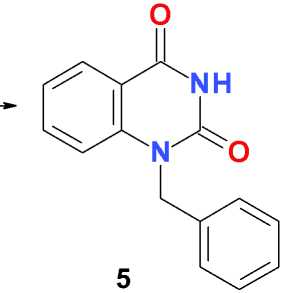
Рис. i: К 2 СО 3 , ДМФА, 25 оС, 48 ч; ii: PhCH 2 Cl, К 2 СО 3 , ДМФА, 25 оС, 48 ч; iii: NH 4 OH, 90 % EtOH, кипячение, 5 мин; 25 оС, 24 ч
Региоселективность алкилирования, в частности, нахождение бензильного заместителя у атома азота N1 хиназолиновой системы в соединении 5 подтверждено корреляционной (NOESY) спектроскопией ЯМР.
3-Бензоилхиназолин-2,4(1 Н ,3 Н )-дион ( 6 ) является удобным синтоном, позволяющим получать разнообразные N1-замещенные производные хиназолиновой природы. В литературе описан синтез 3-бензоилхиназолин-2,4(1 Н ,3 Н )-диона ( 6 ) путем N1-дебензоилирования 1,3-ди-бензоилхиназолин-2,4(1 Н ,3 Н )-диона ( 1 ) карбонатом калия в среде водного диоксана, однако выход целевого соединения не превышал 23 %
[1]. В связи с этим нами была исследована возможность получения 3-бензоилхиназолин-2,4(1 Н ,3 Н )-диона ( 6 ) в условиях, соответствующих разработанному методу алкилирования. Обнаружено, что взаимодействие 1,3-дибен-зоилхиназолин-2,4(1 Н ,3 Н )-диона ( 1 ) с карбонатами щелочных металлов при молярном соотношении 1:2 в среде безводного ДМФА при комнатной температуре в течение 24 ч характеризуется различной конверсией исходного соединения и разным соотношением продуктов N1- ( 6 ) и N1,N3-дебензоилирования ( 3 ) в зависимости от природы используемого щелочного реагента (табл.).
Влияние природы карбоната щелочного металла на выход и соотношение продуктов N1– и N1, N3-дебензоилирования
|
Реагент |
Выход (по выделенному соединению), % |
Молярное соотношение 6 : 3 |
||
|
1 |
3 |
6 |
||
|
Li 2 CO 3 |
45 |
30 |
16 |
0,53 |
|
Na 2 CO 3 |
25 |
15 |
52 |
3,47 |
|
K 2 CO 3 |
13 |
26 |
53 |
2,04 |
|
Cs 2 CO 3 |
0 |
44 |
49 |
1,11 |
Установлено, что наиболее эффективными дебензоилирующими реагентами являются карбонат натрия, обеспечивающий наибольшую селективность реакции, и карбонат калия, дающий более высокую конверсию исходного соединения при удовлетворительной селективности.
ЗАКЛЮЧЕНИЕ
Таким образом, взаимодействие 1,3-ди-бензоилхиназолин-2,4(1Н,3Н)-диона (1) с карбонатами натрия или калия в среде безводного ДМФА при комнатной температуре приводит с достаточно высоким выходом к соответствующей соли 3-бензоилхиназолин-2,4(1Н,3Н)-диона (6), которая может быть использована in situ для одностадийного синтеза N1-замещенных производных хиназолин-2,4(1Н,3Н)-диона. Раз- работанный нами простой и удобный метод получения 3-бензоилхиназолин-2,4(1Н,3Н)-диона (6) расширяет синтетические возможности в ряду соединений хиназолиновой природы.
Список литературы Селективный синтез 1-бензилхиназолин-2,4(1 н,3н)-диона
- Glowacka I. E., Balzarini J., Wroblewski A. E. // Eur. J. Med. Chem. - 2013. - Vol. 70. - P. 703-722.
- Khan I. [et al.] // Eur. J. Med. Chem. - 2015. -Vol. 90. - P. 124-169.
- Martinez A. [et al.] // Antivir. Chem. Chemother. -2003. - Vol. 14. - P. 107-114.
- Matharu D. S. [et al.] // J. Med. Chem. - 2014. -Vol. 57. - P. 10314-10328.
- Novikov M. S. [et al.] // Bioorg. Med. Chem. -2013. - Vol. 21. - № 5. - P. 1150-1158.
- Ozerov A. [et al.] // Heterocycles. - 2017. -Vol. 94. - №. 5. - P. 912-922.


