Сезонные изменения микробиома рубца у северного оленя (Rangifer tarandus) в условиях российской Арктики
Автор: Ильина Л.А., Филиппова В.А., Лайшев К.А., Йылдырым Е.А., Дуняшев Т.П., Бражник Е.А., Дубровин А.В., Соболев Д.В., Тюрина Д.Г., Новикова Н.И., Лаптев Г.Ю., Южаков А.А., Романенко Т.М., Вылко Ю.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиомы
Статья в выпуске: 4 т.55, 2020 года.
Бесплатный доступ
Северный олень ( Rangifer tarandus ) - крупное голарктическое травоядное животное, особенности условий обитания которого, в том числе низкие температур и скудные рационы, обусловили эволюционное развитие уникальной рубцовой микробиоты, необходимой для эффективного усвоения арктической флоры. В зимний период большую долю кормовых растений северного оленя составляют лишайники, богатые вторичными метаболитами, которые могут влиять на представителей микробного консорциума пищеварительного тракта. Ранее сообщалось о токсическом действии некоторых метаболитов лишайников (например, усниновой кислоты) на ряд микроорганизмов ( Clostridiales, Enterococcus, Staphylococcus aureus , Escherichia coli и др.), а также на жвачных животных (лосей). Однако о влиянии потребления лишайников на микробиом рубца северных оленей мало что известно. Нами с применением молекулярно-биологического анализа впервые были исследованы сезонные закономерности формирования микробных сообществ рубца северных оленей R. tarandus , обитающих в условиях Российской Арктики. Цель исследования - сравнение состава бактериального сообщества рубца северных оленей в летне-осенний и зимне-весенний периоды с использованием метода NGS-секвенирования. При анализе микробных сообществ оценивали биоразнообразие, таксономическую структуру, а также взаимозависимость этих показателей с особенностями питания северного оленя в связи со сменой сезона. Образцы содержимого рубца отбирали в летне-осенний и зимне-весенний периоды в 2017-2018 годах у 20 особей ненецкой породы (4-8-месячные телята и взрослые животные в возрасте 3-6 лет, n ≥= 3 для каждой возрастной группы) в Ненецком автономном округе (АО). Сезонные, но не половозрастные различия оказались основным фактором влияния на бактериальное сообщество рубца северных оленей, что, по всей видимости, обусловлено неодинаковым составом пастбищного рациона. В летне-осенний период отмечено достоверное повышение показателей a-биоразнообразия микробиома рубца по сравнению с зимне-весенним по числу OTUs (Operational Taxonomic Units), индексам Chao1 и Шеннона. Сопоставление b-разнообразия микробиоты рубца северных оленей продемонстрировало наличие выраженной кластеризации образцов по сезонам года. Несмотря на то, что в зимний период рацион северных оленей был представлен преимущественно лишайниками, которые не являются типичным кормом для других жвачных (крупного рогатого скот, овец и др.), было интересно отметить, что в целом полученный микробиомный профиль соответствовал современным представлениям о микробиоте рубца жвачных животных. Тем не менее в разные сезонные периоды отмечены значимые изменения представленности ряда таксонов, наиболее четкие из которых были детектированы для микроорганизмов, ассоциированных с процессами ферментации полисахаридов корма. Так, в зимне-весенний сезон выявлено достоверное увеличение обилия микроорганизмов, разлагающих полисахариды лишайников, в том числе гемицеллюлозу ( Butyrivibrio , Ruminococcus ) и лихенин ( Succiniclasticum , Paraprevotellaceae , Prevotella ). В летние-осенний период отмечается достоверное увеличение доли целлюлозолитических бактерий Clostridium , Blautia , Clostridiales , Christensenellaceae , Mogibacteriaceae , Prevotellaceae. Кроме того, показано, что в летний период в рубце северного оленя развивается группа микроорганизмов, которые относятся к возбудителям инфекций ( Erysipelotrichaceae , Coriobacteriaceae , Mycoplasmataceae , Rickettsiales ). В целом полученные результаты позволяют сделать вывод о достаточно четкой ассоциации микробиома рубца северного оленя с особенностями питания в разные сезоны, определяющей адаптацию животных к экологическим условиям.
Северный олень, рубец, микробиом, сезонность, ngs-секвенирование, российская арктика
Короткий адрес: https://sciup.org/142226328
IDR: 142226328 | УДК: 636.294:579.62:577.2 | DOI: 10.15389/agrobiology.2020.4.697rus
Текст научной статьи Сезонные изменения микробиома рубца у северного оленя (Rangifer tarandus) в условиях российской Арктики
Важнейшая проблема физиологии северного оленя связана со скудностью рациона (особенно в период длительного холодного сезона), которая усугубляется суровостью погодных условий. Дефицит доступных кормов определяет одну из причин смертности северных оленей в зимний период
∗ Исследование выполнено при поддержке гранта РНФ для реализации научного проекта ¹ 17-76-20026 «Микробиоценоз рубца Rangifer tarandus Арктических регионов России как фундаментальная основа получения перспективных биотехнологий для сельскохозяйственных животных».
(1, 2). Состав кормовой базы северного оленя значительно различается по сезонам. В летне-осенний период основу рациона может составлять до 300 видов растений, включая злаки, осоки, листья ив, карликовых берез. На лишайники при этом приходится не более 15 %. В зимне-весенний период доля лишайников в рационе северных оленей возрастает до 75 %, а остальные 25-30 % — это остатки зеленых растений, мхи, веточные корма и различные примеси (2). Лишайники крайне бедны питательными веществами, азотистыми и минеральными соединениями, что приводит к замедлению роста и развития молодняка, истощению животных, особенно переболевших в летний период, стельных важенок и быков (3, 4). Кроме того, лишайники продуцируют вторичные метаболиты — органические соединения с бактерицидной активностью, в частности усниновую кислоту (5, 6). Некоторые исследователи отмечают ее токсичное действие на животных. Так, сообщалось о гибели 300 лосей вследствие употребления лишайников при отсутствии альтернативного корма (7). Также известно, что усниновая кислота в высокой концентрации токсична для овец (8). Однако установлено, что северные олени могут употреблять лишайники без негативных последствий (9) благодаря способности анаэробных микроорганизмов рубца к детоксикации вторичных фенольных метаболитов лишайников (10). При этом усниновая кислота и ее метаболиты не обнаруживаются в содержимом рубца, моче и экскрементах северного оленя (10). Перечисленные факты обусловливают интерес к углубленному изучению физиологических особенностей питания этих жвачных животных, и прежде всего их уникальной рубцовой микробиоты, необходимой для эффективного усвоения арктической флоры.
Проведенные ранее зарубежными авторами исследования различных представителей жвачных позволили выявить, что состав микробиома рубца может зависеть от многих факторов, в числе которых генотип животных (11), возраст (12), местообитание (13), сезон года (4, 14), рацион и режим кормления (15), состояние здоровья, применение антимикробных соединений (16), световой режим суток (17), стресс (18) и условия окружающей среды (19). Поэтому, без сомнения, изучение адаптационных приспособлений северных оленей должно опираться на оценку условий их местообитания, питания и других факторов.
Об изменениях состава микробиома рубца северных оленей в зимний период, связанных с увеличением доли потребления лишайников, мало что известно. Результаты, полученные M.A. Olsen с соавт. (20) на основе классических микробиологических методов, продемонстрировали снижение общего количества микроорганизмов в рубце северных оленей Rangifer tarandus platyrhynchus в зимний период по сравнению с летним на порядок. Аналогичные результаты по снижению в зимний период численности жизнеспособных зооспор хитридиомицетов описаны также для других видов жвачных (21, 22).
Результаты молекулярно-генетических исследований микробиома желудочно-кишечного тракта вступают в некоторое противоречие с данными, полученными с помощью культуральных методов. Так, сообщалось о значимом изменении представленности некоторых микроорганизмов в рубце северного оленя в зависимости от сезона (23). Показано, что в зимний период доля целлюлозолитических бактерий Butyrivibrio fibrisolvens повышалась (22 % летом и 30 % зимой), тогда как амилолитических бактерий Streptococcus bovis — снижалась (17 % летом и 4 % зимой). Другие авторы, напротив, не выявили значимых изменений в биоте рубца у Rangifer tarandus platyrhynchus архипелага Шпицберген по количеству метаногенов, бактерий и простейших в связи со сменой состава растительности естественных пастбищ в осенний и весенний период (24). Аналогичные результаты получили A. Salgado-Flores с соавт. (25) при оценке различий в микробиоте рубца и слепой кишки северных оленей Rangifer tarandus tarandus, обитающих на территории Норвегии, при скармливании лишайников и гранулированных кормов. Авторы установили отсутствие значимого влияния рациона на численность основных групп микроорганизмов (бактерий, грибов, архей), но тем не менее показали наличие существенных различия по составу бактериального и археотного сообществ как в рубце, так и в слепой кишке. В частности, в рубце животных, которые получали лишайниковый рацион, отмечено достоверное снижение доли некоторых бактерий рода Ruminococcus, порядка Bacteroidales, принимающих участие в процессах разложения растительной клетчатки.
Мы впервые применили молекулярно-биологический анализ для изучения сезонных особенности формирования бактериальных сообществ рубца у северных оленей Rangifer tarandus из Российской Арктики. В результате проведенного исследования охарактеризована приуроченность изменений микробиоты к структуре кормовой базы и их связь с половозрастными различиями. Впервые показано, что сезонные изменения — один из ключевых факторов формирования микробиом рубца у северного оленя, что, вероятно, связано с особенностями кормовой базы животных.
Цель работы — сравнительная оценка состава бактериального сообщества рубца северных оленей регионов Арктической зоны России в летнеосенний и зимне-весенний периоды с использованием метода NGS-секвенирования.
Методика . Объектом исследования были 20 особей северного оленя ( Rangifer tarandus ) ненецкой породы, в том числе телята (возраст 4-8 мес) и взрослые особи (3-6 лет). Образцы содержимого рубца отбирали в летнеосенний и зимне-весенний период в 2017 и 2018 годах ( n = 3 для каждой возрастной группы животных) в Ненецком автономном округе (АО) (п. Нельмин-Нос, тундровая природно-климатическая зона). В те же сроки в летне-осенний и зимне-весенний периоды отбирали образцы пастбищной растительности, составляющей основу рациона северных оленей. Проводили ботаническое описание образцов растительности по «Определителю кормовых растений северного оленя» (26), учитывали соотношение различных видов растительности в рационе и его питательность (27).
Для анализа состава бактериального сообщества рубца северных оленей методом NGS-секвенирования (Next generation sequencing) из образцов выделяли тотальную ДНК, используя набор Genomic DNA Purification Kit («Fermentas, Inc.», Литва) согласно рекомендациям производителя. Конечную концентрацию тотальной ДНК в растворе измеряли на флуориметре Qubit («Invitrogen, Inc.», США) с наборами Qubit dsDNA BR Assay Kit («In-vitrogen, Inc.», США) в соответствии с рекомендациями производителя.
NGS-секвенирование проводили на платформе для секвенирования следующего поколения MiSeq («Illumina, Inc.», США) с праймерами для V3-V4 региона 16S рРНК; прямой праймер — 5´-TCGTCGGCAGCGTCAG-ATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3´; обратный праймер — 5´-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTA-CHVGGGTATCTAATCC-3´.
Для приготовления библиотек использовали реагенты Nextera® XT
IndexKit («Illumina, Inc.», США), для очистки ПЦР-продуктов — Agencourt AMPure XP («Illumina, Inc.», США), для проведения секвенирования — MiSeq® ReagentKit v2 (500 cycle) («Illumina, Inc», США).
Обработку полученных ридов (фильтрация по качеству Q30, трим-мирование праймеров) выполняли с помощью биоинформатической платформы Illumina («Illumina, Inc», США). Контроль качества ридов, оценку таксономического состава бактерий проводили в программе QIIME2 v.2019.10 с использованием базы данных GreenGenes версии 13.5 .
Для сравнения бактериальных сообществ рассчитывали показатели
α- и β-разнообразия. Для оценки α-разнообразия вычисляли индексы видового богатства (число OTUs — Operational Taxonomic Units, индекс обилия Chao 1) и индекс разнообразия Шеннона в программном обеспечении QIIME2 (28) с использованием параметров по умолчанию. Дополнительно определяли число общих и уникальных OTUs для образцов, сгруппированных по сезонному признаку, с использованием пакета VennDiagram (29) в программном обеспечении R . β-Разнообразие бактериальных сообществ оценивали в программном обеспечении R с применением алгоритма неметрического многомерного шка- лирования NMDS (nonmetric multidimensional scaling) (30) с использованием метрики расстояния Брея-Кёртиса из пакета «vegan» (RDocumentation. Package ‘vegan’, 2019, .
Тепловые карты, характеризующие различия в составе микробиома рубца в зимний и летний сезоны, строили с применением пакета «pheatmap» Version 1.0.12 для программного обеспечения R . При построении тепловых карт центрировали и масштабировали числовую матрицу по строкам и выполняли иерархическую кластеризацию по алгоритму Уорда (Ward’s method) на основании матрицы квадрата евклидовых расстояний.
Рис. 1. Регион отбора образцов содержимого рубца северных оленей Rangifer tarandus ненецкой породы (Ненецкий автономный округ, 2017 и 2018 годы).
Результаты NGS-секвенирования бактериального сообщества рубца северного оленя были депонированы в NCBI (National Center for Biotechnology Information) на сервисе BioProject в Sequence Read Archive (SRA) под номером PRJNA576999.
Статистический анализ данных осуществляли с применением программного обеспечения Microsoft Excel 2010. Приведены средние значения показателей ( M ) и их стандартные ошибки (±SEM). Достоверность различий оценивали при помощи t -критерия Стьюдента.
Результаты. На рисунке 1 показано место в Ненецком АО, где осуществляли отбор образцов. Усредненный со- став и питательность летне-осеннего и зимне-весеннего пастбищного рациона северных оленей представлены в таблице 1.
-
1. Усредненный состав и питательность пастбищного рациона северных оленей ( Rangifer tarandus ) ненецкой породы по сезонам года ( M ±SEM, Ненецкий АО, 2017-2018 годы)
-
2. Образцы содержимого рубца северных оленей ( Rangifer tarandus ) ненецкой породы по сезонам года, исследованные методом NGS-секвенирования (Ненецкий АО, 2017-2018 годы)
Номер образца
П Число прочтений П Сезон отбора образцов
Возраст
Пол
7SNAM
86227
Летне-весенний
Взрослая особь
Хор
12SNAF
84970
Летне-осенний
Взрослая особь
Важенка
8SNAM
81850
Летне-осенний
Взрослая особь
Хор
16SNCM
77574
Летне-осенний
Теленок
Хор
15SNCM
76548
Летне-осенний
Теленок
Хор
14SNAF
57229
Летне-осенний
Взрослая особь
Важенка
10SNAF
56651
Летне-осенний
Взрослая особь
Важенка
13SNCM
54770
Летне-осенний
Теленок
Хор
9SNAM
44070
Летне-осенний
Взрослая особь
Хор
11SNAF
41268
Летне-осенний
Взрослая особь
Важенка
16WNAF
31759
Зимне-весенний
Взрослая особь
Важенка
15WNAF
29221
Зимне-весенний
Взрослая особь
Важенка
20WNAM
28141
Зимне-весенний
Взрослая особь
Хор
18WNCM
26760
Зимне-весенний
Теленок
Хор
19WNCM
26538
Зимне-весенний
Теленок
Хор
22WNAM
25629
Зимне-весенний
Взрослая особь
Хор
14WNAF
24944
Зимне-весенний
Взрослая особь
Важенка
17WNCM
20437
Зимне-весенний
Теленок
Хор
13WNAF
17683
Зимне-весенний
Взрослая особь
Важенка
21WNAM
14443
Зимне-весенний
Взрослая особь
Хор
Северные олени — единственные животные, которые могут эффективно использовать скудные растительные ресурсы обширных пространств тундры, лесотундры, северной тайги (31). Одна из особенностей рациона этих животных — высокая доля лишайников. Скудность северного рациона заставляет северных оленей даже в летний период активно поедать различные виды лишайников (1, 2), содержащие большое количество их токсичных метаболитов, например усниновой кислоты (9). При этом в зимний период доля лишайников в рационе северного оленя может достигать 75 % (2). Лишайники, состоящие из грибов и водорослей, химически и структурно очень отличаются от сосудистых растений. У растений клеточные стенки состоят в основном из целлюлозы (34-68 %), гемицеллюлозы (3460 %) и лигнина (5-17 %) (32), тогда как у лишайников — преимущественно из гемицеллюлозы и лихенина (3).
Показатель I Летне-осенний сезон Зимне-весенний сезон
Показатели питательности
|
Растворимые углеводы (сахара), г/кг |
66,86±3,50 |
40,22±1,82 |
|
Массовая доля сухого вещества, % |
82,04±1,46 |
79,15±3,01 |
|
Сырой жир, г/кг |
15,46±0,54 |
10,62±0,26 |
|
Сырой протеин, г/кг |
64,03±3,50 |
40,69±1,40 |
|
Сырая зола, г/кг |
23,95±1,80 |
30,95±1,12 |
|
Сырая клетчатка, г/кг |
160,55±8,60 |
168,45±7,40 |
|
Компоненты |
рациона |
|
|
Лишайники рода Кладония ( Cladonia ) |
10 |
75 |
|
Береза обыкновенная ( Betula pendula Roth) |
20 |
5 |
|
Ива северная ( Sаlix borеalis Fries) |
15 |
|
|
Голубика обыкновенная ( Vaccinium uliginosum L.) |
5 |
5 |
|
Береза карликовая ( Bеtula nаna L.) |
20 |
|
|
Смесь многолетних трав |
30 |
15 |
П р и м е ч а н и е. Прочерки означают, что эти растения в пробе отсутствовали.
В таблице 2 приведена характеристика образцов содержимого рубца северного оленя, изученных методом NGS-секвенирования.
Известно, что в рубце жвачных бактерии составляют наиболее крупную фракцию, которая разнообразна по таксономическому составу и спектру продуцируемых ферментов, необходимых для усвоения растительных полисахаридов (33-35). В связи с этим в представленном исследовании нами впервые было изучено изменение структуры бактериального сообщества рубца северных оленей в разные сезонные периоды. Для исследований был выбран метод высокопроизводительного секвенирования (NGS-секвенирование), применение которого ранее позволило ряду авторов (11, 36) существенно расширить информацию о составе рубцового микробиома жвачных, в том числе северного оленя, по сравнению с классическими культуральными методами.
В результате NGS-секвенирования ДНК образцов мы получили библиотеку ридов, включающую 906712 последовательностей. Среднее число проанализированных последовательностей (ридов) в одном образце — 45336, минимальное — 14443, максимальное — 86227. Секвенированные последовательности были de novo кластеризованы в операционные таксономические единицы ОТЕ (OTUs) с порогом идентичности 97 %.
3. Характеристика α -биоразнообразия бактериального сообщества рубца у северных оленей ( Rangifer tarandus ) ненецкой породы по результатам NGS-секвенирования ( M ±SEM, Ненецкий автономный округ, 2017-2018 годы)
|
Параметр |
Величина показателя по группам сравнения |
p-value* |
|
|
Фактор сезонных |
различий |
||
|
Группа сравнения |
Зимне-весенний период |
Летне-осенний период |
|
|
Индекс Шеннона |
7,68±0,09 |
8,26±0,06 |
0,0000523 |
|
OTUs |
423,90±25,03 |
535,00±24,14 |
0,0075542 |
|
Индекс Chao1 |
435,71±25,87 |
548,82±25,09 |
0,0084612 |
|
Фактор возрастных |
различий |
||
|
Группа сравнения |
Телята |
Взрослые особи |
|
|
Индекс Шеннона |
8,03±0,10 |
7,95±0,11 |
0,7685305 |
|
OTUs |
497,67±7,87 |
471,64±30,19 |
0,5885066 |
|
Индекс Chao1 |
511,16±8,07 |
484,17±31,08 |
0,5963144 |
|
Фактор половых различий |
|||
|
Группа сравнения |
Хоры |
Важенки |
|
|
Индекс Шеннона |
8,01±0,10 |
7,93±0,15 |
0,4976555 |
|
OTUs |
482,33±24,90 |
475,13±39,74 |
0,8484414 |
|
Индекс Chao1 |
495,60±25,85 |
487,26±40,60 |
0,8311257 |
П р и м еч а ни е. Описание групп см. в разделе «Методика».
* Значение t- критерия Стьюдента, характеризующие достоверность различий между парой групп сравнения.
В таблице 3 представлены значения параметров α -биоразнообразия (OTUs, индексы Chao1 и Шеннона). Видно, что статистически значимые различия параметров α -биоразнообразия бактериального сообщества в рубце северного оленя наблюдались между группами образцов, отобранных в разные сезоны. Так, коэффициенты биоразнообразия для образцов, собранных в летне-весенний период, были достоверно выше по сравнению с таковыми для образцов в зимне-весенний период по индексам Chao1 (р = 0,0084612), Шеннона (р = 0,0000523) и числу OTUs (р = 0,0075542). Достоверных различий по коэффициентам α -биоразнообразия бактериального сообщества рубца в связи с половозрастными особенностями у северного оленя мы не выявили.
Полученные результаты оценки параметров биоразнообразия свидетельствуют не только о достоверном расширении качественного состава видов (OTUs) в летне-осенний период, но и о росте их относительной численности (или выравненности), что отражается индексом Шеннона, который учитывает видовое богатство и равномерность распределения OTUs (28). Увеличение значения индекса Chao1, который, помимо видового богатства, придает больший вес редким видам, также указывает на повышение биоразнообразия микробного сообщества рубца у северных оленей в летнеосенний период по сравнению с зимне-весенним.

Рис. 2. Сравнительный анализ α -разнообразия микробиома рубца у северных оленей ( Rangifer tarandus ) ненецкой породы в летне-осенний и зимне-весенний периоды с применением метода Venn graph analysis (Ненецкий АО, 2017-2018 годы).
Поскольку, судя по показателям α-разнообразия, сезонный фактор оказал наибольшее влияние на микробное сообщество рубца северного оленя, для визуализации различий мы рассчитали число общих и уникальных OTUs с использованием статистического пакета VennDiagram (рис. 2). Результаты выполненного анализа показали, что для каждого сезона был характерен свой уникальный набор OTUs. Общее число уникальных OTUs, которые встречались в микробиоме рубца хотя бы один раз, равнялось 1280. При этом в летний период выявили 1713 уни- кальных OTUs, в то время как в зимний период их число составило 1573.
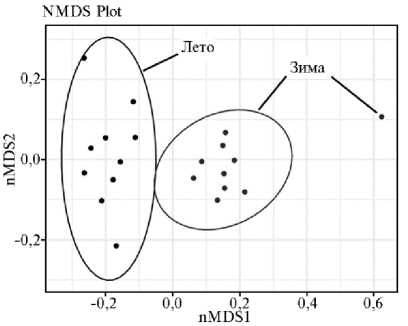
Рис. 3. Сравнительный анализ β -разнообразия микробиома рубца у северных оленей ( Rangifer tarandus ) ненецкой породы в летне-осенний и зимне-весенний периоды с применением метода NMDS (алгоритм неметрического многомерного шкалирования) (Ненецкий АО, 2017-2018 годы).
Изменения β-разнообра-зия, происходящие в структуре микробиома рубца под влиянием смены сезонов, визуализировали методом NMDS (алгоритм неметрического многомерного шкалирования), результаты которого представлены в виде двухмерного графика на рисунке 3. Сопоставление β-разнообразия состава микробиоты рубца северных оленей из разных подгрупп продемонстрировало наличие выраженной совместной кластеризации образцов по сезонам года. При этом наблюдалось значительное смещение по первой оси nMDS1 для образцов из летне-осенней и зимне-весенней подгрупп, чем под- тверждается уникальность состава микробиома северного оленя в разные сезоны года.
Полученные результаты согласуются с данными исследований, где сообщалось о присутствии специфических микробных таксонов в пищеварительном тракте, которые могут варьироваться у животных одного вида или генотипа (37). Такие внутри- и межвидовые вариации в составе микробиоты могут служить индикаторами экологических процессов, которые формируют связанное с хозяином микробное сообщество. С учетом этого факт изменений показателей биоразнообразия в микробиоте рубца у исследованных нами особей подтверждает существующее мнение о том, что микробное сообщество может отражать физиологическое состояние животных. На наш взгляд, детектированные нами изменения рубцовой микробиоты у северных оленей логичны, поскольку питание — один из наиболее значимых факторов, влияющих на состав микробиома рубца жвачных (11, 33).
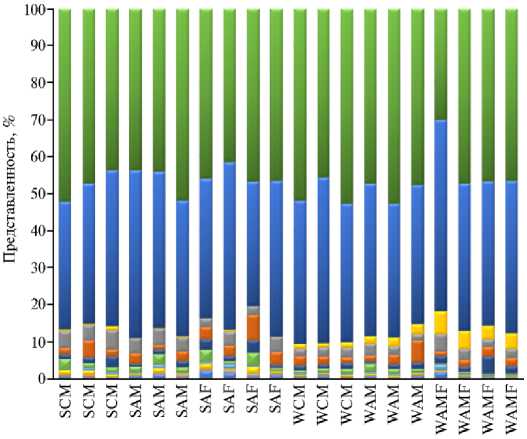
На рисунке 4 в виде гистограммы показан состав бактериального сообщества рубца исследованных нами особей северных оленей на уровне филумов. В целом состав микробиома рубца был представлен 20 филумами бактерий.
-
- Firmicutes
-
■ Bacteroidetes
uSRl и Veiracomicrobia
-
4 Spirochaetes
-
■ TM7
“ Ptanctomycetes
■ Proteobacteria Chloroflexi
I Actinobacteria i Невдешифицированные
-
■ Прочие
Рис. 4. Соотношение бактериальных филумов в микробиоме рубца у северных оленей ( Rangifer tarandus ) ненецкой породы в летне-осенний и зимне-весенний периоды : SCM, SAM, SAF — образцы летне-осеннего сезона от хоров-телят и взрослых особей — хоров и важенок; WCM, WAM, WAF — образцы зимне-весеннего сезона от хоров-телят и взрослых особей — хоров и важенок (Ненецкий АО, 2017-2018 годы).
На уровне филумов в сообществе доминировали представители Firmicutes (29,98-52,67 %) и Bacteroidetes (33,55-51,87 %), общая доля которых между сезонами достоверно не различалась. В меньшей степени в сообществе рубца оказались представлены бактерии филумов Proteobacteria (0,201,64 %), Verrucomicrobia (1,67-5,21 %), TM7 (0,69-4,67 %), Spirochaetes (1,206,88 %), Actinobacteria (0,40-3,50 %), Planctomycetes (0,27-3,50 %) и SR1 (0,146,09%). Доля бактерий из остальных филумов ( Cyanobacteria , Nitrospirae , Chloroflexi , Synergistetes , Fibrobacteres , Fusobacteria , Elusimicrobia , Tenericutes , OD1, Synergistetes и 2 неидентифицируемых филума) составила менее 1 % от всего бактериального сообщества.
На уровне семейства в большинстве образцов преобладали Rum-inococcaceae (5,87-16,17 %), Prevotellaceae (12,02-29,16 %). Другие доминирующие таксоны с высокой относительной численностью включали неклассифицированные бактерии порядка Bacteroidales (9,76-16,00 %) и семейства Clostridiales (4,31-15,83 %), Lachnospiraceae (4,17-14,29 %), Veillonellaceae (1,67-14,88%).
На уровне рода доминирующее положение в рубце северного оленя занимали представители Prevotella (8,83-27,04 %), Succiniclasticum (0,27-12,22 %), неидентифицированные бактерии родов из семейств V eillonellaceae (0,21-2,71 %), Lachnospiraceae (2,12-8,14 %), Ruminococcaceae (5,02-14,14 %) и из порядков Clostridiales (2,42-7,71 %) и Bacteroidales (9,6417,00 %).
Интересно отметить у некоторых особей присутствие в минорных долях микроорганизмов, которые традиционно относятся к возбудителям различных заболеваний млекопитающих, в том числе членов семейств Fuso-bacteriaceae и Mycoplasmataceae.
Несмотря на то, что в зимний период рацион северных оленей был представлен преимущественно лишайниками, которые не являются типичным кормом для других жвачных (крупный рогатый скот, овцы и др.), важно отметить, что в целом полученные профили состава микробиома соответствовали современным представлениям о микробиоте рубца жвачных животных. Полученные нами данные служат прямым подтверждением результатов G. Henderson с соавт. (11), которые при изучении микробиомов рубца различных жвачных 32 видов и подвидов показали наличие у них корового сообщества, которое оставалось стабильным у всех изученных видов и подвидов. В составе корового сообщества рубца жвачных эти авторы отметили среди представителей филумов Firmicutes и Bacteroidetes бактерии родов Prevotella , Butyrivibrio и Ruminococcus . По их данными, число других микроорганизмов (например, бактерий семейств Lachnospiraceae, Ruminococcaceae , Bacteroidales и Clostridiales ) менялось в зависимости от питания и окружающей среды, определяя тем самым уникальность каждого вида жвачных. При этом различия между группами животных, определяющие своего рода адаптацию к экологическим условиям, проявлялись на уровне минорных таксонов.
Стоит отметить важную физиологическую роль микроорганизмов филумов Firmicutes и Bacteroidetes в жизнедеятельности жвачных. Многие микроорганизмы, входящие в состав указанных таксонов (например, представители семейств Lachnospiraceae , Ruminococcaceae , Clostridiaceae , Bacter-oidaceae и др.), — это активные продуценты ферментов (целлюлаз, геми-целлюлаз, ксиланаз, гликозидгидролаз и т.д.), которые организм хозяина не способен вырабатывать самостоятельно. Микробные ферменты позволяют организму жвачных усваивать широкий спектр растительных полисахаридов, обеспечивая организм животных летучими жирными кислотами (ЛЖК), такими как ацетат, пропионат, бутират, и другими питательными соединениями (33, 34).
Сообщалось, что пропорция филумов Firmicutes и Bacteroidetes в рубце жвачных зависит от места обитания и типа питания (13). Так, многие бактерии филума Firmicutes (родов Ruminococcus , Clostridium , Butirivibrio и др.) активно продуцируют целлюлозолитические ферменты, что позволяет им расщеплять растительную клетчатку, тогда как представители Bacteroidetes синтезируют преимущественно амилолитические ферменты и способствуют усвоению легко сбраживаемых углеводов (34). Пояэтому изменение представленности микроорганизмов перечисленных групп может также приводить к изменению спектра продуцируемых ими метаболитов, оказывая тем самым влияние на организм хозяина.
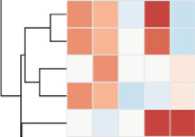
В нашем исследовании установлено, что смена сезонов вызывала значимые различия в численность микроорганизмов филумов Firmicutes и Bacteroidetes , а также ряда представителей других таксонов. На рисунках 5 и 6 представлены тепловые карты, отражающие представленность микроорганизмов, содержание которых в рубце северного оленя достоверно различалось в зимне-весенний и летне-осенний периоды.
Анализ данных, представленных на рисунке 5, показывает, что в летне-осенний период по сравнению с зимне-весенним доля представителей филумов SR1 (0,33±0,11 % против 3,09±0,52 %, r = 0,00004, р < 0,05) и Planctomycetes (0,01±0,006 % против 0,24±0,15 %, r = 0,02, р < 0,05) была достоверно меньше.
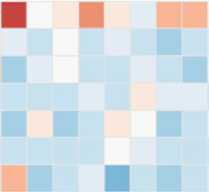
p_SRl p Chloroflexi pPlanctomycetes pTenericutes kBacteria p Actinobacteria p_ Verrucomicrobia
Рис. 5. Тепловая карта, отражающая различия в представленности филумов бактерий в образцах содержимого рубца у северных оленей ( Rangifer tarandus ) ненецкой породы в летне-осенний и зимне-весенний периоды : S — летний, W — зимний, A — взрослая особь, С — молодняк, M — хор, F — важенка; k — царство, p — филум (Ненецкий АО, 2017-2018 годы).
Цветовая шкала
^Rum inococcus ^Butyrivibrio g_Succiniclasticum gCoprococcus o_RF32 o_GMD14H09 g_CF231 p_SRl g Prevotella f_RFP12 oBacteroidales f_[ MogibacieriaceaeA ^Clostridium oWCHBI-41
?_Mv coplasm ataceae f_S24-7 о Clostridiales f Christensen ellaceae ^Bulleidia k Bacteria g_p-75-a5
^_ Clostridiales VPirellulaceae g SHD-231 o_PeHg47 oStreptophyta fPrevotellaceae ^Blautia f_ Coriobacteriaceae oRickettsiales g_L7A_Ell
-1

Цветовая шкала
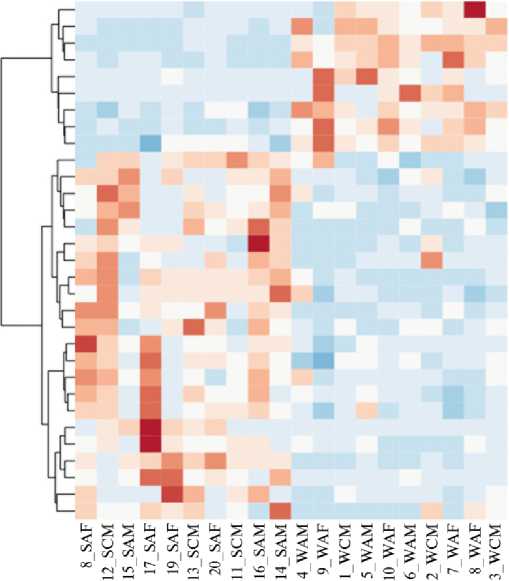
Рис. 6. Тепловая карта, отражающая различия в представленности родов бактерий в образцах содержимого рубца у северняых оленей (Rangifer tarandus) ненецкой породы в летне-осенний и зимне-весенний периоды: S — летний, W — зимний, A — взрослая особь, С — молодняк, M — хор, F — важенка; g — род, f — семейство, o — порядок, k — царство, р — филум (Ненецкий АО, 2017-2018 годы).
В зимне-весенний период отмечали достоверное снижение представленности ряда филумов, в том числе Actinobacteria (0,26±0,08 % против 0,03±0,01 %, r = 0,004), Chloroflexi (0,95±0,15 % против 0,43±0,06 %, r = 0,004), Tenericutes (3,10±0,08 % против 0,05±0,02 %, r = 0,006), Verrucomicrobia (0,27±0,06 % против 0,09±0,03 %, r = 0,01), неидентифицируемой филы
(1,96±0,32 % против 1,01±0,24 %, r = 0,02); для всех r р < 0,05. Как закономерность, необходимо отметить снижение доли бактерии филумов Actinobacteria , Verrucomicrobia и Chloroflexi в рубце в зимний период (по мнению ряда исследователей, эти микроорганизмы ассоциированы с почвенными и растительными экосистемами) (38).
Кроме того, по результатам нашего исследования, общая доля доминирующих в рубце северного оленя бактерий филумов Firmicutes и Bac-teroidetes в целом не показала достоверных различий в связи со сменой сезона. Однако, как видно из рисунка 6, на более низком таксономическом уровне численность некоторых представителей указанных таксонов в зимний период достоверное вовзрастала. Интересно, что достоверные различия были выявлены прежде всего для микроорганизмов, ассоциированных с процессами ферментации растительных полисахаридов. Так, в зимний период в рубце северного оленя происходило значимое увеличение количества бактерий родов Succiniclasticum (от 1,59±0,26 % в летне-осенний период до 9,55±0,68 % в зимне-весенний, r = 0,000000001), Paraprevotellaceae (от 1,08±0,14 % до 2,41±0,20 %, r = 0,00002), Coprococcus (от 0,08±0,03% до 1,18±0,21 %, r = 0,00004), Butyrivibrio (от 0,77±0,10 % до 3,58±0,55 %, r = 0,00007), Prevotella (от 14,13±1,13 % до 20,10±0,91 %, r = 0,0005) и Ruminococcus (от 0,28±0,01 % до 0,97±0,253 %, r = 0,01); для всех r р < 0,05.
Напротив, доля целого набора других микроорганизмов из филумов Firmicutes и Bacteroides в зимний период существенно снижалась, Такие закономерности наблюдались в отношении представителей родов Clostridium (от 0,98±0,13 % до 0,41±0,07 %, r = 0,001), Blautia (от 1,20±0,15 % до 0,18±0,04 %, r = 0,000006), неидентифицируемых родов из порядка Clostrid-iales (от 5,71±0,43 % до 2,81±0,21 %, r = 0,000006), из семейств Christensen-ellaceae (от 2,39±0,213 % до 1,11±0,17 %, r = 0,00001), Mogibacteriaceae (от 2,23±0,41 % до 0,89±0,19 %, r = 0,007) и Prevotellaceae (от 3,29±0,50 % до 1,99±0,17 %, r = 0,02); для всех r р < 0,05.
Полученные нами данные подтверждают мнение G. Henderson с со-авт. (11) о том, что различия в микробиоме рубца жвачных, определяющие своего рода адаптацию к экологическим условиям проявляются на уровне минорных таксонов.
Анализируя результаты нашего исследования, можно сделать вывод о достаточно четкой ассоциации микробиома рубца северного оленя с особенностями питания в разные сезоны. Учитывая, что лишайники состоят в основном из структурных углеводов (3, 32), таких как гемицеллюлоза, представляется закономерным преобладание в рубце в зимне-весенний период бактерий родов Butyrivibrio и Ruminococcus , гидролизующих указанный полисахарид. Известно, что роль в рубцовом микробиоме других бактерий — представителей родов Prevotella и Paraprevotella из филума Bacteroidetes связана с деградацией крахмалистых полисахаридов посредством синтеза амилаз (39). Рост их представленности в зимний период может быть закономерен в связи с высоким содержанием в рационе северного оленя крахмала лишайников — лихенина. Также интересен обнаруженный факт роста представленности превотелл в рубце китайского пятнистого оленя, рацион которого включал большое количество листьев дуба, содержащих значительное количество вторичных метаболитов растений с антимикробным действием (40).
Необходимо отметить, что численность другого представителя пре-вотелл (неидентифицируемого рода из семейства Prevotellaceae ) в рубце северного оленя была, напротив, выше в летне-осенний период (см. рис. 6).
Это может объясняться высокой вариабельностью генома микроорганизмов указанного семейства, вследствие чего бактерии разных родов и видов пре-вотелл проявляют способность синтезировать широкий спектр ферментов, гидролизующих растительные полисахариды. Таким образом, повышение представленности бактерий выявленного нами представителя превотелл в летне-осенний период возможно благодаря его способности к образованию целлюлаз, расщепляющих растительную клетчатку, доля которой летом в составе рациона северного оленя возрастает.
Представители родов Clostridium и Blautia также относятся к целлюлозоразлагающим бактериям рубца жвачных, что объясняет достоверное увеличение их присутствия у северного оленя в летне-осенний период и свидетельствует о повышении потенциала микробного сообщества в отношении ферментации растительных полисахаридов. Кроме того, ранее сообщалось о значительном антимикробном действии усниновой кислоты лишайников ряд штаммов клостридий (5). Отметим, что полученные ранее результаты T.H. Aagnes с соавт. (3) вступают в некоторое противоречие с нашими данными, поскольку эти авторы сообщали об увеличение представленности клостридий в зимний период, что, очевидно, также может объясняться видовыми метаболическими особенностями различных видов из рода Clostridium .
В исследовании F. Li с соавт. (41) при анализе микробиома рубца у 709 особей крупного рогатого скота отмечено, что присутствие комплекса бактерий (в том числе неидентифицируемых бактерий порядка Clostridiales , семейств Christensenellaceae , Mogibacteriaceae ) прямо и положительно коррелирует с количеством ацетата, а бактерий рода Succiniclasticum — с количеством пропионата. Продемонстрированные авторами данные свидетельствуют о наличии определенных метаболических взаимосвязей между указанными микроорганизмами. Так, известно, что образование ацетата в рубце жвачных связано с процессами расщепления растительной клетчатки, тогда как пропионата — с метаболизмом крахмала (34). Таким образом, полученные нами результаты объясняют повышение обилия бактерий, синтезирующих ацетат, в летний период, когда основу питания северного оленя составляют растения, а продуцирующих пропионат — в зимний период, когда животные преимущественно поедают лишайники.
Помимо этого, в зимне-весенний период нами выявлено некоторое снижение представленности микроорганизмов, относящихся к филе Cyanobacteria (от 0,07±0,02 % до 0 %, r = 0,00004, р < 0,05). По результатам нашего исследования, как уже отмечалось, представленность цианобактерий в рубце особей северного оленя, обитающих на территории Ненецкого АО, как в летне-осенний, так и в зимне-весенний период, в целом оказалась минорной. Тем не менее, в других работах (26, 42) упоминалось о наличии в сообществе рубца северных оленей достаточно высокого числа цианобактерий, что представляется вполне логичным, поскольку цианобактерии относятся к симбионтам лишайников, составляющих до 10-15 % летнего пастбищного рациона северных оленей и до 75% — зимнего (43).
Интересные закономерности были отмечены нами для целого спектра условно-патогенных микроорганизмов, Полученные результаты показали, что в летне-осенний период в рубце северного оленя получают развитие многие микроорганизмы, которые относятся к возбудителям инфекций. При этом в зимне-весенний период представленность таких микроорганизмов достоверно снижается: для Erysipelotrichaceae — с 1,12±0,17 % в летнеосенний период до 0,50±0,06 % в зимне-весенний ( r = 0,003), для Coriobac-teriaceae — с 0,26±0,08 % до 0,02±0,01 % ( r = 0,005), Mycoplasmataceae — с
0,22±0,06 % до 0,04±0,02 % ( r = 0,02) и Rickettsiales — с 0,39±0,11 % до 0,10±0,02 % ( r = 0,017); для всех r р < 0,05.
Полученные нами результаты в некоторой степени подтверждаются исследованием (44), в котором было обнаружено, что бактерии семейства Coriobacteriaceae — одни из наиболее чувствительных индикаторов, реагирующих на изменения в рубцовом микробиоме жвачных. Отметим, что выявленное нами достоверное увеличение представленности в рубце микоплазм семейства Mycoplasmataceae , в состав которого входит большое число патогенных бактерий, в летний период соответствует имеющимся сведениям о большей заболеваемости северных оленей именно в летний сезон (45).
Ранее были выявлены интересные закономерности положительной корреляции между обилием грамположительных бактерий семейства Erysiopelotrichaceae и особенностями кормления крупного рогатого скота (46). Подобно видам рода Lactobacillus , большинство представителей этого семейства ферментируют широкий спектр сахаров с образованием в основном молочной кислоты, что в результате повышает кислотность в рубце. Известно, что увеличение количества молочной кислоты в рубце жвачных приводит к нарушению переваривания клетчатки вследствие повышения рН среды и развитию лактатного ацидоза. Исследования J.E. Nocek с соавт. (47) показали, что повышение содержания молочной кислоты в рубце крупного рогатого скота может приводить к инфицированию фузобактериями вида Fusobacterium necrophorum и развитию некробактериозов в результате проникновения патогена через повреждения рубцового эпителия в кровь. Учитывая, что некробактериоз в стадах оленей носит сезонный (летний) характер, повышение численности представителей семейства Erysipelothri-haceae , которое мы выявили в указанный период года, представляется закономерным и интересным.
Таким образом, исследования северного оленя ( Rangifer tarandus ) ненецкой породы, проведенные нами в Российской Арктике, показали достоверное увеличение α -биоразнообразия в летне-осенний период по сравнению с зимне-весенним, в том числе по числу OTUs (р = 0,0075542), индексам Chao1 (р = 0,0084612) и Шеннона (р = 0,0000523). Статистически значимых различий по коэффициентам биоразнообразия бактериального сообщества рубца в связи с половозрастными особенностями у северного оленя мы не обнаружили. Независимо от сезона в содержимом рубца доминирующими были представители филумов Firmicutes и Bacteroidetes , менее представленными оказались бактерии филумов Proteobacteria , Actinobacteria , Verrucomicrobia , TM7, Spirochaete , Planctomycetes и SR1, доля других детектированных таксонов была минорна. Выявлен ряд значимых изменений в составе определенных таксономических групп бактерий в разные сезоны года. Так, в зимние-весенний период в рубце отмечается увеличение численности бактерий, участвующих в разложении полисахаридов лишайников, в том числе гемицеллюлозы ( Butyrivibrio , r = 0,00007; Ruminococcus , r = 0,01), и лихенина ( Succiniclasticum , r = 0,000000001; Paraprevotellaceae , r = 0,00002; Prevotella , r = 0,0005). В летние-осенний период повышается обилие микроорганизмов, ассоциированных с разложением растительной клетчатки, в том числе представителей родов Clostridium ( r = 0,001), Blautia ( r = 0,000006), неидентифицируемых родов из порядка Clostridiales ( r = 0,000006), из семейств Christensenellaceae ( r = 0,00001), Mogibacteriaceae ( r = 0,007) и Prevotel-laceae ( r = 0,02). Также обнаружено, что в летний период в рубце северного оленя развивается группа микроорганизмов, которые относятся к возбудителям инфекционных процессов, включая бактерии семейств Erysipelotricha-ceae ( r = 0,003), Coriobacteriaceae ( r = 0,005), Mycoplasmataceae ( r = 0,02),
Rickettsiales ( r = 0,017). Для всех значений r р < 0,05.
Итак, полученные нами микробиомные профили северного оленя в целом соответствовали современным представлениям о микробиоте рубца жвачных животных. В летне-осенний период отмечено достоверное повышение показателей α -биоразнообразия микробиома рубца по сравнению с зимне-весенним. Сопоставление β -разнообразия микробиоты рубца северных оленей продемонстрировало наличие выраженной кластеризации образцов по сезонам года. В зимне-весенний сезон выявлено достоверное увеличение обилия микроорганизмов, разлагающих полисахариды лишайников, в том числе гемицеллюлозу ( Butyrivibrio , Ruminococcus ) и лихенин ( Succiniclasticum , Paraprevotellaceae , Prevotella ). В летние-осенний период отмечается достоверное увеличение доли целлюлозолитических бактерий Clostridium , Blautia , Clostridiales , Christensenellaceae , Mogibacteriaceae , Prevotellaceae. Кроме того, показано, что в летний период в рубце северного оленя развивается группа микроорганизмов, которые относятся к возбудителям инфекций ( Erysipelotrichaceae , Coriobacteriaceae , Mycoplasmataceae , Rickettsiales ). В целом, анализируя результаты исследования, можно сделать вывод о достаточно четкой ассоциации микробиома рубца северного оленя с особенностями питания в различные сезонные периоды. При этом различия в микробиоме рубца жвачных, определяющие адаптацию к экологическим условиям, проявляются на уровне минорных таксонов. Полученные данные могут быть использованы при разработке средств адаптации северных оленей к экологическим условиям территории, а также средств профилактики и лечения заболеваний, так или иначе связанных с сезонными изменениями микробиома рубца.
Список литературы Сезонные изменения микробиома рубца у северного оленя (Rangifer tarandus) в условиях российской Арктики
- Morgavi D.P., Kelly W.J., Janssen P.H., Attwood G.T. Rumen microbial (meta)genomics and its application to ruminant production. Animal, 2013, 7(1): 184-201 ( ). DOI: 10.1017/S1751731112000419
- Mathiesen S.D., Mackie R.I., Aschfalk A., Ringø E., Sundset M.A. Microbial ecology of the digestive tract in reindeer: seasonal changes. In: Biology of growing animals. Vol. 2 Microbial ecology in growing animals /W.H. Holzapfel, P.J. Naughton, S.G. Pierzynowski, R. Zabielski, E. Salek (eds.). Elsevier Ltd., Edinburgh, 2005: 75-102 ( DOI: 10.1016/S1877-1823(09)70037-2)
- Aagnes T.H., Sørmo W., Mathiesen S.D. Ruminal microbial digestion in free living, in captive lichen-fed and in starved reindeer (Rangifer tarandus tarandus) in winter. Applied and Environmental Microbiology, 1995, 61(2): 583-591.
- Orpin C.G., Mathiesen S.D., Greenwood Y., Blix A.S. Seasonal changes in the ruminal microflora of the high-arctic Svalbard reindeer (Rangifer tarandus platyrhynchus). Applied and Environmental Microbiology, 1985, 50(1): 144-151.
- Sundset M.A., Kohn A., Mathiesen S.D., Praesteng K.E. Eubacterium rangiferina, a novel usnic acid-resistant bacterium from the reindeer rumen. Naturwissenschaften, 2008, 95(8): 741-749 ( ). DOI: 10.1007/s00114-008-0381-0
- Kartsev V., Lichitsky B., Geronikaki A., Petrou A., Smiljkovic M., Kostic M., Radanovic O., Soković M. Design, synthesis and antimicrobial activity of usnic acid derivatives. Med. Chem. Commun., 2018, 9(5): 870-882 ( ).
- DOI: 10.1039/C8MD00076J
- Roach J.A.G., Musser S.M., Morehouse K., Woo J.Y.J. Determination of usnic acid in lichen toxic to elk by liquid chromatography with ultraviolet and tandem mass spectrometry determination. J. Agric. Food. Chem., 2006, 54(7): 2484-2490 ( ).
- DOI: 10.1021/jf052767m
- Dailey R.N, Montgomery D.L., Ingram J.T., Siemion R., Vasquez M., Raisbeck M.F. Toxicity of lichen secondary metabolite (+)-Usnic acid in domestic sheep. Veterinary Pathology, 2008, 45(1): 19-25 ( ).
- DOI: 10.1354/vp.45-1-19
- Palo R.T. Usnic acid, a secondary metabolite of lichens and its effect on in vitro digestibility in reindeer. Rangifer, 1993, 13(1): 39-43 ( ).
- DOI: 10.7557/2.13.1.1071
- Sundset M.A., Barboza P.S., Green T.K., Folkow L.P., Blix A.S., Mathiesen S.D. Microbial degradation of usnic acid in the reindeer rumen. Naturwissenschaften, 2010, 97: 273-278 ( ).
- DOI: 10.1007/s00114-009-0639-1
- Henderson G., Cox F., Ganesh S., Jonker A., Young W., Global Rumen Census Collaborators, Janssen P.H. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range. Scientific Reports, 2015, 5: 14567 ( ).
- DOI: 10.1038/srep14567
- Fonty G., Joblin K., Chavarot M., Roux R., Naylor G., Michallon F. Establishment and development of ruminal hydrogenotrophs in methanogen-free lambs. Applied and Environmental Microbiology, 2007, 73(20): 6391-6403 ( ).
- DOI: 10.1128/AEM.00181-07
- Sundset M.A., Præsteng K.E., Cann I.K.O., Mathiesen S.D., Mackie R.I. Novel rumen bacterial diversity in two geographically separated sub-species of reindeer. Microb. Ecol., 2007, 54(3): 424-438 ( ).
- DOI: 10.1007/s00248-007-9254-x
- Crater A.R., Barboza P.S., Forster R. Regulation of rumen fermentation during seasonal fluctuations in food intake of muskoxen. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology, 2007, 146(2): 233-241 ( ).
- DOI: 10.1016/j.cbpa.2006.10.019
- Rustomo B., AlZahal O., Odongo N., Duffield T.F., McBride B.W. Effects of rumen acid load from feed and forage particle size on ruminal pH and dry matter intake in the lactating dairy cow. Journal of Dairy Science, 2006, 89(12): 4758-4768 (
- DOI: 10.3168/jds.S0022-0302(06)72525-5)
- Kleen J.L., Hooijer G.A., Rehage J., Noordhuizen J.P. Subacute ruminal acidosis (SARA): a review. Journal of Veterinary Medicine Series A, 2003, 50(8): 406-414 ( ).
- DOI: 10.1046/j.1439-0442.2003.00569.x
- McEwan N.R., Abecia L., Regensbogenova M., Adam C.L., Findlay P.A., Newbold C.J. Rumen microbial population dynamics in response to photoperiod. Letters in Applied Microbiology, 2005, 41(1): 97-101 ( )
- DOI: 10.1111/j.1472-765X.2005.01707.x
- Uyeno Y., Sekiguchi Y., Tajima K., Takenaka A., Kurihara M., Kamagata Y. An rRNA-based analysis for evaluating the effect of heat stress on the rumen microbial composition of Holstein heifers. Anaerobe, 2010, 16(1): 27-33 ( ).
- DOI: 10.1016/j.anaerobe.2009.04.006
- Romero-Pérez G.A., Ominski K.H., McAllister T.A., Krause D.O. Effect of environmental factors and influence of rumen and hindgut biogeography on bacterial communities in steers. Applied and Environmental Microbiology, 2011, 77(1): 258-268 ( ).
- DOI: 10.1128/AEM.01289-09
- Olsen M.A., Aagnes T.H., Mathiesen S.D. The effect of timothy silage on the bacterial population in rumen fluid of reindeer (Rangifer tarandus tarandus) from natural summer and winter pasture. FEMS Microbiology Ecology, 1997, 24(2): 127-136 ( ).
- DOI: 10.1111/j.1574-6941.1997.tb00429.x
- Wang T.Y., Chen H.L., Lu M.J., Chen Y.C., Sung H.M., Mao C.T., Cho H.Y., Ke H.M., Hwa T.Y., Ruan S.K., Hung K.Y., Chen C.K., Li J.Y., Wu Y.C., Chen Y.H., Chou S.P., Tsai Y.W., Chu T.C., Shih C.A., Li W.H., Shih M.C. Functional characterization of cellulases identified from the cow rumen fungus Neocallimastix patriciarum W5 by transcriptomic and secretomic analyses. Biotechnol. Biofuels, 2011, 4: 24 ( ).
- DOI: 10.1186/1754-6834-4-24
- Fonty G., Joblin K.N. Rumen anaerobic fungi: their role and interactions with other rumen microorganisms in relation to fiber digestion. In: Physiological aspects of digestion and metabolism in ruminants. Academic Press, Toronto, ON, 1990: 665-680.
- Sundset M.A., Edwards J.E., Cheng Y.F., Senosiain R.S., Fraile M.N., Northwood K.S., Præsteng K.E., Glad T., Mathiesen S.D., Wright A.D.G. Molecular diversity of the rumen microbiome of Norwegian reindeer on natural summer pasture. Microb. Ecol., 2009, 57(2): 335-348 ( ).
- DOI: 10.1007/s00248-008-9414-7
- Sundset M.A., Edwards J.E., Cheng Y.F., Senosiain R.S., Fraile M.N., Northwood K.S., Praesteng K.E., Glad T., Mathiesen S.D., Wright A.D. Rumen microbial diversity in Svalbard reindeer, with particular emphasis on methanogenic archaea. FEMS Microbiology Ecology, 2009, 70(3): 553-562 ( ).
- DOI: 10.1111/j.1574-6941.2009.00750.x
- Salgado-Flores A., Hagen L.H., Ishaq S.L., Zamanzadeh M., Wright A.D.G., Pope P.B., Sundset M.A. Rumen and cecum microbiomes in reindeer (Rangifer tarandus tarandus) are changed in response to a lichen diet and may affect enteric methane emissions. PLoS ONE, 2016, 11(5): e0155213 ( ).
- DOI: 10.1371/journal.pone.0155213
- Полежаев А.Н., Беркутенко А.Н. Определитель кормовых растений северного оленя: Магаданская область. Магадан, 1981.
- Мотовилов К.Я., Булатов А.П, Позняковский П.М., Ланцева Н.Н., Миколайчик И.Н. Экспертиза кормов и кормовых добавок. Новосибирск, 2004.
- Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peсa A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7: 335-336 ( ).
- DOI: 10.1038/nmeth.f.303
- Oliveros J.C. Venny. An interactive tool for comparing lists with Venn's diagrams. 2007. Режим доступа: http://bioinfogp.cnb.csic.es/tools/venny/index.html. Без даты.
- Warton D.I., Wright T.W., Wang Y. Distance-based multivariate analyses confound location and dispersion effects. Methods in Ecology and Evolution, 2012, 3(1): 89-101 ( ).
- DOI: 10.1111/j.2041-210X.2011.00127.x
- Morgavi D.P., Kelly W.J., Janssen P.H., Attwood G.T. Rumen microbial (meta)genomics and its application to ruminant production. Animal, 2013, 7(1): 184-201 ( ).
- DOI: 10.1017/S1751731112000419
- Person S.J., White R.G., Luick J.R. Determination of nutritive value of reindeer-caribou range, In: Proceedings of the 2nd International Reindeer and Caribou Symposium /E. Reimers, E. Gaare, S. Skjenneberg (eds.). Direktoratet for vilt og ferskvannsfisk, Trondheim, Norway, 1980: 224-239.
- Church D.C. Ruminant animal: digestive physiology and nutrition. Prentice Hall, New Jersey, 1993.
- Hungate R.E. The rumen and its microbes. Academic Press, NY, 1966.
- Hackmann T.J., Spain J.N. Invited review: ruminant ecology and evolution: perspectives useful to ruminant livestock research and production. Journal of Dairy Science, 2010, 93(4): 1320-1334 ( ).
- DOI: 10.3168/jds.2009-2071
- Peng S., Yin J., Liu X., Jia B., Chang Z., Lu H., Jiang N., Chen Q. First insights into the microbial diversity in the omasum and reticulum of bovine using Illumina sequencing. J. Appl. Genetics, 2015, 56(3): 393-401 ( ).
- DOI: 10.1007/s13353-014-0258-1
- Smith C.C.R., Snowberg L.K., Gregory C.J., Knight R., Bolnick D.I. Dietary input of microbes and host genetic variation shape among-population differences in stickleback gut microbiota. ISME J., 2015, 9(11): 2515-2526 ( ).
- DOI: 10.1038/ismej.2015.64
- Fiere N. Embracing the unknown: disentangling the complexities of the soil microbiome. Nature Reviews Microbiology, 2017, 15: 579-590 ( ).
- DOI: 10.1038/nrmicro.2017.87
- Shen J., Zheng L., Chen X., Han X., Cao Y., Yao J. Metagenomic analyses of microbial and carbohydrate-active enzymes in the rumen of dairy goats fed different rumen degradable starch. Frontiers in Microbiology, 2020, 11: 1003 ( ).
- DOI: 10.3389/fmicb.2020.01003
- Li Z.P., Liu H.L., Guang Y.L., Bao K., Wang K.Y., Xu C., Yang Y.F., Yang H.F., Wright A.D.G. Molecular diversity of rumen bacterial communities from tannin-rich and fiber-rich forage fed domestic Sika deer (Cervus nippon) in China. BMC Microbiol., 2013, 13: 151 ( ).
- DOI: 10.1186/1471-2180-13-151
- Li F., Li C., Chen Y., Liu J. Host genetics influence the rumen microbiota and heritable rumen microbial features associate with feed efficiency in cattle. Microbiome, 2019, 7: 92 ( ).
- DOI: 10.1186/s40168-019-0699-1
- Zielińska S., Kidawa D., Stempniewicz L., Łoś M., Łoś J.M. New insights into the microbiota of the Svalbard Reindeer Rangifer tarandus platyrhynchus. Frontiers in Microbiology, 2016, 7: 170 ( ).
- DOI: 10.3389/fmicb.2016.00170
- Mathiesen S.D, Haga Ø.E, Kaino T., Tyler N.J.C. Diet composition, rumen papillation and maintenance of carcass mass in female Norwegian reindeer (Rangifer tarandus tarandus) in winter. Journal of Zoology, 2000, 251(1): 129-138 ( ).
- DOI: 10.1111/j.1469-7998.2000.tb00598.x
- Zhou M., Peng Y., Chen Y., Klinger C., Masahito O., Liu J., Guan L. Assessment of microbiome changes after rumen transfaunation: implications on improving feed efficiency in beef cattle. microbiome, 2018, 6: 62 ( ).
- DOI: 10.1186/s40168-018-0447-y
- Казановский Е.С., Карабанов В.П., Клебенсон К.А. Болезни северных оленей. Сыктывкар, 2011.
- Morita H., Shiratori C., Murakami M., Takami H., Toh H., Kato Y., Nakajima F., Takagi M., Akita H., Masaoka T., Hattori M. Sharpea azabuensis gen. nov., sp. nov., a Gram-positive, strictly anaerobic bacterium isolated from the faeces of thoroughbred horses. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(12): 2682-2686 ( ).
- DOI: 10.1099/ijs.0.65543-0
- Nocek J.E. Bovine acidosis: implications on laminitis. Journal of Dairy Science, 1997, 80: 1005-1028 (
- DOI: 10.3168/jds.S0022-0302(97)76026-0)


