Шкала оценки риска развития феномена "no-reflow" в прогнозировании нарушений миокардиальной перфузии по данным контрастной эхокардиографии у пациентов с острым инфарктом миокарда с подъемом сегмента ST после эндоваскулярной реваскуляризации
Автор: Бессонов И.С., Криночкин Д.В., Шадрин А.А., Зырянов И.П.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.37, 2022 года.
Бесплатный доступ
Цель: изучить возможности шкалы оценки риска развития ангиографического феномена «no-reflow» в прогнозировании нарушений миокардиальной перфузии по данным контрастной эхокардиографии (ЭхоКГ) у пациентов с острым инфарктом миокарда с подъемом сегмента (ОИМпST) после выполнения чрескожных коронарных вмешательств (ЧКВ).Материал и методы. В исследование были включены 40 пациентов с ОИМпST, которым выполняли ЧКВ. Всем пациентам проводили расчет индивидуального риска развития феномена «no-reflow» с использованием разработанной ранее шкалы. При количестве баллов ≥ 35 риск развития феномена «no-reflow» расценивался как высокий. В течение 6 ч после ЧКВ всем пациентам проводили контрастную ЭхоКГ с оценкой миокардиальной перфузии. При анализе госпитальных результатов вмешательств оценивали летальность, частоту рецидива ИМ, тромбоза стента.Результаты. Высокий риск развития феномена «no-reflow» определялся у 13 (32,5%) пациентов. Ангиографический феномен «no-reflow» статистически значимо чаще определялся у пациентов в группе высокого риска в сравнении с больными низкого риска (46,2 против 11,1%; р = 0,038). Нарушения миокардиальной перфузии по данным контрастной ЭхоКГ статистически значимо чаще определялись у пациентов в группе высокого риска (61,5 против 18,5%; р = 0,011). По результатам ROC-анализа чувствительность шкалы оценки риска развития феномена «no-reflow» в определении пациентов с нарушением миокардиальной перфузии по данным контрастной ЭхоКГ составила 62%, специфичность - 85%, площадь под кривой (AUC) - 0,789 (p = 0,003).Выводы. Разработанная на основе ангиографических критериев шкала персонифицированного риска развития феномена «no-reflow» позволяет с хорошей прогностической точностью выявлять пациентов с высоким риском развития нарушений миокардиальной перфузии по данным контрастной ЭхоКГ.
Острый инфаркт миокарда, чрескожное коронарное вмешательство, феномен «noreflow», миокардиальная перфузия, контрастная эхокардиография
Короткий адрес: https://sciup.org/149140499
IDR: 149140499 | УДК: 616.127-005.8-089.819.5-06-073.43-8 | DOI: 10.29001/2073-8552-2022-37-2-57-64
Текст научной статьи Шкала оценки риска развития феномена "no-reflow" в прогнозировании нарушений миокардиальной перфузии по данным контрастной эхокардиографии у пациентов с острым инфарктом миокарда с подъемом сегмента ST после эндоваскулярной реваскуляризации
Bessonov I.S., Krinochkin D.V., Shadrin A.A., Zyrianov I.P. Risk assessment score of noreflow phenomenon in predicting myocardial perfusion disorders by contrast echocardiography in ST-segment elevation myocardial infarction patients after endovascular revascularization. The Siberian Journal of Clinical and Experimental Medicine. 2022;37(2):57–64. https://doi. org/10.29001/2073-8552-2022-37-2-57-64.
В настоящее время в лечении острого инфаркта миокарда с подъемом сегмента ST (ОИМпST) используют патофизиологической подход, направленный на скорейшую реперфузию миокарда путем реканализации инфаркт-связанной коронарной артерии. На современном этапе основной является инвазивная стратегия реперфузии, когда коронарный кровоток восстанавливается в ходе проведения чрескожного коронарного вмешательства (ЧКВ) [1]. Во многом благодаря широкому распространению инвазивной стратегии реперфузии в последние годы удалось существенно сократить уровень летальности у пациентов с ОИМпST [2]. Несмотря на это, в 5–30% случаев существует вероятность развития фе- номена «no-reflow», который также называют феноменом микроциркуляторной обструкции. Этот феномен выражается в отсутствии должного кровоснабжения миокарда на уровне тканей даже после полного восстановления проходимости коронарной артерии. Развитие феномена «no-reflow» ассоциируется с неблагоприятным прогнозом и часто приводит к систолической дисфункции и образованию аневризмы левого желудочка (ЛЖ). Также при развитии феномена «no-reflow» увеличивается риск возникновения повторного ИМ [3].
По результатам проведенных ранее исследований нами была разработана шкала (балльная система) для расчета риска развития феномена «no-reflow» [4, 5]. В ее основе лежат 6 показателей, такие как возраст, время от начала болевого синдрома до проведения реваску- ляризации, уровень глюкозы в крови, содержание нейтрофилов в крови, исходный кровоток по TIMI (Thrombolysis In Myocardial Infarction), техническая возможность проведения прямого стентирования инфаркт-связанной коронарной артерии. Использование шкалы позволяет с хорошей прогностической точностью выявлять пациентов с высоким риском развития феномена «no-reflow». При разработке шкалы феномен «no-reflow» диагностировался по ангиографическим критериям, таким как степень восстановления коронарного кровотока по TIMI и степень миокардиального свечения (Myocardial blush grade). Этот подход является наиболее распространенным в клинической практике. Вместе с тем следует отметить, что такие методики визуализации, как магнитно-резонансная томография с контрастированием и миокардиальная контрастная эхокардиография (ЭхоКГ) обладают лучшими показателями чувствительности в определении микро-циркуляторной обструкции [6]. Таким образом, важной представляется оценка диагностических возможностей разработанной шкалы с использованием более чувствительного визуализирующего метода.
Цель работы: анализ возможностей шкалы оценки риска развития феномена «no-reflow» в прогнозировании нарушений миокардиальной перфузии по данным контрастной ЭхоКГ у пациентов с ОИМпST после выполнения ЧКВ.
Материал и методы
В исследование были включены 40 пациентов в остром периоде ИМ в возрасте от 39 до 82 лет, среди них 31 мужчина и 9 женщин. Критериями включения в исследование являлись: продолжительный приступ ангинозных болей, возникший менее 12 ч до госпитализации в стационар, элевация сегмента ST по данным ЭКГ ≥ 1 мм в 2 и более последовательных отведениях от конечностей и/или ≥ 2 мм в грудных отведениях, эндоваскулярное восстановление кровотока ≤ 12 ч от возникновения ангинозного приступа.
У всех пациентов оценивали степень коронарного кровотока в инфаркт-связанной коронарной артерии по шкале TIMI, степень миокардиального свечения по шкале MBG (Myocardial Blush Grade), исходную степень коронарного тромбоза по шкале TTG (TIMI Thrombus Grade Score).
При оценке степени коронарного кровотока использовали следующую классификацию [7]:
-
– TIMI 0 (отсутствие кровотока) – отсутствие антероградного поступления контрастного вещества дистальнее места окклюзии.
-
– TIMI 1 (минимальный кровоток) – контраст поступает дистальнее места окклюзии, но в небольших количествах и не может полностью заполнить дистальный сегмент коронарной артерии.
-
– TIMI 2 (неполное восстановление кровотока) – контраст поступает дистальнее места окклюзии и заполняет дистальный сегмент инфаркт-связанной артерии, но его заполнение и освобождение от контраста происходят медленнее, чем в проксимальном сегменте от места окклюзии.
-
– TIMI 3 (полное восстановление кровотока) – нормальный антероградный кровоток дистальнее места окклюзии.
При оценке миокардиального свечения применяли следующую градацию [8]:
-
– MBG 0 – миокардиальное свечение отсутствует.
-
– MBG 1 – минимальное миокардиальное свечение.
-
– MBG 2 – умеренное миокардиальное свечение, характеризующееся меньшей интенсивностью в сравнении с неинфаркт-связанными коронарными артериями.
-
– MBG 3 – нормальное миокардиальное свечение, по своей интенсивности сопоставимое с неинфаркт-связан-ными коронарными артериями.
При оценке степени коронарного тромбоза использовалась классификация [9]:
-
– ТТG 0 – нет ангиографических признаков тромбоза.
-
– ТТG 1 – вероятно наличие тромба, нарушение пристеночного контрастирования, неровность контуров сосуда.
-
– ТТG 2 – тромб размером не более ½ инфаркт-свя-занной артерии.
-
– ТТG 3 – продольный размер тромба > ½, но < 2 диаметров инфаркт-связанной артерии.
-
– ТТG 4 – продольный размер тромба >2 диаметров инфаркт-связанной артерии;
-
– ТТG 5 – массивный тромбоз инфаркт-связанной артерии.
Ангиографическим успехом вмешательства являлись: восстановление коронарного кровотока, определяемое, как TIMI 3, а также 3-я степень миокардиального свечения по шкале MBG, отсутствие окклюзии боковых ветвей и пристеночных тромбов. Ангиографическими критериями развития феномена «no-reflow» являлись: отсутствие должного уровня миокардиальной перфузии либо неполное восстановление проходимости коронарной артерии (степень коронарного кровотока по шкале TIMI менее 3 и/или степень миокардиального свечения по шкале MBG менее 3).
Во время проведения ЧКВ всем пациентам проводили расчет индивидуального риска развития феномена «no-reflow» с использованием разработанной ранее шкалы [4, 5]. При количестве баллов ≥ 35 риск развития феномена «no-reflow» расценивался как высокий. При анализе госпитальных результатов вмешательств оценивали летальность, частоту рецидива ИМ, тромбоза стента.
В течение 6 ч после ЧКВ всем пациентам выполняли стандартную двухмерную допплер- и тканевую допплер-ЭхоКГ с определением размеров камер сердца, расчетом показателя фракции выброса (ФВ) ЛЖ по Симпсону и оценкой степени снижения локальной сократимости ЛЖ.
Миокардиальную контрастную ЭхоКГ осуществляли на системе IE 33 (Philips, США) с обширным спектром режимов визуализации, в том числе со способностью оценки перфузии в реальном времени. Для контрастирования использовали препарат SonoVue (Вrассо (Италия)), который вводили внутривенно. Оценку миокардиальной перфузии после введения эхоконтрастного препарата в дозе 2 мл производили с применением низкого механического индекса (МИ) < 0,2; что позволяло контрастировать полости сердца. Далее использовали функцию flash (вспышка), представляющую собой кратковременные группы сигналов высокой мощности для мгновенного разрушения микропузырьков ультразвукового контраста, с целью визуализации проникновения и удаления контрастного вещества из миокардиальной стенки. Анализ результатов исследования осуществляли на рабочей станции QLAB (Philips, США) с программой Low IM, имеющей низкий МИ. Оценку интенсивности эхосигнала в участках миокарда проводили при помощи конечного систолического изображения ЛЖ с определением времени поступления и равномерности распределения эхоконтраста в интересующих зонах (миокардиальная перфузия). Перфузия считалась удовлетворительной при возникновении акустического сигнала в интересующей зоне менее чем через 5 с после деструкции микропузырьков функцией flash. Появление сигнала позднее 5 с и неравномерное наполнение более 2 сегментов ЛЖ эхоконтрастным веществом определялись как нарушение перфузии, указывающее на наличие феномена «no-reflow».
Все пациенты подписали информированное согласие на участие в исследовании. Протокол исследования был одобрен локальным этическим комитетом (выписка из протокола № 145 от 29.01.2019 г.).
Статистическую обработку материала проводили с использованием пакета статистических прикладных программ (SPSS Inc., версия 21.0, IBM, США). Количественные показатели представлены средним значением (М) и стандартным отклонением (SD): M ± SD либо медианой (Ме) и межквартильным промежутком [Q1; Q3]: Me [Q1; Q3]. Категориальные показатели описаны абсолютными (n) и относительными (%) частотами встречаемости. Проверку нормальности распределения количественных переменных проводили с использованием критерия Шапиро – Уилка. Для сравнения количественных показателей в независимых группах пациентов применяли критерий Манна – Уитни. Сравнение категориальных показателей в группах проводили с использованием критерия χ2 и точного критерия Фишера. В качестве порогового уровня значимости было выбрано значение р = 0,05. Для оценки классификационной способности ранее разработанной шкалы (балльной системы) [4] в определении феномена «no-reflow» по данным миокардиальной контрастной ЭхоКГ использовали ROC-анализ с расчетом площади под кривой (AUC), специфичности и чувствительности. При этом в качестве проверяемой переменной применяли индивидуально рассчитанные баллы риска развития феномена «no-reflow». В качестве переменной состояния (зависимой переменной) использовали наличие феномена «no-reflow» по данным миокардиальной контрастной ЭхоКГ.
Результаты исследования
Высокий риск развития феномена «no-reflow» определялся у 13 (32,5%) пациентов. Клиническая характеристика этой группы пациентов в сравнении с больными низкого риска развития феномена «no-reflow» представлена в таблице 1.
Таблица 1. Клиническая характеристика пациентов в зависимости от риска развития феномена «no-reflow»
Table 1. Clinical characteristics of patients depending on risk of developing no-reflow phenomenon
|
Показатели Variables |
Пациенты с высоким риском развития феномена «no-reflow», n = 13 High risk of no-reflow, n = 13 |
Пациенты с низким риском развития феномена «no-reflow», n = 27 Low risk of no-reflow, n = 27 |
p |
|
Возраст Age |
64,8 ± 8,7 |
59,8 ± 10,2 |
0,078 |
|
Мужской пол Male gender |
22 (81,5) |
9 (69,2) |
0,437 |
|
Индекс массы тела, кг/м² Body mass index, kg/m² |
28,4 ± 4,4 |
29,7 ± 5,5 |
0,549 |
|
СД в анамнезе History of DM |
2 (15,4) |
1 (3,7) |
0,242 |
|
ИБС в анамнезе History of IHD |
1 (7,7) |
4 (14,8) |
1,000 |
|
ИМ в анамнезе History of myocardial infarction |
– |
1 (3,7) |
1,000 |
|
АГ в анамнезе History of arterial hypertension |
10 (76,9) |
18 (66,7) |
0,716 |
|
ХБП в анамнезе History of CKD |
4 (30,8) |
1 (3,7) |
0,031 |
|
Реваскуляризация в анамнезе History of revascularization |
1 (7,7) |
1 (3,7) |
1,000 |
|
Кардиогенный шок при поступлении Cardiogenic shock at admission |
1 (7,7) |
1 (3,7) |
1,000 |
|
Догоспитальный тромболизис Prehospital thrombolysis |
1 (7,7) |
2 (7,4) |
1,000 |
|
Время от начала болевого синдрома до госпитализации, мин Time from the onset of pain to hospitalization, minutes |
160 [100; 203,5] |
155 [80; 255] |
0,955 |
|
Время от госпитализации до начала ЧКВ (дверь-баллон), мин Time from hospitalization to PCI (door-to-balloon), minutes |
35 [23,5; 106] |
43 [30; 66] |
0,932 |
|
Общее время ишемии миокарда, мин Total time of myocardial ischemia, minutes |
230 [149; 297,5] |
200 [122; 334] |
0,887 |
|
СКФ, мл/мин/1,73 м2 Glomerular filtration rate, mL/min/1.73 m2 |
77,8 ± 17,7 |
84,8 ± 24,7 |
0,549 |
|
Уровень глюкозы при поступлении, ммоль/л Admission glucose, mmol/L |
10,6 ± 4,2 |
7,9 ± 1,9 |
0,018 |
|
Содержание нейтрофилов, *109/л Neutrophils, *109/L |
8,1 ± 3,8 |
6,6 ± 1,7 |
0,360 |
Примечание: СД – сахарный диабет, ИБС – ишемическая болезнь сердца, ИМ – инфаркт миокарда, АГ – артериальная гипертензия, ХБП – хроническая болезнь почек, ЧКВ – чрескожное коронарное вмешательство.
Note: DM – diabetes mellitus, IHD ischemic heart disease, MI myocardial infarction, AH arterial hypertension, CKD – chronic kidney disease, PCI – percutaneous coronary intervention.
При анализе клинической характеристики было выявлено, что пациенты с высоким риском развития феномена «no-reflow» имели тенденцию к увеличению возраста. Также у них статистически значимо чаще определялась хроническая болезнь почек в анамнезе, был выше уровень гликемии при поступлении.
При анализе ангиографической характеристики (табл. 2) была установлена тенденция к увеличению количества баллов по шкале Syntax у пациентов с высоким риском развития феномена «no-reflow».
У пациентов с высоким риском развития феномена «no-reflow» чаще определялась полная тромботическая окклюзия инфаркт-связанной коронарной артерии (TTG5), чаще выполнялась баллонная предилатация перед проведением стентирования. При оценке госпитальных результатов случаев летальности развитие нефатального ИМ и тромбоза стента не определялось. При анализе ангиографических и ЭхоКГ показателей, характеризующих миокардиальную перфузию (табл. 3), была выявлена тенденция к снижению частоты достижения финального кровотока TIMI 3 у пациентов с высоким риском развития феномена «no-reflow». Кроме того, в этой группе статистически значимо чаще определялся феномен «no-reflow» как по данным ангиографической, так и ЭхоКГ – оценки.
Таблица 2. Ангиографическая характеристика пациентов в зависимости от риска развития феномена «no-reflow»
Table 2. Angiographic characteristics of patients depending on risk of developing no-reflow phenomenon
|
Показатели Variables |
Пациенты с высоким риском развития феномена «no-reflow», n =13 High risk of no-reflow, n = 13 |
Пациенты с низким риском развития феномена «no-reflow», n =27 Low risk of no-reflow, n = 27 |
p |
||
|
Тип поражения коронарных артерий The number of diseased vessels |
Однососудистое One-vessel |
8 (61,5) |
15 (55,6) |
1,000 |
|
|
Двухсосудистое Two-vessel |
3 (23,1) |
10 (37) |
0,484 |
||
|
Многососудистое Multivessel |
2 (15,4) |
2 (7,4) |
0,584 |
||
|
Количество баллов по шкале Syntax SYNTAX score |
14,3 ± 6,7 |
10,7 ± 5,5 |
0,094 |
||
|
Инфаркт-связанная коронарная артерия Infarction-associated coronary artery ПКА RCA ОВ/ВТК LCx/OM |
ПМЖВ LAD |
9 (69,2) |
13 (48,1) |
0,312 |
|
|
3 (23,1) |
9 (33,3) |
0,716 |
|||
|
1 (7,7) |
5 (18,5) |
0,643 |
|||
|
Степень коронарного тромбоза по шкале TTG TTG grade of coronary thrombosis 2 3 4 5 |
1 |
- |
4 (14,8) |
0,284 |
|
|
– |
1 (3,7) |
1,000 |
|||
|
– |
2 (7,4) |
1,000 |
|||
|
– |
3 (11,1) |
0,538 |
|||
|
13 (100) |
17 (63) |
0,016 |
|||
|
Баллонная предилатация Balloon predilation |
6 (46,2) |
4 (14,8) |
0,052 |
||
|
Количество имплантированных стентов Number of stents implanted |
1,0 |
1,2 ± 0,4 |
0,360 |
||
|
Стенты с антипролиферативным покрытием Number of antiproliferative coated stents implanted |
11 (84,6) |
25 (92,6) |
0,584 |
||
|
Использованием ингибиторов IIbIIIa рецепторов тромбоцитов Use of glycoprotein IIB/IIIA inhibitors |
1 (7,7) |
– |
0,325 |
||
Примечание: ПМЖВ – передняя межжелудочковая ветвь, ПКА – правая коронарная артерия, ОВ – огибающая ветвь, ВТК – ветвь тупого края.
Note: LAD – left anterior descending, RCA – right coronary artery, LCx – left circumflex artery, OM – obtuse marginal branch.
Таблица 3. Показатели реперфузии у пациентов в зависимости от риска развития феномена «no-reflow»
Table 3. Reperfusion characteristics in patients depending on the risk of developing no-reflow phenomenon
|
Показатели Variable |
Пациенты с высоким риском развития феномена «no-reflow», n = 13 High risk of no-reflow, n = 13 |
Пациенты с низким риском развития феномена «no-reflow», n = 27 Low risk of no-reflow, n = 27 |
p |
|
Финальный кровоток TIMI 3 Final blood flow TIMI 3 |
10 (76,9) |
26 (96,3) |
0,092 |
|
Миокардиальное свечение MBG 3 Myocardial blush grade 3 |
7 (53,8) |
20 (74,1) |
0,284 |
|
Ангиографический феномен «no-reflow» Angiographic no-reflow |
6 (46,2) |
3 (11,1) |
0,038 |
|
Феномен «no-reflow» по данным миокардиальной контрастной ЭхоКГ Myocardial contrast echocardiography no-reflow |
8 (61,5) |
5 (18,5) |
0,011 |
По результатам ROC-анализа (рис. 1) при оценке прогностической точности ранее разработанной шкалы в определении пациентов с феноменом «no-reflow» по данным миокардиальной контрастной ЭхоКГ, чувствительность составила 62%, специфичность – 85%, площадь под кривой (AUC) – 0,789 ( p = 0,003), что, согласно экспертной шкале для значений AUC, соответствует хорошему качеству модели [10].
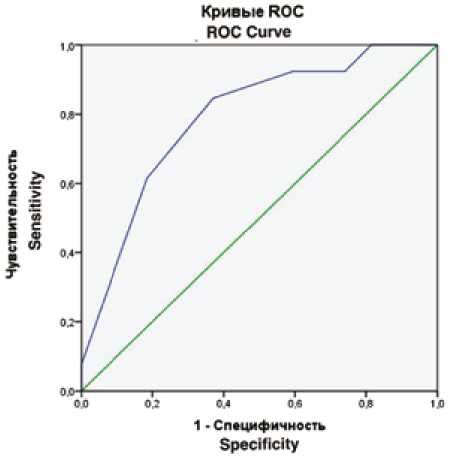
Рис. 1. Результаты ROC-анализа
Fig. 1. ROC analysis results
Обсуждение
Полученные в нашем исследовании результаты продемонстрировали, что использование шкалы (балльной системы) оценки риска развития феномена «no-reflow» позволяет с хорошей прогностической точностью определять нарушение процессов миокардиальной перфузии по данным контрастной ЭхоКГ. Нужно отметить, что в сравнении с ангиографической оценкой использование миокардиальной контрастной ЭхоКГ в качестве диагностического метода определения феномена «no-reflow» характеризовалось снижением показателя чувствительности шкалы с 70 до 62% [4]. Это является закономерным, так как миокардиальная контрастная ЭхоКГ является более чувствительной методикой в определении микроваскулярной обструкции. Так, в сравнении с ангиографической оценкой при проведении миокардиальной контрастной ЭхоКГ микроваскулярная обструкция чаще определялась в группах пациентов как с высоким, так и с низким риском развития феномена «no-reflow».
Преимущества использования миокардиальной контрастной ЭхоКГ в определении феномена «no-reflow» были описаны в ряде исследований. В основном они связаны с тем, что восстановление кровотока TIMI 3 в инфаркт-связанной артерии, а также резолюция сегмента ST по данным электрокардиограммы не являются абсолютными маркерами восстановления миокардиальной перфузии [11, 12]. Кроме того, проведение миокардиальной контрастной ЭхоКГ позволяет оценить наличие микро-васкуляторной обструкции в динамике [13]. Это является важным, поскольку в ряде случаев микроваскулярная обструкция носит обратимый характер и может разрешаться через несколько часов после проведения ЧКВ [14].
Развитие состояния микроваскулярной обструкции у пациентов с ОИМпST характеризуется неблагоприятным прогнозом. Было показано, что развитие микроваскуляр-ной обструкции, по данным МРТ, являлось независимым предиктором годичной летальности и прогрессирования сердечной недостаточности [15]. У пациентов с нарушениями миокардиальной перфузии, по данным контрастной эхокардиографии, через 5 лет наблюдения определялось снижение сократительной функции миокарда ЛЖ и увеличение частоты летальности. Важно подчеркнуть, что у всех этих больных после проведения ЧКВ определялся коронарный кровоток TIMI3 [16].
Прогнозирование риска развития микроваскулярной обструкции у пациентов с ОИМпST является важной клинической задачей. Было установлено, что развитие феномена «no-reflow» сложно поддается коррекции. Основные усилия должны быть направлены на предупреждение развития этого осложнения [17]. На сегодняшний день наиболее эффективным методом профилактики и лечения феномена «no-reflow» можно считать использование блокаторов гликопротеиновых IIbIIIa рецепторов тромбоцитов. Однако их рутинное применение не имеет доказанной эффективности и сопровождается увеличением частоты геморрагических осложнений [1]. Таким образом, выявление пациентов высокого риска и превентивное использование у них препаратов этой группы потенциально позволило бы снизить риски развития микроваскулярной обструкции. Однако эффективность и безопасность такого подхода требует подтверждения в клинических исследованиях.
Выводы
Использование шкалы (балльной оценки) персонифицированного риска развития феномена «no-reflow», разработанной на основе ангиографических критериев, позволяет с хорошей прогностической точностью выявлять пациентов с высоким риском развития нарушений миокардиальной перфузии по данным контрастной ЭхоКГ.
Список литературы Шкала оценки риска развития феномена "no-reflow" в прогнозировании нарушений миокардиальной перфузии по данным контрастной эхокардиографии у пациентов с острым инфарктом миокарда с подъемом сегмента ST после эндоваскулярной реваскуляризации
- Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2019;40(2):87-165. https://doi.org/10.1093/eurheartj/ehy394.
- Szummer K., Wallentin L., Lindhagen L., Alfredsson J., Erlinge D., Held C. et al. Improved outcomes in patients with ST-elevation myocardial infarction during the last 20 years are related to implementation of evidence-based treatments: Experiences from the SWEDEHEART registry 1995-2014. Eur. Heart J. 2017;38(41):3056-3065. https://doi.org/10.1093/eurheartj/ehx515.
- Kloner R.A., King K.S., Harrington M. No-reflow phenomenon in heart and brain. Am. J. Physiol. Heart Circ. Physiol. 2018;315(3):550-562. https://doi.org/10.1152/ajpheart.00183.2018.
- Бессонов И.С., Кузнецов В.А., Горбатенко Е.А., Сапожников С.С., Дьякова А.О., Зырянов И.П. и др. Шкала оценки риска феномена no-reflow при чрескожных коронарных вмешательствах у пациентов с острым инфарктом миокарда с подъемом сегмента ST. Патология кровообращения и кардиохирургия. 2020;24(3):68. https://doi.org/10.21688/1681-3472-2020-3S-68-76.
- Бессонов И.С., Дьячков С.М. Калькулятор расчета риска возникновения феномена «no-reflow». Свидетельство о регистрации программы для ЭВМ 2020661255, 21.09.2020.
- Senior R., Becher H., Monaghan M., Agati L., Zamorano J., Vanoverschelde J.L. et al. Clinical practice of contrast echocardiography: recommendation by the European Association of Cardiovascular Imaging (EACVI) 2017. Eur. Heart J. Cardiovasc. Imaging. 2017;18(11):1205-1205af. https://doi.org/10.1093/ehjci/jex182.
- Antman E.M., Cohen M., Bernink P.J., McCabe C.H., Horacek T., Papuchis G. et al. The TIMI risk score for unstable angina/non-ST elevation MI: A method for prognostication and therapeutic decision making. JAMA. 2000;284(7):835-842. https://doi.org/10.1001/jama.284.7.835.
- Van ‘t Hof A.W., Liem A., Suryapranata H., Hoorntje J.C., de Boer M.J., Zijlstra F. Angiographic assessment of myocardial reperfusion in patients treated with primary angioplasty for acute myocardial infarction: myocardial blush grade. Zwolle Myocardial Infarction Study Group. Circulation. 1998;97(23):2302-2306. https://doi.org/10.1161/01.cir.97.23.2302.
- Gibson C.M., de Lemos J.A., Murphy S.A., Marble S.J., McCabe C.H., Cannon C.P. et al. Combination therapy with abciximab reduces angiographically evident thrombus in acute myocardial infarction: A TIMI 14 substudy. Circulation. 2001;103(21):2550-2554. https://doi.org/10.1161/01.cir.103.21.2550.
- Kamarudin A.N., Cox T., Kolamunnage-Dona R. Time-dependent ROC curve analysis in medical research: Current methods and applications. BMC Med. Res. Methodol. 2017;17(1):53. https://doi.org/10.1186/s12874-017-0332-6.
- Durante A., Laricchia A., Benedetti G., Esposito A., Margonato A., Rimoldi O. et al. Identification of high-risk patients after st-segment-elevation myocardial infarction: comparison between angiographic and magnetic resonance parameters. Circ. Cardiovasc. Imaging. 2017;10(6):e005841. https://doi.org/10.1161/CIRCIMAGING.116.005841.
- Криночкин Д.В., Бессонов И.С., Кузнецов В.А., Ярославская Е.И., Такканд А.Г. Контрастная эхокардиография с оценкой миокардиальной перфузии в диагностике феномена «no-reflow» у пациента с острым инфарктом миокарда. Атеросклероз. 2019;15(2):52-58. https://doi.org/10.15372/ATER20190208.
- Lindner J.R. Microvascular impairment after myocardial infarction: It is not just about obstruction. Circ. Cardiovasc. Imaging. 2020;13(6):e011083. https://doi.org/10.1161/CIRCIMAGING.120.011083.
- Kloner R.A. The importance of no-reflow/microvascular obstruction in the STEMI patient. Eur. Heart J. 2017;38(47):3511-3513. https://doi.org/10.1093/eurheartj/ehx288.
- De Waha S., Patel M.R., Granger C.B., Ohman E.M., Maehara A., Eitel I. et al. Relationship between microvascular obstruction and adverse events following primary percutaneous coronary intervention for ST-segment elevation myocardial infarction: an individual patient data pooled analysis from seven randomized trials. Eur. Heart J. 2017;38(47):3502-3510. https://doi.org/10.1093/eurheartj/ehx414.
- Xie F., Qian L., Goldsweig A., Xu D., Porter T.R. Event-free survival following successful percutaneous intervention in acute myocardial infarction depends on microvascular perfusion. Circulation: Cardiovascular Imaging. 2020;13(6):e010091. https://doi.org/10.1161/CIRCIMAGING.119.010091.
- Niccoli G., Kharbanda R.K., Crea F., Banning A.P. No-reflow: Again prevention is better than treatment. Eur. Heart J. 2010;31(20):2449-2455. https://doi.org/10.1093/eurheartj/ehq299.


