Симультанные оперативные вмешательства при доброкачественной гиперплазии предстательной железы крупных и гигантских размеров
Автор: Панферов А.С., Елагин В.В., Гаджиев Н.К.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 2 т.18, 2025 года.
Бесплатный доступ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) – это полиэтиологическое, возраст-ассоциированное хроническое заболевание, характеризуещееся увеличением объема предстательной железы (ПЖ) за счет роста периуретральной железистой ткани, приводящее к механической обструкции нижних мочевых путей и ухудшению качества мочеиспускания. Совокупность клинических проявлений, связанных со снижением качества мочеиспускания при ДГПЖ объединены термином «симптомы нижних мочевых путей» (СНМП), механизмы развития которых многочисленны и могут быть не связаны с мочевыделительной системой [1]. По данным обобщенных эпидемиологических исследований, встречаемость ДГПЖ в мире достигает 26,2%. Точная информация по распространенности заболевания в России на данный момент неизвестна. О.И. Аполихин и соавт. в 2016 г. провели популяционное исследование, согласно которому из 4876 мужчин в возрасте 40-69 лет СНМП умеренной и тяжелой степени выявлены в 11% случаев, при этом в общей популяции с возрастом частота их прогрессивно увеличивалась [2]. Схожие результаты демонстрирует мета-анализ 2017 г.: в возрастных группах от 40 до 49 лет встречаемость симптоматики составляет 14,8%, а через 10 лет увеличивается практически в 3 раза [3, 4]. С течением времени у ряда пациентов наблюдается прогрессирование симптомов, неэффективность фармакотерапии и необходимость в хирургическом лечении, в том числе в связи с развитием осложнений заболевания, поражающих мочевой пузырь и верхние мочевые пути. Вид оперативного лечения зависит от объема ПЖ, определяемого методами визуализации (ультразвуковое исследование – УЗИ, магнитро-резонансная томография – МРТ), оснащения клиники, навыков хирурга и соматического статуса пациента. При ДГПЖ крупных размеров (более 80 см3) и с наличием показаний к хирургическому лечению возможно выполнение трансуретральной энуклеации ПЖ или эндовидеохирургической аденомэктомии лапароили экстраперитонеоскопическим доступом, в том числе с использованием роботических хирургических систем [5]. Согласно данным представленным Всемирной организацией здравоохранения в 1995 г., при обследовании пациентов перед хирургическим вмешательством в 25-30% случаев выявляются дополнительные заболевания, требующие хирургического лечения, однако, симультанные операции выполняются примерно лишь у 3% пациентов [6]. Возможными ограничениями в выполнении симультанных операций в настоящее время являются: недостаточное обследование пациентов при подготовке к оперативному лечению, преувеличение операционно-анестезиологического риска, неполная обзорная лапароскопия, экономическая нагрузка на клинику при выполнении двух и более операций в течение одной госпитализации в системе государственного здравоохранения, повышенная юридическая ответственность операционной бригады и клиники в случае неблагоприятного исхода. Несомненными же преимуществами комбинированных операций считают возможность излечения от нескольких заболеваний при одном анестезиологическом пособии, ускоренной реабилитации, общего снижения затрат на лечение в клинике и повышение комплаентности пациента к лечению. Грыжа – это выход под кожу и мягкие ткани покрытых брюшиной внутренних органов через естественные или искусственные отверстия в брюшной стенке, тазовом дне или диафрагме. Местом формирования паховой грыжи (ПГ) является паховый канал, при этом выделяют косую и прямую ПГ. Косая ПГ выходит из латеральной паховой ямки, расположена внутри оболочек семенного канатика, может проходить через весь паховый канал и спускаться в мошонку, тогда как прямая ПГ выходит из медиальной паховой ямки, окружена только поперечной фасцией и располагается вне семенного канатика и медиально от него [7]. Исторически непосредственными причинами развития грыжи считали «несоответствие внутрибрюшного давления сопротивлению мышц передней брюшной стенки», а также снижение «прочности брюшной стенки» ввиду старения. В настоящее время выделяют следующие факторы риска ПГ: мужской пол, возраст, наследственность, хроническая обструктивная болезнь легких, запоры, позадилонная простатэктомия, низкий индекс массы тела, открытый влагалищный отросток. Точкой приложения при этом выступает коллагеновая матрица, слабость которой предположительно обусловлено аномалиями матриксной металлопротеиназы [8]. Показанием к оперативному лечению ПГ является наличие выпячивания в паховой области и боль в области выпячивания [9]. Несмотря на обилие публикаций общих этиологических факторов ДГПЖ и ПГ до настоящего времени выявлено не было, однако указывают на бО́льшую распространенность ПГ у мужчин с СНМП, обусловленных ДГПЖ. Так, в крупном когортном исследовании с участием 44620 человек за десятилетний период наблюдения ПГ развилась у 1867 пациентов, при этом у 1303 человек имелись СНМП, а у 735 таковых не отмечалось, кроме того, вероятность развития ПГ с возрастом повышалась [10].
Доброкачественная гиперплазия предстательной железы, лапароскопическая трансвезикальная аденомэктомия, паховая грыжа, лапароскопическая трансабдоминальная преперитонеальная герниопластика, симультанные операции
Короткий адрес: https://sciup.org/142245362
IDR: 142245362 | DOI: 10.29188/2222-8543-2025-18-2-68-77
Текст научной статьи Симультанные оперативные вмешательства при доброкачественной гиперплазии предстательной железы крупных и гигантских размеров
экспериментальная и клиническая урология № 2 2025
Доброкачественная гиперплазия предстательной железы (ДГПЖ) – это полиэтиологическое, возраст-ас-социированное хроническое заболевание, характеризу-ещееся увеличением объема предстательной железы (ПЖ) за счет роста периуретральной железистой ткани приводящее к механической обструкции нижних мочевых путей и ухудшению качества мочеиспускания. Совокупность клинических проявлений, связанных со снижением качества мочеиспускания при ДГПЖ объединены термином «симптомы нижних мочевых путей» (СНМП), механизмы развития которых многочисленны и могут быть не связаны с мочевыделительной системой [1]. По данным обобщенных эпидемиологических исследований, встречаемость ДГПЖ в мире достигает 26,2%. Точная информация по распространенности заболевания в России на данный момент неизвестна. О.И Аполихин и соавт. в 2016 г. провели популяционное исследование, согласно которому из 4876 мужчин в возрасте 40-69 лет СНМП умеренной и тяжелой степени выявлены в 11% случаев, при этом в общей популяции с возрастом частота их прогрессивно увеличивалась [2] Схожие результаты демонстрирует мета-анализ 2017 г.: в возрастных группах от 40 до 49 лет встречаемость симптоматики составляет 14,8%, а через 10 лет увеличивается практически в 3 раза [3, 4]. С течением времени у ряда пациентов наблюдается прогрессирование симптомов, неэффективность фармакотерапии и необходимость в хирургическом лечении, в том числе в связи с развитием осложнений заболевания, поражающих мочевой пузырь и верхние мочевые пути. Вид оперативного лечения зависит от объема ПЖ, определяемого методами визуализации (ультразвуковое исследование – УЗИ, магнитро-резонансная томография – МРТ), оснащения клиники, навыков хирурга и соматического статуса пациента. При ДГПЖ крупных размеров (более 80 см3) и с наличием показаний к хирургическому лечению возможно выполнение трансуретральной энуклеации ПЖ или эндовидеохирургической аденомэктомии лапаро- или экстраперитонеоскопическим доступом, в том числе с использованием роботических хирургических систем [5].
Согласно данным представленным Всемирной организацией здравоохранения в 1995 г., при обследова- нии пациентов перед хирургическим вмешательством в 25-30% случаев выявляются дополнительные заболевания, требующие хирургического лечения, однако симультанные операции выполняются примерно лишь у 3% пациентов [6]. Возможными ограничениями в выполнении симультанных операций в настоящее время являются: недостаточное обследование пациентов при подготовке к оперативному лечению,преувеличение операционно-анестезиологического риска, неполная обзорная лапароскопия, экономическая нагрузка на клинику при выполнении двух и более операций в течение одной госпитализации в системе государственного здравоохранения, повышенная юридическая ответственность операционной бригады и клиники в случае неблагоприятного исхода.Несомненными же преимуществами комбинированных операций считают возможность излечения от нескольких заболеваний при одном анестезиологическом пособии ускоренной реабилитации, общего снижения затрат на лечение в клинике и повышение комплаентности пациента к лечению.
Грыжа – это выход под кожу и мягкие ткани покрытых брюшиной внутренних органов через естественные или искусственные отверстия в брюшной стенке, тазовом дне или диафрагме. Местом формирования паховой грыжи (ПГ)является паховый канал при этом выделяют косую и прямую ПГ. Косая ПГ выходит из латеральной паховой ямки, расположена внутри оболочек семенного канатика,может проходить через весь паховый канал и спускаться в мошонку тогда как прямая ПГ выходит из медиальной паховой ямки, окружена только поперечной фасцией и располагается вне семенного канатика и медиально от него [7]. Исторически непосредственными причинами развития грыжи считали «несоответствие внутрибрюш-ного давления сопротивлению мышц передней брюшной стенки», а также снижение «прочности брюшной стенки» ввиду старения.В настоящее время выделяют следующие факторы риска ПГ: мужской пол возраст, наследственность, хроническая обструктивная болезнь легких, запоры, позадилонная простатэктомия, низкий индекс массы тела, открытый влагалищный отросток. Точкой приложения при этом выступает коллагеновая матрица, слабость которой предположительно обусловлено аномалиями матриксной металлопротеиназы [8]. Показанием к оперативному лечению ПГ является наличие выпячивания в паховой области и боль в области выпячивания [9].
Несмотря на обилие публикаций общих этиологических факторов ДГПЖ и ПГ до настоящего времени выявлено не было, однако указывают на бО ́ льшую распространенность ПГ у мужчин с СНМП, обусловленных ДГПЖ. Так, в крупном когортном исследовании с участием 44620 человек за десятилетний период наблюдения ПГ развилась у 1867 пациентов, при этом у 1303 человек имелись СНМП, а у 735 таковых не отмечалось, кроме того, вероятность развития ПГ с возрастом повышалась [10]. В данном исследовании авторы отмечают, что аналогичная тенденция прослеживалась еще в 2011 г., когда R. Reis и соавт. показали положительную корреляционную связь между присутствием СНМП умеренной и тяжелой степени и наличием у пациентов ПГ.Возможными причинами такой связи может являться как необходимость нату-живания для улучшения качества мочеиспускания и, следовательно, повторное повышение висцерального давления и воздействие на брюшную стенку, так и общность факторов риска ПГ и ДГПЖ,проявляю-щихся при старении организма [11].
Актуальность настоящего исследования состоит в отсутствии клинических рекомендаций и стандартов симультанного хирургического лечения пациентов с крупной и гигантской ДГПЖ и симптоматической ПГ при том, что сочетание данных патологий учащается с возрастом,а анестезиологический риск возрастает ввиду наличия у данной категории больных сопутствующих заболеваний. В ходе трансабдоминальной паховой герниопластики выполняется эндопротезирование передней брюшной стенки и в случае одномоментной аденомэктомии существует теоретический риск инфицирования сетчатого протеза в результате попадания мочи в зону операции, однако многие авторы, анализируя такого рода осложнения после симультанного хирургического лечения рака ПЖ и ПГ, указывают на их отсутствие [12-15].
Таким образом, перспективным направлением является внедрение симультанных оперативных вмешательств при ДГПЖ и ПГ в хирургическую практику Цель исследования : определить эффективность и безопасность симультанной лапароскопической трансвезикальной аденомэктомии и паховой герниопластики при крупной и гигантской ДГПЖ и симптоматической ПГ.
МАТЕРИАЛЫ И МЕТОДЫ
В Центре урологии медицинского центра «Медас-сист» в период с января 2020 года по декабрь 2024 года проанализированы 126 пациентов с наличием ДГПЖ и ПГ с показаниями к хирургическому лечению. Исследование носило ретроспективный характер и одоб- рено региональным этическим комитетом (протокол заседания №10 от 23.12.2024).
Критерии включения:
-
• высокий балл шкалы IPSS (International Prostate Symptom Score – Mеждународная система суммарной оценки симптомов болезней предстательной железы в баллах) (20-35 баллов);
-
• рецидивирующая задержка мочеиспускания;
-
• гидронефроз, обусловленный ДГПЖ;
-
• камни мочевого пузыря;
-
• рецидивирующая макрогематурия;
-
• объем ПЖ более 80 см3;
-
• отсутствие эффекта от консервативной терапии;
-
• наличие симптоматической ПГ.
Критерии невключения:
-
• нейрогенная дисфункция мочевого пузыря;
-
• стриктура уретры;
-
• рак ПЖ;
-
• опухоли мочевого пузыря;
-
• предыдущие оперативные вмешательства на мочевом пузыре, ПЖ и уретре;
-
• степень анестезиологического риска ASA (шкала Американского Общества Анестезиологов) IV и выше.
В соответствии с критериями в исследование включено 77 пациентов, которым в период с ноября 2020 года по декабрь 2023 года выполнена лапароскопическая трансвезикальная аденомэктомия (ЛТВАЭ) с симультанной трансабдоминальной преперитоне-альной герниопластикой (TAПП) по показаниям. Пациенты были распределены на 2 группы в зависимости от вида хирургического лечения:группу А составили 52 пациента, которым выполнена ЛТВАЭ (67,9%), группу Б – 25 пациентов с симультанным оперативным вмешательством в объеме ТАПП (32,1%). В раннем послеоперационном периоде всем пациентам предлагали оценить выраженность болевого синдрома на 1,3 и 5 сутки с помощью визуальной аналоговой шкалы боли (ВАШ). Контрольное обследование проводилось через 1, 3, 6 и 12 месяцев после операции Оценивали суммарный балл шкалы IPSS, шкалы Quality of life (Оценка качества жизн – QoL), значения простатического антигена (ПСА), показатели урофло-уметрии, объем ПЖ при трансректальном ультразвуковом исследовании (ТРУЗИ). В течение 1 месяца после операции всем пациентам назначались альфа-адреноблокаторы и м-холиноблокаторы (алфузозин 10 мг 1 раз в сутки, солифенацин 5 мг 1 раз в сутки). Дизайн исследования представлен на рисунке 1.
Первичные конечные точки исследования – анализ частоты ранних послеоперационных осложнений по шкале Clavien-Dindo. Вторичные конечные точки – оценка послеоперационных параметров (выраженность болевого синдрома, данные шкалы IPSS, QoL показатели урофлоуметрии, данные УЗИ).
экспериментальная и клиническая урология № 2 2025
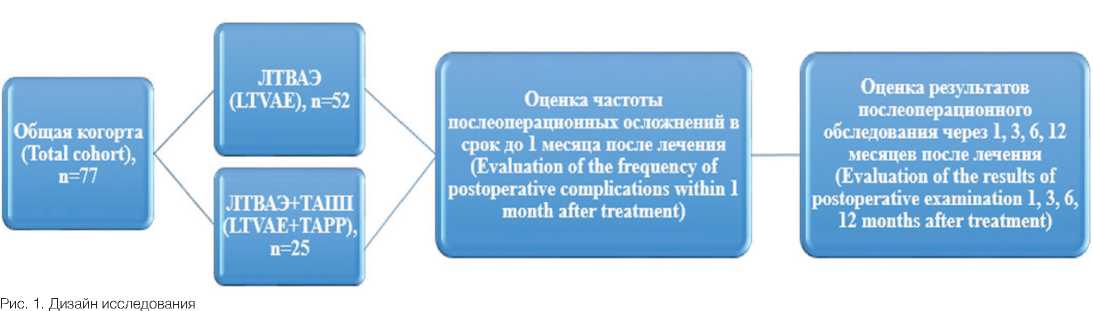
Fig. 1. Study design
Описание оперативного вмешательства
Положение пациента на операционном столе лежа на спине.После стандартной обработки операционного поля под низкопоточной ингаляционной анестезией в мочевой пузырь вводили уретральный катетер Фолея №20 по Шарьеру. На 1 см выше пупка устанавливали оптический троакар 12 мм. Накладывали кар-боксиперитонеум с давлением 12 мм рт. ст. Далее пациента переводили в положение Транделенбурга. В левой подвздошной области устанавливали два рабочих троакара 15 и 5 мм. В правой подвздошной области – два троакара 5 и 5 мм. Выполняли обзорную лапаро-скопию,при наличии спаечного процесса в брюшной полости выполняли адгезиолизис.Визуально определяли наличие ПГ. В мочевой пузырь вводили 300 мл физиологического раствора хлорида натрия. Далее выполняли цистотомию по задней стенке, визуально определяли устья мочеточников (рис. 2, 3).
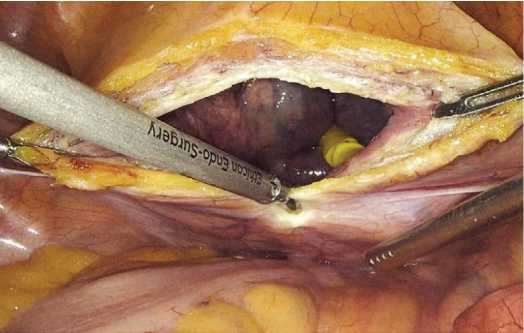
Рис. 2. Цистотомия по задней стенке
Fig. 2. Posterior bladder wall cystotomy
Следующий этап – рассечение слизистой оболочки в области шейки мочевого пузыря с помощью ультразвукового диссектора, при наличии средней доли ПЖ – по ее нижнему контуру. После визуализации аденоматозной ткани и определения слоя между ней и хирургической капсулой ПЖ выполняли циркулярную инструментальную энуклеацию узлов аденомы. В ходе энуклеации возможно выделение аденоматозной ткани как единым блоком, так и по долям. После энуклеации
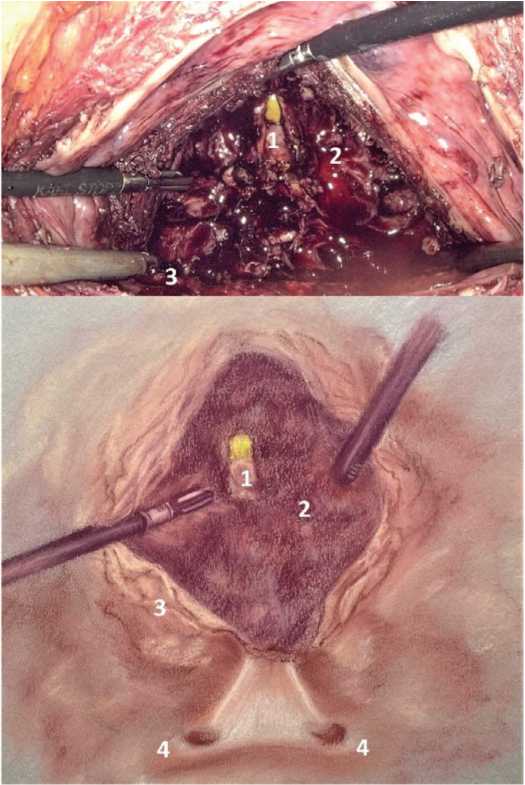
Рис. 3. Цистотомия. 1 – уретра, 2 – хирургическая капсула ПЖ, 3 – стенка мочевого пузыря, 4 – устья мочеточников
Fig. 3. Cystotomy. 1 – urethra, 2 – surgical capsule, 3 – bladder wall, 4 – ureteral or fices производили контрольную инспекцию ложа аденомы на предмет наличия резидуальной ткани (рис. 4). Гемостаз осуществляли биполярной коагуляцией сосудов Аденоматозную ткань помещали в эндоскопический мешок и удаляли из брюшной полости через одну из троакарных ран. Также для фрагментации узлов можно использовать морцеллятор или рассечь их ножницами и удалить через тубус троакара.
Далее производили везикализацию ложа аденомы с помощью анастомоза шейки мочевого пузыря и уретры непрерывным швом с использованием синтетической рассасывающейся моноволоконной нити из полидиоксанона 4/0, игла ½ (рис. 4). Шов начинается на 6 часах условного циферблата на нижней полуокружности уретры с направлением иглы изнутри кнаружи с последующим захватом хирургической капсулы предстательной железы и дальнейшим проведением иглы через стенку мочевого пузыря с завязыванием узла. Затем продолжается непрерывный шов против часовой стрелки с аналогичным поочередным захватом вышеуказанных анатомических образований до 7 часов условного циферблата. Оставшийся раневой дефект между 6 и 7 часами условного циферблата ушивают наглухо. Таким образом, производится реконструкция шейки мочевого пузыря и полное укрывание ложа удаленных аденоматозных узлов.
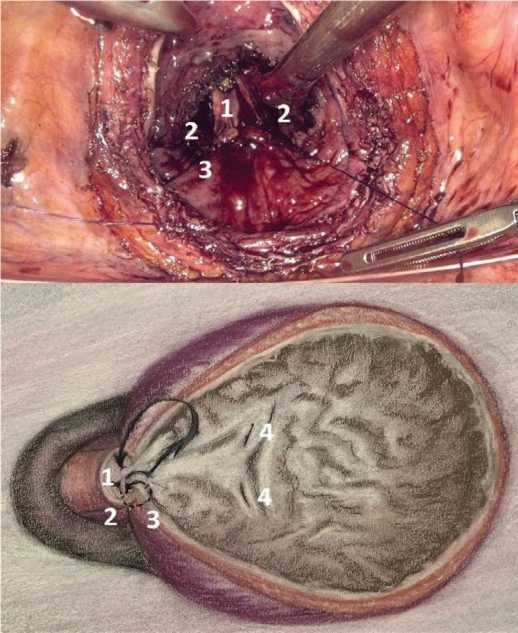
Рис. 4. Везикализация ложа аденомы. 1 – уретра, 2 – хирургическая капсула
ПЖ, 3 – стенка мочевого пузыря, 4 – устья мочеточников
Fig. 4. Vesicalisation 1 – urethra, 2 – surgical capsule, 3 – bladder wall, 4 – ureteral orifices
В мочевой пузырь трансуретрально проводили трехканальный уретральный катетер Фолея №20 по Шарьеру с наполнением баллона не более 40 мл Стенку мочевого пузыря ушивали двурядным непрерывным швом (синтетическая рассасывающаяся мо-новолоконная нить из полидиоксанона 2/0, игла 5/8 26 мм) с последующим контролем его герметичности путем наполнения мочевого пузыря 150 мл физиологического раствора хлорида натрия (рис. 5).
При наличии ПГ выполняли рассечение париетальной брюшины кпереди от внутреннего пахового кольца,выделяли семенной канатик и отводили его латерально. Далее иссекали грыжевой мешок. Сетча-
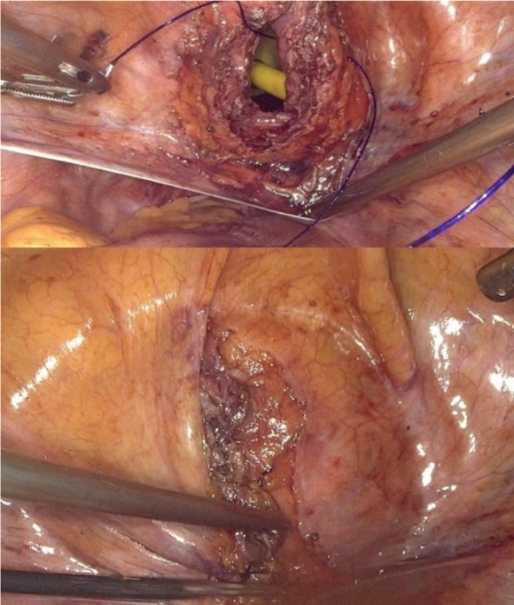
Рис. 5. Ушивание стенки мочевого пузыря. Контроль герметичности Fig. 5. Bladder wal suturing. Tightness control тый протез укладывали над внутренним паховым кольцом, фиксировали его к передней брюшной стенке при помощи герниостеплера, укрывали париетальной брюшиной (рис. 6-8). Устанавливали дренаж
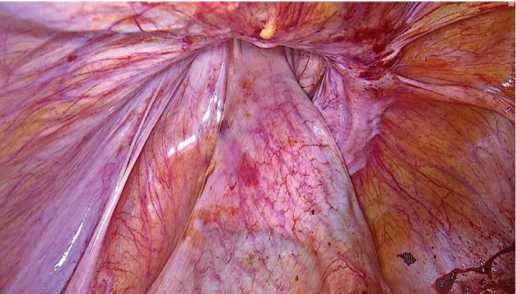
Рис. 6. Левосторонняя паховая грыжа
Fig. 6. Left-sided inguinal hernia
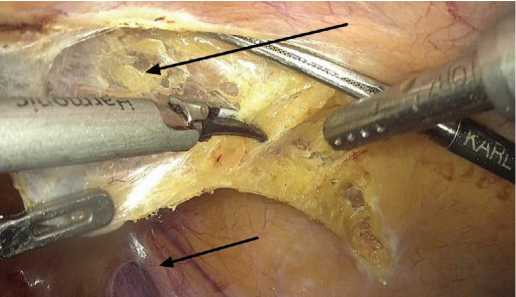
Рис.7. Рассечение париетальной брюшины над внутренним паховым кольцом (отмечены стрелками)
Fig. 7. Dissection of the parietal peritoneum above the internal inguinal ring (marked with arrows)
экспериментальная и клиническая урология № 2 2025 в пространство малого таза. Троакары поочередно уда- ляли с контролем гемостаза
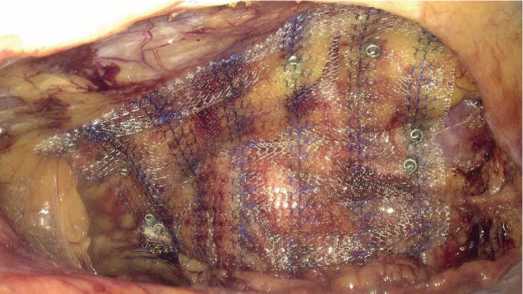
Рис.8. Фиксация сетчатого протеза к передней брюшной стенке
Fig. 8. Fixation of the mesh prosthesis to the anterior abdominal wall
Статистические методы
Статистическая обработка данных производилась с использованием прикладного программного обеспечения Excel 2 019 («Microsoft», США), JM P Pro 17 («SAS», США). Для проверки распределения количественных показателей на нормальность применялся критерий Колмогорова-Смирнова с коррекцией Лил-лиефорса. Показатели с нормальным распределением выражались как среднее ± стандартное отклонение Показатели с распределением, отличным от нор-мального,описывались в виде медианы и квартилей
«Me [Q25%; Q75%]». Качественные признаки представлены в виде долей и частот выявления признака (%) Сопоставления двух несвязанных групп по количественным показателям с нормальным распределением осуществлялись при помощи t-критерия Стьюдента, при ненормальном распределении – с помощью непараметрического критерия Манна-Уитни. Анализ динамики показателей в трех и более измерений выполнялся с помощью непараметрического критерия Фридмана. Статистическая значимость различий групп для бинарных и номинальных шкал оценивалась с помощью критерия χ2-Пирсона. Уровень значимости при проверке статистических гипотез был зафиксирован на уровне p <0,05. Для коррекции величины ошибки первого рода при проведении множественных попарных сравнений применялась поправка Бонферрони.
РЕЗУЛЬТАТЫ
Базовые характеристики пациентов представлены в таблице 1. Как видно, показатели обеих групп не отличались между собой,однако в группе пациентов с наличием ПГ частота ранее выполненных троакарных цистостомий, как критерия осложненного течения ДГПЖ, составила 36%. Несмотря на недостигнутую статистическую значимость различий ( p =0,415), отмечается отчетливый тренд к увеличению частоты
Таблица 1. Предоперационные показатели у пациентов
Table 1. Patients indicators before surgery
|
Показатели Indicatots |
Группа А, Me [LQ; UQ] (n=52) Group A |
Группа Б, Me [LQ; UQ] (n=25) Group B |
p |
|
Возраст, лет Age, years |
67,00 [63,75; 72,00] |
71,00 [66,00; 76,00] |
0,066 |
|
Объем ПЖ, см3 Prostate volume, cm3 |
134,00 [119,00; 176,50] |
138,00 [116,00; 168,00] |
0,795 |
|
Qmax до операции, мл/сек Qmax, ml/sec |
9,70 [6,90; 11,10] |
7,45 [6,20; 9,10] |
0,281 |
|
Объем микции до операции, мл Excreted urine volume, ml |
154,00 [110,00; 175,00] |
147,00 [88,00; 165,00] |
0,697 |
|
Объем остаточной мочи, мл Residual urine volume, ml |
54,00 [30,00; 110,00] |
40,00 [25,00; 111,50] |
0,304 |
|
IPSS до операции, балл IPSS,points |
23,00 [19,00; 25,75] |
21,50 [18,75; 25,25] |
0,250 |
|
Quality of life, балл Quality of life, points |
4,00 [4,00; 5,00] |
5,00 [4,00; 5,00] |
0,128 |
|
Гемоглобин исходный, г/л Hemoglobin initial, g/l |
147,50 [136,75; 156,25] |
142,00 [138,00; 147,00] |
0,086 |
|
Цистостома, n (%) Cystostomy, n (%) |
14 (26,9) |
9 (36) |
0,415 |
|
Биопсия ПЖ, n (%) Prostate biopsy, n (%) |
23 (44,2) |
7 (28) |
0,171 |
|
ASA I, n (%) |
2 (4) |
– |
– |
|
ASA II, n (%) |
35 (67) |
17 (68) |
– |
|
ASA III, n (%) |
15 (29) |
8 (32) |
– |
данного показателя в группе больных с ПГ, что требует проведения дальнейших исследований с включением большей когорты пациентов.
Биопсия предстательной железы выполнена 30 пациентам (38%). Срок от выполнения биопсии до оперативного лечения не превышал 3 недель, что, по нашим данным,не повлияло на течение послеоперационного периода и результаты лечения.
Интра- и ранние послеоперационные показатели пациентов отражены в таблице 2.
При сравнении интраоперационных показателей медиана продолжительности оперативного вмешательства в группе ЛТВАЭ составила 117,50 [100,00; 140,00] минут, в группе ЛТВАЭ+ТАПП – 170,00 [135,00; 190,00] минут. Отмечена ожидаемая статистически значимая разница по данному показателю ( p <0,0001), однако это не повлияло на течение послеоперационного периода и длительность стационарного лечения пациентов,о чем говорят сопоставимые показатели медиан послеоперационного уровня гемоглобина, продолжительности катетеризации мочевого пузыря,дренирования брюшной полости и суммарного балла ВАШ боли на 5 сутки послеоперационного периода.
На 10 сутки после операции всем пациентам выполнялась ретроградная цистография. В случае экстра- вазации контрастного вещества катетеризация мочевого пузыря продолжалась до достижения отсутствия затеков при контрольной цистографии. При патомор-фологическом исследовании операционного материала случаев наличия злокачественного новообразования зафиксировано не было.
В таблице 3 представлены послеоперационные осложнения в соответствии с классификацией Clavien-Dindo. Осложнения I степени в группе ЛТВАЭ выявлены у 14 пациентов, из которых у 12 – зафиксированная лихорадка, потребовавшая введения антипиретиков, у 1 пациента развилась клиническая картина острого эпидидимита, купированная консервативно Еще у одного пациента срок дренирования мочевого пузыря был продлен до 17 суток, в связи с экстраваза-цией контрастного вещества при цистографии В группе ЛТВАЭ+ТАПП у 4 человек осложнения I степени также были представлены лихорадкой,купиро-ванной антипиретиками,у двух пациентов эпидиди-митом,разрешившимся с помощью консервативного лечения и у одного пациента экстравазацией контрастного вещества при цистографии,потребовавшей пролонгации срока катетеризации мочевого пузыря до 23 суток. Осложнения IIIa степени в виде гнойного ор-хоэпидидимита выявлены у 1 человека из каждой
Таблица 2. Операционные и ранние послеоперационные показатели у пациентов Table 2. Intra- and early postoperative patient parameters
|
Показатели Indicatots |
Группа А, Me [LQ; UQ] (n=52) Group A |
Группа Б, Me [LQ; UQ] (n=25) Group B |
p |
|
Длительность операции, мин Duration of surgery, min |
117,50 [100,00; 140,00] |
170,00 [135,00; 190,00] |
<0,0001 |
|
Гемоглобин после операции, г/л Hemoglobin after surgery, g/l |
133,00 [124,00; 145,00] |
131,00 [119,00; 136,00] |
0,340 |
|
Кровопотеря, мл Estimated blood loss, ml |
100,00 [100,00; 200,00] |
150,00 [100,00; 300,00] |
0,473 |
|
Длительность наличия уретрального катетера, дни Duration of urethral catheter stay, days |
10,0 |
10,0 |
0,608 |
|
Длительность наличия дренажа, ч. Duration of drainage stay, hour |
20,0 [18,8; 22,0] |
21,0 [20,0; 22,0] |
0,951 |
|
Койко-день, дни Length of stay, days |
5,0 [5,0; 5,0] |
5,0 [5,0; 6,0] |
0,356 |
|
ВАШ боли, балл/ Visual Analog Scale (VAS), points 1 сутки/1 day 3 сутки/3 days 5 сутки/5 days |
60,0 [50,0; 65,0] 40,0 [35,0; 50,0] 10,0 [10,0; 20,0] |
35,0 [25,00; 40,00] 35,0 [30,0; 40,0] 15,0 [10,0; 15,0] |
<0,0001 0,098 0,971 |
Таблица 3. Послеоперационные осложнения (в соответствии с усовершенствованной классификацией Clavien-Dindo)
Table 3. Postoperative complications (according to the improved Clavien-Dindo classification)
|
Степень Degree |
Группа А, Me [LQ; UQ] (n=52) Group A |
Группа Б, Me [LQ; UQ] (n=25) Group B |
p |
|
I |
14 (87,5) |
7 (77,8) |
0,3962 |
|
IIIa |
1 (6,2) |
2 (22,3) |
|
|
IIIb |
1 (6,2) |
- |
|
|
Всего/Total |
16 |
9 |
0,6484 |
группы, обоим пациентам выполнена орхоэпидидимэк-томия. Кроме того, через 6 месяцев после хирургического лечения у 1 пациента из группы симультанного лечения диагностирован склероз шейки мочевого пузыря, потребовавший выполнения трансуретральной инцизии шейки мочевого пузыря. Примечательно, что данному пациенту интраоперационно везикализация ложа аденомы не выполнялась.Данное наблюдение представляет интерес в отношении роли везикализа-ции ложа ПЖ в профилактике склероза шейки мочевого пузыря.У одного пациента из группы ЛТВАЭ в раннем послеоперационном периоде развилась гемотампонада мочевого пузыря.В связи с неэффективностью консервативного лечения и признаками продолжающегося кровотечения, пациенту выполнена лапароскопическая ревизия ложа удаленной аденомы ПЖ и коагуляция кровеносного сосуда, локализовавшегося в хирургической капсуле (степень IIIb).
После удаления уретрального катетера случаев острой задержки мочеиспускания зафиксировано не было
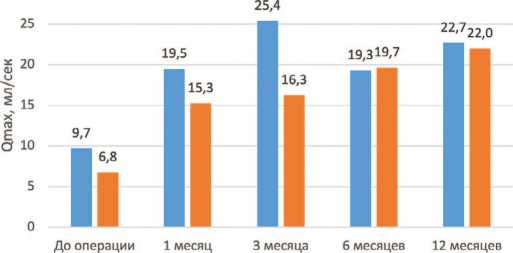
При контрольном обследовании у всех пациентов отмечены удовлетворительные показатели максимальной скорости потока мочи (Qmax) и малый объем остаточной мочи (ООМ). К 3 месяцу наблюдения в группах ЛТВАЭ и ЛТВАЭ+ТАПП медиана Qmax увеличилась на 161,9% и 140,7% и составила 25,4 [20,25; 26,60] мл/сек и 16,3 [13,70; 19,92] мл/сек соответственно. Через 12 месяцев после оперативного вмешательства данное значение оставалось удовлетворительным и составляло 22,7 [19,30; 25,30] мл/сек и 22,0 [21,40; 25,00] мл/сек для группы ЛТВАЭ и ЛТВАЭ+ТАПП соответственно (рис. 9). Медиана ООМ уже через 1 месяц после хирургического лечения снизилась на 90,2% и 89,5% в группах ЛТВАЭ и ЛТВАЭ+ТАПП соответственно. При обследовании пациентов через 1 год после операции также отмечен малый ООМ, соответствующий нормальному.
В группе ЛТВАЭ медиана балла опросника IPSS через 1 месяц после хирургического лечения снизилась на 66,7% и 71,1% в группах ЛТВАЭ и ЛТВАЭ+ТАПП со-
Период
■ ЛТВАЭ
■ ЛТВАЭ+ТАПП
Рис. 9. Динамика максимальной скорости потока мочи после хирургического лечения
Fig. 9. Dynamics of maximum urine flow rate after surgical treatment ответственно,не достигнув статистически значимой разницы по сравнению с предоперационными показателями, однако к 3 месяцу послеоперационного наблюдения зафиксировано ее уменьшение на 91,7% (р<0,0001) и 84,2% (p<0,0359) в группе ЛТВАЭ и симультанного хирургического лечения соответственно.При сравнении данных показателей с таковыми через 12 месяцев после операции статистически значимой разницы выявлено не было.
Статистически значимая разница по медиане балла QoL по сравнению с предоперационными показателями в обеих группа достигнута через 3 месяца после хирургического лечения. В группе ЛТВАЭ медиана снизилась на 75,0% ( р <0,0001) и составила 1,00 [1,00; 2,00] балл, не отличаясь от такового в группе ЛТВАЭ, где она уменьшилась на 80,0% от исходных значений ( p =0,0019).
Рецидива ПГ и признаков инфицирования сетчатого протеза при наблюдении в течение 12 месяцев после оперативного вмешательства ни в одном случае выявлено не было.
ОБСУЖДЕНИЕ
Паховая грыжа является одним из часто встречающихся сопутствующих заболеваний у мужчин с СНМП, вызванных ДГПЖ. Распространенность сочетания данных патологий по данным многочисленных исследований составляет 15-25% [16, 17]. В настоящем исследовании отмечается сопоставимая встречаемость сопутствующей ПГ, которая достигла 32%. В литературе встречаются публикации большого количества клинических случаев и сравнительных исследований симультанного открытого хирургического лечения ДГПЖ и ПГ, а также трансуретральной резекции ПЖ с одномоментной открытой паховой гернио-пластикой. Исследований, демонстрирующих результаты симультанных оперативных вмешательств через один хирургический доступ при сочетании данных па-тологий,нами встречено не было.Рекомендации по одномоментному лечению ПГ и ДГПЖ в настоящее время отсутствуют, однако многие авторы указывают на целесообразность данной тактики ввиду снижения рисков послеоперационной острой задержки мочеиспускания, продолжительности госпитализации, затрат на лечение, а также необходимости этапных хирургических вмешательств [18-20].
Несмотря на статистически значимо превосходящую медиану продолжительности операции в пользу группы ЛТВАЭ,показатели послеоперационного периода в обеих группах не отличались и не оказывали влияние на продолжительность стационарного лечения и частоту осложнений. Стоит отметить, что с учетом вероятности развития рубцовых осложнений в течение 3-6 месяцев после операции, по нашему мнению, с целью своевременной диагностики контрольное наблюдение за пациентами необходимо осуществлять 1 раз в 3 месяца в течение 1 года после операции.Примером может выступать пациент из группы симультанного лечения, у которого через 6 месяцев после операции выявлен склероз шейки мочевого пузыря, что не связано с проведением паховой герниопластики. Во всех остальных случаях в течение 12 месяцев после хирургического лечения качество мочеиспускания оставалось удовлетворительным. Полученные результаты соответствуют близким по дизайну опубликованным в международной литературе исследованиям. E. Cimentepe и соавт. в сравнительной работе проанализировали послеоперационной период трансуретральной резекции ПЖ,открытой паховой герниопластики и их сочетания, получив сопоставимую продолжительность госпитализации во всех группах, которые незначительно отличались только по длительности операции в пользу группы трансуретральной резекции предстательной железы. H. Ting-Wei и соавт. при сравнении двух групп хирургического лечения ДГПЖ методом трансуретральной резекции с симультанными паховыми герниопластиками открытым и лапароскопическим доступом сделали вывод об эффективности обоих методов лечения, так как открытый доступ уступал только по длительности оперативного вмешательства, не оказывая влияния на продолжительность госпитализации и частоту послеоперационных осложнений [20, 21]. В соответствии с литературными данными, частота рецидива ПГ при эндовидеохирургическом лечении составляет от 0,9% до 5,25 % случаев. Среди ряда предрасполагающих факторов рецидива выделяют ДГПЖ и гнойно-воспалительные осложнения [22]. Осложнений в виде рецидива ПГ и случаев инфицирования сетчатого протеза в настоящем исследовании зафиксировано не было, что соответствует ранее опубликованным в литературе рабо- там. A. Atmaca и соавт. при наблюдении в течение 13 месяцев за 20 пациентами, которым симультанно выполнена роботассистированная радикальная простатэктомия с паховой герниопластикой, не выявили ни одного случая рецидива ПГ и признаков инфицирования сетчатого протеза [23]. D. Finley и соавт. на примере 80 случаев отметили схожие результаты и сделали вывод о безопасности одномоментного хирургического лечения рака предстательной железы и ПГ в отношении инфекционных осложнений [12].
При анализе предоперационных параметров в настоящем исследовании отмечен тренд к большей частоте наличия цистостом в группе пациентов с ПГ Данное наблюдение согласуется с литературными данными о более выраженных расстройствах мочеиспускания у пациентов с ПГ [11]. Противоречащим настоящим наблюдениям выступает исследование A. Senturk и соавт., в котором участвовало 100 пациентов с ДГПЖ, разделенных поровну на 2 группы в зависимости от наличия у них сопутствующей ПГ При анализе опросников IPSS существенной разницы между двумя группами получено не было, что может объясняться небольшим размером выборки.Анало-гичное ограничение характерно и для настоящего исследования. Для повышения достоверности полученных данных требуется включение в группу симультанного лечения большего количества пациентов.
ЗАКЛЮЧЕНИЕ
Симультанное хирургическое лечение крупной и гигантской ДГПЖ с симптоматической ПГ лапароскопическим доступом является эффективным и безопасным методом, позволяющим одномоментно устранить обе патологии без отрицательного влияния на послеоперационный период.
ИШАТШШРЕЕЕШЕ
ЛИТЕРАТУРА/REFERENCES ство АЛЕФ, 2024. С. 65-66. [Isaev H.M.R., Abdulzhalilov M.K., Imanaliev M.R., Isaev M.Kh. Comparative characteristics of oblique and straight inguinal hernias. Innovations in pedagogy and surgery: materials of a scientific and practical conference with an international participation dedicated to the 90th anniversary of the organization of the Department of General Surgery of FSBEI in the DGMU (1934-2024), Makhachkala:, December 19, 2024. Makhachkala: Alef Publishing House, 2024. P. 65-6. (In Russian)].
cases. J Endourol 2011;25(4):625-9.
Сведения об авторах:
Панферов А.С. – к.м.н., руководитель Центра урологии медицинского центра «Медассист», доцент кафедры медицинской биоинженерии Юго-Западного государственного университета, Курск, Россия; РИНЦ Author ID 1281872,
Гаджиев Н.К. – д.м.н.,профессор кафедры кафедры урологии медицинского института Санкт-Петербургского государственного университета,заместитель директора по медицинской части (урология) Клиники высоких медицинских технологий им. Н.И. Пирогова; Санкт-Петербург,Россия; РИНЦ Author ID 819314,
Вклад авторов:
Панферов А.С. – концепция и дизайн исследования, общее руководство работой, 40% Елагин В.В. – поиск и обзор публикаций по теме исследования, сбор и анализ результатов исследования, статистическая обработка данных, написание текста статьи, 30%
Гаджиев Н.К. – концепция и дизайн исследования, научное консультирование, 30%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Статья подготовлена без финансовой поддержки.


