Синдром микрососудистого повреждения миокарда у пациентов с первичным инфарктом миокарда с подъемом сегмента ST: распространенность и связь с клиническими характеристиками
Автор: Вышлов Е.В., Алексеева Я.В., Усов В.Ю., Мочула О.В., Рябов В.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
Цель исследования: оценка распространенности микрососудистой обструкции (МСО) и геморрагическое пропитывание миокарда (ГПМ) и их сочетания, а также их взаимосвязи с клиническими и анамнестическими характеристиками у пациентов с первичным инфарктом миокарда с подъемом сегмента ST (STEMI) электрокардиограммы после коронарной реперфузии.Материал и методы. Настоящее исследование было одноцентровым наблюдательным когортным. В общей сложности в исследование вошли 60 пациентов с первичным STEMI и успешной коронарной реперфузией в первые 12 ч от начала заболевания, все были обследованы с использованием магнитного резонанса сердца с контрастным усилением на 2-й день после STEMI. Данное исследование было зарегистрировано в ClinicalTrials.gov, номер: NCT03677466.Результаты. Общая частота явлений МСО и ГПМ составляет 68,3%. Различные фенотипы микрососудистого повреждения миокарда распределены следующим образом: только МСО - 17%, только ГПМ - 15%, комбинация МСО и ГПМ - 36%, без микрососудистого повреждения миокарда - 32% обследованных. У пациентов только с МСО и комбинацией МСО и ГПМ наблюдался более длительный период «боль - реперфузия» по сравнению с пациентами без этих явлений: 205 (140-227) и 193 (95-400) против 130 (91-160) мин (p = 0,049). Напротив, время ишемии миокарда у пациентов только с ГПМ (113 мин) не отличалось от показателя у пациентов без этих явлений. Все пациенты были разделены на группу фармакоинвазивной стратегии коронарной реперфузии (ФИС) (n = 39) и группу первичного чрескожного вмешательства (ПЧТКА) (n = 21). Основные клинические и анамнестические характеристики на исходном уровне не различались между этими группами. Количество случаев только МСО и только ГПМ не различалось между группами ФИС и ПЧТКА: 17,9 против 14,2% и 12,8 против 19,1% в группах ФИС и ПЧТКА соответственно. Была обнаружена тенденция к снижению частоты встречаемости комбинации МСО и ГПМ в группе ФИС по сравнению с группой ПЧТКА: 30,8 против 47,6% (р = 0,09).Заключение. Общая частота явлений МСО и ГПМ у пациентов с первичным STEMI после коронарной реперфузии достигает 68,3%. Сочетание этих явлений развивается чаще, чем каждое из них в отдельности: 36 против 17% (только МСО) и 15% (только ГПМ). Развитие только МСО и комбинации МСО с ГПМ связано с большей продолжительностью ишемии миокарда по сравнению с группой без этих явлений. Разницы во времени ишемии миокарда между группой только с ГПМ и группой без этих явлений нет. Тромболизис не увеличивает частоту возникновения ГПМ в группе ФИС по сравнению с группой ПЧТКА. Наблюдается тенденция к снижению встречаемости комбинации МСО и ГПМ в группе ФИС по сравнению с группой ПЧТКА: 30,8 против 47,6% (р = 0,09).
Инфаркт миокарда, микрососудистая обструкция, геморрагическое пропитывание миокарда, первичное чрескожное вмешательство, тромболизис, кардио-мрт
Короткий адрес: https://sciup.org/149140018
IDR: 149140018 | УДК: 616.127-005.8-021.3-06
Текст научной статьи Синдром микрососудистого повреждения миокарда у пациентов с первичным инфарктом миокарда с подъемом сегмента ST: распространенность и связь с клиническими характеристиками
The emergency reperfusion of the infarct-related coronary artery is the most effective way to preserve a viable myocardium and reduce mortality in patients with acute ST-segment elevation myocardial infarction (STEMI). However, the benefit of this reperfusion is diminished by the phenomena of microvascular myocardial injury: microvas-cular obstruction (MVO) and intramyocardial hemorrhage (IMH) [1–3].
The study of these phenomena has been challenging for a long time due to the impossibility of establishing accurate diagnostics. The presence of severe MVO in the no-reflow phenomenon was evaluated using an invasive coronary angiography (CAG) and contrast echocardiography. However, IMH phenomenon was identified during an autopsy or in an experiment [3, 4]. Contrast-enhanced cardiac magnetic resonance imaging (CMR) allows for noninvasive visualization of both MVO and IMH in STEMI patients in vivo [5].
During recent years, a number of studies were performed using CMR. The studies showed that MVO and/or IMH are associated with a larger myocardial infarction and increased occurrences of major adverse cardiac events (MACE) [6, 7, 8 et al.]. Based on these observations, it was proposed to use these phenomena for the prognosis of disease [9] and as a novel target in the future adjunctive STEMI treatment [10]. However, the prevalence of these phenomena remains not entirely clear: according to different authors, the prevalence of MVO varies from 9.5% [11] to 66% [5], and the prevalence of IMH ranges from 10% [12] to 50% [5]. There is lack of data regarding the prevalence of combination of MVO and IMH. Carrick et al. [13] and Ma et al. [1] were the only ones who showed the prevalence of 41% and 44% for this condition in patients with STEMI and PPCI, respectively. It remains unclear what significance the combination of MVO and IMH has in comparison with MVO only and IMH only. Also, there is no published data on the impact of two different methods of coronary reperfusion such as the pharmaco-invasive strategy reperfusion (PIS) and the primary percutaneous coronary intervention (PPCI) to the risk of developing these phenomena.
The aim of this study was to evaluate the prevalence of MVO and IMH and their combination, as well as their relationship to the clinical and anamnestic characteristics in patients with primary STEMI after coronary reperfusion.
Material and Methods
A single-center observational cohort study was conducted in the Cardiology Research Institute, Tomsk National Research Medical Center of the Russian Academy of Sciences. The Biomedical Ethics Committee of the Institute approved the study protocol and the patient informed тута утвердил протокол исследования и форму информированного согласия пациента. Все процедуры, выполняемые в исследованиях с участием людей, соответствовали Хельсинкской декларации 1964 г. и более поздним поправкам к ней. Информированное согласие было получено от каждого участника, включенного в исследование. Это испытание было зарегистрировано в ClinicalTrials.gov # NCT03677466.
Критерии включения: первичный STEMI и успешная коронарная реперфузия в первые 12 ч от начала заболевания.
Критерии исключения: отказ пациента, реваскуляризация коронарной артерии в анамнезе, острая сердечная недостаточность III–IV классов по Killip, острые психические расстройства, хроническая болезнь почек 4-й стадии (скорость клубочковой фильтрации < 30 мл/мин/ 1,73 м2) и противопоказания к кардио-МРТ.
Запись изображений кардио-МРТ
Все пациенты были обследованы с использованием кардио-МРТ с контрастным усилением на 2-й день после STEMI. Кардио-МРТ была выполнена с помощью сканера Toshiba Vantage Titan 1,5T для каждого пациента. Контрастное усиление проводилось с использованием обычных доз парамагнетика, в частности Гадовиста или Омнискана, в дозе 0,1 мл на кг массы тела. Кроме того, был использован базовый кардиологический пакет, такой как ЭКГ и регистрация дыхания.
Анализ изображений
Протоколы кардио-МРТ состояли из стандартных импульсных последовательностей: TSE T2-взвешенная последовательность темной крови и T1-взвешенная последовательность SE с подавлением жира – по короткой оси сердца в двухкамерной проекции и динамических последовательностей – GRE-SSFP «светлая кровь». Поглощение миокардом контраста различной степени трансмуральности в толще стенки левого желудочка (ЛЖ) было оценено и зарегистрировано как признак инфаркта миокарда, если оно присутствует при сканировании кардио-МРТ с отсроченным контрастированием. Сканирование кардио-МРТ проводилось в режиме инверсии – восстановления с настройкой времени инверсии для получения нормального черного цвета миокарда (т. е. нулевой или минимальной интенсивности). Размер инфаркта определяли на изображениях с отсроченным consent form. All procedures, performed in studies involving human participants, were in accordance with the 1964 Helsinki Declaration and its later amendments. An informed consent was obtained from each participant enrolled in the study. This trial was registered on ClinicalTrials.gov (Identifier: NCT03677466).
Inclusion criterion was primary STEMI and successful reperfusion of the event within 12 hours of the onset of symptoms.
Exclusion criteria were patient refusal, previous coronary artery revascularization, acute heart failure Killip classes III-IV, acute mental disorders, chronic kidney disease stage 4 (glomerular filtration rate ˂ 30 mL/min/1.73 m2), and contraindications to CMR.
Image Acquisition
All patients were studied using contrast-enhanced CMR on the second day of STEMI. The CMR scans were performed on Toshiba Vantage Titan 1.5T scanner for each participant. A contrast enhancement was carried out employing common dosages of paramagnetic contrast agents, in particular, Gadovist or Omniscan as 0.1 mM per kg of body weight. Also, a basic cardiology package such as Cardiac ECG and breath-gated acquisitions were employed.
Image Data Analysis
The CMR protocols were comprised of standard pulse sequences (TSE T2-weighted dark blood sequence and T1-weighted SE sequence with fat suppression) on a short axis in a two-chamber projection and dynamic sequences (IE GRE-SSFP “light blood”). A myocardial contrast uptake of various degrees of transmurality through the wall of the left ventricle (LV) was analyzed and reported as a sign of myocardial infarction if present on delayed contrast-enhanced CMR scans. The CMR scans were performed in the inversion recovery mode with the inversion time adjusted to obtain the normal myocardium black (i.e. of zero or minimal intensity). The size of infarction was identified on images with a delayed contrast using semi-automatic tracing of hyperintense areas (including the central hypointense if any) and expressed as a percentage of LV mass. MVO was defined as hypointense areas on delayed contrast-enhanced MRI scans in the IR-mode with normal myocardium black (Fig. 1).
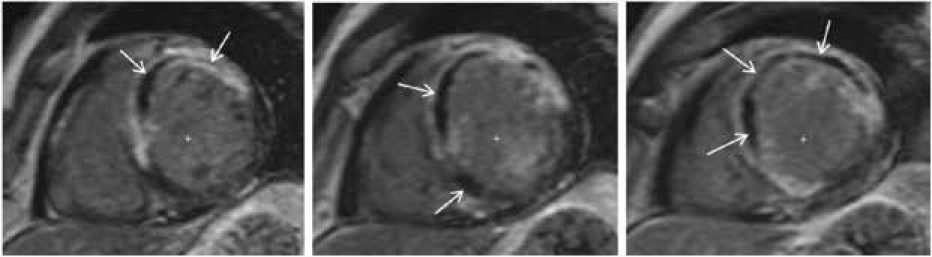
a
c
Fig. 1. Microvascular obstruction MRI (obstruction zone shown with arrows)
Рис. 1. МРТ-картина микрососудистой обструкции (зона обструкции отмечена стрелками)
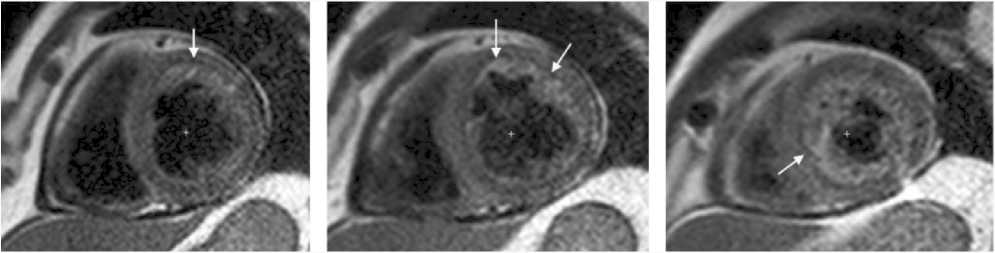
контрастированием с использованием полуавтоматического выделения гиперинтенсивных областей (включая центральную гипоинтенсивную, если таковая имеется) и выражали в процентах от массы ЛЖ. МСО определяли как гипоинтенсивные области на МРТ с отсроченным контрастированием в ИК-режиме с нормальным черным миокардом (рис. 1). ГПМ отображался как гипоинтенсив-ная область на фоне миокарда с повышенной интенсивностью сигнала в режиме T2-взвешенного (рис. 2).
The IMH was imaged as a hypointense area over the background of myocardium with increased signal intensity in T2-weighted mode (Fig. 2).
The CMR images were acquired along a short axis of the basal, middle, and apical ( a , b , c ) LV sections. Hypointense areas correspond to no-reflow in the projections of the anterior-septum wall of the LV ( a , b , c ) and the inferior-lateral wall (b, c) of the LV in the delayed contrast inversion recovery mode.
a
c
Fig. 2. MRI of intramyocardial hemorrhage
Рис. 2. МРТ-картина внутримиокардиального кровоизлияния
Статистический анализ полученных данных проводили с использованием программного пакета STATISTICA 10. Количественные показатели представлены медианой ( Me ) и межквартильным диапазоном ( Q 25– Q 75). Категориальные показатели описывали абсолютными и относительными (%) частотами встречаемости. Статистическую значимость различий между двумя независимыми количественными показателями оценивали с помощью U-критерия Манна – Уитни. Для определения значимости различий в множественных сравнениях использовали критерий Краскела – Уоллиса. Статистическую значимость различий категориальных показателей оценивали с помощью критерия хи-квадрат Пирсона и точного критерия Фишера. Различия между группами считали статистически значимыми при уровне значимости р < 0,05.
Результаты
В это исследование были последовательно включены 60 пациентов с первичным STEMI. Всем пациентам были выполнены КАГ и ЧКВ с достижением в результате 2– 3-й степени кровотока TIMI. Реперфузия с использованием ФИС была выполнена 39 пациентам, ПЧТКА – 21 пациенту. Тромболитическая терапия проводилась на догоспитальном этапе. В группе успешного тромболизиса время ишемии миокарда определялось как время «боль – игла» плюс 60 мин, когда регистрировалась электрокардиограмма с признаками реперфузии. В группе неудачного тромболизиса время ишемии миокарда определялось как время «боль – спасительное ЧКВ». В группе ПЧТКА время ишемии миокарда регистрировалось как время «боль – баллон». Признаки реперфузии по ЭКГ после тромболизиса наблюдались у 84,6% ( n = 33) пациентов. Лечение STEMI проводилось в соответствии с применимыми современными рекомендациями [14]. Смертель-
The CMR images were acquired along a short axis of the basal, middle, and apical ( a , b , c ) LV sections. Hypointense areas are present in the projections of the anterior wall ( a , b ) and the inferior-lateral wall ( b , c ) of the LV in the T2-WI mode.
Statistics
Statistical analysis of the obtained data was performed using the STATISTICA 10 software package. The resulting values are presented as a median (Me) and interquartile range ( Q 1– Q 3). Statistical significance of differences between two independent quantitative indicators was evaluated using the Mann – Whitney U test. The Kruskal – Wallis test was used to determine the significance of differences in multiple comparisons. The statistical significance of differences in qualitative characteristics was assessed using the Pearson’s chi-squared test and the Fisher F-test. Differences between groups were considered statistically significant at the p < 0.05 level.
Results
A total of 60 patients with primary STEMI were sequentially included in this trial. A CAG and PCI with the achievement of TIMI blood flow grades 2–3 were performed in all patients. A PIS reperfusion was performed in 39 patients, and PPCI was performed in 21 patients. The thrombolytic therapy was performed at a prehospital stage. In the successful thrombolysis group, the time of myocardial ischemia was defined as the pain-needle time plus 60 minutes when the ECG with signs of reperfusion was recorded. In the unsuccessful thrombolysis group, the time of myocardial ischemia was defined as the pain–rescue percutaneous coronary intervention (PCI) time. In PPCI group, the time of myocardial ischemia was recorded as pain–balloon ных случаев не было, все пациенты были выписаны из клиники на амбулаторный этап.
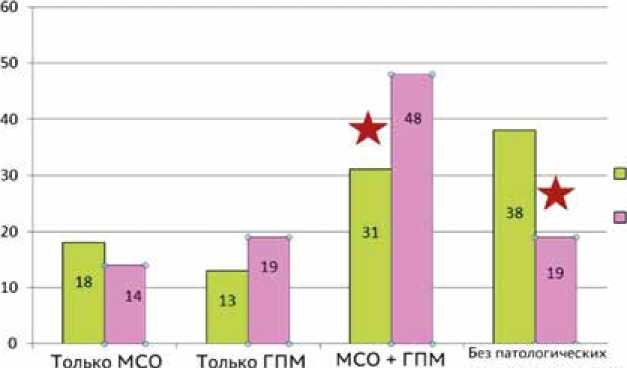
Первоначально на этапе 1 (рис. 3), пациенты были разделены на 4 группы: без явлений микрососудистого повреждения миокарда – 1-я гр. (n = 19), только МСО – 2-я гр. (n = 10), только ГПМ – 3-я гр. (n = 9), комбинация МСО и ГПМ – 4-я гр. (n = 22) (рис. 4). В целом данные феномены были обнаружены у большинства пациентов: всего у 41 из 60 пациентов что составило 68,3%. Клинические и анамнестические характеристики этих групп представлены в таблице 1. У пациентов 2-й гр. время ишемии миокарда, индекс массы тела и уровень глюкозы при поступлении были статистически значимо выше по сравнению с 1-й гр. У пациентов 4-й гр. время ишемии time. The ECG signs of reperfusion after thrombolysis were observed in 84.6% (n = 33). The acute STEMI management followed the applicable contemporary guidelines [14]. There were no deaths, and all patients were discharged from the hospital.
First, at step 1 (Fig. 3), patients were divided into four groups: group 1 comprised patients without phenomena of microvascular myocardial injury ( n = 19), group 2 comprised patients with MVO only ( n = 10), group 3 included patients with IMH only ( n = 9), and group 4 comprised patients with combination of MVO and IMH ( n = 22).
So, these phenomena were found in the majority of patients, namely: in 41 of 60 patients (68.3%) (Fig. 4).
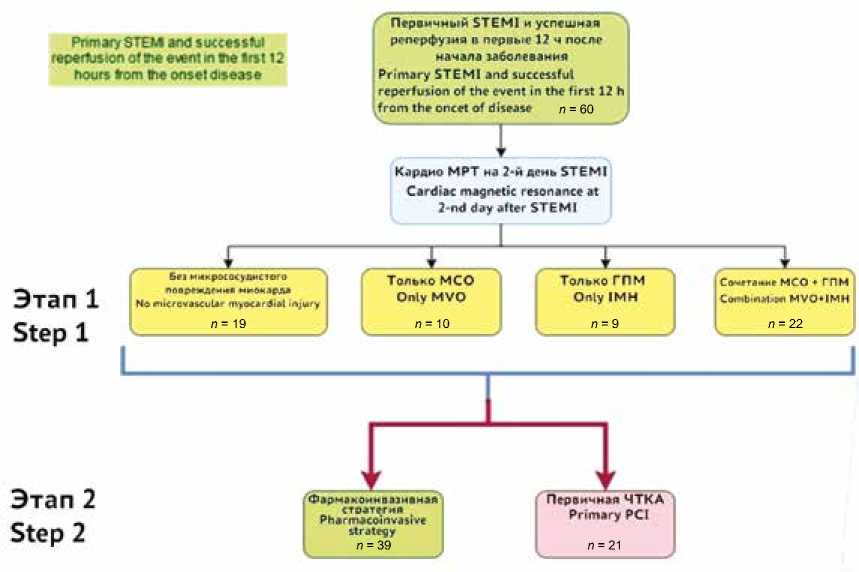
Fig. 3. Study flow diagram. STEMI – ST-segment elevation myocardial infarction, MVO – microvascular obstruction, IMH intramyocardial hemorrhage, PCI – percutaneous coronary intervention
Рис. 3. Диаграмма проведения исследования. STEMI – инфаркт миокарда с подъемом сегмента ST, MVO – микрососудистая обструкция, IMH – вну-тримиокардиальное кровоизлияние, PCI – чрескожное коронарное вмешательство
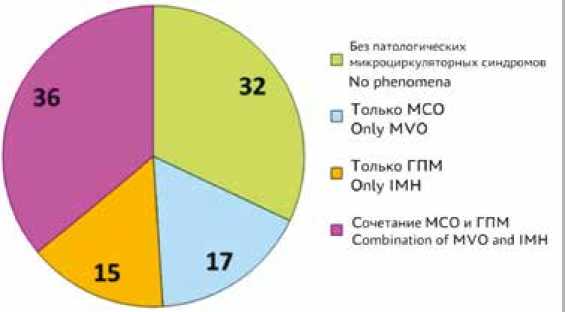
Fig. 4. Prevalence of microvascular myocardial injury phenomena in patients with primary STEMI after coronary reperfusion, %
Рис. 4. Частота микрососудистых феноменов миокардиального повреждения у пациентов с первичным STEMI после коронарной реперфузии, %
миокарда, уровень глюкозы при поступлении и размер инфаркта миокарда по кардио-МРТ были статистически значимо большими по сравнению с 1-й гр. В то же время все характеристики у пациентов 1 и 3-й групп не различались. Другие показатели между группами также не различались.
На этапе 2 все пациенты были разделены на группу ФИС ( n = 39) и группу ПЧТКА ( n = 21). Основные клинические и анамнестические характеристики при поступлении не различались между этими группами (табл. 2).
Частота встречаемости изолированной МСО не различалась между группами: 17,9 против 14,2% в группах ФИС и ПЧТКА соответственно (табл. 3). Частота изолированного ГПМ также не отличалась: 12,8 против 19,1%. Была обнаружена тенденция к снижению частоты встречаемости комбинации МСО и ГПМ в группе ФИС: 30,8 против 47,6% ( р = 0,09). Напротив, наблюдалась тенденция к увеличению отсутствия обоих этих феноменов в группе ФИС:
The clinical and anamnestic characteristics of the groups are presented in Table 1. The patients in group 2 had significantly longer pain-reperfusion time, greater body mass index, and higher glucose on admission level versus group 1. The patients in group 4 had significantly longer pain-reperfusion time, higher glucose levels on admission, and greater size of the myocardial infarction by CMR versus group 1. At the same time, the characteristics in patients of groups 1 and 3 did not differ. Other criteria were similar between the groups.
During the second stage, all patients were divided into PIS group ( n = 39) and PPCI group ( n = 21). The key clinical and anamnestic characteristics at the baseline did not differ between these groups (Table 2).
The incidence of MVO only did not differ between the groups: 17.9% versus 14.2% in PIS and PPCI groups, respectively (Table 3).
Table 1. Characteristics of groups
Таблица 1. Характеристика групп
|
Characteristics Характеристики |
Group 1 ( n = 19) Microvascu-lar myocardial injury is absent 1 гр. ( n = 19) Микросо-судистое повреждение отсутствует |
Group 2 ( n = 10) MVO only 2 гр. ( n = 10) Только МСО |
Group 3 ( n = 9) IMH only 3 гр. ( n = 9) Только ГПМ |
Group 4 ( n = 22) Combination of MVO and IMH 4 гр. ( n = 22) Сочетание МСО и ГПМ |
|
Age, years Возраст, лет |
59 (49–66) |
63 (59–67) |
65 (62–69) |
62 (55–65) |
|
Gender: m/f Пол: м/ж |
15/4 |
8/2 |
6/3 |
17/5 |
|
BMI, кg/m2 ИМТ, кg/м2 |
26 (24–30) |
34.6 (27.3–36.3) * |
25 (21.5–29) |
28.2 (26.7–31) |
|
Pain-reperfusion time, мin Время «боль-реперфузия», мин |
130 (91–160) |
205 (140–227) * |
113 (100–179) |
193 (95–400) * |
|
Localization of MI, n (%) Локализация ОИМ, n (%) Anterior Передний Inferior Нижний |
10 (52.6) 9 (47.4) |
4 (40) 6 (60) |
4 (44.4) 5 (55.6) |
16 (72.7) 6 (27.3) |
|
Hypertension, n (%) Артериальная гипертония, n (%) |
18 (94.7) |
8 (80) |
8 (88.9) |
20 (90.9) |
|
Diabetes mellitus, n (%) Сахарный диабет, n (%) |
2 (10.5) |
2 (20) |
2 (22.2) |
7 (31.8)* |
|
Glucose on admission, mmol/L Уровень глюкозы при поступлении, ммоль/л |
6.9 (6.1–9.1) |
9.4 (8.5–10.8)* |
7.8 (6.9–8.9) |
10.1 (7.9–12.2)* |
|
Cholesterol, mmol/l Холестерин, ммоль/л |
4.9 (4.35–6.3) |
4.9 (4.0–5.5) |
4.9 (4.4–5.9) |
5.7 (3.5–6.4) |
|
Smoking, n (%) Курение, n (%) |
16 (84.2) |
5 (50) |
7 (77.8) |
15 (68.2) |
|
Killip class of heart failure, n (%) Тяжесть по Killip, n (%) I II |
12 (85.7) 2 (14.3) |
10 (90.9) 1 (9.1) |
7 (87.5) 1 (12.5) |
9 (64.3) 5 (35.7) |
|
One-/Two-/Three-vessel lesion, n Одно/Двух/Трех-сосудистое поражение, n |
3/7/9 |
5/3/2 |
0/4/5 |
4/10/8 |
|
No-reflow phenomenon by CAG, n (%) Феномен «no-reflow» при КАГ, n (%) |
0 |
0 |
0 |
3 (13.6) |
|
Size of the myocardial infarction by CMR, % Размеры ОИМ, по данным кардио-МРТ, % |
10 (8–18) |
17.3 (12–30) |
23.2 (9–25) |
24.8 (17.5–35) * |
Note: * – p ˂ 0.05 versus group 1, MI – myocardial infarction, IMH – intramyocardial hemorrhage, MVO – microvascular obstruction, BMI – body mass index, CAG – coronary angiography, CMR – cardiac magnetic resonance.
Примечание: * p < ˂0.05 по сравнению с группой 1, ОИМ – острый инфаркт миокарда, ГПМ – геморрагическое пропитывание миокарда, МСО – микрососудистая обструкция, ИМТ – индекс массы тела, КАГ – коронароангиография, кардио-МРТ – кардиологическая магнитно-резонансная томография.
Table 2. Clinical characteristics of patients in PIS and PPCI groups at baseline
Таблица 2. Клинические характеристики групп пациентов с ФИС и первичным ЧКВ
|
Characteristics Характеристики |
PIS (n = 39 ) |
Primary PCI (n = 21 ) |
p |
|
Age, years Возраст, лет |
59 [54–65] |
64 [55–69] |
> 0.05 |
|
Male/Female, % Пол: м/ж, % |
79.5/20.5 |
76.2/23.8 |
> 0.05 |
|
Hypertension, n (%) Артериальная гипертония, n (%) |
34 (87.2) |
20 (95.2) |
> 0.05 |
|
Diabetes mellitus, n (%) Сахарный диабет, n (%) |
6 (15.3) |
5 (23.8) |
> 0.05 |
|
Smoking, n (%) Курение, n (%) |
22 (56) |
10 (47,6) |
> 0.05 |
|
Obesity, n (%) Ожирение, n (%) |
10 (25.6) |
10 (47.6) |
> 0.05 |
|
Localization of myocardial infarction: Локализация ОИМ, n (%): Anterior Передний Inferior Нижний |
19 (48.7) 20 (51.3) |
14 (66.7) 7 (33.3) |
> 0.05 |
|
Pain–needle time (min) Время «боль – реперфузия», мин |
119 (72–180) |
– |
> 0.05 |
|
Total myocardial ischemic time, min Полное время ишемии миокарда, мин |
209 (156.5–260) |
220 (147–375) |
> 0.05 |
|
Size of myocardial infarction by CMR, % Размеры ОИМ, по данным кардио-МРТ, % |
17 (9–29) |
17.5 (10–24) |
> 0.05 |
Table 3. The CMR data in PIS and PPCI groups
Таблица 3. Показатели кардио-МРТ в группах ФИС и ПЧТКА
|
Phenomena Феномены |
PIS (n = 39 ) |
PPCI (n = 21 ) |
p |
|
MVO only, n (%) Изолированная МСО, n (%) |
7 (17.9) |
3 (14.2) |
0.2 |
|
IMH only, n (%) Изолированное ВМК, n (%) |
5 (12.8) |
4 (19.1) |
0.89 |
|
Combination of MVO and IMH, n (%) Сочетание МСО и ВМК, n (%) |
12 (30.8) |
10 (47.6) |
0.09 |
|
The absence of MVO and IMH, n (% ) Отсутствие МСО и ВМК, n (%) |
15 (38.5) |
4 (19.1) |
0.09 |
|
Size of myocardial infarction by CMR, % Размеры ОИМ, по данным кардиоМРТ, % |
17 (8.5–28) |
17.5 (10.5–23.1) |
0.8 |
Fig. 5. Occurrence of MVO and IMH in patients with primary STEMI after pharmaco-invasive strategy reperfusion (PIS) and primary percutaneous coronary intervention (PPCI), % – p = 0.09.
Рис. 5. Частота МСО и ВМК у пациентов с первичным STEMI после фармакоинвазивной стратегии реперфузии (PIS) и первичного чрескожного коронарного вмешательства (PPCI), % – p = 0,09.
ФИС PIS ПЧТКА PPG I
Only MVO
Only IMH
MVO * IMH
михроциркуляторных синдромов
No phenomena
38,5 против 19% ( р = 0,09) (рис. 5). В то же время показатели размера инфаркта миокарда не различались между группами: 17 [8,5–28] и 17,5 [10,5–23,1] % массы миокарда ЛЖ, в группах ФИС и ПЧТКА соответственно.
Обсуждение
В нашем исследовании изучаемые феномены МСО и/или ГПМ были визуализированы в 68% случаев. Это подтверждает тот факт, что эти феномены широко распространены у пациентов с STEMI. В то же время следует учитывать, что в исследование включались не самые тяжелые пациенты с острым инфарктом миокарда. Мы можем предположить, что у пациентов с тяжелыми осложнениями, такими как отек легких, кардиогенный шок и смерть, частота этих явлений может быть еще выше.
Согласно результатам нашего исследования, МВО развивается при более длительной ишемии миокарда. Увеличение продолжительности ишемии миокарда естественным образом приводит к увеличению размера инфаркта миокарда в соответствии с данными кардио-МРТ в комбинации группы МСО и ГПМ. Это подтверждает известное правило «время – миокард».
В то время как развитие ГПМ в сочетании с МСО объясняется патофизиологией процесса и может быть связано с повреждением сосудистой стенки [15], вызванным окклюзией эпикардиальной коронарной артерии и МСО, патофизиология изолированного ГПМ остается неясной. Время ишемии миокарда в группе без этих феноменов и только с ГПМ не различалось. Всем пациентам была проведена двойная антитромбоцитарная терапия. Логично предположить, что определенную роль может играть тромболизис, который был проведен в группе ФИС, поскольку существуют результаты более ранних исследований, основанных на результатах аутопсии, где ГПМ было описано как осложнение тромболизиса [16, 17]. Чтобы проверить эту гипотезу, пациенты были разделены на группы в зависимости от метода коронарной реперфузии.
По нашим данным, встречаемость ГПМ как в форме только ГПМ, так и в форме комбинации МСО и ГПМ между группами ФИС и ПЧТКА не различалась. Следовательно, можно сделать вывод, что тромболизис, как минимум, не увеличивает риск развития ГПМ. В то же время была обнаружена тенденция к увеличению частоты встречаемости комбинации МСО и ГПМ в группе ПЧТКА по сравнению с группой ФИС ( p = 0,09), комбинация МСО и ГПМ развивалась чаще, чем эти явления в одиночку. Это подтверждает патофизиологическую связь между этими явлениями. Вероятно, ПЧТКА и механическое разрушение тромба приводят к большому количеству микроэмболизаций, которые и вызывают МСО [18, 19]. ГПМ развивается как осложнение дополнительного повреждения миокарда.
Большинство случаев стентирования в группе ФИС происходит на фоне полностью лизированного сгустка крови или его остатков, без большого количества микроэмболий и с более редким развитием МСО. Так, были представлены наши ранние данные, показывающие, что явление «no-reflow» в группе ФИС встречается реже по сравнению с группой ПЧТКА [20]. Возможно, разница в количестве случаев микрососудистого повреждения миокарда является причиной результатов недавнего метаанализа, показывающего более высокую частоту кардиогенного шока в группе ПЧТКА по сравнению с группой ФИС [21].
The incidence of IMH only also did not differ: 12.8% versus 19.1%. The tendency to decreased occurrences of MVO and IMH combination was found in PIS group: 30.8% versus 47.6% ( p = 0.09). In contrast, there was a tendency to the increase in the absence of phenomena in PIS group: 38.5% versus 19% ( p = 0.09) (Fig. 5). At the same time, myocardial infarction size did not differ between the groups: 17 [8.5–28] and 17.5 [10.5–23.1]% in PIS and PPCI groups, respectively.
Discussion
In our research, MVO and/or IMH were visualized in 68% of cases. This observation confirms that these phenomena are widespread in patients with STEMI. At the same time, it should be taken into consideration that these patients were not the most severe patients. We can assume that the incidence of these phenomena could be even higher in patients with severe complications, such as a pulmonary edema, cardiogenic shock, and death.
According to the results of our study, MVO develops during a prolonged myocardial ischemia. An increase in the duration of myocardial ischemia naturally leads to a larger size of myocardial infarction according to CMR data in the group of patients with combination of MVO and IMH. This confirms the well-known “time-myocardium” rule.
The development of IMH in combination with MVO may be explained by the pathophysiology and can be attributed to the vascular wall damage [15] caused by an epicardial coronary artery occlusion and MVO, whereas the pathophysiology of isolated IMH remains unclear. The myocardial ischemia time did not differ between the group without the phenomena and with IMH only. A double antiplatelet therapy was administered to all patients. It is possible that the thrombolysis, performed in PIS group, was important. The earlier studies, based on autopsy investigations, describe IMH as a complication from thrombolysis [16, 17]. To investigate this hypothesis, the patients were divided into the groups depending on the method of coronary reperfusion.
According to our data, the occurrence of IMH both in the form of IMH only, and in the form of combination of MVO and IMH did not differ between PIS and PPCI groups. Therefore, it can be concluded that thrombolysis did not increase the risk of IMH development. At the same time, a tendency to an increase in the occurrence of MVO and IMH combination in PPCI group, compared to PIS group, was found ( p = 0.09), and the combination of MVO and IMH developed more often than the isolated phenomena. This confirms the pathophysiological association between these phenomena. It is likely that PPCI and mechanical destruction of blood clot leads to a large number of microemboli, which cause MVO [18, 19]. The IMH develops as a complication of additional myocardial injury. Most stenting in PIS group occurs with a fully lysed blood clot or its remnants without a large number of microemboli and with a rarer MVO development. Our early data show that the occurrence of no-reflow phenomenon in PIS group is less common compared to that in PPCI group [20]. It is possible that the difference in the number of microvascular myocardial injury events is the reason for a recent meta-analysis showing a higher frequency of cardiogenic shock in PPCI group compared to PIS group [21].
В любом случае, влияние антитромботической терапии на развитие ГПМ, по-видимому, значительно меньше, чем продолжительность ишемии миокарда. При длительной ишемии миокарда и последующей реперфузии нарушается целостность сосудистой стенки и происходит экс-травазация эритроцитов [3]. Следовательно, увеличение продолжительности ишемии миокарда и размера некроза миокарда увеличивает возможность МСО, а также комбинации МСО и ГПМ.
Ограничения исследования
Наше исследование имело некоторые ограничения. Наиболее важным из них было то, что это было одноцентровое исследование с относительно небольшой выборкой. Также мы не включали пациентов с тяжелыми осложнениями заболевания, такими как отек легких и кардиогенный шок, поэтому результаты нашего исследования не могут быть применены к этим пациентам.
Выводы
Общая частота МСО и ГПМ у пациентов с первичным STEMI после коронарной реперфузии достигает 68,3%.
Различные фенотипы микрососудистого повреждения миокарда распределены следующим образом: только МСО – 16,7%, только ГПМ – 15%, сочетание МСО и ГПМ – 36,7%, без этих явлений – 31,7%.
Развитие только МСО и комбинации МСО и ГПМ связано с более длительным временем ишемии миокарда и более высоким уровнем глюкозы при поступлении по сравнению с группой без этих явлений. Напротив, все характеристики у пациентов между группой только ГПМ и группой без микрососудистого повреждения миокарда не различаются.
Тромболизис не увеличивает частоту возникновения ГПМ в группе ФИС по сравнению с группой ПЧТКА.
Наблюдается тенденция к снижению частоты сочетания МСО и ГПМ в группе ФИС по сравнению с группой ПЧТКА: 30,8 против 47,6% ( р = 0,09).
In any case, the effect of antithrombotic therapy on IMH development seems to be significantly less than the effect of myocardial ischemia duration. With the long-term myocardial ischemia and subsequent reperfusion, the integrity of the vascular wall is damaged, and an extravasation of erythrocytes occurs [3]. Therefore, the increases in myocardial ischemia duration and myocardial necrosis size increase a possibility of MVO and combination of MVO and IMH.
Study limitations
Our study had some limitations. The most important one was that it was a single-center study with a relatively small patient sample. Also, we did not include patients with severe complications from the disease, such as: pulmonary edema and cardiogenic shock. Therefore, the results of our study cannot be applied to these patients.
Conclusions
The total occurrence of MVO and IMH in patients with primary STEMI after coronary reperfusion reached 68.3%.
The different phenotypes of microvascular myocardial injury were distributed as follows: MVO only was present in 16.7% of patients; IMH only was found in 15% of patients; combination of MVO and IMH was observed in 36.7% of patients; and 31.7% of patients were free of these phenomena.
The development of MVO only and combination of MVO and IMH was associated with the longer time of myocardial ischemia and higher glucose level on admission compared to the group without these phenomena. In contrast, the characteristics did not differ between patients from IMH only group and group without the microvascular myocardial injury.
The thrombolysis did not increase the occurrence of IMH in PIS group compared to PPCI group.
There was a tendency to a decreased occurrence of combination of MVO and IMH in PIS group compared to PPCI group: 30.8% versus 47.6% ( p = 0.09).
Список литературы Синдром микрососудистого повреждения миокарда у пациентов с первичным инфарктом миокарда с подъемом сегмента ST: распространенность и связь с клиническими характеристиками
- Ma M., Diao K., Yang Z., Zhu Y., Guo Y., Yang M. et al. Clinical associations of microvascular obstruction and intramyocardial hemorrhage on cardiovascular magnetic resonance in patients with acute ST segment elevation myocardial infarction (STEMI): An observational cohort study. Medicine (Baltimore). 2018;97(30):e11617. DOI: 10.1097/ MD.0000000000011617.
- Kaul S. The «no reflow» phenomenon following acute myocardial infarction: Mechanisms and treatment options. J. Cardiol. 2014;64(2):77-85. DOI: 10.1016/j.jjcc.2014.03.008.
- Betgem R.P., de Waard G.A., Nijveldt R., Beek A.M., Escaned J., van Royen N. Intramyocardial haemorrhage after acute myocardial infarction. Nat. Rev. Cardiol. 2015;12(3):156-167. DOI: 10.1038/nrcardio.2014.188.
- Sezer M., van Royen N., Umman B., Bugra Z., Bulluck H., Hausenloy D.J. et al. Coronary microvascular injury in reperfused acute myocardial infarction: A view from an integrative perspective. J. Am. Heart Assoc. 2018;7(21):e009949. DOI: 10.1161/JAHA.118.009949.
- Kandler D., Lücke C., Grothoff M., Andres C., Lehmkuhl L., Nitzche S. et al. The relation between hypointense core, microvascular obstruction and intramyocardial haemorrhage in acute reperfused myocardial infarction assessed by cardiac magnetic resonance imaging. Eur. Radiol. 2014;24(12):3277-3288. DOI: 10.1007/s00330-014-3318-3.
- Zia M.I., Ghugre N.R., Connelly K.A., Strauss B.H., Sparkes J.D., Dick A.J. et al. Characterizing myocardial edema and hemorrhage using quantitative T2 and T2* mapping at multiple time intervals post ST-Segment elevation myocardial infarction. Circ. Cardiovasc. Imaging. 2012;5(5):566-572. DOI: 10.1161/CIRCIMAGING.112.973222.
- Waha S., Patel M.R., Granger C., Ohman B.E.M., Maehara A., Eitel I. et al. Relationship between microvascular obstruction and adverse events following primary percutaneous coronary intervention for STsegment elevation myocardial infarction: An individual patient data pooled analysis from seven randomized trials. Eur. Heart. J. 2017;38(47):3502-3510. DOI: 10.1093/eurheartj/ehx414.
- Kranenburg M.V., Magro M., Thiele H., Waha S., Eitel I., Cochet A. et al. Prognostic value of microvascular obstruction and infarct size, as measured by CMR in STEMI patients. JACC Cardiovasc. Imaging. 2014;7(9):930-939. DOI: 10.1016/j.jcmg.2014.05.010.
- Reinstadler S.J., Stiermaier T., Reindl M., Feistritzer H.-J., Fuernau G., Eitel C. et al. Intramyocardial haemorrhage and prognosis after ST-el-evation myocardial infarction. Eur. Heart. J. Cardiovasc. Imaging. 2019;20(2):138-146. DOI: 10.1093/ehjci/jey101.
- Robbers L.F., Eerenberg E.S., Teunissen P.F.A., Jansen M.F., Hollander M.R., Horrevoets A. et al. Magnetic resonance imaging-defined areas of microvascular obstruction after acute myocardial infarction represent microvascular destruction and haemorrhage. Eur. Heart J. 2013;34(30):2346-2353. DOI: 10.1093/eurheartj/eht100.
- Ndrepepa G., Tiroch K., Keta D., Fusaro M., Fusaro M., Seyfarth M. et al. Predictive factors and impact of no reflow after primary percutaneous coronary intervention in patients with acute myocardial infarction. Circ. Cardiovasc. Interv. 2010;3(1):27-33. DOI: 10.1161/CIRCINTERVEN-TIONS.109.896225.
- Amabile N., Jacquier A., Shuhab A., Gaudart J., Bartoli J.M., Paganelli F. et al. Incidence, predictors, and prognostic value of intramyocardial hemorrhage lesions in ST elevation myocardial infarction. Catheter. Cardiovasc. Interv. 2012;79(7):1101-1108. DOI: 10.1002/ccd.23278.
- Carrick D., Haig C., Ahmed N., McEntegart M., Petrie M.C., Eteiba H. et al. Myocardial hemorrhage after acute reperfused ST-segment elevation myocardial infarction: Relation to microvascular obstruction and prognostic significance. Circ. Cardiovasc. Interv. 2016;9(1):e004148. DOI: 10.1161/CIRCIMAGING.115.004148.
- Ibanez B., James S., Agewall S., Antunes M.J., Bucciarelli-Ducci C., Bueno H. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the anagement of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2018;39(2):119-177. DOI: 10.1093/eurheartj/ ehx393.
- French C.J., Zaman A.K., Kelm R.J., Spees J.L., Sobel B.E. Vascular rhexis: Loss of integrity of coronary vasculature in mice subjected to myocardial infarction. Exp. Biol. Med. (Maywood). 2010;235(8):966-973. DOI: 10.1258/ebm.2010.010108.
- Gertz S.D., Kalan D.M., Kragel A.H., Braunwald E. Cardiac morphologic findings in patients with acute myocardial infarction treated with recombinant tissue plasminogen activator. Am. J. Cardiol. 1990;65(15):953-961. DOI: 10.1016/0002-9149(90)90996-e.
- Fujiwara H., Onodera T., Tanaka M., Fujiwara T., Wu D.J., Kawai C. et al. A clinicopathologic study of patients with hemorrhagic myocardial infarction treated with selective coronary thrombolysis with urokinase. Circulation. 1986;73:749-757. DOI: 10.1161/01.CIR.73.4.749.
- Yunoki K., Naruko T., Inoue T., Sugioka K., Inaba M., Iwasa Y. et al. Relationship of thrombus characteristics to the incidence of angiographically visible distal embolization in patients with STDsegment elevation myocardial infarction treated with thrombus aspiration. JACC Cardiovasc. Interv. 2013;6(4):377-385. DOI: 10.1016/j.jcin.2012.11.011.
- Napodano M., Peluso D., Marra M.P., Frigo A.C., Tarantini G., Buja P. et al. Time dependent detrimental effects of distal embolization on myocardium and microvasculature during primary percutaneous coronary intervention. JACC Cardiovasc. Interv. 2012;5(11):1170-1177. DOI: 10.1016/j.jcin.2012.06.022.
- Вышлов Е.В., Севастьянова Д.С., Крылов А.Л., Марков В.А. Первичная ангиопластика и фармакоинвазивная реперфузия при инфаркте миокарда: влияние на клинические исходы и феномен no-reflow. Кардиоваскулярная терапия и профилактика. 2015;14(1):17-22. DOI: 10.15829/1728-8800-2015-1-17-22. Vyshlov E.V., Sevastyanova D.S., Krylov A.L., Markov V.A. Primary angioplastics and pharmacoinvasive reperfusion in myocardial infarction: impact on clinical outcomes and no-reflow phenomenon Cardiovascular Therapy and Prevention. 2015;14(1):17-22. (In Russ.). DOI: 10.15829/1728-8800-2015-1-17-22.
- Vanhaverbeke M., Bogaerts K., Sinnaeve P.R., Janssens L., Armstrong P.W., van de Wer F. Prevention of cardiogenic shock after acute myocardial infarction. Circulation. 2019;139(1):137-139. DOI: 10.1161/CIRCU-LATIONAHA.118.036536.


