Синдром Реклингхаузена–Энгеля. Скелетное проявление гиперпаратиреоидизма: обзор литературы и клиническое наблюдение
Автор: Васильев Н.В., Вторушин С.В., Хакимов Х.И., Анисеня И.И., Лоос Д.М., Бокова У.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Цель исследования – представить обзор с современными сведениями о номенклатуре и терминологических особенностях синдрома Реклингхаузена–Энгеля (паратиреоидная остеодистрофия), его патогенезе, типичных морфологических и лучевых проявлениях. Уделить особое внимание вопросам дифференциальной диагностики бурой опухоли и гигантоклеточной опухоли скелета. Привеcти клинико-морфологические критерии разграничения этих состояний, систематизированные в виде сравнительной таблицы. Материал и методы. Поиск соответствующих источников производился в системах Medline, PubMed, Elibrary и др. Из 100 найденных исследований 30 были использованы для написания систематического обзора. Приведен клинический случай резецированной бурой опухоли бедренной кости у 58-летнего мужчины с ранее не распознанным гиперпаратиреозом, продемонстрированы особенности морфологического диагноза и динамика заболевания. Результаты. Синдром Реклингхаузена–Энгеля (паратиреоидная остеодистрофия) представляет собой редкое, но клинически важное метаболическое поражение скелета, развивающееся на фоне гиперпаратиреоидизма. Он характеризуется выраженной остеокластической активностью, формированием кистозных очагов, субпериостальной резорбцией и так называемых бурых опухолей. Несмотря на доброкачественную природу, данный синдром часто имитирует агрессивные гигантоклеточные новообразования кости, что создает сложности в интерпретации клинико-рентгенологических и морфологических данных и повышает риск диагностических ошибок. Заключение. Обсуждаются трудности диагностики при отсутствии выраженной клинической симптоматики гиперпаратиреоза и подчеркивается ключевая роль патоморфолога в составе междисциплинарной команды. Своевременное выявление гиперсекреции паратгормона и радикальное удаление гиперплазированной или опухолевой паращитовидной железы обеспечивают регресс изменений костной ткани и благоприятный прогноз.
Гиперпаратиреоидизм, бурая опухоль, остеодистрофия, гигантоклеточная опухоль, остеокластическая резорбция, морфология костной ткани
Короткий адрес: https://sciup.org/140312776
IDR: 140312776 | УДК: 616-006.38.03:616.71:616.447-008.6 | DOI: 10.21294/1814-4861-2025-24-5-198-205
Текст научной статьи Синдром Реклингхаузена–Энгеля. Скелетное проявление гиперпаратиреоидизма: обзор литературы и клиническое наблюдение
Среди множества опухолеподобных сим-птомокомплексов и заболеваний скелета существует системное расстройство костной ткани метаболической природы, именуемое синдромом Реклингхаузена–Энгеля (СРЭ), которое привлекает внимание характерной морфологической картиной и высоким риском диагностической ошибки [1–3]. Синдром Реклингхаузена–Энгеля не является самостоятельным заболеванием, а представляет собой совокупность патологических изменений, сосредоточенных в скелете и возникающих в результате избыточной секреции паратгормона при гипер-паратиреоидизме. Поскольку изменения скелета являются наиболее частым проявлением гиперпа-ратиреоидизма, данный синдром фактически выступает его клинико-морфологическим эквивалентом и первым диагностическим маркером [4, 5]. По данным литературы, около 25 % всех заболеваний костной ткани обусловлены гиперпаратиреоидиз-мом [5–14]. Впервые совокупность этих проявлений была описана Фридрихом Даниэлем фон Реклингхаузеном и Герхардом Энгелем и впоследствии получила их имя [15]. Следует отметить важную терминологическую проблему. Из-за фамилии одного из первоописателей патологического состояния синдром Реклингхаузена–Энгеля часто путают с нейрофиброматозом 1-го типа, также известным как болезнь Реклингхаузена [4, 14, 16–19]. Это два принципиально разных состояния, объединенных лишь фамилией одного автора, описавшего их в 1881 г. и 1882 г. соответственно. В англоязычной литературе термин «синдром Реклингхаузена–Энгеля» практически не употребляется; предпочтение отдается терминам «osteitis fibrosa cystica», «паратиреоидная остеодистрофия» и др. [2, 20, 21]. Среди синонимов также встречаются: фиброзная остеодистрофия, генерализованная болезнь Реклингхаузена, бурая опухоль, гиперпаратиреоидная остеопатия [1, 18, 21, 22]. При этом не все из них корректны с нозологической точки зрения.
Синдром Реклингхаузена–Энгеля – это процесс активной перестройки костной ткани, которая представляет собой мультифакторное костное ремоделирование с выраженным преобладанием резорбтивных процессов над остеогенезом [5]. Гиперсекреция паратгормона стимулирует остео- кластическую активность, нарушая баланс между резорбцией и остеогенезом. В результате развиваются остеопения, деминерализация и кистозная перестройка кости [3, 5, 19, 20, 22, 23]. Поражение скелета может быть очаговым или генерализованным, с предпочтительным поражением длинных трубчатых костей, челюстей, фаланг, черепа [1, 5, 8, 13, 24–26]. Морфологически это проявляется субпериостальными эрозиями, остеолитическими очагами, кистами, микролакунарной остеопенией, остеосклерозом и хондрокальцинозом [5, 22, 23, 25–27]. Ранняя рентгенологическая находка – субпериостальная резорбция фаланг является специфичным диагностическим признаком [19]. Наиболее значимым маркером СРЭ является формирование бурой опухоли – гигантоклеточного образования, содержащего остеокластоподобные клетки, гемосидерофаги и элементы кровоизлияния, которое чаще всего встречается у женщин старше 50 лет [1, 3, 10, 12, 16, 20, 23, 26, 27]. Несмотря на доброкачественную природу, бурая опухоль может клинически и морфологически имитировать истинные опухоли (центральную гигантоклеточную гранулему, аневризмальную кисту и др.) [4, 6, 7, 15, 17, 19, 28].
Гиперпаратиреоидизм приводит к глубокой перестройке костной ткани за счет активации остеокластической резорбции. Паратгормон (ПТГ) активирует остеобласты, которые экспрессируют лиганды RANKL, взаимодействующие с рецепторами RANK на остеокластах-предшественниках, стимулируя их дифференцировку и пролиферацию [19]. В этих условиях развивается несбалансированный процесс костного ремоделирования, при котором костеобразование не успевает за резорбцией. Это ведет к потере костной массы, деминерализации и замещению кости фиброзной тканью. Морфологически это проявляется в виде остеопении, остеопороза, очагов кистозной перестройки, субпериостальной резорбции, остеосклероза в участках реактивного ремоделирования. В патологических очагах часто выявляются гигантские многоядерные клетки типа остеокласта, геморрагические включения, сидерофаги, фиброзная строма и деструкция структур зрелой костной ткани [18, 23, 26]. Патогенез СРЭ тесно связан не только с первичным гиперпаратиреозом, но и с вторичным – при хронической почечной недостаточности, где механизм обусловлен гипофосфатемией и снижением синтеза витамина D, вызывающим компенсаторную гиперсекрецию ПТГ. В этих случаях изменения могут носить более генерализованный характер [2, 24, 25].
Диагностика СРЭ основывается на сочетании клинико-инструментальных и морфологических данных. Проявления СРЭ нередко трактуются как признаки опухолевого поражения скелета, особенно при отсутствии данных об эндокринной патологии в анамнезе. Обычно пациенты предъ- являют жалобы на боли в костях, патологические переломы, деформации скелета. Нередко возникают множественные остеолитические очаги, выявляемые при рентгенографии, КТ или МРТ, что создает основу для ложного онкологического диагноза. Особую сложность представляет диагностика изолированной бурой опухоли, когда отсутствует выраженная клиническая симптоматика гиперпаратиреоза, а образование трактуется как гигантоклеточная опухоль или остеосаркома [4, 20, 24, 25].
Лабораторная диагностика включает определение уровня общего и ионизированного кальция в сыворотке крови, уровня фосфора, активности щелочной фосфатазы и, главным образом, концентрации паратгормона. При первичном гиперпаратиреозе характерны гиперкальциемия, гипофосфатемия и высокий уровень ПТГ [7, 18, 22, 28]. При вторичном гиперпаратиреозе уровень кальция может оставаться в пределах нормы или быть пониженным, тогда как ПТГ значительно повышен [10, 24].
Лучевая диагностика играет важнейшую роль: рентгенография выявляет субпериостальные эрозии фаланг, кистозные очаги в длинных костях и челюстях, остеопению, остеолиз и остеосклероз. КТ и МРТ позволяют визуализировать степень разрушения кости, оценить структуру и границы патологических очагов. Для выявления гиперфунк-ционирующей паращитовидной железы используется сцинтиграфия с 99мТс [7, 16, 22, 26].
Гистологическое исследование при бурой опухоли выявляет гигантские многоядерные клетки типа остеокласта, кровоизлияния, отложение гемосидерина, фиброзную строму и разрушения предсуществующей кости, что требует исключения гигантоклеточной опухоли, центральной гигантоклеточной гранулемы, аневризмальной кисты и др. [6, 7, 20, 28–30].
Важнейшей задачей является дифференциальная диагностика бурой опухоли и истинных гигантоклеточных новообразований скелета. Бурая опухоль может имитировать гигантоклеточную опухоль кости, центральную гигантоклеточную гранулему, аневризмальную костную кисту, фиброзную дисплазию и даже остеолитические метастазы [4, 6, 16, 19, 26]. Ключевыми признаками, позволяющими провести разграничение между этими состояниями, являются клинико-лабораторные данные, множественность поражений и системный характер изменений при бурой опухоли.
При морфологическом сходстве бурой опухоли и гигантоклеточной опухоли кости (ГКО), особенно в условиях ограниченной клинической информации, иммуногистохимическое исследование может выполнить вспомогательную роль. Оба процесса содержат многоядерные остеокластоподобные клетки и стромальные мононуклеарные элементы, что делает неспецифические маркеры
Таблица/table
Клинико-морфологические различия между бурой опухолью и гигантоклеточной опухолью differences in clinical and morphological characteristics between brown tumor and giant cell tumor
|
Признак/Characterictics |
Бурая опухоль/Brown tumor |
Гигантоклеточная опухоль/ Giant cell tumor |
|
Возраст пациента/Patient age |
>50 лет, чаще женщины/ >50 years, more common in women |
20–40 лет, без гендерных различий/ 20–40 years, no gender predilection |
|
Этиология/Etiology |
Вторична, на фоне гиперпаратиреоза/ Secondary, due to hyperparathyroidism |
Первичное новообразование/ Primary bone neoplasm |
|
Количество очагов/ Number of Lesions |
Часто множественные/ Often multiple |
Обычно одиночное/ Usually solitary |
|
Локализация/Location |
Любые кости, особенно челюсти, ребра/ Any bone, particularly jaws, ribs |
Эпифизы длинных трубчатых костей/ Epiphyses of long tubular bones |
|
Клиника/Clinical presentation |
Системные симптомы, гиперкальциемия/ Systemic symptoms, hypercalcemia |
Местная боль, припухлость/ Local pain, swelling |
|
Уровень ПТГ и кальция/ PTH and Cclcium levels |
Повышен/ Elevated |
В норме/ Normal |
|
Морфология/Morphology |
Остеокластоподобные клетки, гемосидерин/ Osteoclast-like cells, hemosiderin deposits |
ГКО, фиброзная строма, митозы/ Mononuclear stromal cells, fibrous stroma, mitoses |
|
ИГХ: H3F3A G34W/ IHC: H3F3A G34W |
Отрицательно/ Negative |
Положительно (в стромальных клетках)/ Positive (in stromal cells) |
|
ИГХ: p63/IHC: p63 |
Отрицательно/ Negative |
Положительно (в стромальных клетках)/ Positive (in stromal cells) |
|
ИГХ: CD68/IHC: CD68 |
Положительно (в гигантоклеточных элементах)/ Positive (in giant cell elements) |
Положительно (в гигантоклеточных элементах)/ Positive (in giant cell elements) |
Примечание: таблица составлена авторами.
Note: created by the authors.
(например, CD68, RANK) малоинформативными. Наиболее значимым иммуногистохимическим маркером является моноклональное мутационноспецифическое антитело к H3F3A G34W, выявляющее мутацию в гене H3.3, характерную для истинной ГКО [21]. Дополнительным дифференциальным параметром может служить маркер p63, также экспрессируемый в стромальных клетках гигантоклеточной опухоли и отсутствующий в бурой опухоли [29]. В таблице приведено сравнение основных характеристик бурой опухоли и ГКО.
Дифференциальная диагностика бурой опухоли и солидного варианта аневризмальной костной кисты сосредоточена на поиске характерных для последней микрокистозных полостей, выстланных уплощенными фибробластами, выполненных кровью и, зачастую, с незрелыми костными трабекулами в стенке полости [4, 22, 30].
Отсутствие детальных характеристик гистологической картины фиброзной дисплазии позволит исключить диагноз бурой опухоли: наличие в фиброзной строме регулярных трабекул незрелой кости, как правило, без остеобластического ободка, визуально напоминающих «китайские иероглифы» (изогнутые трабекулы в виде «C» и «S»). Кроме того, фиброзная дисплазия чаще всего (до 80 %) носит моностозный характер [4, 22].
Основным патогенетическим методом лечения СРЭ является хирургическое удаление гиперпла- зированной или опухолево-измененной паращитовидной железы как источника гиперсекреции паратгормона, что ведет к нормализации уровня кальция, фосфора и паратиреоидного гормона в сыворотке крови [7, 11, 25, 26]. После устранения гормонального дисбаланса костные поражения, включая бурые опухоли, как правило, подвергаются обратному развитию в течение нескольких месяцев. Наличие множественных бурых опухолей не является показанием для ортопедических вмешательств, за исключением случаев патологических переломов или значительных деформаций скелета [16, 24]. Прогноз при СРЭ благоприятный при своевременной диагностике и оперативном лечении. При затянувшемся течении возможны осложнения, требующие комплексного наблюдения и коррекции метаболических нарушений.
Для иллюстрации диагностических и морфологических особенностей бурой опухоли представляем клинический случай из практики.
Клиническое наблюдение
Пациент Ф., 58 лет, обратился в НИИ онкологии Томского НИМЦ в 2018 г. с жалобами на периодические боли в области левого бедра, преимущественно при физической нагрузке, которые наблюдались в течение 2 лет.
При рентгенографии коленного сустава (рис. 1) в дистальном метадиафизе бедренной кости
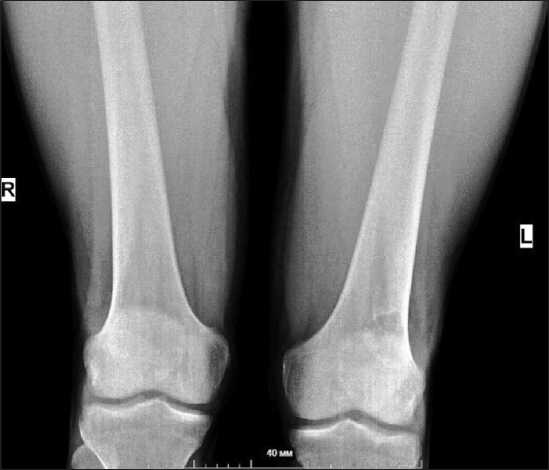
Рис. 1. Рентгенография коленного сустава. Участок деструкции кости по медиальной поверхности наружного мыщелка левой бедренной кости.
Примечание: рисунок выполнен авторами
Fig. 1. Knee joint radiography. An area of bone destruction is seen on the medial aspect of the lateral condyle of left femur. Note: created by the authors
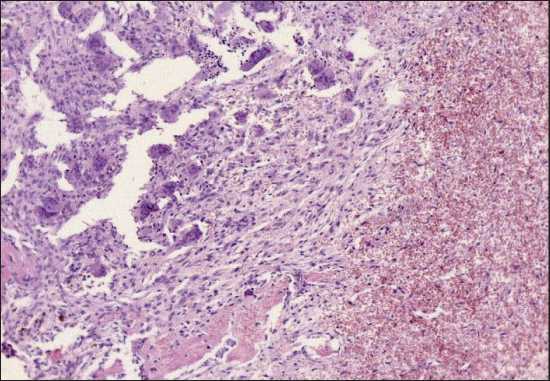
Рис. 2. Микрофото. Бурая опухоль. Очаговое скопление гигантских многоядерных остеокластоподобных клеток по периферии зоны кровоизлияния. Окраска гематоксилином и эозином, ×100. Примечание: рисунок выполнен авторами Fig. 2. Microphoto. Brown Tumor. Focal aggregation of giant multinucleated osteoclast-like cells at the periphery of a hemorrhagic area.
Hematoxylin and eosin stain, ×100. Note: created by the authors
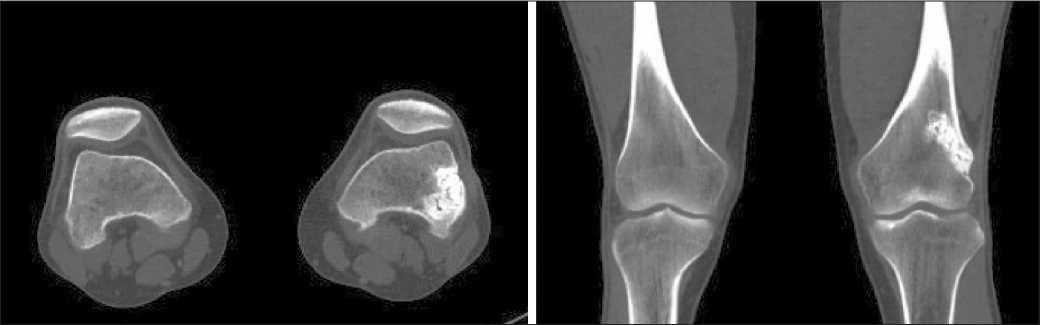
Рис. 3. СКТ коленного сустава. Зона реконструкции и ремоделирования в области ранее резецированного участка кости слева. Примечание: рисунок выполнен авторами
Fig. 3. Computed tomography of the knee. An area of bone reconstruction and remodeling at the site of the previous bone resection of left knee. Note: created by the authors
слева, медиальнее наружного мыщелка, визуализировался участок смешанной деструкции с размытыми контурами. В дифференциальный диагноз включались: гигантоклеточная опухоль, внутрикостная киста, фиброма, фиброзная дисплазия, хондрома. 21.03.18 выполнена малоинвазивная рентген-видео-ассистированная резекция пораженного участка с криодеструкцией стенок полости и аллопластикой дефекта. Послеоперационный период протекал без осложнений.
Гистологическое исследование (№ 8005–07, от 27.03.18): бурая опухоль, представленная очагами скопления гигантских многоядерных остеокластоподобных клеток по периферии зоны кровоизлияния (рис. 2). При иммуногистохимическом исследовании с антителом к p63 (клон DAK-p63, RTU, Dako) окрашивание в стромальных клетках не определялось.
После операции выявлено значительное повышение уровня паратгормона – до 410 пг/мл (при норме 15–65 пг/мл), что подтвердило наличие гиперпаратиреоза. При эндокринологическом обследовании выявлена аденома в левой нижней паращитовидной железе. Направлен на лечение в эндокринологическое отделение с последующим хирургическим удалением новообразования. Через 10 дней после эндокринологической операции уровень ПТГ снизился до 122 пг/мл, через 1 мес – до 68 пг/мл, через 2 мес он стабилизировался в пределах нормы – 42 пг/мл.
Через год после операции пациент не предъявлял жалоб: движения в коленном суставе сохранялись в полном объеме, ходьба без опоры, походка ровная. Послеоперационный рубец – без особенностей. При КТ-контроле – признаки репаративного ремоделирования и аллопластики в зоне ранее выявленного литического очага (рис. 3).


