Синтетические биоматериалы на основе гидроксиапатита и трикальцийфосфата: анализ текущих клинических испытаний
Автор: Мухаметов У.Ф., Ивлиев Д.С., Гареев И.Ф., Люлин С.В., Борзунов Д.Ю.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.30, 2024 года.
Бесплатный доступ
Введение. На сегодняшний день в области травматологии и ортопедии, нейрохирургии и челюстно-лицевой хирургии (ЧЛХ) в качестве заменителя костных трансплантатов было предложено и использовано большое количество разнообразных синтетических материалов, включая металлы, полимеры и керамику. Однако наиболее изученными материалами являются кальций-фосфатная керамика (КФК), в частности гидроксиапатит и трикальцийфосфат, а также их смеси, называемые двухфазными фосфатами кальция. Интерес связан с тем, что основным компонентом кости является апатитовый минерал фосфат кальция. Гидроксиапатит и трикальцийфосфат являются одними из наиболее часто используемых и эффективных синтетических заменителей костных трансплантатов. Они обладают не только остеокондуктивными свойствами, но и остеоиндуктивными. Эти свойства в сочетании с клеточно-опосредованной резорбцией обеспечивают полную регенерацию костных дефектов. В данном исследовании проведен анализ существующих клинических испытаний использования гидроксиапатита и трикальцийфосфата в области травматологии и ортопедии, нейрохирургии и ЧЛХ, зарегистрированных на сайте clinicaltirals.gov.Цель работы - выявить потенциал клинического применения, а также возможные побочные эффекты КФК в качестве замены костным трансплантатам.Материалы и методы. Стратегия поиска заключалась в использовании материала с веб-сайта clinicaltrials.gov, в котором основное внимание уделялось ключевым терминам как: hydroxyapatite, tricalcium phosphate, hydroxyapatite and tricalcium phosphate, traumatology and orthopedics, maxillofacial surgery, dentistry, neurosurgery, bone, и diseases of the musculoskeletal system.Результаты и обсуждение. К ноябрю 2022 года было зарегистрировано около 85 клинических испытаний по использованию гидроксиапатита, около 49 клинических испытаний по использованию трикальцийфосфата и около 16 клинических работ по использованию комбинации гидроксиапатит/трикальцийфосфат. Большинство исследований относятся к Фазе 1-2, Фазе 2 или Фазе 4. Большинство из них были сосредоточены на таких направлениях как терапия травм большеберцовой кости, остеопороз/остеопения, резорбция альвеолярной кости и хирургия позвоночника. Полноценные результаты были опубликованы только для 12 клинических испытаний по применению гидроксиапатита, трикальцийфосфата и их комбинации (3, 7 и 2). Все клинические испытания имеют схожие методы подготовки, и все из данных клинических испытаний дали положительные результаты без серьезных побочных эффектов.Заключение. Комбинация гидроксиапатита и трикальцийфосфата имеет множество преимуществ. Использование гидроксиапатита и трикальцийфосфата отдельно или в комбинации не имеет никаких серьезных побочных эффектов. Результаты будущих доклинических и клинических исследований по использованию гидроксиапатита и трикальцийфосфата помогут дополнительно изучить их клинический потенциал.
Гидроксиапатит, трикальцийфосфат, заболевания опорно-двигательного аппарата, терапия, анализ, клинические испытания
Короткий адрес: https://sciup.org/142240812
IDR: 142240812 | УДК: 616.71-77 | DOI: 10.18019/1028-4427-2024-30-1-76-89
Текст научной статьи Синтетические биоматериалы на основе гидроксиапатита и трикальцийфосфата: анализ текущих клинических испытаний
Костная ткань обладает замечательной способностью к регенерации и восстановлению в процессе физиологического ремоделирования или в ответ на повреждение. В ряде ситуаций восстановление костной ткани не может произойти спонтанно вследствие определённых (неблагоприятных) локальных причин (повреждение сосудов, инфекция и др.), формирования костного дефекта критического размера, системных причин или их сочетания [1, 2]. Ряд хирургических вмешательств для стимуляции регенерации костной ткани подразумевает использование «биологической поддержки» в виде костного трансплантата или заменителя, природного или синтетического [3-6]. «Золотым стандартом» костной пластики остается аутогенная костная пластика (аутотрансплантат). Только аутотрансплантат обеспечивает наиболее желательные свойства биоматериала, включая остеокон-дукцию, остеоиндукцию и остеогенез [7-9]. Однако при получении костных аутотрансплантатов требуются дополнительные хирургические вмешательства, что может привести к осложнениям, и, что немаловажно, объем аутологичной костной ткани всегда ограничен. Использование аллотрансплантатов может решить ряд проблем, связанных с применением аутотрансплантатов, но оно также вызывает некоторые опасения, такие как риск передачи инфекций, иммунологические реакции реципиента, потеря биологических и механических свойств вследствие их обработки, повышенная стоимость и недостаточная доступность [10, 11]. Повышенная биологическая безопасность является желательной характеристикой синтетических костных трансплантатов. Приблизительно 60 % синтетических заменителей костной ткани, доступных в настоящее время, являются керамическими биоматериалами [12]. Один из их ярких представителей – кальций-фосфатная керамика (КФК), характеризующаяся химическим составом, близким к минеральной фазе кальцинированной ткани, а именно к гидроксиапатиту кальция [13]. Кроме того, можно контролировать состав необработанного продукта, регулируя соотношение кальция и фосфата (Ca/P) [13]. Гидроксиапатит и трикальцийфосфат являются наиболее широко используемыми, главным образом, в комбинации в так называемой двухфазной керамике из фосфата кальция [14, 15]. Гидроксиапатит и трикальцийфосфат являются одними из наиболее распространенных биоактивных материалов, применяемых в настоящее время в нейрохирургии, ортопедической и стоматологической хирургии [16-18]. Этот класс материалов может быть синтезирован в соответствии с несколькими протоколами, такими как реакции в твердом состоянии, золь-гель, методы осаждения, методы эмульсий, гидротермальные реакции, механохимические методы, гидролиз других фосфатов кальция и химическое осаждение из паровой фазы [19, 20].
Многочисленные исследования продемонстрировали способность гидроксиапатита стимулировать образование новой кости in vivo , поэтому этот материал обычно считается остеоиндуктивным [21]. Образование новой кости без добавления костных морфогенетических белков или остеогенных клеток во внескелетных участках также наблюдалось при использовании трикальцийфосфата [22]. Однако следует подчеркнуть, что в настоящее время некоторые механизмы, лежащие в основе остеоиндукции, до конца не изучены. Это свойство действительно нетривиально связано с химическим составом и кристалличностью материала, с его стехиометрией, поведением при растворении/осаждении, химией поверхности и зарядом, а также микропористостью и шероховатостью. И гидроксиапатит, и трикальцийфосфат были широко использованы в качестве костных наполнителей в виде порошков, цементов, плотных и пористых тел, дисков и гранул во многих клинических испытаниях еще в 80-х годах прошлого столетия [23]. Гидроксиапатит также использовали для создания биоактивных покрытий на металлических имплантатах, с целью повышения биомиметического отклика таких протезов [24]. На сегодняшний день единственным коммерчески приемлемым методом нанесения таких покрытий является плазменное напыление.
Трикальцийфосфат имеет три признанных полиморфа: 1) β -трикальцийфосфат, который стабилен при температуре ниже 1125 °C; 2) α -трикальцийфосфат, который стабилен между 1125 °С и 1400 °С, и 3) α '-трикальцийфосфат, который может быть стабилен при температуре выше 1430 °C [14, 15]. α -трикальцийфосфат и β -трикальцийфосфат имеют разную скорость растворения в организме, и их можно использовать вместе в соответствующих комбинациях [25]. α -трикальцийфосфат и α '-трикальцийфосфат имеют более низкую теоретическую плотность, чем гидроксиапатит, однако β -трикальцийфосфат более предпочтителен для биомедицинских применений вследствие его механических характеристик, химической стабильности и скорости резорбции [26].
Еще одна важная область исследований биоматериалов на основе CaP была сосредоточена на двухфазных фосфатах кальция (BCP – biphase calcium phosphates). Согласно определению, BCP состоит из двух отдельных фаз CaP: чаще всего из более стабильной фазы гидроксиапатита и более растворимой фазы β-трикальцийфосфата в разных пропорциях [27]. Эта комбинация имеет значительные преимущества по сравнению с другими типами биокерамики CaP, позволяя лучше контролировать биологическую активность и биодеградацию, что гарантирует стабильность биоматериала и способствует остеоин- теграции новообразованной костной ткани в имплант. Комбинация гидроксиапатит/трикальцийфос-фат обладает остеокондуктивными свойствами c возможностью приобретения остеоиндуктивных свойств [28, 29].
К ноябрю 2022 года на сайте clinicaltrials.gov размещено около 85 зарегистрированных клинических испытаний использования гидроксиапатита отдельно или в комбинации с другими биоматериалами в травматологии и ортопедии, челюстно-лицевой хирургии (ЧЛХ) и нейрохирургии. По использованию трикальцийфосфата было зарегистрировано 49 клинических испытаний в тех же областях медицины. Однако только в пяти из этих клинических испытаний опубликованы полноценные результаты с использованием гидроксиапатита и в семи – трикальцийфосфата. Кроме того, имеются 16 клинических испытаний с применением комбинации гидроксиапатита/трикальцийфосфата, с преобладанием того или иного синтетического биоматериала, из них два клинических испытания с результатами.
В данном исследовании проведен анализ различного применения синтетических биоматериалов (ги-дроксиапатитные и трикальцийфосфатные композиты) в травматологии и ортопедии, челюстно-лицевой хирургии и нейрохирургии, особое внимание мы уделили соответствующим методам синтеза и обработки композитов гидроксиапатита и трикальцийфосфата, а также условиям их хранения.
Цель работы – выявить потенциал клинического применения кальций-фосфатной керамики в качестве замены костным трансплантатам, а также возможные побочные эффекты использования.
МАТЕРИАЛЫ И МЕТОДЫ
Стратегия поиска
Мы провели всесторонний поиск клинических испытаний, демонстрирующих использование композитов гидроксиапатита и трикальцийфосфата по отдельности или в комбинации в качестве эффективных синтетических костных заменителей при различных патологических состояниях опорно-двигательной системы. Базы данных, включая сайт clinicaltirals.gov , были использованы для получения всех соответствующих клинических испытаний. Поисковые слова: hydroxyapatite, tricalcium phosphate, hydroxyapatite and tricalcium phosphate, traumatology and orthopedics, maxillofacial surgery, dentistry, neurosurgery, bone и diseases of the musculoskeletal system. Для выбора исследований мы использовали следующие критерии включения и исключения, которые были разделены на два этапа.
Этап 1:
-
1) клинические испытания на людях с использованием гидроксиапатита и трикальцийфосфата;
-
2) клинические испытания с 1 по 4 фазы:
-
а) расположение;
-
б) область применения;
-
в) фаза;
-
г) статус исследования.
Этап 2:
-
1) клинические испытания, результаты которых были опубликованы;
-
2) фазы клинических испытаний с выбранными критериями исследования для проведения статистического анализа:
-
а) область применения;
-
б) лечение;
-
в) модель вмешательства;
-
г) источник;
-
д) методы выделения и обработки;
-
е) результаты.
Выбор клинических испытаний
После применения критериев включения и исключения на первом этапе было исключено в общей сложности 67 клинических испытаний с использованием гидроксиапатита, 29 клинических испытаний с использованием трикальцийфосфата и 12 клинических испытаний с использованием комбинации гидроксиапатит / трикальцийфосфат, так как имелись работы, которые либо находились на ранней фазе 1, либо фаза не была указана, либо имели неприменимую фазу (примечание: за исключением тех, у которых есть результаты). Мы проанализировали оставшиеся клинические испытания (18, 20 и 4 соответственно) по области их применения, фазе, статусу и местоположению. Для второго этапа было отобрано только 12 клинических испытаний с использованием гидроксиапатита и трикальцийфосфата по отдельности или в их комбинации (3, 7 и 2 соответственно), поскольку они соответствовали заявленным критериям данного исследования (рис. 1).
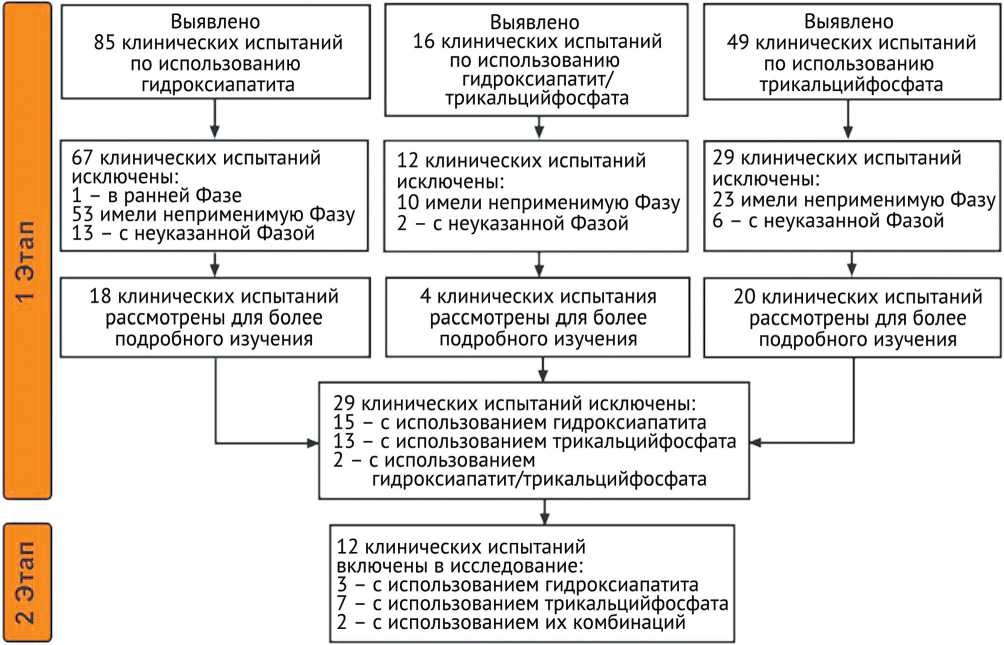
Рис. 1. Дизайн исследования
Коммерческие продукты
Из данных сайта clinicaltirals.gov было идентифицировано около двадцати трех основных коммерческих продуктов костных трансплантатов (скаффолдов): OsteoGen™, NanoBone®, Kyphos FS™, KYPHON ActivOs®, Ossix™, Bio-Oss®, CERAMENT® G, Siloss®, i-FactorTM, ReproBone®, AllogenixTM, Straumann BoneCeramic®, CustomBone, OsteoGen® Plug, CERVIOS chronOS™, AttraX® Putty, chronOS®, Easy-graft®CLASSIC, NovoMax™, Guidor®, Guidor easy-graft® CRYSTAL, PD VitalOs cement®, Neofuse®, которые могут отличаться составом друг от друга, т.е. содержать в своем составе гидроксиапатит или трикальцийфосфат, или же данные синтетические биоматериалы применяли дополнительно. Кроме того, были обнаружены четыре костных трансплантата, усиленных фактором роста, и два ксеногибридных костных трансплантата, усиленных пептидами.
Статистический анализ
Был применен t-критерий, ANOVA, анализ chi-square или критерий Манна – Уитни. Вероятность p value < 0,05 (*), < 0,01 (**), или < 0,001 (***) будет считаться статистически значимой. Статистический анализ выполнен с помощью программного обеспечения IBM SPSS 22.0, а графики получены с использованием Graphpad Prism 7.0.
РЕЗУЛЬТАТЫ
Статистика зарегистрированных клинических испытаний по использованию гидроксиапатита и трикальцийфосфата
Применение синтетических биоматериалов является относительно новой областью, имеющей большой потенциал для решения многих серьезных проблем в нейрохирургии, травматологии и ортопедии и ЧЛХ (рис. 2). Чтобы полностью использовать этот потенциал, могут потребоваться дополнительные исследования, но уже сейчас есть уверенность, что достигнут значительный прогресс в изучении эффективности использования гидроксиапатита и трикальцийфосфата в данных областях медицины (рис. 3).

Рис. 2. Наиболее часто встречаемые патологии, при лечении которых в качестве костных заменителей используют гидроксиапатит и трикальцийфосфат
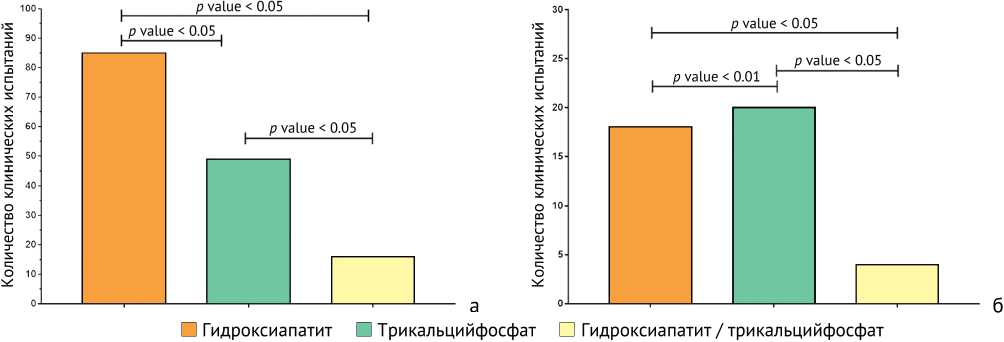
Рис. 3. Сравнительный анализ клинических испытаний по использованию гидроксиапатита, трикальцийфосфата и их комбинации: а – гидроксиапатит vs. трикальцийфосфат vs. гидроксиапатит / трикальцийфосфат при первом этапе данного исследования, 85, 49 и 16 клинических испытаний ( p value < 0,05 и p value < 0,01); б – гидроксиапатит vs. трикальцийфосфат vs. гидроксиапатит / трикальцийфосфат после критериев включения и исключения при первом этапе данного исследования, 18, 20 и 4 клинических испытаний ( p value < 0,05 и p value < 0,01)
На момент выполнения исследования (ноябрь 2022 года) в мире было зарегистрировано 85 клинических испытаний с использованием гидроксиапатита и 49 – с использованием трикальцийфосфата. Также проведены 16 клинических испытаний с использованием комбинации гидроксиапатит / трикальцийфосфат для изучения их клинического применения при заболеваниях опорно-двигательной системы. Число зарегистрированных клинических испытаний значительно увеличилось с тех пор, как 15 ноября 2005 г. было сообщено об их первом официальном использовании и 11 сентября 2006 г. – о регистрации на сайте clinicaltrials.gov (рис. 4).
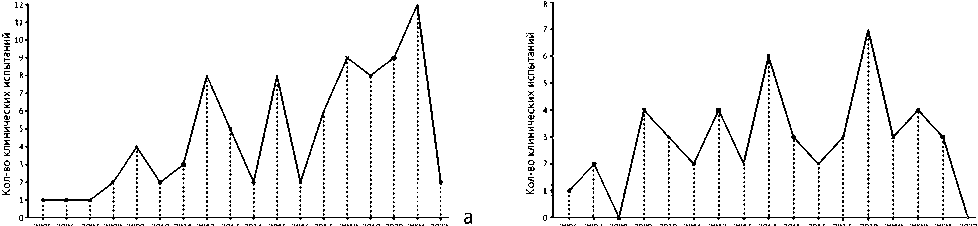
Рис. 4. Статистика зарегистрированных клинических испытаний по проверке клинического потенциала в соответствии с динамикой временных (годовых) регистраций с момента начала первого клинического испытания, зарегистрированного на сайте clinicaltrials.gov: а – гидроксиапатитных композитов; б – трикальцийфосфатных композитов; в – комбинации гидроксиапатит / трикальцийфосфатных композитов
2005 2006 2007 2008 2009 2010 2011 2012 2015 2014 2015 2016 2017 2018 2019 2020 2021 2022
Годы
2006 2007 2008 2009 2010 2011 2012 2015 2014 2015 2016 2017 2018 2019 2020 2021 2022
Годы
б
2009 2010 2011 2012 2015 2014 2015 2016 2017 2018 2019 2020 2021 2022
Годы
в
Особенности клинических испытаний
С учетом критериев включения и исключения было проанализировано 42 клинических испытания с использованием гидроксиапатита, трикальцийфосфата и с их комбинацией (18, 20 и 4 соответственно). Причины исключения на первом этапе исследования клинических испытаний (рис. 5) были следующими: 53 (79,1 %), 23 (79,1 %) и 10 (83,3 %) клинических испытаний имели неприменимую фазу, 13 (19,4 %), 6 (20,9 %) и 2 (16,7 %) клинических испытаний были с неуказанной фазой. Кроме того, было одно клиническое испытание с использованием гидроксиапатита в ранней фазе.
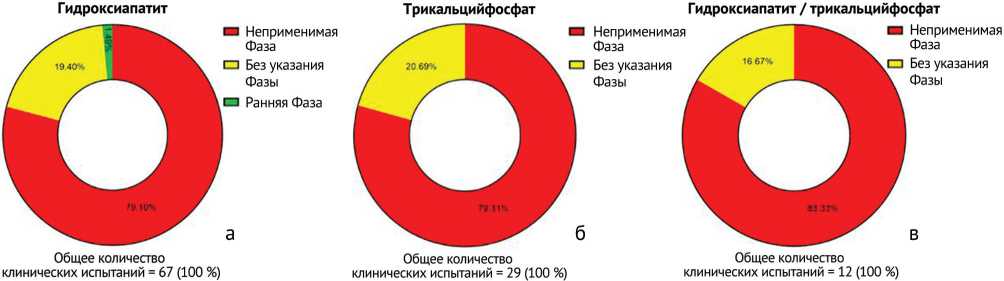
Рис. 5. Причины исключения на первом этапе исследования клинических испытаний по применению: а – гидроксиапатита, б – трикальцийфосфата; в – комбинации гидроксиапатит / трикальцийфосфата
Клинические испытания с использованием гидроксиапатита представлены по 6 фазам (рис. 6, а), с использованием трикальцийфосфата – по 5 фазам (рис. 6, б), с использованием комбинации гидроксиапатит / трикальцийфосфата – по 2 фазам (рис. 6, в).
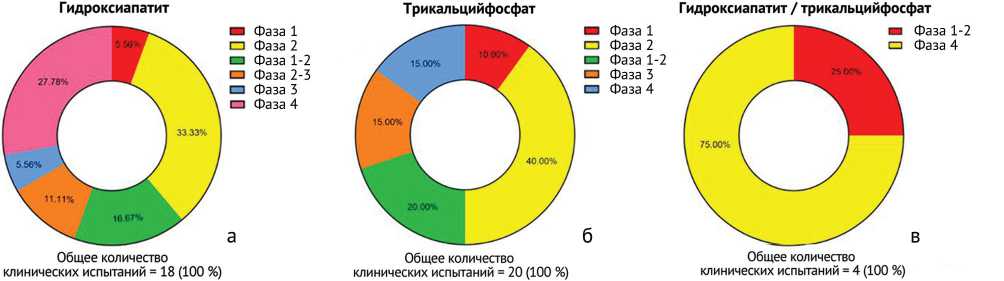
Рис. 6. Распределение по фазам зарегистрированных клинических испытаний по применению: а – гидроксиапатита, б – трикальцийфосфата; в – комбинации гидроксиапатит / трикальцийфосфата
Однако из этого небольшого количества клинических испытаний только по 12 опубликовали полноценные результаты (3, 7 и 2 соответственно).
Зарегистрированные статусы клинических испытаний: не начали набор пациентов; набирают пациентов; активные, но еще нет набора пациентов; прекращены; завершены; отозваны и имеют неизвестный статус (рис. 7).
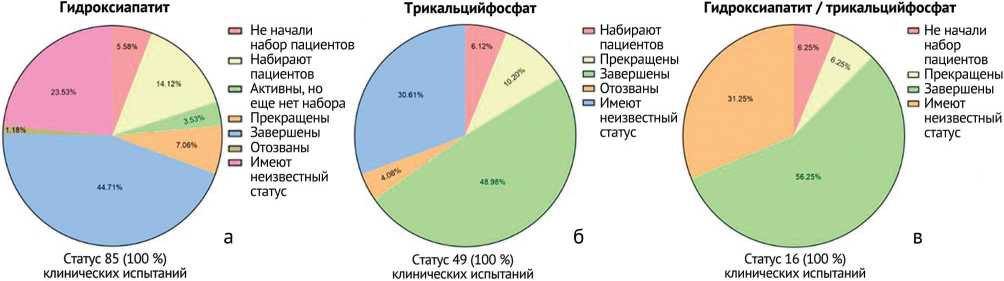
Что касается статуса анализируемых 42 клинических испытаний, то клинические испытания с использованием гидроксиапатита в основном завершены (50 % от 18 клинических испытаний), с использованием трикальцийфосфата в большей доле завершены (40 % от 20) и имеют неизвестный статус (40 % от 20), с использованием комбинации гидроксиапатит / трикальцийфосфат в основном завершены (75 % от 4 клинических испытаний) (рис. 8).
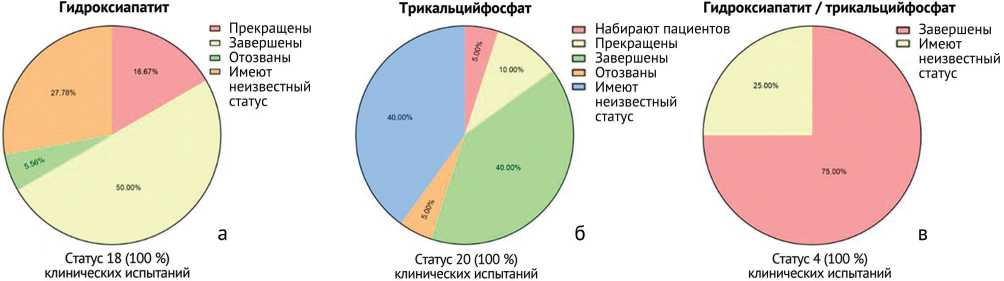
Рис. 8. Распределение в зависимости от прогресса анализируемых клинических испытаний по применению: а – гидроксиапатита, б – трикальцийфосфата; в – комбинации гидроксиапатит / трикальцийфосфата
Географическое распределение
Анализируемые 42 клинических испытания с гидроксиапатитом и трикальцийфосфатом в настоящее время проводят в 19 странах. США, Швейцария, Иран и Индия лидируют по количеству клинических испытаний с гидроксиапатитом, Испания, США и Россия – по количеству испытаний с трикальцийфосфатом. Распределение по количеству клинических испытаний с комбинацией гидроксиапатит / трикальцийфосфат равномерное (табл. 1).
Таблица 1
Распределение клинических испытаний по регионам
|
Страна |
Количество испытаний |
|||||||||
|
Всего |
гидроксиапатит |
трикальцийфосфат |
комбинации гидроксиапатит / трикальцийфосфат |
|||||||
|
абс. |
% |
фазы |
абс. |
% |
фазы |
абс. |
% |
фазы |
||
|
США |
5 |
2 |
11,0 |
4 |
3 |
15,0 |
1, 3 и 1-2 |
|||
|
Испания |
4 |
1 |
5,6 |
1-2 |
3 |
15,0 |
1 и 2 |
|||
|
Австрия |
3 |
1 |
5,6 |
1-2 |
1 |
5,0 |
1-2 |
1 |
25,0 |
1-2 |
|
Египет |
3 |
1 |
5,6 |
2 |
1 |
5,0 |
2 |
1 |
25,0 |
4 |
|
Бразилия |
2 |
1 |
5,6 |
2-3 |
1 |
25,0 |
4 |
|||
|
Германия |
2 |
1 |
5,6 |
3 |
1 |
5,0 |
2 |
|||
|
Индия |
2 |
2 |
11,0 |
2 |
||||||
|
Иран |
2 |
2 |
11,0 |
2 |
||||||
|
Россия |
2 |
2 |
10,0 |
2 и 1-2 |
||||||
|
Швейцария |
3 |
2 |
11,0 |
2 и 4 |
1 |
5,0 |
4 |
|||
|
Южная Корея |
2 |
1 |
5,6 |
4 |
1 |
25,0 |
4 |
|||
|
Бельгия |
1 |
1 |
5,0 |
4 |
||||||
|
Венгрия |
1 |
1 |
5,0 |
2 |
||||||
|
Индонезия |
1 |
1 |
5,6 |
1 |
||||||
|
Мексика |
1 |
1 |
5,0 |
3 |
||||||
|
Сингапур |
1 |
1 |
5,0 |
2 |
||||||
|
Франция |
1 |
1 |
5,6 |
1-2 |
||||||
|
Швеция |
1 |
1 |
5,6 |
2-3 |
||||||
|
США + Австрия + Канада + Англия |
2 |
1 |
5,6 |
4 |
1 |
5,0 |
3 |
|||
|
Неизвестно |
3 |
3 |
15,0 |
2, 1-2, 4 |
||||||
|
Итого |
42 |
18 |
100 |
20 |
100 |
4 |
100 |
|||
Выводы из методик / протоколов, используемых для клинического применения гидроксиапатита и трикальцийфосфата
В результате было выявлено, что гидроксиапатит и трикальцийфосфат применяют во множестве различных композиционных и структурных форм, включая стехиометрические, кальций-дефицитные и ионно-замещенные, плотные и пористые, нанокристаллические и микрокристаллические, коллоидные, гранулированные и монолитные. Каждая из этих форм обладает специфическими свойствами и вызывает уникальные биологические реакции. Наноструктурированные и нанокристаллические СаР являются традиционным материалом, применяемым в биоинженерии костной ткани. Среди примерно дюжины различных фаз CaP синтетический гидроксиапатит и трикальцийфосфат вследствие их высокого сходства с натуральной костью наиболее часто использовали в качестве заменителя костной ткани. Поэтому по сравнению с другими CaP-материалами количество клинических исследований использования гидроксиапатита и трикальцийфосфата наибольшее.
Существуют протоколы с включением гидроксиапатита в полимеры шелка. Этот тип композитного материала проявлял более высокую склонность к клеточной адгезии и способность к остеогенной дифференцировке по сравнению с его отдельными компонентами. Кроме того, чтобы облегчить связь между скаффолдом и тканью хозяина, гидроксиапатит использовали не только в качестве объемного компонента скаффолда, но и в качестве поверхностного покрытия. В этой форме гидроксиапатит может ингибировать высвобождение некоторых соединений или элементов, ограниченных объемной структурой материала. Для ингибирования высвобождения неорганического полифосфата с поверхности остеохондральных конструкций, состоящих из полифосфата кальция, оказался эффективным тонкий слой покрытия из гидроксиапатита, дающий новую форму двухфазных конструкций. Частицы гидроксиапатита, легированные ионами, также часто встречались в протоколах. Некоторые клинические испытания включали погружение костных морфогенетических белков или других факторов роста, например, рекомбинантного основного фактора роста фибробластов человека- β (rhFGF- β ) на скаффолды на основе гидроксиапатитов и трикальцийфосфатов для индукции дифференцировки клеток или других специфических эффектов. CaP-цементы представляют собой особую форму материалов на основе гидроксиапатита или трикальцийфосфата, поскольку их основными ингредиентами являются аморфный CaP или моно-, ди-, три- или тетра-CaP, которые могут схватываться и затвердевать в гидроксиапатит или трикальцийфосфат только после их помещения в костную полость.
В настоящее время нет единого мнения об идеальном соотношении фаз BCP для клинического применения. В литературе оценивали различные соотношения гидроксиапатита и трикальцийфосфата в их комбинации, чтобы определить оптимальное для регенерации кости, однако применяли только соотношения гидроксиапатита / трикальцийфосфата 65/35, 60/40 и 50/50, которые успешно прошли клинические испытания на людях. Интересно, что два соотношения гидроксиапатита / трикальцийфосфата (30/70 и 20/80) также проявляли некоторые остеоиндуктивные свойства.
Все эти клинические испытания находились в фазе 1-2, фазе 2 или фазе 4. Клинические испытания показали положительные результаты без серьезных побочных эффектов (табл. 2).
Таблица 2
|
Показания |
Кол-во испытуемых |
Вмешательство |
NCT номер |
Фаза |
Краткое описание |
|
Гидроксиапатит |
|||||
|
Стеноз позвоночного канала и спондилез |
69 |
Трансфораминальный поясничный межтеловой артродез |
NCT02485574 |
— |
Оценка костного мостовидного протеза у пациентов, перенесших трансфораминальный межтеловой артродез поясничного отдела позвоночника. Вариант применения аутокости с гидроксиапатитом не уступал варианту применения только аутокости |
|
Артропатия тазобедренного сустава |
167 |
Вертлужная оболочка с покрытием BoneMaster и вертлужная оболочка с плазменным покрытием |
NCT00859976 |
– |
Рандомизированное контролируемое исследование пациентов, которым требовалась полная замена тазобедренного сустава. Способ фиксации тазобедренного сустава к кости – нанесение покрытия на имплантат для стимуляции роста кости на замененном бедре. Было исследовано, позволяет ли Bonemaster (тонкое электрохимически нанесенное покрытие из гидроксиапатита) стимулировать костный рост на чашечке, сравнение – с плазменным напылением |
Продолжение таблицы 2
|
Показания |
Кол-во испытуемых |
Вмешательство |
NCT номер |
Фаза |
Краткое описание |
|
Расщелина губы и неба |
5 |
Использование верхнечелюстного альвеолярного трансплантата |
NCT01932164 |
— |
Выполнение реконструкции дефекта альвеолярной кости у пациентов с расщелиной губы и неба с использованием мезенхимальных стволовых клеток из пульпы молочного зуба, связанных с биоматериалом из коллагена и гидроксиапатита (Geistlich Bio-Oss®) |
|
Трикальцийфосфат |
|||||
|
Сохранение альвеолярного отростка. Зубные имплантаты |
9 |
Easy-graft CLASSIC ( β -трикальцийфосфат) |
NCT03215667 |
— |
Клиническая и гистологическая оценка аллопластического уплотнения in situ, формируемого костного трансплантата из β -трикальцийфосфата и полилактидной мембраны в сохранении альвеолярного отростка после удаления немолярных зубов с неудерживаемыми экстракционными лунками |
|
Резорбция альвеолярной кости и заболевания пародонта |
88 |
Только β -трикальцийфосфат |
NCT01728844 |
— |
Заменитель костного трансплантата GUIDOR®, усиленный фактором роста (рекомбинантный основной фактор роста фибробластов человека- β (rhFGF- β )), в пародонтальной хирургии демонстрировал более высокую регенерацию десны и кости по сравнению с одним заменителем костного трансплантата |
|
Заболевания пародонта |
8 |
Easy-graft CLASSIC ( β -трикальцийфосфат) |
NCT02221557 |
– |
Серия случаев для сравнения эффективности двух различных подходов к лечению: с использованием нового материала аллопластического костного трансплантата при сохранении альвеолярного отростка и существующих методов использования аллотрансплантата |
|
Дегенеративное заболевание поясничного отдела позвоночника |
104 |
Инструментальный заднебоковой спондилодез с межтеловой поддержкой |
NCT00943384 |
– |
ChronOS Strip – синтетический наполнитель костных пустот / дефектов, изготовлен из гранул β -трикальцийфосфата и рассасывающегося полимера [поли(лактид-ко- ε -капролактон)]. chronOS Strip в сочетании с аутокостью и/или костным мозгом или аутотрансплантатом, предназначен для заднелатерального спондилодеза. Проспективная многоцентровая серия клинических случаев для оценки частоты заднелатерального спондилодеза в проспективной серии пациентов с дегенеративным заболеванием диска. ChronOS Strip в сочетании с аспиратом костного мозга и местной костью накладывали на заднебоковые желоба |
|
Зубные имплантаты |
26 |
Синус-лифтинг и имплантация зубов. Aastrom (BRCs) |
NCT00980278 |
Фаза 1-2 |
Определение возможности собственной ткани костного мозга способствовать регенерации (росту) кости в области челюсти, где был установлен имплантат. Название процесса – терапия клеток восстановления костей Aastrom (BRC) |
|
Периимплантит |
5 |
Easy-graft CLASSIC ( β -трикальцийфосфат) |
NCT03213210 |
– |
Исследование с одной группой для оценки эффективности подхода к лечению с использованием нового формируемого костного трансплантата из β -трикальцийфосфата и полилактидной мембраны при периимплантите |
|
Сохранение альвеолярного отростка. Зубные имплантаты |
45 |
Easy-graft CLASSIC ( β -трикальцийфосфат). Лиофилизированный костный аллотрансплантат FDBA с коллагеновой пробкой |
NCT02702609 |
— |
Рандомизированное контролируемое исследование для сравнения эффективности двух различных подходов к лечению с использованием нового формируемого костного трансплантата из β -трикальцийфосфата при сохранении альвеолярного отростка в области атравматичной экстракционной лунки по сравнению с аллотрансплантатом с коллагеновой заглушкой |
|
Гидроксиапатит / трикальцийфосфат |
|||||
|
Парадонтоз |
41 |
Производное эмалевой матрицы, гидроксиапатит/ β -трикальцийфосфат, операция лоскутным доступом |
NCT02474498 |
Фаза 4 |
Клиническая оценка лечения дефектов фурка-ции нижней челюсти II класса с использованием производного эмалевого матрикса (EMD) и/или трансплантата, замещающего кость, из гидроксиапатит / трикальцийфосфата |
Продолжение таблицы 2
|
Показания |
Кол-во испытуемых |
Вмешательство |
NCT номер |
Фаза |
Краткое описание |
|
Дегенерация межпозвонкового диска, смещение межпозвонкового диска и оссифи-кация задней продольной связки |
85 |
CERVIOS chronOS™ и Bonion™ |
NCT01615328 |
Фаза 4 |
Cervios ChronOs™ представляет собой клетку из полиэфирэфиркетона (PEEK) с β -трикальцийфосфатом. Bonion™ – каркас из PEEK, наполненный гидроксиапатитом / деминерализованным костным матриксом (DBM). Однако сравнительных исследований между кейджем из PEEK с β -трикальцийфосфатом и кейджем из PEEK с гидроксиапатит / DBM не проводили. Проведена оценка скорости сращения костей между этими кейджами шейного отдела позвоночника с использованием послеоперационной компьютерной томографии (КТ) |
Примечание: тип исследования – интервенционный.
ОБСУЖДЕНИЕ
Исследования использования синтетических биоматериалов на основе КФК достигли значительного прогресса за последние четыре десятилетия, с тех пор, как они были впервые применены в клинических условиях. Это исследование было сосредоточено на анализе наиболее широко используемых в клинической практике синтетических биоматериалов на основе керамики, а именно гидроксиапатита и трикальцийфосфата. Основные области их клинического применения – это травматология и ортопедия, нейрохирургия и ЧЛХ. Среди наиболее встречаемых патологий, где они используются, – травмы / переломы трубчатых костей, остеопроз / остеопения, дегенеративные заболевания позвоночника и резорбция альвеолярной кости; но существует также значительное количество клинических испытаний при остеоартритах, краниопастике и пародонтальных дефектах. Эти клинические испытания открывают новые горизонты новейших методов трансплантации синтетических биоматериалов, которые предлагают потенциальные преимущества для будущего глобального общественного здравоохранения, поскольку они нацелены на область регенеративной медицины и тканевой инженерии заболеваний опорно-двигательной системы.
Растущее число клинических испытаний по применению гидроксиапатита и трикальцийфосфата представляет собой переход от доклинической к клинической медицине. Текущие клинические испытания, зарегистрированные на сайте clinicaltrials.gov, находятся в основном в фазе 1-2, фазе 2 или фазе 4 и демонстрируют безопасность и эффективность применения. Учитывая многообещающие результаты клинических испытаний по использованию композитных биоматериалов на основе гидроксиапатита, трикальцийфосфата или в их комбинации, можно констатировать, что их применение имеет большой потенциал для использования в качестве заменителей костных трансплантатов.
Гидроксиапатит представляет собой химический аналог биогенного апатита, основного компонента всех твердых тканей организма млекопитающих, за исключением карбонатно-кальциевых отоконий внутреннего уха. Он привлек к себе внимание на заре науки о биоматериалах вследствие ожидаемой биосовместимости, обусловленной высоким уровнем его химического и кристаллографического сходства с неорганическим компонентом костей и зубов [30]. Биоактивность и биосовместимость гидроксиапатита дают ему преимущество перед биоинертной керамикой, такой как диоксид титана, оксид алюминия и кремнезем, что и помогает вступить в более тесное взаимодействие с клетками и тканями биологической среды [31]. Кроме того, для гидроксиапатита было установлено множество относительно простых протоколов синтеза, позволяющих исследователям изготавливать частицы точно заданных размеров и форм [32]. Функционализация и модификация поверхности гидроксиапатита могут быть осуществлены с помощью столь же простых нековалентных взаимодействий, используя преимущества сильной физической сорбционной способности поливалентных ионов, составляющих поверхность частиц самого гидроксиапатита [33, 34]. В настоящее время гидроксиапатит также широко известен как средство доставки лекарственного вещества (антибиотики, факторы роста, нуклеиновые кислоты или лиганды, способствующие адресной доставке и специально контролируемой скорости высвобождения лекарства). Помимо загрузки терапевтическими агентами, гидроксиапатит также можно превратить в агент биоимиджинга, используя различные стратегии функционализации [35]. Будучи относительно устойчивым к биоразложению, но обладая способностью быстро разлагаться в определенных средах, например, вблизи раковых клеток, гидроксиапатит также обладает потенциалом действовать как «умный» биоматериал, реагирующий на раздражители окружающей среды [36]. Эта способность достигать нескольких функциональных характеристик позволяет использовать его для доставки не- скольких лекарств, при этом ее местоположение отслеживается и контролируется различными методами диагностики (например, компьютерной томографией), что является одним из предварительных условий для применения в тераностике.
Основным свойством трикальцийфосфата является его остеокондуктивность, которая является одной из основных причин его использования в качестве биоматериала для восстановления костных дефектов. Однако только свойство остеокондуктивности лишает трикальцийфосфатные композитные материалы достаточной степени регенерации и ремоделирования кости [37]. На сегодняшний день известно, что для роста новой кости необходимы следующие факторы: биоактивные материалы с функцией скаффолда; различные факторы роста, индуцирующие дифференцировку клеток; стволовые клетки, обладающие потенциалом дифференцировки в костную ткань. Следовательно, костно-восстанавлива-ющий эффект трикальцийфосфата может быть максимально улучшен, если мы обеспечим его стволовыми клетками и/или факторами роста для стимуляции дифференцировки остеобластов. В клиническом применении деградация и механические свойства являются важными физическими параметрами трикальцийфосфата, которые в основном связаны с пористостью и размером поверхности. Непрерывная деградация трикальцийфосфата обеспечивает достаточное пространство для роста клеток, в то время как отличные механические свойства могут поддерживать структуру пространства для длительного роста клеток [38]. Однако они ограничивают друг друга, потому что большая пористость приводит к более высокой деградации и худшим механическим свойствам [38]. Следовательно, для улучшения физических свойств трикальцийфосфата по восстановлению кости необходимо комбинировать его с другими материалами. Поэтому комбинация гидроксиапатита и трикальцийфосфата имеет множество преимуществ [27]. Трикальцийфосфат предоставляет ионы кальция и фосфора, которые полезны для дифференциации созревания остеобластов. Фактически, гидроксиапатит обеспечивает благоприятную микропористую среду скаффолда, которая способствует пролиферации и дифференцировке остеобластов. Как трикальцийфосфат, так и гидроксиапатит могут способствовать образованию новой кости [28, 29]. Однако по сравнению с одиночным использованием гидроксиапатита или трикальцийфосфата, их комбинация может воспроизводить больше новой костной массы за более короткий период времени [39]. Регулируя соотношение гидроксиапатит / трикальцийфосфат, можно поддерживать равновесие между абсорбцией керамического материала и образованием новой кости. В частности, так называемый ReproBone® представляет собой пористый резорбируемый керамический заменитель костного трансплантата (в составе – 60 % гидроксиапатита и 40 % β -трикальцийфосфата), похожий на минеральный компонент человеческой кости, который уже прошел клинические испытания для создания синтетических костных трансплантатов с многообещающими результатами [40, 41].
ЗАКЛЮЧЕНИЕ
По результатам клинических испытаний выявлено, что комбинация гидроксиапатита и трикальцийфосфата имеет множество преимуществ. Использование гидроксиапатита и трикальцийфосфата отдельно или в комбинации не имеет никаких серьезных побочных эффектов.
Мы ожидаем, что число клинических исследований, посвященных применению синтетических биоматериалов на основе гидроксиапатита и трикальцийфосфата в травматологии и ортопедии, нейрохирургии и ЧЛХ, поможет более чётко определить потенциал их терапевтического применения, которое может ускорить регенерацию костной ткани и потенциально улучшить качество жизни пациентов с костными дефектами.
Список литературы Синтетические биоматериалы на основе гидроксиапатита и трикальцийфосфата: анализ текущих клинических испытаний
- Kawaiah A, Thakur M, Garg S, et al. Fingertip Injuries and Amputations: A Review of the Literature. Cureus. 2020;12(5):e8291. doi: 10.7759/cureus.8291
- Березуцкий С.Н. Особенности лечения травматических ампутаций части дистальных фаланг пальцев кисти у детей. Детская хирургия. 2022;26(1):23.
- Кокарев В.А., Шалин В.В. Травмы пальцев кисти: Ампутация или артропластика? Кремлевская медицина. Клинический вестник. 2022;(4):81-83.
- Маликов М.Х., Артыков К.П., Карим-Заде Г.Д. и др. Отсроченные реконструктивные операции при тяжёлых травмах кисти. Вестник Авиценны. 2022;24(3):404-412. doi: 10.25005/2074-0581-2022-24-3-404-412
- Петрушин А.Л. Травматические ампутации сегментов кисти, анализ лечебных мероприятий на различных этапах оказания медицинской помощи в сельском районе. Казанский медицинский журнал. 2013; 94 (3): 327-334.5.
- Jerome JTJ, Malshikare VA. Fingertip Injuries Outcome Score. Plast Reconstr Surg Glob Open. 2022;10(6):e4386. doi: 10.1097/G0X.0000000000004386
- Wang J, Zhou X, Qiang L, Xue M. Thumb fingertip injuries reconstruction using a dorsoulnar flap of the thumb combined with relay V-Y flaps for donor site repair. J Orthop Surg (Hong Kong). 2022;30(2):23094990211025089. doi: 10.1177/23094990211025089
- Reid DBC, Shah KN, Eltorai AEM. et al. Epidemiology of finger amputations in the united states from 1997 to 2016. J Hand Surg Glob Online. 2019;1(2):45-51. doi: 10.1016/j.jhsg.2019.02.001
- Wang K, Sears ED, Shauver MJ, Chung KC. A systematic review of outcomes of revision amputation treatment for fingertip amputations. Hand (N Y). 2013;8(2):139-45. doi: 10.1007/s11552-012-9487-0
- Braga Silva J. Fingernail injury. Hand SurgRehabil. 2023:S2468-1229(23)00027-0. doi: 10.1016/j.hansur.2023.01.002
- Ng HJH, Yuan J, Rajaratnam V. Management of Fingertip Injuries: A Survey of Opinions of Surgeons Worldwide. J Hand Microsurg. 2020;14(1):64-70. German. doi: 10.1055/s-0040-1713072
- James V, Heng TYJ, Yap QV, Ganapathy S. Epidemiology and Outcome of Nailbed Injuries Managed in Children's Emergency Department: A 10-Year Single-Center Experience. PediatrEmerg Care. 2022;38(2):e776-e783. doi: 10.1097/ PEC.0000000000002400
- Woo SH, Kim YW, Cheon HJ, et al. Management of complications relating to finger amputation and replantation. Hand Clin. 2015;31(2):319-38. doi: 10.1016/j.hcl.2015.01.006
- Samantaray SA, Oommen J, Thamunni CV, et al. Fingertip injury epidemiology: an Indian perspective. J Plast Surg Hand Surg.. 2022;56(4):224-228. doi: 10.1080/2000656X.2021.1962332
- Yildirim T, Gunturk OB, Erol K, Toros T. Long-term outcomes of homodigital neurovascular island flap reconstruction of fingertip injuries in children. J Hand Surg Eur Vol. 2022;47(8):845-850. doi: 10.1177/17531934221108470
- Schultz J, Wruck JE, Trips E, et al. Semi-occlusive management of fingertip injuries with finger caps: A randomized controlled trial in children and adults. Medicine (Baltimore). 2022;101(27):e29324. doi: 10.1097/MD.0000000000029324
- Pastor T, Hermann P, Haug L, et al. Semi-occlusive dressing therapy versus surgical treatment in fingertip amputation injuries: a clinical study. Eur J Trauma Emerg Surg. 2023;49(3):1441-1447. doi: 10.1007/s00068-022-02193-6
- Koh SH, Park I, Kim JS, et al. Fingertip reconstruction with a subcutaneous flap and composite graft composed of nail bed and volar pulp skin. Arch Plast Surg. 2022;49(1):70-75. doi: 10.5999/aps.2021.01200
- Mohsen I, Mahmoud M, Shaheen A. Modified Bilateral V-Y Rotation Advancement Flap for Coverage of Fingertip Amputations. J Hand Surg Asian Pac Vol. 2022;27(6):1013-1020. doi: 10.1142/S2424835522500977
- Balde FB, Mukenge T, Benmassaoud Z, et al. Local or distal flap in the management of digital trauma in children. Afr JPaediatr Surg. 2022;19(1):5-8. doi: 10.4103/ajps.AJPS_56_21
- Hao R, Wang H, Huo Y, et al. Fingertip degloving injury coverage with homodactyle bipedicled dorsal island flap. Hand Surg Rehabil. 2023;42(2):134-140. doi: 10.1016/j.hansur.2023.01.009
- Yang S, Li Z. Finger-shaped dressing for fingers and toes after nail surgeries. J Am Acad Dermatol. 2023;88(2):e83-e84. doi: 10.1016/j.jaad.2019.07.020
- Hunt TJ, Powlan FJ, Renfro KN, et al. Common Finger Injuries: Treatment Guidelines for Emergency and Primary Care Providers. Mil Med. 2023:usad022. doi: 10.1093/milmed/usad022
- Xu J, Cao JY, Graham DJ, et al. Clinical Outcomes and Complications of Primary Fingertip Reconstruction Using a Reverse Homodigital Island Flap: A Systematic Review. Hand (N Y). 2023;18(2):264-271. doi: 10.1177/15589447211003179
- Samantaray SA, Kalathingal K, Muhammed H. The Aesthetic Outcomes of Fingertip Amputation Are Better with Proximal Nail Fold Recession. J Hand Surg Asian Pac Vol. 2023;28(1):108-112. doi: 10.1142/S2424835523500054
- Moellhoff N, Throner V, Frank K, et al. Epidemiology of hand injuries that presented to a tertiary care facility in Germany: a study including435 patients. Arch Orthop Trauma Surg. 2023;143(3):1715-1724. doi: 10.1007/s00402-022-04617-9
- Delle Femmine PF, Bruno E, Tosi D, et al. Reversed distal laterodigital adipofascial flap for nail-bed reconstruction. Microsurgery. 2023. doi: 10.1002/micr.31048
- Ji Z, Nie R, Li S, et al. Clinical effects of resurfacing fingertip amputations in long fingers using homodigital dorsal neurofascial broaden pedicle island flaps. J Plast Surg Hand Surg. 2023;57(1-6):453-458. doi: 10.1080/2000656X.2022.2152825
- Martin-Playa P, Foo A. Approach to Fingertip Injuries. Clin Plast Surg. 2019;46(3):275-283. doi: 10.1016/j.cps.2019.02.001
- Neustein TM, Payne SH Jr, Seiler JG 3rd. Treatment of Fingertip Injuries. JBJSRev. 2020;8(4):e0182. doi: 10.2106/JBJS. RVW.19.00182
- Venkatesh A, Khajuria A, Greig A. Management of Pediatric Distal Fingertip Injuries: A Systematic Literature Review. Plast Reconstr Surg Glob Open. 2020;8(1):e2595. doi: 10.1097/GOX.0000000000002595
- Golinvaux NS, Maslow JI, Hovis JP, Lee DH. Fingertip Injury and Management. JBJS Essent Surg Tech. 2019;9(3):e30. doi: 10.2106/JBJS.ST.19.00008
- Mak WK, Cheah JM, Chua DT, et al. Outcomes of Surgically Treated Fingertip Injuries in Migrant Workers. Ann Acad Med Singap. 2020;49(6):405-407.
- Gunasagaran J, Sian KS, Ahmad TS. Nail bed and flap reconstructions for acute fingertip injuries - A case review and report of a chemical burn injury. J Orthop Surg (Hong Kong). 2019;27(2):2309499019839278. doi: 10.1177/2309499019839278
- Lam WL, Jordan D. Management of fingertip injuries in Scotland and the United Kingdom. J Hand Surg Eur Vol. 2019;44(10):1102-1105. doi: 10.1177/1753193419873555
- Zhang JF, Wang L, Hao RZ, et al. Treatment of fingertip avulsion injuries using two periposition pedicled flaps. JPlast ReconstrAesthet Surg. 2019;72(4):628-635. doi: 10.1016/j.bjps.2018.12.051
- Tang JB. Fingertip repair methods: choices for different fingers and sides emphasizing sensation. J Hand Surg Eur Vol. 2019;44(10):1109-1111. doi: 10.1177/1753193419876496
- Petrella G, Tosi D, Sapino G, Adani R. Fingertip defect reconstruction with a modified pivot flap. J Hand Surg Eur Vol. 2021;46(1):75-79. doi: 10.1177/1753193420956320


