Синтез 1- (3-бензоилбензил) производных урацила как потенциальных противовирусных агентов
Автор: Новиков М.С., Лысенко К.Н., Гейсман А.Н., Озеров А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 4 (28), 2010 года.
Бесплатный доступ
Конденсацией эквимолярных количеств 2,4-бис(триметилсилилокси)пиримидинов с 3-(бензоил)бензилбромидами был осуществлен синтез 1-(3-бензоилбензил)урацилов, содержащих в положении 5 остатка урацила различные заместители. Выход целевых соединений был равен 56-69 %. Данные соединения представляют интерес в качестве потенциальных анти-ВИЧ-1 агентов.
Синтез, урацил, 4-бис(триметилсилилокси)пиримидины, потенциальные противовирусные агенты
Короткий адрес: https://sciup.org/142148858
IDR: 142148858 | УДК: 615.3:547.854.4
Текст научной статьи Синтез 1- (3-бензоилбензил) производных урацила как потенциальных противовирусных агентов
Актуальность проблемы вирусных заболеваний и, в частности, вируса иммунодефицита человека (ВИЧ) в настоящее время трудно переоценить. Эпидемия синдрома приобретенного иммунодефицита (СПИД) длится более 20 лет. По данным Всемирной организации здравоохранения, в 2007 г. в мире насчитывалось более 33 млн человек — носителей ВИЧ [4]. В связи с этим первостепенная роль отводится созданию высокоактивных и малотоксичных в отношении организма человека антиретровирусных соединений.
Одним из наиболее перспективных классов соединений, проявляющих активность в отношении вирусов ВИЧ-1 и ВИЧ-2, являются ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ). Их преимущество перед нуклеозидными ингибиторами обратной транскриптазы заключается в том, что мишенью их действия является не конкурентное взаимодействие в каталитическом центре с нуклеозидами — субстратами биосинтеза дезоксирибонуклеиновой кислоты (ДНК), а влияние на аллостерическую регуляцию ферментативной активности. ННИОТ, связываясь с аллостерическим центром, находящимся в 10 Е от каталитического, подавляют его ферментативную активность за счет изменения его конформации.
Ранее сообщалось [4], что соединение 1 проявляет мощную ингибиторную активность в отношении дикого и некоторых мутантных штаммов ВИЧ-1. Однако наличие бензофуранового фрагмента приводит к существенному ингибированию соеди- нением 1 цитохрома CYP3A4, что крайне нежелательно в условиях полипрагмазии при СПИДе, так как ингибиторы системы микросомальных оксидаз печени могут замедлить метаболизм и увеличить токсичность других антиретровирусных средств. С другой стороны, потенциальной противовирусной активностью могут обладать соединения, содержащие в положении 1 пиримидинового цикла 3-феноксибен-зильный фрагмент [2, 6, 7].
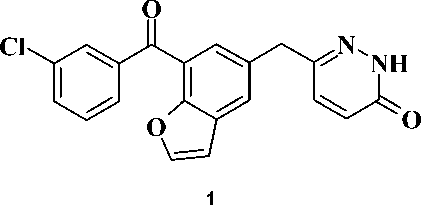
Рис. 1. Соединение 1
На основании вышеприведенных данных было высказано предположение о потенциальной антиретровирусной активности бензоилбензильных аналогов урацила.
ЦЕЛЬ РАБОТЫ
С целью поиска новых потенциальных противовирусных агентов нами был осуществлен син- тез производных урацила, содержащих в положении 1 пиримидинового цикла 3-бензоилбензиль-ный фрагмент.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker DRX-500» (500 МГц) в ДМСО-D6, внутренний стандарт тетраметилсилан. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пластинах «Silufol UV-254», проявление в парах йода. В качестве элюента использовали этилацетат. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
3-Бензоилбензилбромид (4) . В колбу объемом 250 мл, снабженную капельной воронкой, помещают раствор 8,05 г (41,02 моль) 3-бензоилто-луола ( 2 ) в 50 мл безводного тетрахлорметана. К кипящему раствору при облучении светом прибавляют по каплям раствор 2,2 мл (42,70 ммоль) брома в 15 мл тетрахлорметана. Через 6 ч тетрах-лорметан упаривают при пониженном давлении, остаток перегоняют в вакууме и собирают фракцию, кипящую при 189—192 °С (3 мм рт. ст.). Получили 6,91 г (выход 61 %) продукта в виде прозрачной жидкости желтоватого цвета со слабым характерным запахом.
3-Бензоил-4-метоксибензилбромид (5). В колбу объемом 250 мл, снабженную капельной воронкой, помещают раствор 2,5 г (11,05 ммоль) 3-бензоил-4-метокситолуола ( 3 ) в 35 мл безводного тетрахлорметана. К кипящему раствору при облучении светом прибавляют по каплям раствор 0,55 мл (10,68 ммоль) брома в 15 мл тетрахлорметана. Через 1 ч тетрахлорметан упаривают при пониженном давлении, остаток – вязкая жидкость желтого цвета – без дополнительной перегонки в вакууме используют на следующей стадии.
Общий метод получения 1-(3-бензоилбен-зил)урацилов (9—12). К раствору 22,30 ммоль 2,4-бис(триметилсилилокси)пиримидина (4) в 50 мл безводного 1,2-дихлорэтана прибавляют раствор
25,11 ммоль бензилбромида 4 или 5 в 10 мл 1,2-дихлорэтана и полученную смесь кипятят в течение 35 ч. Затем реакционную массу охлаждают, фильтруют, обрабатывают 2-пропанолом, вновь фильтруют, фильтрат упаривают при пониженном давлении досуха, остаток перекристаллизовывают из этанола.
1-(3-Бензоилбензил)урацил (7). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 4,92 с (2H, CH2); 5,57 д (1H, J = 8, H-5); 7,48-7,69 м (10H, ароматические H); 7,78 д (1H, J = 8, H-6); 11,34 с (1H, NH).
1-(3-Бензоилбензил)-5-фениламиноурацил (8). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 4,93 с (2H, CH2); 6,57-6,77 м (3H, ароматические H); 7,017,05 м (3H, NH-Ph, ароматические H); 7,44-7,68 м (9H, ароматические H); 7,74 c (1H, H-6); 11,57 с (1H, NH).
1-(3-Бензоил-4-метоксибензил)урацил (9). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 3,30 с (3Н, OCH3), 4,90 с (2H, CH2); 5,61 д (1H, J = 7,5, H-5); 7,277,29 м (2H, H-6’, ароматический H); 7,38-7,41 м (2H, H-5’, ароматический H); 7,58-7,63 м (2H, ароматические H); 7,72-7,77 м (1Н, ароматический H); 7,80 д (1H, J = 7,5, H-6); 8,11-8,13 м (2Н, ароматические H); 11,54 с (1H, NH).
1-(3-Бензоил-4-метоксибензил)-5-фенилами-ноурацил (10). 1Н ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 3,28 с (3Н, OCH3), 4,92 с (2H, CH2); 7,27-7,29 м (2H, H-6’, ароматический H); 7,36-7,66 м (6H, H-5’, NH, ароматические H); 7,70-8,09 м (8Н, ароматические H, H-6); 11,57 с (1H, NH).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
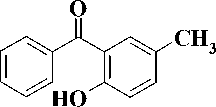
Синтез производных урацила, содержащих в положении (1) 3-бензоилбензильный фрагмент, был проведен в 3-й стадии. На первой стадии были получены 3-бензоилтолуол ( 2 ) и 3-бензоил-4-метоксито-луол ( 3 ). 3-Бензоилтолуол ( 2 ) был синтезирован ацилированием бензола мета -метилбензоилхлоридом в присутствии хлорида алюминия, а 3-бензоил-4-метокситолуол ( 3 ) – обработкой 2-гидрокси-5-метил-бензофенона ( 1 ) полуторакратным мольным избытком CH3I в присутствии карбоната калия в соответствии с известными методами [3,5] (рис. 2).
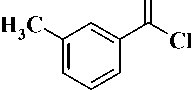
C6H6, AlCl3
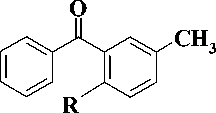
Рис. 2. R = H (2), R = OCH3 (3)
CH3I, K2CO3
На второй стадии бензофеноны 2 и 3 обработкой бромом в кипящем тетрахлорметане превращали в соответствующие бензилбромиды 4 и 5, кото- рые затем конденсировали с эквимолярным количеством 2,4-бис(триметилсилилокси)пиримидина 6 в кипящем безводном 1,2-дихлорэтане в соответ- ствии с ранее описанными условиями [1]. При этом, согласно данным тонкослойной хроматографии, образовывались исключительно N1-замещенные продукты. Целевые 1-(3-бензоилбензил)производ-ные урацила 7–10 были получены с выходами 56—69 % (рис. 3).
2 или 3
Br2, CCl4
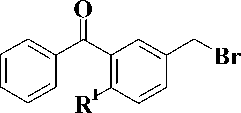
Me3Si ~
3 O
Me3Si ~
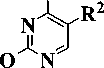
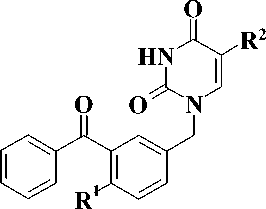
4, 5 6 7 – 10
Рис. 3. R1 = H, OCH3, R2= H, NHPh
Чистота полученных соединений определялась методом тонкослойной хроматографии, строение – 1Н ЯМР-спектроскопией, физико-химические свойства 1-(3-бензоилбензил)производных урацила 7–10 представлены в табл.
Свойства синтезированных соединений


