Синтез 1,3-дибензоил- и 3-бензоил-6-бромхиназолин-2,4(1 н,3н)-диона
Автор: Озеров А.А., Новиков М.С., Ходес Е.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология. Токсикология
Статья в выпуске: 4 (60), 2018 года.
Бесплатный доступ
Взаимодействие 1,3-дибензоилпроизводного 6-бромхиназолин-2,4(1Н,3Н)-диона с карбонатом калия в безводном ДМФА при комнатной температуре сопровождается выделением двуокиси углерода и образованием легко растворимой калиевой соли 3-бензоил-6-бромхиназолин-2,4(1Н,3Н)-диона и мало растворимого калия бензоата. В отличие от дибензоилпроизводного 6-метилурацила, ^-дебензоилирование 1,3-дибензоилпроизводного 6-бромхиназолин-2,4(1Н,3Н)-диона в указанных условиях протекает менее селективно и частично дает продукт полного дебензоилирования - 6-бромхиназолин-2,4(1Н,3Н)-дион.
6-бромхиназолин-2, 4(1н, 3н)-дион, бензоилирование, дебензоилирование
Короткий адрес: https://sciup.org/142222507
IDR: 142222507 | УДК: 547.856.1
Текст научной статьи Синтез 1,3-дибензоил- и 3-бензоил-6-бромхиназолин-2,4(1 н,3н)-диона
Проблема селективного N1-алкилирования соединений пиримидиновой природы, в частности, производных урацила, остается по-прежнему актуальной [1]. Если при использовании алкилирующих агентов с высокой реакционной способностью, в частности, альфа-галогенэфиров, высокую региоселективность обеспечивает триметилсилильный вариант метода Гилберта-Джонсона [2, 6], то в случае реагентов с более низкой подвижностью уходящей группы (алкил-, бензилгалогениды или толуол-сульфонаты алифатических спиртов) этот метод непригоден, и известны лишь отдельные примеры успешного N1-алкилирования триме-тилсилилпроизводных урацила такими реагентами [3, 7]. Альтернативный способ высокоселективного синтеза N1-замещенных производных урацила основан на использовании субстратов, в которых положение N3 имеет защиту ацильного типа, легко снимаемую щелоч- ным гидролизом [11]. Этот метод обеспечивает достаточно высокий выход целевых продуктов при проведении реакции в среде ДМФА в присутствии оснований даже при наличии заместителя в положении 6 пиримидинового цикла, например, в случае 6-метилурацила [10] или хиназолин-2,4(1Н,3Н)-диона [9].
В настоящей статье описан синтез N-бен-зоилпроизводных 6-бромхиназолин-2,4(1 Н ,3 Н )-диона, которые могут быть использованы в качестве ценных субстратов в подобных реакциях N1-алкилирования.
ЦЕЛЬ РАБОТЫ
Исследование процессов N1,N3-дибензо-илирования и N1-дебензоилирования с участием 6-бромхиназолин-2,4(1 Н ,3 Н )-диона с целью получения 3-бензоил-6-бромхиназолин-2,4(1 Н ,3 Н )-диона в качестве субстрата в процессах региоселективного N1-алкилирования.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 600» (600 МГц для 1H и 150 МГц для 13С) в ДМСО-D 6 , внутренний стандарт тетраметилсилан.
Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 (Advanced Chemistry Development, Канада).
Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
Метиловый эфир 2-амино-5-бромбен-зойной кислоты (II). К перемешиваемому раствору 25,0 мл (0,193 моль) метилового эфира антраниловой кислоты ( I ) в 200 мл безводного ДМФА добавляют в один прием 35,0 г (0,201 моль) N-бромсукцинимида и перемешивают в течение суток при комнатной температуре. Реакционную массу выливают в 500 мл холодной воды, перемешивают, выдерживают в течение 12 ч при температуре 0–5 °С, образовавшийся осадок отфильтровывают, промывают 100 мл холодной воды, сушат на воздухе, перекристаллизовывают из 50 мл изопропилового спирта и получают 26,0 г (59 %) белого кристаллического вещества, Т. пл. 72–75 °С.
6-Бромхиназолин-2,4(1 Н ,3 Н )-дион (III). Смесь 12,0 г (0,052 моль) метилового эфира 2-амино-5-бромбензойной кислоты ( II ) и 5,0 г (0,083 моль) мочевины нагревают при перемешивании при температуре 210–220 °С в течение 20 мин, охлаждают, добавляют 100 мл кипящей воды, растирают и выдерживают при комнатной температуре в течение суток. Образовавшийся осадок отфильтровывают, промывают водой, сушат на воздухе и получают 11,8 г (94 %) светло-желтого кристаллического вещества, Т. пл. > 350 °С.
Полученный продукт может быть использован для дальнейшего бензоилирования без дополнительной очистки.
Аналитический образец получают перекристаллизацией 1,0 г продукта-сырца из 5 мл безводного ДМФА, выход 0,7 г, Т. пл. 360– 362,5 °С.
Спектр ЯМР 1Н, δ, м. д.: 7,07 д (1Н, 9 Гц, Н8); 7,71 д (1Н, 9 Гц, Н7); 7,88 с (1Н, Н5); 11,25 уш. c (2Н, NH).
Спектр ЯМР 13С, δ, м. д.: 113,76; 116,14; 117,69; 128,86; 137,35; 139,99; 149,96; 161,63.
1,3-Дибензоил-6-бромхиназолин-2,4(1Н, 3Н)-дион (IV). К суспензии 10,0 г (0,042 моль) 6-бромхиназолин-2,4(1Н,3Н)-диона (III) в 100 мл безводного ацетонитрила и 20 мл безводного пиридина добавляют в один прием 15,0 мл (0,129 моль) бензоилхлорида и перемешивают при комнатной температуре в течение 3 суток до образования прозрачного раствора. Раствор упаривают в вакууме при температуре не выше 60 °С, остаток растворяют в 200 мл хлороформа, охлаждают и интенсивно перемешивают в течение 5 мин со 100 мл охлажденной воды. Органический слой отделяют, сушат сульфатом натрия, фильтруют и упаривают в вакууме при температуре не выше 60 °С.
Остаток растирают с 50 мл диэтилового эфира, выдерживают в течение суток при температуре 0–5 °С, образовавшийся осадок отфильтровывают, промывают диэтиловым эфиром, петролейным эфиром, сушат на воздухе и получают 13,7 г (73 %) оранжево-желтого кристаллического вещества, Т. пл. – 155–200 °С (разл.). Полученный продукт может быть использован для дальнейшего дебензоилирования без дополнительной очистки.
Для получения аналитического образца 1,0 г продукта-сырца экстрагируют 25 мл кипящего этилацетата, фильтруют, фильтрат охлаждают, добавляют 25 мл петролейного эфира, выдерживают при температуре 15–20 °С в течение суток, образовавшийся осадок отфильтровывают, промывают петролейным эфиром, сушат на воздухе и получают 0,8 г светлокоричневого кристаллического вещества, представляющего собой, по данным спектроскопии ЯМР, комплекс 1,3-дибензоил-6-бромхиназо-лин-2,4(1 Н ,3 Н )-диона ( IV ) с этилацетатом при молярном соотношении 1:1, Т. пл. 163,5– 165,5 оС (разл.).
Спектр ЯМР 1Н, δ, м. д.: 1,15 т (3Н, 7 Гц, СН 3 , этилацетат); 1,96 с (3Н, СН 3 , этилацетат); 4,00 кв (2Н, 7 Гц, СН 2 , этилацетат); 7,09 д (1Н, 9 Гц, Н8); 7,56-7,63 м (4Н, ароматические Н); 7,75–7,81 м (2Н, ароматические Н); 7,88 дд (1Н, 2 Гц, 9 Гц, Н7); 8,19 д (1Н, 2 Гц, Н5); 8,21–8,26 м (4Н, ароматические Н).
Спектр ЯМР 13С, δ, м. д.: 14,04; 20,70; 59,71; 116,26; 117,38; 117,42; 129,43; 129,57; 129,93; 130,79; 130,95; 131,35; 135,79; 136,05; 137,64; 138,36; 147,53; 159,88; 168,13; 169,09; 170,28.
3-Бензоил-6-бромхиназолин-2,4(1 Н ,3 Н )-дион (V). Смесь 5,0 г (0,011 моль) 1,3-дибензоил-6-бромхиназолин-2,4(1 Н ,3 Н )-диона ( IV ) и 5,0 г (0,036 моль) тонко измельченного безводного карбоната калия перемешивают в 100 мл безводного ДМФА в течение 24 ч, фильтруют, фильтрат упаривают в вакууме при температуре не выше 80 °С, остаток распределяют между 100 мл хлороформа и 200 мл 5%-го раствора калия гидроксида, водную фазу отделяют, нейтрализуют уксусной кислотой, выдерживают при температуре 0–5 °С в течение 12 ч, образовавшийся осадок отфильтровывают, промывают водой и сушат на воздухе.
Полученное вещество экстрагируют 5 раз по 50 мл кипящего этилацетата, объединенный экстракт охлаждают, выдерживают при температуре 15–20 °С в течение суток, образовавшийся осадок отфильтровывают, промывают охлажденным этилацетатом, петролейным эфиром и получают 2,4 г (63 %) белого игольчатого кристаллического вещества, Т. пл. 251–254 °С.
Спектр ЯМР 1Н, δ, м. д.: 7,22 д (1Н, 9 Гц, Н8); 7,57 т (2Н, 8 Гц, м -Н, бензоил); 7,76 т (1Н, 8 Гц, п -Н, бензоил); 7,89 дд (1Н, 2 Гц, 9 Гц, Н7); 7,99 д (1Н, 2 Гц, Н5); 8,07 д (2Н, 8 Гц, о -Н, бензоил), 11,93 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 114,53; 115,79; 118,25; 129,07; 129,39; 130,51; 131,32; 135,46; 138,34; 139,64; 148,57; 160,67; 169,43.
Не растворившееся при экстракции вещество в количестве 0,7 г представляет собой продукт полного дебензоилирования –
6-бромхиназолин-2,4(1 Н ,3 Н )-дион ( III ), Т. пл. 356– 359 оС (ДМФА), выход 26 %.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Известно, что N-бромсукцинимид (NBS) в среде безводного ДМФА является мягким и селективным бромирующим агентом, позволяющим с высоким выходом получать моно- и ди-бромпроизводные ароматических соединений, содержащих электронодонорные заместители [4, 8]. При использовании в качестве субстрата метилового эфира антраниловой кислоты ( I ) при действии NBS при комнатной температуре легко образуется 5-бромметилантранилат ( II ), выход которого составил 59 %. Его последующая конденсация с мочевиной при температуре 210– 220 °С с высоким выходом (94 %) приводит к 6-бромхиназолин-2,4(1 Н ,3 Н )-диону ( III ) (схема).
O
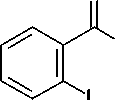
NH2
CH
O х 3 NBS
DMF
O
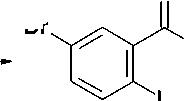
Br
CH
O"CH 3 NH2C(O)NH2
NH2
O
Br
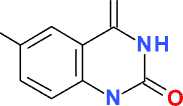
H III
I
II
BzCl
Py / MeCN
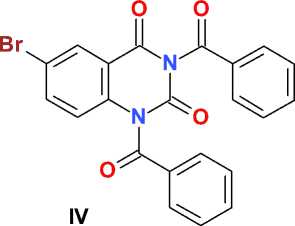
OO
K 2 CO 3 Br
DMF
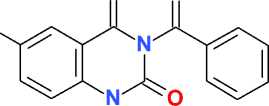
H
V
Схема. Синтез 3-бензоил-6-бромхиназолин-2,4(1 Н ,3 Н )-диона
Реакция бензоилирования 6-бромхи-назолин-2,4(1 Н ,3 Н )-диона ( III ) избытком бензо-илхлорида (молярное соотношение 1:3) в смеси пиридина и ацетонитрила протекает существенно медленнее по сравнению с бензоилированием незамещенного хиназолин-2,4(1 Н ,3 Н )-диона [9], что, вероятно, связано с уменьшением растворимости исходного субстрата за счет наличия в его структуре атома брома.
Полученный с выходом 73 % 1,3-дибен-зоил-6-бромхиназолин-2,4(1 Н ,3 Н )-дион ( IV ), по данным спектроскопии ЯМР 1Н и 13С, образует стабильный сольват (1:1) при кристаллизации из этилацетата с достаточно высокой (163,5– 165,5 °С) температурой плавления.
Дебензоилирование 1,3-дибензоил-6-бром-хиназолин-2,4(1Н,3Н)-диона (IV) было осуществлено в условиях, предложенных нами ранее для дебензоилирования 1,3-дибензоилхи-назолин-2,4(1Н,3Н)-диона [9].
Интенсивное перемешивание субстрата с избытком тонко измельченного карбоната калия (молярное соотношение 1:3) в среде безводного ДМФА при комнатной температуре в течение суток сопровождается выделением двуокиси углерода и приводит к целевому 3-бензоил-6-бромхи-назолин-2,4(1 Н ,3 Н )-диону ( V ) (выход 63 %) вместе с продуктом полного дебензоилирования – 6-бромхиназолин-2,4(1 Н ,3 Н )-дионом ( III ) (выход 26 %). Таким образом, молярное соотношение указанных продуктов реакции составило 2,42:1, что очень близко к показателям дебензоилирования не бромированного аналога (2,04:1 [9]).
Очевидно, что как целевой 3-бензоил-6-бромхиназолин-2,4(1Н,3Н)-дион (V), так и про- межуточный 1,3-дибензоил-6-бромхиназолин-2,4(1Н,3Н)-дион (IV) могут быть использованы в синтезе разнообразных N1-монозамещенных производных хиназолинового ряда, в том числе обладающих выраженной фармакологической активностью [5].
ЗАКЛЮЧЕНИЕ
Бензоилирование 6-бромхиназолин-2,4(1 Н , 3 Н )-диона избытком бензоилхлорида в ацетонитриле в присутствии пиридина при комнатной температуре приводит к 1,3-дибензоил-6-бромхи-назолин-2,4(1 Н ,3 Н )-диону с выходом 73 %. Его взаимодействие с карбонатом калия в среде безводного ДМФА в течение суток при комнатной температуре дает продукты N1- и N1,N3-дебензоилирования в молярном соотношении 2,42:1.
Полученный 3-бензоил-6-бромхиназолин-2,4(1 Н ,3 Н )-дион является ценным полупродуктом в синтезе N1-моноза-мещенных производных хи-назолин-2,4(1 Н ,3 Н )-диона.
Список литературы Синтез 1,3-дибензоил- и 3-бензоил-6-бромхиназолин-2,4(1 н,3н)-диона
- Курочкин Н. Н., Тараров В. И., Дреничев М. С. [и др.] // Совр. пробл. науки и образов. - 2012. - № 5. -С. 1-8; http://science-education.ru/ru/article/view?id=7040.
- Новиков М. С., Озеров А. А., Орлова Ю. А. и др. // Хим. гетероциклич. соед. - 2005. - № 5. - С. 726-731.
- Новиков М. С., Озеров А. А. // Хим. гетероциклич. соед. - 2005. - № 7. - С. 1071-1075.
- Солодунова Е. А., Новиков М. С., Озеров А. А. // ВНМЖ. - 2015. - № 5. - С. 36-38.
- Тюренков И. Н., Озеров А. А., Солодунова Е. А. [и др.] // Хим.-фарм. журн. - 2013. - Т. 47, № 5. - С. 7-10.
- Griengl H., Wanek E., Schwarz W. [et al.] // J. Med. Chem. - 1987. - Vol. 30. - P. 1199-1204.
- Latxague L., Thibon J., Deleris G. // Tetrahedron Lett. - 1998. - Vol. 39. - P. 4025-4028.
- Mitchell R. H., Lai Y.-H., Williams R. V. // J. Org. Chem. - 1979. - Vol. 44, № 25. -P. 4733-4735.
- Ozerov A. A., Novikov M. S. // Int. J. Chem. Sci. - 2018. - Vol. 16, № 3. - P. 279-283.
- Ozerov A., Novikov M., Khandazhinskaya A. [et al.] // Heterocycles. - 2017. - Vol. 94, № 5. - P. 912-922.
- Zhou J., Shevlin P. B. // Synth. Commun. - 1997. - Vol. 27. - P. 3591-3597.


