Синтез 2-С-метил-D-эритрит-2,4-циклодифосфата коринеподобными бактериями
Автор: Цыренов В.Ж., Островский Д.Н., Санданов А.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 1 (46), 2014 года.
Бесплатный доступ
В статье рассмотрен процесс биоснтеза 2-С-метил-D-эритрит-2,4-циклодифосфата (МЭЦ) различными коринеподобными бактериями. Установлен наиболее эффективный продуцент 2-С-метил-D-эритрит-2,4-циклодифосфата. Определен выход продукта. С помощью ионообменной хромотографии произведена количественная оценка различных фосфорных соединений, содержащихся в клеточном экстракте, полученном из клеток, культивированных в присутствии редокс-медиатора. Полученный штамм-продуцент может быть использован для получения препарата МЭЦ для потребностей фармацевтической биотехнологии.
2-с-метил-d-эритрит-2, 4-циклодифосфат, немевалонатный путь, биосинтез изопреноидов, окислительный стресс, сorynebacterium
Короткий адрес: https://sciup.org/142142829
IDR: 142142829 | УДК: 615.9+577.472(28):614+577.4
Текст научной статьи Синтез 2-С-метил-D-эритрит-2,4-циклодифосфата коринеподобными бактериями
2-С-метил-D-эритрит-2,4-циклодифосфат (МЭЦ) является ключевым метаболитом недавно открытого метилэритрофосфатного пути (МЭФ – пути) биосинтеза изопреноидов [1]. МЭЦ имеет перспективы применения при создании новых антибиотиков, а также может быть использован для перевода микроорганизмов из дормантного состояния в активное [2]. Д.Н. Островским установлено накопление значительных количеств МЭЦ в клетках только одного штамма Сorynebacterium ammoniagenes АТСС 6872 в условиях окислительного стресса [3]. Такое накопление МЭЦ может быть использовано как биохимический механизм для препаративного получения этого соединения методом микробиологического синтеза.
Цель исследования изучить методом ЯМР-спектроскопии изменение содержания фосфорных соединений, в том числе МЭЦ в клетках разных культур коринеподобных бактерий в условиях окислительного стресса, достигаемого использованием редокс медиатора; изучить процесс микробиологического синтеза МЭЦ при использовании различных культур коринеподобных бактерий, определить наиболее эффективный продуцент.
Экспериментальная часть
Объектом исследования явились представители группы коринебактерий: Corynebacterium ammoniagenes ВСТИ 403, Corynebacterium flavum ВСТИ 301, Corynebacterium species ВСТИ 4, из коллекции ФГУП «ГосНИИгенетика» и коллекции кафедры биотехнологии ВСГУТУ. Corynebacterium ammoniagenes АТСС 6872, Micrcoccus lysodelkticus (luteus) коллекция Института биохимии им. А.Н. Баха.
Посевная среда содержала: 20 г D-глюкозы моногидрата, 10 г пептона, 10 г дрожжевого экстракта и 2,5 г NaCl на 1 л воды. Перед стерилизацией рН доводили до 7,2 с помощью 3 н NaOH. Инокулят (10%) готовили на посевной среде. Культуру микроорганизмов объемом по 50 мл выращивали в колбах Эрленмейера объемом 750 мл.
Ферментационная среда Nutrient broth М002 (Himedia) содержала 50 г глюкозы моногидрата, 3 г дрожжевого экстракта, 5 г NaCl на 1 л воды. Для осуществления биосинтеза МЭЦ ферментационную среду разливали по 200 мл в качалочные колбы на 750 мл, доводили рН 5 н NaOH до 7,6 и стерилизовали в течение 15 мин при 1 атм.
Культуру с косяка петлей переносили в 200 мл посевной среды и помещали на качалку (220 об/мин). После суток роста при 30±1°С посевной культурой в количестве 10 об.% инокулировали ферментационную среду. Для осуществления синтеза МЭЦ в ферментационную среду добавляли бензилвиологен 50 мкг/мл, а также глюкозу 40%-ную 10 мл после 24 ч ферментации. Продолжительность ферментации составляла 48 ч.
Наблюдение за ростом клеток проводили измерением оптической плотности при 578 нм.
Бумажную хроматографию нуклеотидов проводили на бумаге Whatman. Высокоэффективная жидкостная хроматография (ВЭЖХ) клеточного экстракта с градиентной элюцией выполнялась по методу [3] с использованием хроматографа Agilent 1100 (производство США) [3]. Содержание нуклеотидов в элюате контролировали, измеряя поглощение при 260 нм.
Для идентификации и количественного определения МЭЦ биомассу бактерий осаждали центрифугированием. Раствор использовали для регистрации 31Р-ЯМР (спектрометр фирмы «Вгикег» (США), модель АМХ-400).
Молярную концентрацию МЭЦ рассчитывали по интегралу спектра 31Р-ЯМР путем сравнения со спектром известной навески NADP при отнесении интегралов к интенсивности сигналов стандарта.
Для выделения и очистки МЭЦ с сигналом 31Р-ЯМР с химическим сдвигом 14,8 м.д. клетки выращивали в присутствии радиоактивного фосфата (10 Мбк на 1 мл), экстракты наносили на колонку с анионобменником Dowex 1x4 (Serva) в формиатной форме.
Элюат с колонки анализировали на содержание радиоактивности и поглощение при 260 нм, а также на наличие сигналов 31Р-ЯМР [3].
В опытах использовали препарат МЭЦ, полученный в лаборатории биохимии стрессов микроорганизмов Института биохимии им. А.Н. Баха РАН.
Обсуждение результатов
Исследуемые микроорганизмы культивировали в отсутствии или присутствии бензил-виологена или другого редокс медиатора, клетки экстрагировали этанолом и экстракт затем использовали в качестве образца для снятия спектров 31Р-ЯМР, по интенсивности их сигналов определяли концентрацию фосфорных соединений.
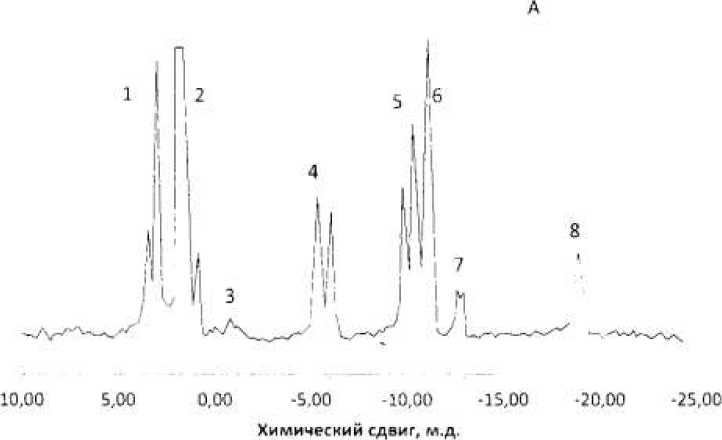
Установлено, что в клетках большинства исследуемых нами культур коринеподоных бактерий происходит в той или иной мере накопление фосфорного соединения с химическим сдвигом в спектре 31Р-ЯМР = -14,8 м.д. Это иллюстрирует рисунок 1, где приведен спектр 31Р-ЯМР-экстракта из клеток Corynebacterium flavum ВСТИ 301 после их инкубации с бен-зилвиологеном.
Б
10,00 5,00 0,00 -5,00 -10,00 -15,00 -20,00 -25,00
Химический сдвиг, м.д.
Рис 1. Спектр 31Р-ЯМР-экстрактов из клеток Corynebacterium flavum ВСТИ 301, выращенных в отсутствие (а) и в присутствии (б) бензилвиологена (50 мкг на 1 мл среды). Традиционное отнесение сигналов: 1 – фосфодиэфиры; 2 ортофосфат; 3 фосфодиэфиры; 4 гамма-фосфор+нулеозидди и трифосфаты; 5 альфа-фосфор-нуклеозидди- и нуклеозидтрифосфатов;
6 NAD; 7 UDP-caxapa; 8 бэта-фосфор-нуклеозидтрифосфаты. ФС фосфорное соединение.
Спектры 31Р-ЯМР экстрактов из бактерий сняты в Институте органической химии РАН (г. Москва)
Данные соединения в клетках всех исследуемых организмов в отсутствие редокс-медиатора, что впервые показано на примере культур Micrococcus luteus и Corynebacterium ammoniagenes АТСС 6872, а соответствующее соединение идентифицировано как 2-С-метил-0-эритритол-2,4-циклодифосфат (МЭЦ) [3].
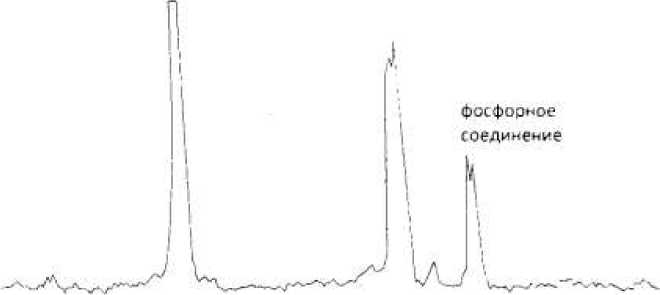
Как видно из рисунка 1 а, в отсутствие бензилвиологена в клетке после их инкубации обнаруживается большее количество (около 8) сигналов фосфорных соединений, относимых к фосфомоноэфирам, ортофосфату, нуклеозидфосфа-там и другим соединениям. Также видно, что в присутствии редокс-медиатора бензилвиологена количество сигналов уменьшается до трех, и одним из них (сигнал 3) является новый сигнал вещества, индуцированного ре-докс-медиатором. Данное вещество в случае использования Micrococcus luteus,
Corynebacterium ammoniagenes АТСС 6872 Островским и сотрудниками было идентифицировано как МЭЦ [3].
Как видно из таблицы 1, в клетках коринеподобных бактерий в присутствии бензил-виологена наблюдается накопление фосфорного соединения с химическим сдвигом в спектре 31-Р-ЯМР = -14,8 м.д., которое, исходя из данных литературы, предварительно идентифицировано как МЭЦ.
Таблица 1
Содержание фосфорного соединения с химическим сдвигом в спектре
31Р –ЯМР =-14,8 м.д. в клетке у различных штаммов коринеподобных бактерий, выращенных в присутствии редокс-медиатора бензилвиологена в концентрации 100 мкг/мл
|
Микроорганизмы |
Содержание фосфорного соединения 14 м.д., отнесенное к общему фосфору и к суммарному фосфору нуклеотидполифосфатов и нуклеотидов, в % |
|
|
Робш |
Рнукл |
|
|
Corynebacterium ammoniagenes АТСС 6872 |
12,7 ± 1,0 |
26,8 ± 2,5 |
|
Corynebacterium ammoniagenes ВСТИ 403 |
11,4 ± 1,0 |
21,5 ±2,5 |
|
Corynebacterium flavum ВСТИ 301 |
14,2 ± 1,5 |
25,8 ±2,5 |
|
Corynebacterium ammoniagenes ВСТИ 404 |
12,9 ± 1,5 |
23,3 ± 2,5 |
|
Corynebacterium insidiosum 224 |
3,2 ± 0,3 |
5,7 ± 0,5 |
|
Corynebacnerium stationis 336 |
3,6 ± 0,3 |
4,1 ±0,5 |
|
Corynebacterium linenens 242 |
2,4 ± 0,3 |
4,8 ± 0,5 |
Для уточнения идентификации -14,8 м.д. фосфорного соединения МЭЦ, обращающегося в клетках 301, и для его дополнительной количественной оценки проводили его очистку и выделение по методу, основанному на использовании ионообменной хроматографии и изотопного анализа [3]. Для этого биомассу (около 2 г) С. flavum ВСТИ 301, выращенную в присутствии радиоактивного фосфата, отделяли центрифугированием, инкубировали с бензил-виолгеном и экстрагировали этанолом, образец экстракта наносили на хроматографическую колонку. Проводили ионообменную хроматографию этанольного экстракта клеток бактерий.
Хроматографические исследования начаты с постановки модельного опыта с радиоактивным препаратом 32Р МЭЦ, который использовали в качестве реперного соединения. Было показано, что МЭЦ элюируется в виде одного пика по радиоактивности. Затем осуществляли хроматографию этанольных экстрактов клеток С. flavum ВСТИ 301, полученных соответственно после инкубации с редокс-медиатором бензилвиологеном (рис. 2) и без него (контроль). Показано, что хроматографические профили опыта и контроля по показателю содержания УФ-поглощающих веществ (по А 260 ) одинаковы: в том и в другом случаях обнаруживаются 3 пика веществ, которые были идентифицированы как производные нуклеотидов и других низкомолекулярных компонентов нуклеиновых кислот. Хроматографические профили опыта (см. рис. 2) и контроля по результатам анализа содержания радиоактивности в элюатах с колонки обнаруживали существенные различия.
На основе данных спектра 31Р-ЯМР-экстрактов из клеток Corynebacterium ammoniagenes ВСТИ 301 в присутствии бензилвиологена (см. опыт, рис. 2) и в его отсутствие (контроль) и сравнении с данными литературы [1-3], фосфорные соединения в экстракте клеток исследуемых бактерий, синтез которых индуцируется бензилвиологеном, нами идентифицирован как МЭЦ.
Для микробиологического синтеза МЭЦ микроорганизмы культивировали в ферментационной среде до конца логарифмической фазы роста и затем вводили водные растворы бен-зилвиологена двуххлористого до концентрации 75 мкг/л.
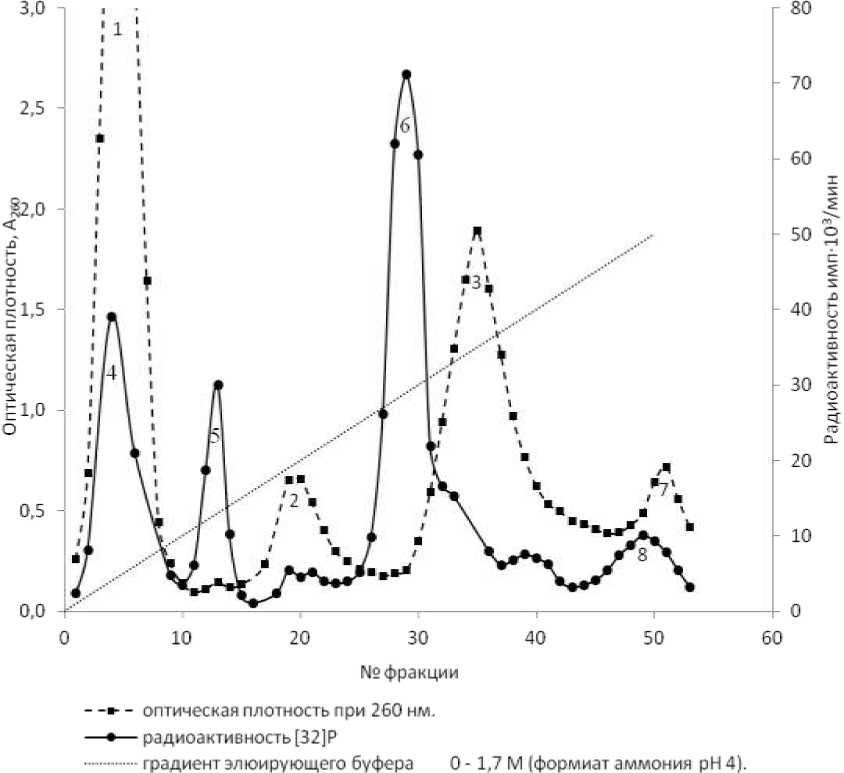
Рис. 2. Хроматография экстракта клеток Corynebacterium flavum ВСТИ 301 в присутствии бензилвиологена на колонке Dowex 1x4 (НСОО. 1,6 x 23 см): в градиенте 0-1,7 М формиата аммония, объем фракций 5 мл, скорость эпюции 1 мл/мин, температура 20 °С. 1,2,3,7 пики по оптической плотности при 260 нм, 4,5,6,8 пики по радиоактивности 32Р
Таблица 2
Содержание МЭЦ в биомассе коринеподобных бактерий, выращенных в среде, содержащей 1,5% глюкозы и инкубированных в присутствии бензилвиологена в концентрации 75 мкг
|
Микроорганизм |
Количество выросшей биомассы, г/л |
Содержание МЭЦ, мг/л культуральной жидкости |
Содержание МЭЦ. мг/г сырой биомассы |
|
Corynebacterium ammoniagenes АТСС 6872 |
11,6 |
320 ±30 |
27,8 ± 3 |
|
Corynebacterium ammoniagenes ВСТИ 403 |
12,4 |
330 ±30 |
26,7 ± 3 |
|
Corynebacterium flavum ВСТИ 301 |
11,4 |
347 ±35 |
30.5 ±3 |
|
Corynebacterium ammoniagenes ВСТИ 404 |
8,9 |
190 ±20 |
21,7±3 |
|
Corynebacterium insidiosum 224 |
7,8 |
36 ±3 |
4,7 ±3 |
Из данных таблицы 2 следует, что все исследуемые коринеподобные бактерии в ответ на окислительный стресс индуцируемый редокс медиатором осуществляет биосинтез МЭЦ.
Уровень накопления данного метаболита у разных культур микроорганизмов различается в существенной мере. В случае использования в ферментации С. flavum 301 выход МЭЦ
(30,5 мг/г) сырой биомассы высокий, что позволяет говорить о его сверхсинтезе и о том, что данный штамм-продуцент может быть использован для получения препаратов МЭЦ для потребностей фармацевтической биотехнологии.
Выводы
В клетках культур коринеподобных бактерий методом ЯМР обнаружены большое количество (8) сигналов фосфорных соединений, относимых к фосфомоноэфирам, ортофосфату, нуклеозидфосфатам и другим. В культурах в условиях окислительного стресса, индуцированного редокс-медиатором бензилвиологеном, количество сигналов уменьшается до трех, и появляется новый сигнал, относимый к 2-С-метил-Д-эритритол-2,4-циклодифосфату.
Различные культуры коринеподобных бактериий испытаны на способность синтезировать МЭЦ, отобран наиболее перспективный продуцент этого соединения.


