Синтез 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновой и 2-аллил-5-амино-1,2,4-триазин-6-карбоновой кислот
Автор: Рыбакова Анастасия Владимировна, Ким Дмитрий Гымнанович, Слепухин Павел Александрович, Чарушин Валерий Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.5, 2013 года.
Бесплатный доступ
При циклизации аллоксан-5-тиосемикарбазона под действием NaOH образуется смесь 3-меркапто-5-оксо-1,2,4-триазин-6-карбоновой кислоты и 3-оксо-5-амино-1,2,4-триазин-6-карбоновой кислоты, при взаимодействии которой с аллилбромидом в среде NaOH H 2O ДМСО образуется 2-аллил-5-амино-3-оксо-1,2,4-триазин-6-карбоновая кислота. Однореакторным синтезом получена 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновая кислота.
Аллоксан-5-тиосемикарбазон, 3-меркапто-5-оксо-1, 4-триазин-6-карбоновая кислота, 3-оксо-5-амино-1, 3-аллилтио-5-оксо-1, 2-аллил-5-амино-3-оксо-1, однореакторный синтез
Короткий адрес: https://sciup.org/147160265
IDR: 147160265 | УДК: 547.873
Текст научной статьи Синтез 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновой и 2-аллил-5-амино-1,2,4-триазин-6-карбоновой кислот
Соединения 1,2,4-триазинового ряда уже давно представляют интерес для научных исследований. Множество соединений этого ряда широко применяются в качестве гербицидов (в частности, это триазины, содержащие азот и серу в боковой цепи), инсектицидов и фунгицидов, а также в противоопухолевой терапии. Многие из них являются фармацевтическими ингредиентами антибактериальных, антималярийных, противовоспалительных, противовирусных, антипсориаз-ных, антигипертензивных, антиартритных и кокцидиостатических средств [1].
Тиосемикарбазоны изучаются особенно интенсивно с 50-х годов, так как многие из них обладают биологической активностью и используются в медицине. Например, монотиосемикарбазон N-метилизатина (метисазон) применяют для лечения вирусных заболеваний (в частности, герпеса), для профилактики оспы, он перспективен как противоопухолевый агент; многие тиосемикарбазоны используют для лечения туберкулеза. Металлические комплексы аллоксан-5-тиосемикарбазона обладают высокой бактерицидной активностью [2].
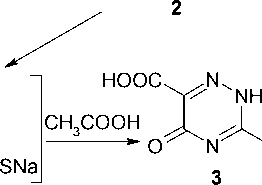
Тиосемикарбазоны легко циклизуются под действием оснований с образованием соответствующих 3-меркапто-1,2,4-триазинов [3]. В литературе [4] имеются данные, что при действии раствора NaOH на 5-тиосемикарбазон аллоксана ( 1 ) вместо 3-меркапто-5,6,7,8-тетрагидропиримидо[4,5-е]-[1,2,4]триазин-6,8-диона ( 2 ) образуется 3-меркапто-5-оксо-1,2,4-триазин-6-карбоновая кислота ( 3 ), свойства которой совершенно не изучены.
Целью настоящей работы является исследование взаимодействия соединения 3 и его аналогов с 3-бромпропеном.
Результаты и обсуждение
Синтез соединения 1 осуществлен взаимодействием аллоксана с тиосемикарбазидом или с его гидрохлоридом в водном растворе. При перекристаллизации соединения 1 из смеси ДМСО– Н2О нами получены монокристаллы. По результатам РСА, соединение кристаллизуется совместно с двумя молекулами ДМСО, которые разупорядочены по двум позициям (рис. 1). Длины связей и валентные углы в молекуле близки к опубликованным в работе [5] для несольватированно-го соединения 1. Так, в гетероциклическом фрагменте ярко выражено различие между C–N и С– С связями, обычно нивелированное в ароматических системах. При этом длины связей С(2)–С(3) и С(3)–С(4) гетероцикла составляют в среднем 1,47(1) Å, что типично для длин одинарных связей систем сопряжения, а не для ароматических связей. Молекула в целом плоская, конформация фиксирована внутримолекулярной водородной связью между атомом О(2) кетогруппы и NH-фрагментом гидразона (таблица). В кристаллической упаковке связанные межмолекулярными водородными связями (ММВС) димеры молекул упакованы в стопки, разделённые молекулами ДМСО, также вовлечёнными в систему ММВС. Образование димеров происходит посредством ММВС между аминогруппой гидразона и атомом О(1) кетогруппы, в то время как NH-группы гетероцикла участвуют в формировании ММВС с молекулами растворителя (рис. 2). Параметры водородных связей представлены в таблице.
Включение в кристалл молекул ДМСО приводит к значительной перестройке системы ММВС по сравнению с несольватированным кристаллом. Обращает на себя внимание отсутствие классических восьмиатомных циклических ММВС, описанных ранее для несольватированной структуры [5]. Атом кислорода в пара -позиции к гидразонному фрагменту в формировании ММВС участия не принимает. Отсутствуют укороченные π-контакты, наблюдающиеся в исходной структуре.
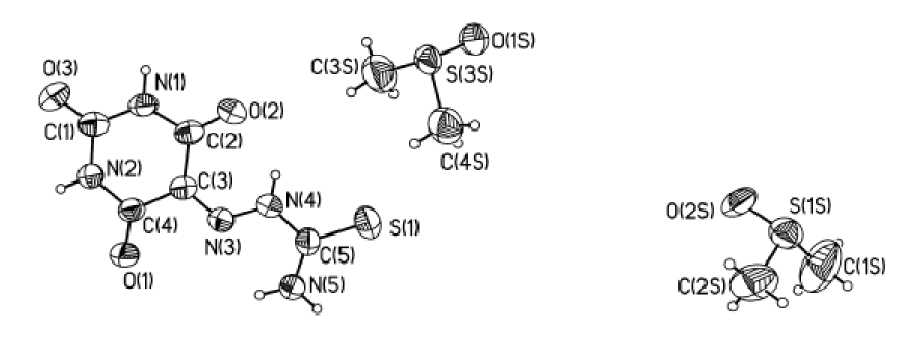
Рис. 1. Общий вид молекулы и принятая в структурном эксперименте нумерация атомов
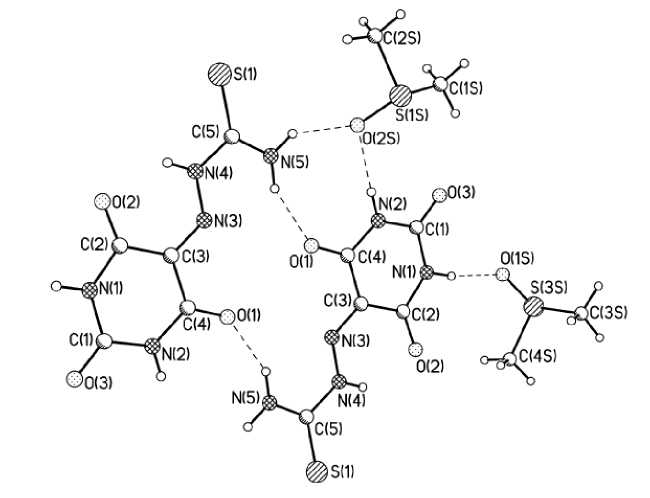
Рис. 2. Система ММВС в кристалле соединения 1
Водородные связи с H..A < r(A) + 2.000 Å и углом DHA > 110°
|
D–H |
d(D–H) |
d(H..A) |
|
d(D..A) |
A |
|
N(4) – H(2) |
0,840 |
2,004 |
135,12 |
2,666 |
O2 |
|
N(5) – H(4) |
0,897 |
2,070 |
150,35 |
2,883 |
O1 [ – x, – y+1, – z] |
|
N(1) – H(1) |
0,888 |
1,919 |
171,14 |
2,800 |
O1S [x+1/2, – y+1/2, z – 1/2] |
|
N(5) – H(3) |
0,900 |
2,044 |
145,55 |
2,832 |
O2S [x – 1/2, – y+1/2, z – 1/2] |
|
N(2) – H(6) |
0,863 |
1,986 |
177,70 |
2,848 |
O2S [ – x+1/2, y+1/2, – z+1/2] |
Органическая химия
Таким образом, как общая геометрия системы ММВС данного соединения в кристалле, так и центры формирования ММВС оказываются чувствительными к эффектам сольватации, что следует учитывать при создании расчётных структурных моделей взаимодействия данного соединения с ближним окружением, таким как активные центры белковых структур.
В работе [4] на основании элементного анализа авторы предполагают, что продуктом циклизации тиосемикарбазона 1 под действием NaOH при комнатной температуре в течение суток является 3-меркапто-5-оксо-1,2,4-триазин-6-карбоновая кислота ( 3 ) с выходом 50 %. По-видимому, промежуточным продуктом является соединение 2 , при гидролизе которого по связям 4а–5 и 7–8 образуется соединение 3 .
Мы повторили синтез соединения 3 , но реакцию проводили при кипячении в течение 3 часов и полученный продукт подвергли действию с аллилбромидом в системе NaOH–H2O–ДМСО. Неожиданно для нас вместо 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновой кислоты ( 4 ) из реакционной смеси была выделена 2-аллил-5-амино-3-оксо-1,2,4-триазин-4-карбоновая кислота ( 5 ):
HOOC N
H
N
HOOC tC
H2N N O
CO2
N
H2N N O
Br
NH
NaOH H2O DMSO
H2N N O
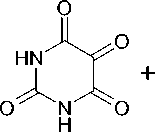
H2N
H 2 N
NH H2O HN
O
H NN
O 8 1
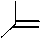

O N OH 2 N H

S NaOH
HN
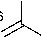
ON
H
N 2 N
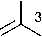
HN N
ONS H
tC
HOOC N
N
Br
CO2
ONS H
HOOC N
ON
NH
4a N SNa
SH
Образование соединения 5 можно объяснить следующим образом. При циклизации тиосемикарбазона 1 в указанных выше условиях образуется не только кислота 3 , но и 3-оксо-5-амино-1,2,4-триазин-6-карбоновая кислота ( 6 ), при аллилировании которой и образуется соединение 5 . В свою очередь, кислота 6 образуется при гидролизе промежуточного соединения 2 по связям 5– 6 и 7–8, а также по связи С–S. Следует отметить, что разрыв связи 5–6 более выгоден, чем 4а–5, так как в последнем случае атом азота связан с ароматическим кольцом.
Структура соединения 5 подтверждается данными ПМР и хроматомасс-спектрометрии. В спектре ЯМР 1Н соединения 5 имеются сигналы протонов N-аллильной группы.
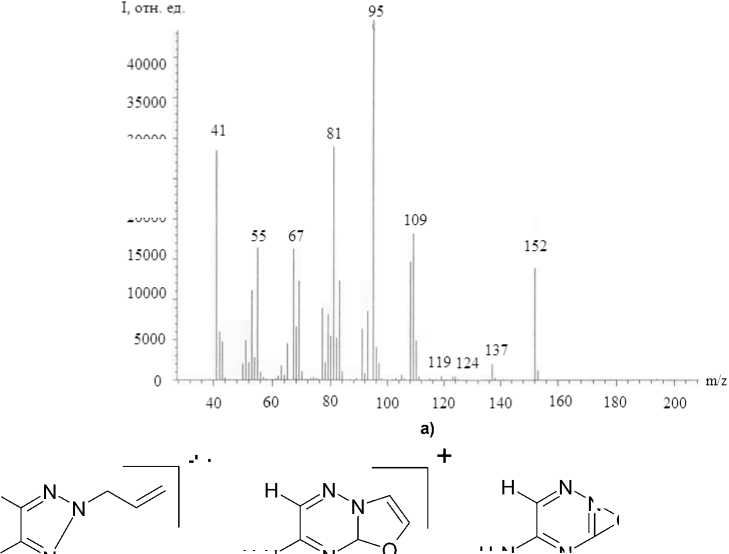
При исследовании соединения 5 методом хроматомасс-спектрометрии (ХМС, температура инжектора 250 °С) происходит декарбоксилирование с образованием 2-аллил-5-амино-3-оксо-1,2,4-триазина ( 7 ), структуре которого соответствует пик молекулярного иона с m/z= 152 (рис. 3а). Максимальным является пик с m/z= 95, который соответствует отщеплению аллилоксирадикала. По-видимому, под действием электронного удара происходит обратимая перегруппировка соединения 5 , аллильная группа переходит с атома азота на атом кислорода. В масс-спектре соединения 5 имеются пики, соответствующие отщеплению М-СО ( m/z =124), M-NHCO ( m/z =109), М CIC ( m/z =137). Масс-спектр и схема фрагментации представлены на рис. 3.
H 2 N
H
+ .
N O
N
N
H
N
N
N m/z = 111
m/z = 124
H2N
H 2 N
30000 ■
+
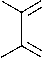
N +
N
H
N
H2N

m/z = 137
m/z =95
+ . - C=O
. CH2CH=CH2
.
- O-CH2CH=CH2
HN m/z = 109
H2N
+ .
+ .
H
- HN=C=O
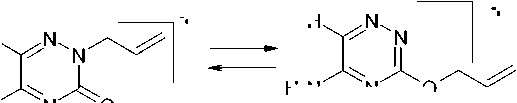
H
O
N
H2N
m/z = 152
б)
Рис. 3. Масс-спектр (а) и схема фрагментации (б) соединения 7
Нам удалось получить 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновую кислоту ( 4 ) в более мягких условиях, однореакторным синтезом из соединения 1 . Сущность его в данном случае заключается в том, что тиосемикарбазон 1 растворяют в 2н NaOH и кипятят в течение 5 часов, а затем добавляют к полученному раствору бромистый аллил и бромид бензилтриэтиламмония в качестве межфазного катализатора и перемешивают при комнатной температуре. Соединение 4 выпадает при добавлении к реакционной смеси концентрированной уксусной кислоты до нейтральной среды.
В спектре ЯМР 1Н соединения 4 имеются протоны S-аллильной группы, а в ИК-спектре – интенсивные полосы поглощения карбонильной группы при 1613 см–1 и гидроксильной группы при 3104 см–1.
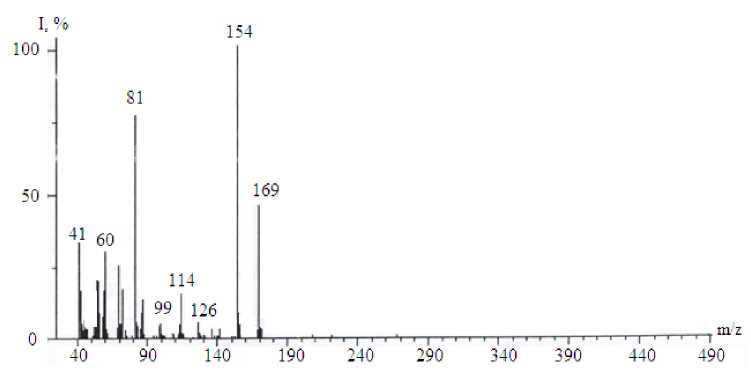
При проведении масс-спектрометрии так же, как и с соединением 5 , происходит декарбоксилирование соединения 4 и образуется катион-радикал 3-аллилтио-5-оксо-1,2,4-триазин ( 8 ). В масс-спектре его имеется пик молекулярного иона m/z= 169 и характерный для S-аллильных соединений [6] максимальный по интенсивности пик М-•СН3 ( m/z= 154). Также в спектре наблюдаются пики, соответствующие отщеплению M-NHCO ( m/z =126), M-CO-HCN ( m/z =114). При отщеплении от молекулярного иона 2 Н -1,2-диазетона-3 (C2H2N2O, m/z =70) образуется ка-тион-радикал аллилтиоцианата (C4H5NS, m/z= 99). Масс-спектр и схема фрагментации показаны на рис. 4.
Органическая химия
+
HN
a)
.

N
HN


+.
H
+ N
m/z = 114
O
N H
HN
+
H
HN
+
S
O
HN
- C=O,
HC N
.
- CH3
m/z = 154
+.
- . SH
+
O
m/z = 81
N N
N H

S
+.
N
- HN=C=O
N
m/z = 169
m/z = 126
- C4H5NS
+.
H
NH
m/z = 70
- C2H2N2O
NS

m/z = 99
- HC N
+.
б)
Рис. 4. Масс-спектр (а) и схема фрагментации (б) соединения 8
Заключение
Нами установлено, что при действии NaOH на аллоксан-5-тиосемикарбазон при нагревании образуется смесь 3-оксо-5-амино-1,2,4-триазин-6-карбоновой кислоты ( 6 ) и 3-меркапто-5-оксо-1,2,4-триазин-6-карбоновой кислоты ( 3 ). При взаимодействии смеси соединений 3 и 6 с аллил-бромидом в среде NaOH–H 2 O–ДМСО выделена 2-аллил-5-амино-3-оксо-1,2,4-триазин-4-карбоновая кислота ( 5 ). 3-Аллилтио-5-оксо-1,2,4-триазин-6-карбоновая кислота получена однореакторным синтезом из аллоксан-5-тиосемикарбазона, NaOH, бромистого аллила в присутствии межфазного катализатора (ТЭБАБ).
Экспериментальная часть
Спектры ЯМР 1Н растворов веществ в ДМСО-d6 получены на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС. ИК-спектры сняты на спектрофотометре Varian 800FT-IR Scimitar Serias. Масс-спектры сняты на приборе ГХ/МС-ЭВМ фирмы HEWLETT PACKARD, газовый хроматограф HP-5890, серия II, масс-селективный детектор MSD-5972, станция контроля и обработки данных HP-G1034C, капиллярная колонка HP-5 MS 30 м 0,25 мм.
Рентгеноструктурное исследование выполнено по стандартной процедуре на дифрактометре Xcalibur 3, оборудованном CCD детектором (λMoК α =0,71073 Å, графитовый монохроматор, 295(2)K, ω-сканирование, размер шагов сканирования – 1o, время измерения фрейма – 20 с). Для анализа соединения использован обломок светло-жёлтого кристалла 0,45×0,28×0,18 мм. Поправка на поглощение не вводилась. Структура расшифрована прямым методом и уточнена полноматричным МНК по F2 с использованием программного пакета SHELXTL97 [7] в анизотропном полноматричном приближении для неводородных атомов. Атомы водорода C–H связей добавлены в геометрически рассчитанные положения и включены в уточнение в изотропном приближении с зависимыми тепловыми параметрами в модели «наездника», атомы водорода N–H-групп уточнены независимо в изотропном приближении. По результатам РСА, кристалл моноклинный, пр.гр. P2 1 /n, a=5,2533(3) Å, b=28,1089(15) Å, c=11,3569(4) Å, β=94,091(4)о, V=1672,74(14) Å3, Z=4 для брутто-формулы C 9 H 17 N 5 O 5 S 3 , d calc =1,475 г/см3, μ=0,471 мм–1, F(000)=736. На углах сканирования 2,90 < θ < 26,37о собрано 6529 отражений, из них 3325 независимых (R int =0,0297), 1555 с I>2σ(I), комплектность для θ=26,37о – 96,8 %. Окончательные параметры уточнения: R 1 =0,0385, wR 2 =0,0604 (для отражений с I>2σ(I)), R 1 =0,1032, wR 2 =0,0662 (для всех отражений) при факторе добротности S=0,999. Δρ ē (min/max)=0,208/–0,176 ēÅ–3.
Полный набор кристаллографических данных депонирован в Кембриджском банке структурных данных (CCDC 945454) и доступен по адресу (or from the CCDC, 12 Union Road, Cambridge CB2 1EZ, UK; fax: +44 1223 336033; e-mail: .
Аллоксан - 5-тиосемикарбазон (2) . К раствору 2,937 г (0,021 моль) аллоксана в 2 мл воды добавляют 2,68 г (0,021 моль) тиосемикарбазида и нагревают до растворения. После охлаждения отфильтровывают ярко-оранжевый осадок, промывают водой и сушат. Выход 84 %, Т пл >300 °С.
3-Аллилтио-5-оксо-1,2,4-триазин-6-карбоновая кислота (4) . Раствор 1,026 г (4,8 ммоль) тиосемикарбазона 2 в 10,5 мл 2н NaOH кипятят в течение 5 часов. Полученный желтый раствор фильтруют и к фильтрату добавляют 0,041 мл (4,8 ммоль) бромистого аллила и 50 мг триэтил-бензиламмоний бромида (ТЭБАБ) и перемешивают в течение 3 часов. Полученный раствор нейтрализуют уксусной кислотой и отфильтровывают образующийся осадок. Выход 30 %, Т пл =190 °С. ИК-спектр, υ, см–1: 1613 (С=О), 3104 (ОН) . Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 3,69 (2Н, д, J =6,8, SCH 2 ); 5,06 (1Н, д.д., J =10,0, J =1,7, =СН 2 ); 5,26 (1Н, д.д., J =1,7, J =16,9; =CН 2 ); 5,93 (1Н, м, СН=).
2-Аллил-5-амино-3-оксо-1,2,4-триазин-4-карбоновая кислота (5) . К раствору 0,395 г NaOH в 5 мл воды добавляют 1,016 г (4 ммоль) тиосемикарбазона 2 и кипятят 3 ч. После охлаждения раствор нейтрализуют уксусной кислотой. Образовавшийся осадок отфильтровывают и добавляют в раствор 0,2 г NaOH в 2 мл воды и 10 мл ДМСО. К полученному раствору приливают 0,605 г(5 ммоль) бромистого аллила и перемешивают при комнатной температуре в течение 1 ч. Упаривают досуха и экстрагируют ацетоном. После испарения ацетона получают 0,31 г масла. Выход 34 %. Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 3,90 (2Н, д, J =6,6, NCH 2 ); 5,20 (1Н, д.д., J =9,8, J =1,5, =СН 2 ); 5,41 (1Н, д.д., J =1,5, J =16,4; =CН 2 ); 5,98 (1Н, м, СН=).
Список литературы Синтез 3-аллилтио-5-оксо-1,2,4-триазин-6-карбоновой и 2-аллил-5-амино-1,2,4-триазин-6-карбоновой кислот
- Charushin, V.N. 1,2,4-Triazines and their Benzo Derivatives/V.N. Charushin, V.L. Rusinov, O.N. Chupakhin//Comprehensive heterocyclic chemistry III. 2008. Vol. 9. P. 95-196.
- Synthesis, characterization and antibacterial activity of Alloxanthosemicarbazone Au(III) complexes/Prasanna Kumari Y.A.S.J., J. Sai Chandra, B. Sreenivasa Rao, Y. Sunandamma//Journal of Current Pharmaceutical Research. 2012. 10 (1). P. 28-33.
- Лигранович, Л.Н. 1,2,4 триазин/Л.Н. Лигранович, В.К. Промоненков//Итоги науки и техники. Серия «Органическая химия». 1990. Т. 22.
- Heinisch, L. Uber 2,4-dioxotetrahydro-6-aza pteridine/L. Heinisch, W. Ozegowski, M. Muhlstadt//Chem. Ber. 1964. № 1. P. 5-15.
- 1-(2,4,6-Trioxo-1,3-diazinan-5-ylidene)-thiosemicarbazide/V.C.D. Bittencourt, V.C. Gervini, L. Bresolin et al.//Acta Crystallographica Section E: Structure Reports Online. 2012. E68, o1187.
- Sheldrick, G.M. A short history of SHELX/G.M. Sheldrick,//Acta Crystallogr. 2008. A64, 112.
- Судолова, Н.М. Синтез новых S-производных 2-меркаптобензотиазола/Н.М. Судалова, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». 2011. Вып. 5. № 12 (229). С. 23-28.


