Синтез 3-фторфенилацетата тетрафенилсурьмы из пентафенилсурьмы и бис(3-фторфенилацетато)трифенилсурьмы
Автор: Шарутин В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.17, 2025 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств пентафенилсурьмы и бис (3-фторфенилацетато)трифенилсурьмы в бензоле получен с выходом 92 % 3-фторфенилацетат тетрафенилсурьмы (1), который был идентифицирован методами ИК-спектроскопии и рентгеноструктурного анализа. РСА проводили на дифрактометре D8 QUEST фирмы Bruker, кристаллографические характеристики элементарной ячейки соединения следующие: пространственная группа моноклинная С с, а = 10,2427(6), b = 17,7825(7), c = 14,6472(5) Å, β = 95,260(4), V = 2656,60(17) Å3, Z = 4, ρвыч = 1,458 г/см3, m = 1,072 мм-1, F (000) = 1176,0, размер кристалла 0,32 ´ 0,2 ´ 0,09 мм, диапазон сбора данных по 2θ, град: 6,952-56,992, диапазон индексов -13 ≤ h ≤ 12, -19 ≤ k ≤ 23, -19 ≤ l ≤ 19, число измеренных рефлексов 9906, число независимых рефлексов 4334, R int = 0,0228, GOOF = 1,139, число параметров 330, R 1 = 0,0350, wR 2 = 0,1042. По данным РСА, атомы сурьмы в соединении имеют искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатной группы в аксиальном положении. Аксиальный угол СSbO составляет 175,9(2)º. Сумма экваториальных углов CSbC равна 357,1(9)º, расстояния Sb-Сэкв [2,109(7), 2,117(5), 2,146(5) Å] значительно короче длин связей Sb-Сакс [2,194(7) Å] и Sb-O [2,244(4) Å]. Организация молекул в кристалле соединения 1 обусловлена водородными связями и СН××× π -взаимодействиями колец арильных и карбоксильных лигандов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2055555; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Пентафенилсурьма, бис(3-фторфенилацетато)трифенилсурьма, 3-фторфенилацетат тетрафенилсурьмы, синтез, реакция перераспределения лигандов, строение
Короткий адрес: https://sciup.org/147248059
IDR: 147248059 | УДК: 546.865 | DOI: 10.14529/chem250119
Текст краткого сообщения Синтез 3-фторфенилацетата тетрафенилсурьмы из пентафенилсурьмы и бис(3-фторфенилацетато)трифенилсурьмы
Аннотация. Взаимодействием эквимолярных количеств пентафенилсурьмы и бис(3-фторфенилацетато)трифенилсурьмы в бензоле получен с выходом 92 % 3-фторфенилацетат тет-рафенилсурьмы (1), который был идентифицирован методами ИК-спектроскопии и рентгеноструктурного анализа. РСА проводили на дифрактометре D8 QUEST фирмы Bruker, кристаллографические характеристики элементарной ячейки соединения следующие: пространственная группа моноклинная Сс, а = 10,2427(6), b = 17,7825(7), c = 14,6472(5) Å, β = 95,260(4), V = 2656,60(17) Å3, Z = 4, Рвыч = 1,458 г/см3, ц = 1,072 мм-1, F(000) = 1176,0, размер кристалла 0,32 х 0,2 х 0,09 мм, диапазон сбора данных по 20, град: 6,952-56,992, диапазон индексов -13 < h < 12, -19 < k < 23, –19 ≤ l ≤ 19, число измеренных рефлексов 9906, число независимых рефлексов 4334, Rint = 0,0228, GOOF = 1,139, число параметров 330, R1 = 0,0350, wR2 = 0,1042. По данным РСА, атомы сурьмы в соединении имеют искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатной группы в аксиальном положении. Аксиальный угол СSbO составляет 175,9(2)º. Сумма экваториальных углов CSbC равна 357,1(9)º, расстояния Sb–Сэкв [2,109(7), 2,117(5), 2,146(5) Å] значительно короче длин связей Sb–Сакс [2,194(7) Å] и Sb–O [2,244(4) Å]. Организация молекул в кристалле соединения 1 обусловлена водородными связями и СН--- п -взаимодействиями колец арильных и карбоксильных лигандов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2055555; или .
Начало изучения реакций перераспределения лигандов в ряду арильных соединений пятивалентной сурьмы относится к 1974 г., когда Фергюсон и Хавли при перекристаллизации дигидроксида трифенилсурьмы из хлороформа в атмосфере воздуха наблюдали образование карбоната бис (тетрафенилсурьмы) [1]. Очевидно, что формирование фрагмента Ph 4 Sb можно объяснить только обменом фенильных заместителей между атомами сурьмы. Изучая строение производного сурьмы, полученного из дихлорида трифенилсурьмы и оксалата серебра, Соверби с Миллин-гоном показали, что данное соединение имеет солеобразное строение [Ph 4 Sb][Ph 2 Sb(Ox) 2 ] (Ох = О 2 ССО 2 ) и предположили, что оно может быть получено из дихлорида трифенилсурьмы [2].
Решив исследовать взаимодействие пентаарилсурьмы с производными общей формулы Ar3SbX2 (Х - электроотрицательный лиганд) авторы [3] полагали, что будет иметь место либо образование комплексов ионного типа, либо перераспределение органических радикалов и синтез производных несимметричного строения. Действительно обнаружено, что пентафенилсурьма реагирует с дигалогенидами, дибензоатом и дироданидом трифенилсурьмы с образованием продуктов несимметричного строения – галогенида, бензоата и роданида тетрафенилсурьмы соответственно, с выходом до 99 %. С помощью этого эффективного способа синтеза производных сурьмы общей формулы Ar 4 SbX (Х – электроотрицательный лиганд) были получены роданиды, нитраты, карбоксилаты, сульфонаты, оксиматы и ароксиды тетраарилсурьмы [4–27]. Преимуществом данного метода синтеза соединений Ar 4 SbX является высокий выход и легкость выделения целевого продукта, а также мягкие условия проведения реакции.
С целью продолжения изучения реакции перераспределения лигандов в ряду арильных соединений пятивалентной сурьмы изучено взаимодействие эквимолярных количеств пентафенилсурьмы с бис (3-фторфенилацетато)трифенилсурьмой в бензоле.
Экспериментальная часть
Синтез 3-фторфенилацетата тетрафенилсурьмы ( 1 ) осуществляли по методике реакции перераспределения лигандов, описанной в работах [27,28].
3-Фторфенилацетат тетрафенилсурьмы (C 6 H 5 ) 4 SbOC(O)CH 2 C 6 H 4 F-3 (1): бледно-желтые кристаллы, выход 92 %, Т пл = 146 °С. ИК-спектр ( ν , см–1): 3107, 3061, 2974, 2927, 1639, 1612, 1587, 1477, 1436, 1311, 1298, 1276, 1269, 1247, 1186, 1159, 1145, 1136, 1064, 1020, 997, 962, 929, 918, 875, 781, 742, 732, 721, 702, 690, 642, 578, 522, 470, 457, 445, 424. Найдено (%): C 65,75; H 4,52. Для C 32 H 26 FO 2 Sb вычислено (%): C 65,89; H 4,50.
ИК-спектр соединения 1 записывали на ИК-спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
РСА кристалла 1 проведен на дифрактометре D8 Quest фирмы Bruker (Mo K α-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT- Plus [29]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [30] и OLEX2 [31]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов.
Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, основные длины связей и валентные углы - в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2055555; или .
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Длины связей и валентные углы в структуре 1
Таблица 1
|
Параметр |
1 |
|
Стехиометрическая формула |
C 32 H 26 FO 2 Sb |
|
М |
583,28 |
|
Сингония |
Моноклинная |
|
Пространственная группа |
С с |
|
a , Å |
10,2427(4) |
|
b , Å |
17,7825(7) |
|
c, Å |
14,6472(5) |
|
α , град. |
90,00 |
|
β, град. |
95,260(4) |
|
γ , град. |
90,00 |
|
V , Å3 |
2656,60(17) |
|
Z |
4 |
|
ρ выч, г/см |
1,458 |
|
µ , мм–1 |
1,072 |
|
F (000) |
1176,0 |
|
Размер кристалла, мм |
0,32 × 0,2 × 0,09 |
|
Диапазон сбора данных по 2 θ , град. |
6,952–56,992 |
|
Диапазон индексов |
–13 ≤ h ≤ 12, –19 ≤ k ≤ 23, –19 ≤ l ≤ 19 |
|
Число измеренных рефлексов |
9906 |
|
Чисто независимых рефлексов |
4334 |
|
R int |
0,0228 |
|
GOOF |
1,139 |
|
Число параметров |
330 |
|
R -факторы по I > 2 σ ( I ) |
R 1 = 0,0350, wR 2 = 0,1042 |
|
R -факторы по всем рефлексам |
R 1 = 0,0374, wR 2 = 0,1078 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,80/–0,91 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb(1)–O(1) |
2,244(4) |
C(31)‒Sb(1)‒O(1) |
175,9(2) |
|
Sb(1)–C(11) |
2,146(5) |
C(21)‒Sb(1)‒C(11) |
121,7(3) |
|
Sb(1)–C(31) |
2,194(7) |
C(1)‒Sb(1)‒C(11) |
116,5(3) |
|
Sb(1)–C(21) |
2,117(5) |
C(1)‒Sb(1)‒C(21) |
118,9(3) |
|
Sb(1)–C(1) |
2,109(7) |
С(48)‒O(1)‒Sb(1) |
122,3(4) |
|
O(1)–C(48) |
1,280(8) |
O(1)‒C(48)‒C(47) |
113,7(6) |
|
O(2)–C(48) |
1,218(9) |
O(2)‒C(48)‒O(1) |
126,1(6) |
|
С(48)–C(47) |
1,558(10) |
O(2)‒C(48)‒C(47) |
120,2(6) |
|
F(1)–C(43) |
1,355(13) |
C(41)‒C(47)‒C(48) |
111,6(5) |
|
Sb(1)∙∙∙O(2) |
3,371(11) |
F(1)‒C(43)‒C(42) |
118,3(10) |
Обсуждение результатов
Известно, что реакции перераспределения лигандов с участием пентафенилсурьмы и дикарбоксилата трифенилсурьмы, независимо от соотношения исходных реагентов протекают с образованием ониевых производных сурьмы Ph 4 SbOC(O)R [3–8]. В продолжение настоящей работы исследовано взаимодействие эквимолярных количеств пентафенилсурьмы и бис (3-фторфенилацетато)трифенилсурьмы, единственным продуктом которого являлcя 3-фторфенилацетат тетрафенилсурьмы ( 1 ), выделенный из реакционной смеси с выходом 92 %.
PhH
Ph 5 Sb + Ph 3 Sb[OC(O)CH 2 C 6 H 4 F-3] 2 ^ 2 Ph 4 SbOC(O)CH 2 C 6 H 4 F-3
Наличие в ИК-спектре полученного комплекса интенсивной полосы поглощения в области валентных колебаний карбонильных групп (1639 см–1), свидетельствует о присутствии в нем карбонильной группы [32]. В ИК-спектре 1 также присутствуют полосы поглощения валентных колебаний фрагмента SbC4 при 457, 445 см–1 и полосы валентных колебаний углеродного скелета арильных групп (1477, 1436 см–1). Валентным колебаниям связей CAr–H отвечают полосы поглощения средней интенсивности при 3107 и 3061 см–1, а внеплоскостным деформационным колебаниям этих же связей – интенсивные полосы при 732 и 702 см–1.
С целью подтверждения строения комплекса 1 было проведено его рентгеноструктурное исследование. По данным РСА атом сурьмы в соединении 1 имеет тригонально-бипирамидальную координацию (см. рисунок).
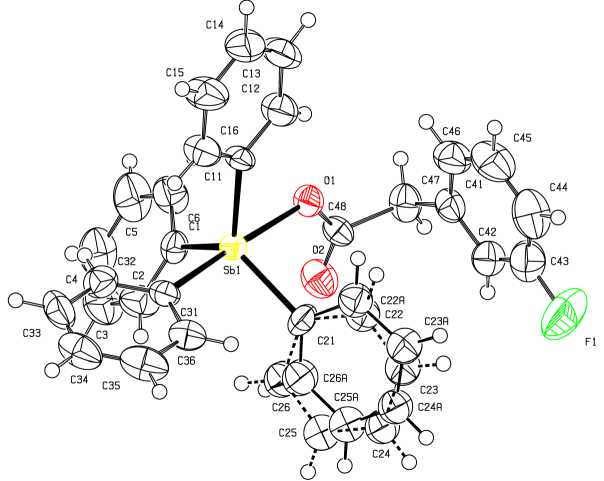
Строение 3-фторфенилацетата тетрафенилсурьмы (1)
В аксиальном положении находится атом кислорода ацилатного заместителя, угол OSbС акс равен 175,9(2) ° (табл. 2). Интервал валентных углов ОSbСэкB составляет 82,25(19)-87,1(2)°, атом сурьмы выходит из экваториальной плоскости на 0,211 Å в сторону аксиального атома углерода. Сумма углов CSbC в экваториальной плоскости равна 357,1 ° , при этом углы между экваториальными арильными заместителями неравноценны и составляют 116,5(3), 118,9(3), 121,7(3) ° . Длины связей Sb–C экв [2,109(7)–2,146(5) Å] меньше расстояния Sb–C акс [2,194(7) Å]. Расстояние Sb–O составляет 2,244(4) Å и близко к подобным расстояниям в карбоксилатах тетраарилсурьмы [33]. В молекуле соединения 1 , как и в других ацилатах тетраарилсурьмы, расстояние между атомом сурьмы и атомом кислорода карбонильной группы Sb --- O=C [3,371(9) А] меньше суммы ван-дер-ваальсовых радиусов соответствующих атомов (3,7 Å [34]). Отметим, что в отличие от большинства карбоксилатов тетраарилсурьмы, в которых контакт центрального атома металла с карбонильным атомом кислорода располагается внутри наибольшего угла CSbC [33], контакт Sb --- O=C располагается внутри угла C(1)Sb(1)C(21), составляющего 118,9(3) ° .
Выводы
Таким образом, взаимодействием пентафенилсурьмы с бис (3-фторфенилацетато)трифенилсурьмой в бензоле с выходом 92 % получен 3-фторфенилацетат тетрафенилсурьмы ( 1 ), который был идентифицирован методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, атомы сурьмы в соединении 1 имеют искаженную тригонально-бипирамидальную координацию с атомом кислорода в аксиальном положении, при этом наличие внутримолекулярного контакта между атомом сурьмы и атомом кислорода карбонильной группы Sb ⋅⋅⋅ О=С [3,371(9) Å] позволяет говорить об увеличении координационного числа атома сурьмы до 6.


