Синтез ацетанилидов - производных 2-тио-6-фенилурацила как вероятных анти-ВИЧ-1 агентов
Автор: Озеров А.А., Новиков М.С., Солодунова Г.Н., Парамонова М.П.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 4 (28), 2010 года.
Бесплатный доступ
Обработкой 2-тио-6-фенилурацила хлорацетанилидамидами, содержащими различные заместители в ароматическом кольце, осуществлен синтез новых 2-[(1,6-дигидро-6-оксо-4-фенил-2-пиримидинил)тио]-N-фенил-ацетамидов, выход которых составил 35-81 %. Данные соединения представляют интерес в качестве потенциальных анти-ВИЧ-1 агентов.
Синтез, 2-тиоурацил, s-алкилирование, потенциальные противовирусные агенты
Короткий адрес: https://sciup.org/142148857
IDR: 142148857 | УДК: 615.3:547.854.4
Текст научной статьи Синтез ацетанилидов - производных 2-тио-6-фенилурацила как вероятных анти-ВИЧ-1 агентов
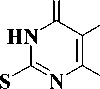
S-Алкилпроизводные 2-тиоурацилов 1 — это семейство ненуклеозидных ингибиторов обратной транскриптазы вируса иммунодефицита человека типа 1 (ВИЧ-1), которые проявляют ингибиторную активность в отношении ВИЧ-1 в клеточной культуре в наномолярных концентрациях [2, 7, 8, 10]. Основным недостатком, препятствующим внедрению данных соединений в клиническую практику, является быстрое развитие к ним резистенции вируса.
Анализ литературных данных показал [4, 5, 9], что производные триазола 2 и тетразола 3, имеющие в составе боковой цепи амидный фрагмент, проявляют мощную анти-ВИЧ-1 активность в клеточной культуре как в отношении дикого штамма, так и в отношении наиболее важных клинических изолятов вируса, устойчивых к действию известных ненуклеозидных ингибиторов. Однако данный ряд соединений имеет низкую биодоступность, что существен- но ограничивает его применение.
O
R
Alkyl
Aryl
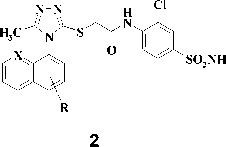
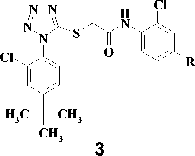
Рис. 2. R = алкил, алкинил, арил
Рис. 1. R = циклоалкил, бензил, 2-оксо-2-фенилэтил
В связи с этим особый интерес для нас представлял синтез химерных аналогов 1 — 3 , содержащих в своей структуре как пиримидиновый цикл, так и амидный фрагмент в боковой цепи у атома серы. Соединения данного ряда до настоящего времени в литературе описаны не были. По этой причине они являются интересным и многообещающим классом соединений, способных ингибировать репродукцию ВИЧ-1 как дикого штамма, так его клинически важные мутантные изоляты.
ЦЕЛЬ РАБОТЫ
Синтез новых производных 2-тиоурацила, который представлен на рис. 3.
R1 'll NH + Cl HN K2CO3
R2 NSO R3 ДМФА
H 68-81 %
4 5
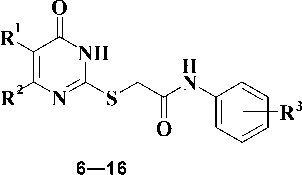
Рис. 3. R1 = H, CH2Ph, CH2(2,5-Me2C6H3), CH2(2,4-Cl2C6H3);
R2 = CH3, Ph; R3 = H, Me, OMe, OРh, (CH3)N.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker DRX-500» (500 МГц) в ДМСО-D6, внутренний стандарт ТМС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пластинах Silufol UV-254, проявление в парах иода. В качестве элюента использовали этилацетат. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
Общий метод получения 2-[(1,6-Дигидро-6-оксо-4-фенил-2-пиримидинил)тио]-N-фенил-ацетамидов (6—16). Смесь 7,34 ммоль 2-тио-урацила 2 и 1,5 г (10,85 ммоль) карбоната калия в 10 мл ДМФА перемешивают при 70—80 °С в течение 1 ч, охлаждают до комнатной температуры, добавляют раствор 7,34 ммоль хлорацетанилида 3 в 10 мл ДМФА, перемешивают при той же температуре еще 5 ч и оставляют на ночь. Затем реакционную массу фильтруют, фильтрат упаривают в вакууме, остаток обрабатывают 100 мл холодной воды, образовавшийся остаток отфильтровывают, сушат на воздухе и перекристаллизовывают из смеси ацетон-ДМФА.
2-[(1,6-Дигидро-6-оксо-4-фенил-2-пиримиди-нил)тио]-N-фенилацетамид (6) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 4,13 c (2H, CH2); 6,66 c (1H, H-5); 7,00-7,04 м (1H, ароматические Н); 7,22-7,41 м (5H, C6Н5); 7,53-7,60 м (2Н, ароматические Н); 7,98-8,01 м (2H, ароматические Н); 10,39 c (1H, NH); 12,83 уш. c (1H, NH).
2-[(1,6-Дигидро-6-оксо-4-фенил-2-пиримиди-нил)тио]-N-(2-метилфенил)ацетамид (7) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,08 с (3H, CH3); 4,20 c (2H, CH2); 6,69 c (1H, H-5); 7,05-7,14 м (2H, H-4’, H-5’); 7,36 м (5H, C6Н5); 8,08 д (2H, J = 5, H-3’, H-6’); 9,63 c (1H, NH); 12,81 уш. c (1H, NH).
2-[(1,6-Дигидро-6-оксо-4-фенил-2-пирими-динил)тио]-N-(4-метилфенил)ацетамид (8) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,20 с (3H, CH3); 4,11 c (2H, CH2); 6,65 c (1H, H-5); 7,07 д (2H, J = 8, H-3’, H-5’); 7,24-7,47 м (5H, C6Н5); 8,00 д (2H, J = 7.5, H-2’, H-6’); 10,28 c (1H, NH); 12,79 уш. c (1H, NH).
2-[(1,6-Дигидро-6-оксо-4-фенил-2-пиримиди-нил)тио]-N-(2-метоксифенил)ацетамид (9) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 3,63 с (3H, CH3); 4,19 c (2H, CH2); 6,72 c (1H, H-5); 6,81-7,03 м (3H, ароматические Н); 7,29-7,44 м (3H, ароматические Н); 7,988,06 м (3H, ароматические Н); 9,49 c (1H, NH); 12,82 уш. c (1H, NH).
2-[(1,6-Дигидро-6-оксо-4-фенил-2-пиримиди-нил)тио]-N-(2-феноксифенил)ацетамид (10) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 4,14 c (2H, CH2); 6,62 c (1H, H-5); 6,77-6,84 м (3H, ароматические Н); 7,007,07 м (3H, ароматические Н); 7,24-7,39 м (5H, С6Н5); 7,96-8,03 м (3Н, ароматические Н); 9,80 c (1H, NH); 12,74 уш. c (1H, NH).
2-[(1,6-Дигидро-6-оксо-5-бензил-4-фенил-2-пиримидинил)тио]-N-фенилацетамид (11) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 3,68 с (2Н, CH2Ph); 3,98 с (2H, CH2); 6,90-7,28 м (13Н, ароматические Н); 7,43-7,50 м (2Н, ароматические Н); 10,15 с (1H, NH); 12,92 уш. c (1H, NH).
2-[(1,6-Дигидро-6-оксо-5-бензил-4-метил-2-пиримидинил)тио]-N-(2-метоксифенил)ацетамид (12) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,11 с (3Н, СН3); 2,14 с (3Н, СН3); 3,70 с (2Н, CH2Ph); 4,04 с (2H, CH2); 7,04-7,30 м (9Н, ароматические Н); 9,55 c (1H, NH); 12,74 уш. c (1H, NH).
2-[[1,6-Дигидро-6-оксо-5-(2,5-диметилбен-зил)-4-метил-2-пиримидинил]тио]-N-фенил-ацетамид (13) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,00 с (3Н, СН3); 2,08 с (3Н, СН3); 2,20 с (3Н, СН3); 3,56 с (2Н, CH2Ar); 4,03 с (2H, CH2); 6,46 с (1Н, H-6’); 6,81 д (1Н, J = 7,5, H-3’); 6,95-7,02 м (2Н, ароматические Н); 7,24 т (2Н, J = 7,5, ароматические Н);
7,49-7,52 м (2Н, ароматические Н); 10,21 с (1H, NH); 12,68 уш. c (1H, NH).
2-[[1,6-Дигидро-6-оксо-5-(2,4-дихлорбен-зил)-4-метил-2-пиримидинил]тио]-N-фенил-ацетамид (14) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,03 с (3Н, СН3); 3,69 с (2Н, CH2Ar); 4,03 с (2H, CH2); 6,90 д (1Н, J = 8,4, H-6’); 6,97-7,02 м (1Н, ароматический Н); 7,22-7,27 м (3Н, ароматические Н); 7,46-7,53 м (3Н, ароматические Н); 10,21 с (1H, NH); 12,80 уш. c (1H, NH).
2-[[1,6-Дигидро-6-оксо-4-метил-2-пиримиди-нил]тио]-N-(4-диметиламинофенил)ацетамид (15) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,09 с (3Н, СН3); 2,79 с (6Н, NCH3); 3,96 с (2Н, СН2); 5,94 с (1Н, H-5); 6,62 д (2Н, J = 9, ароматические Н); 7,31 д (2Н, J = 9, ароматические Н); 9,89 с (1Н, NH); 12,57 уш.с (1Н, NH).
2-[[1,6-Дигидро-6-оксо-4-фенил-2-пиримиди-нил]тио]-N-(4-диметиламинофенил)ацетамид (16) . 1H ЯMР (DMSO-D6), δ, м.д., J (Гц): 2,77 с (6Н, NCH3); 4,06 с (2Н, СН2); 4,93 с (1Н, H-5); 6,62 д (2Н, J = 9, арил); 7,34 с (5Н, фенил); 7,99 д (2Н, J = 9, арил); 10,03 с (1Н, NH); 12,14 уш.с (1Н, NH).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Исходный 2-тиоурацил 4 алкилировали эквимолярным количеством хлорацетанилида 5 в соответствии с известными методами [1, 6]. Реакция протекала в растворе ДМФА в присутствии 1,45–1,5-кратного мольного избытка карбоната калия и вела исключительно к образованию 2-[(1,6-дигидро-6-оксо-4-фенил-2-пиримидинил)тио]-N-фенилацетамидов 6– 16 , выход которых составил 35–81 %. В литературе описано, что использование в качестве алкилирующих агентов первичных алкилгалогенидов ведет к образованию сложной смеси, состоящей из S-моно, S,N1- и S,N3-дизамещенных продуктов алкилирования [3]. Однако, по всей вероятности, в случае использования алкилирующего агента, имеющего большой объем и способного экранировать атомы азота, образуются исключительно S-монозамещен-ные продукты алкилирования 2-тиоурацилов.
Чистота полученных соединений 6–16 определялась методом тонкослойной хроматографии, строение – ПМР-спектроскопией, их физико-химические свойства представлены в табл.
Свойства синтезированных соединений
|
Соед. |
R 1 |
R 2 |
R 3 |
R f * |
Т. пл. ºС |
Выход, % |
|
6 |
H |
C 6 H 5 |
H |
0,47 |
272-274 |
81 |
|
7 |
H |
C 6 H 5 |
2-CH 3 |
0,35 |
259-260 |
69 |
|
8 |
H |
C 6 H 5 |
4-CH 3 |
0,29 |
271-273 |
68 |
|
9 |
H |
C 6 H 5 |
2-OCH 3 |
0,51 |
224-226 |
78 |
|
10 |
H |
C 6 H 5 |
2-OPh |
0,73 |
213-214 |
74 |
|
11 |
PhCH 2 |
C 6 H 5 |
H |
0,52 |
227-228 |
69 |
|
12 |
PhCH 2 |
CH 3 |
2-CH 3 |
0,59 |
234-236 |
72 |
|
13 |
CH3 CH2 H3C |
CH 3 |
H |
0,63 |
251-253 |
88 |
|
14 |
Cl CH2 |
CH 3 |
H |
0,55 |
224-226 |
67 |
|
15 |
H |
CH 3 |
4-(CH 3 )N |
0,40 |
227-230 |
35 |
|
16 |
H |
C 6 H 5 |
4-(CH 3 )N |
0,32 |
253-256 |
51 |
* Элюент: 1,2-дихлорэтан-метанол, 10 : 1
ЗАКЛЮЧЕНИЕ
Таким образом, нами синтезированы 9 новых, ранее не описанных в литературе 2-[(1,6-дигидро-6-оксо-2-пиримидинил)тио]-N-фенилацетамидов, изучены их спектральные и физико-химические свойства. Соединения этого ряда представляют интерес в плане поиска новых высокоэффективных противовирусных агентов.


