Синтез и гетероциклизация 3-(4-бромфенацил)тио-5H-[1,2,4]триазино[5,6-b]индола
Автор: Рыбакова Анастасия Владимировна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.5, 2013 года.
Бесплатный доступ
Осуществлен синтез 3-(4-бромфенацил)тио-5H-[1,2,4]триазино[5,6-b]индола и установлено, что под действием концентрированной серной кислоты происходит его циклодегидратация с образованием 3-(4-бромфенил)[1,3]тиазоло [3',2':2,3][1,2,4]триазино[5,6-b]индола.
3-(4-бромфенацил)тио-5н-[1, 4]триазино[5, 6-b]индол, гетеро циклизация, 3-(4-бромфенил)[1, 3]тиазоло[3''
Короткий адрес: https://sciup.org/147160260
IDR: 147160260 | УДК: 547.873
Текст краткого сообщения Синтез и гетероциклизация 3-(4-бромфенацил)тио-5H-[1,2,4]триазино[5,6-b]индола
Известно, что 2,3-дифенил[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индол оказывает высокое антигипоксическое, антиэкссудативное и антипролиферативное действие и является более эффективным, чем индометацин [1]. Это позволяет предполагать, что и другие производные тиа-золо[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индола также будут обладать высокой биологической активностью.
Синтез 2,3-дифенил[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индола осуществлен взаимодействием 3-бензоилфенилметилтио-1,2,4-триазино[5,6- b ]индола с полифосфорной кислотой при температуре 150 °С и структура его подтверждена данными ИК и УФ спектров [2]. В литературе известен также синтез 3-метил[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индола, который получен двумя различными способами. Один из способов представляет собой внутримолекулярную циклизацию 3-пропаргилтио-5 Н -[1,2,4]триазино[5,6- b ]индола под действием раствора щелочи при нагревании [3]. Второй способ заключается в галогенциклизации 3-аллилтио-5 Н -[1,2,4]триазино[5,6- b ]индола и последующем дегидрогалогенирование иодида 3-иодметил-2,3-дигидро-10 H -[1,3]тиазоло[21,2,4][3,4:׀3,׀]триазино[5,6- b ]индолия под действием карбоната натрия [4].
Целью данной работы является синтез 3-(4-бромфенил)[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индола циклодегидратацией 3-(4-бромфенацил)тио[1,2,4]триазино[5,6- b ]индола.
Обсуждение результатов
В работе [2] 3-(бензоилфенилметил)тио-1,2,4-триазино[5,6- b ]индол получен взаимодействием 3-меркапто-5 Н -[1,2,4]триазино[5,6- b ]индола (1) с 2-бром-1,2-дифенилэтаноном (α-бром-α-фенилацетофенон) в безводном спирте при кипячении с обратным холодильником. Синтез соединения 1 из тиосемикарбазона изатина в различных условиях описан в работе [5].
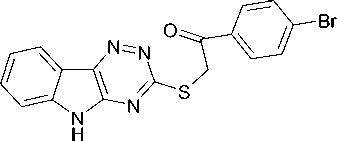
Нами впервые осуществлено взаимодействие соединения 1 с 2-бром-1-(4-бромфенил)эта-ноном (α-бром-4-бромацетофенон, пара -бромфенацилбромидом) в ДМСО в присутствии КОН (суперосновная среда) и при этом получен 3-(4-бромфенацил)тио -5Н- [1,2,4]триазино[5,6- b ]индол (2):
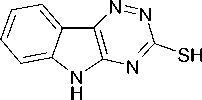
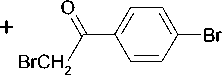
KOH-H2O-DMSO
Краткие сообщения
В ИК-спектре соединения 2 имеется полоса колебаний карбонильной группы при 1691 см–1. В спектре ЯМР 1Н (рис. 1) протоны SCH 2 группы образуют синглет при 4,96 м.д. Сигналы протонов Н'2 и Н'6 находятся в более слабом поле, чем протоны Н'3 и Н'5, что, по-видимому, обусловлено влиянием электроноакцепторной карбонильной группы. Отнесение сигналов осуществлено путем сопоставления с теоретическим спектром ЯМР 1Н соединения 2, который был рассчитан нами с помощью программы ACD/Labs HNMR Databases.
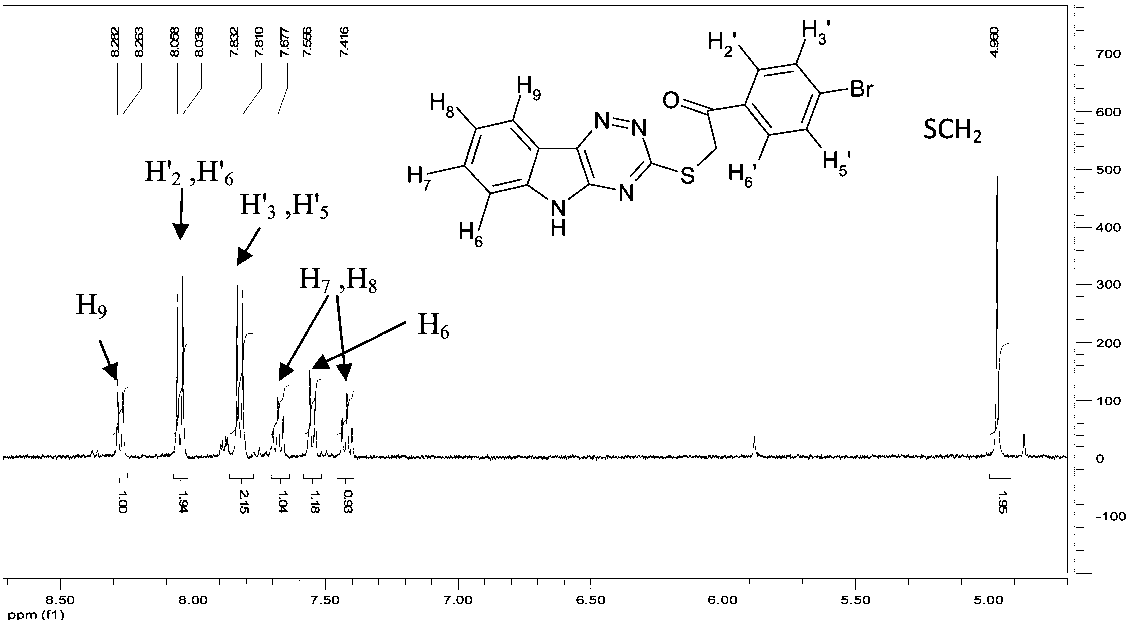
Рис. 1. Спектр ЯМР 1Н 3-(4-бромфенацил)тио[1,2,4]триазино[5,6- b ]индола
Соответствующие химические сдвиги протонов теоретического и экспериментального спектров близко совпадают (разница не более 0,36 м.д.) и приведены в табл. 1. Следует отметить, что сигналы всех протонов за исключением протона Н 6 в экспериментальном спектре расположены в более слабом поле по сравнению с расчетным.
Таблица 1
Химические сдвиги расчетного и экспериментального спектров ЯМР 1Н 3-(4-бромфенацил)тио[1,2,4]триазино[5,6- b ]индола
|
Протон |
δ, м.д. |
|
|
Расчет |
Эксперимент |
|
|
SCH 2 |
4,89 |
4,96 |
|
Н 7 |
7,30 |
7,42 |
|
Н 8 |
7,59 |
7,67 |
|
Н' 3 , Н' 5 |
7,75 |
7,83 |
|
Н 6 |
7,92 |
7,56 |
|
Н' 2 , Н' 6 |
7,97 |
8,03 |
|
Н 9 |
8,06 |
8,28 |
Нами впервые осуществлена циклодегидратация соединения 2 под действием концентрированной серной кислоты. По аналогии с циклизацией 3-(бензоилфенилметил)тио-1,2,4-триа-зино[5,6- b ]индолом мы считаем, что реакция протекает с участием атома N-2 и с образованием 3-(4-бромфенил)[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индола (3):
Реакция очевидно протекает через внутримолекулярное присоединение по карбонильной группе с образованием 3-(4-бромфенил)-2,3-дигидро-[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]ин-дол-3-ол (4) и его последующую дегидратацию.
Попытки осуществить гетероциклизацию соединения 2 при кипячении его в водном растворе щелочи или в изопропиловом спирте в присутствии изопропилата натрия не привели к образованию соединения 3.
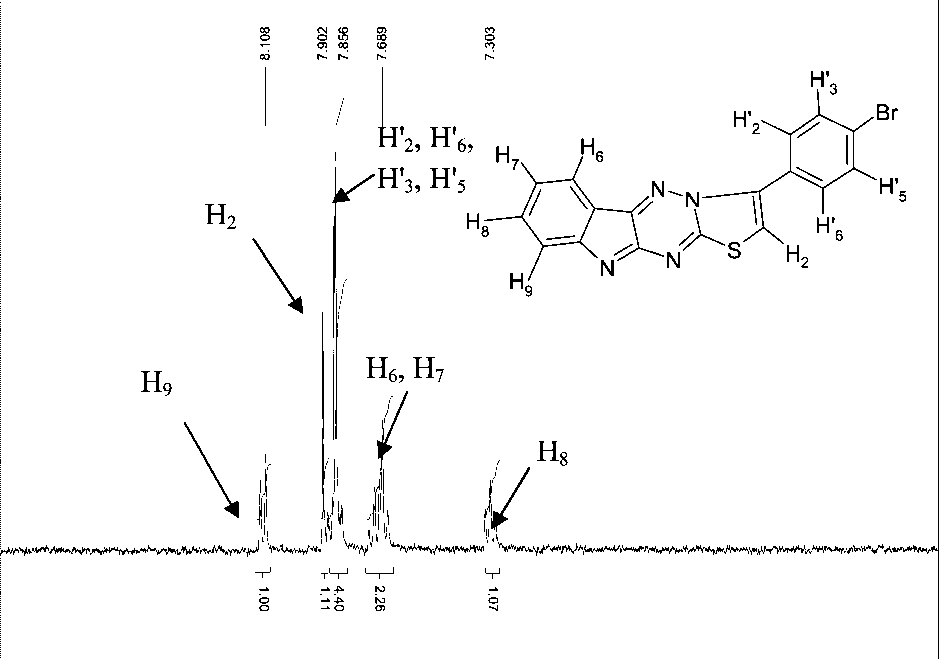
В спектре ЯМР 1Н (рис. 2) соединения 3 в отличие от соединения 2 отсутствует сигнал протонов SCH 2 группы и присутствует сигнал протона Н 2 , который образует синглет при 7,90 м.д. Следует отметить, что химические сдвиги протонов Н' 2 , Н' 6 , Н' 3 , Н' 5 бромфенильного кольца очень близки и происходит их наложение, а также наложение сигналов протонов Н 7 и Н 6 . Это можно объяснить удлинением цепи сопряжения по сравнению с соединением 2 за счет появления тиазольного цикла. Отнесение сигналов проведено путем сопоставления с теоретическим ЯМР 1Н спектром соединения 3, рассчитанного с помощью программы ACD/Labs HNMR Databases.
— 150
— 100
— 50
— 0
9.00 8.50 8.00 7.50 7.00 6.50 6.00
PPm (f1)
Рис. 2. Спектр ЯМР 1Н 3-(4-бромфенил)[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индола
Краткие сообщения
В отличие от соединения 2, разница расчетного и экспериментального химических сдвигов (табл. 2) для некоторых протонов значительна. Так, для протона Н 2 она составляет 1,78 м.д., а для протонов Н' 2 , Н' 6 , Н 8 , Н 7 – 0,43–0,60 м.д.
Таблица 2
Химические сдвиги расчетного и экспериментального спектров ЯМР 1Н 3-(4-бромфенацил)тио[1,2,4]триазино[5,6- b ]индола
|
Протон |
δ, м.д. |
|
|
Расчет |
Эксперимент |
|
|
Н 2 |
6,12 |
7,90 |
|
Н 7 |
7,10 |
7,69 |
|
Н 8 |
7,84 |
7,30 |
|
Н' 3 , Н' 5 |
8,04 |
7,86 |
|
Н 6 |
8,06 |
7,69 |
|
Н 9 |
8,15 |
8,13 |
|
Н' 2 , Н' 6 |
8,29 |
7,86 |
Экспериментальная часть
Спектры ЯМР 1Н раствора вещества в ДМСО-d 6 получены на спектрометре Bruker (400 МГц), внутренний стандарт ТМС. ИК спектры сняты на спектрофотометре Varian 800FT-IR Scimitar Serias.
3-(4-Бромфенацил)тио -5Н- [1,2,4]триазино[5,6- b ]индол (2) . К смеси 0,114 г (0,6 ммоль) соединения 3 и 0,024 г (0,6 ммоль) в 10 мл ДМСО добавляют 0,157 г (0,6 ммоль) п- бромфена-цилбромида. Реакционную смесь перемешивают в течение 3 ч. Затем добавляют 50 мл воды. Выпавший осадок желтого цвета, отфильтровывают, промывают водой, сушат, перекристаллизова-выют из водного ДМФА. Выход 0,223 г (99 %). Т. пл. 130 °С.
ИК спектр, υ, см–1: 1691 (С=О). Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 4,96 (2 H, с, SCH 2 ); 7,42 (1Н, т., J 6,7 =7,96; J =7,41, Н 7 ); 7,56 (1Н, д., J 6,7 =7,96, Н 6 ); 7,68 (1Н, т., J 8,9 =8,05; J =7,24, Н 8 ); 7,83 (2Н, д., J =8,59, Н' 3 , Н' 5 ); 8,03 (2Н, д., J =8,59, Н' 2 , Н' 6 ); 8,28 (1Н, д., J 8,9 =8,05, Н 9 ).
3-(4-Бромфенил)[1,3]тиазоло[31,2,4][2,3:׀2,׀]триазино[5,6- b ]индол (3). Раствор 0,200 г (0,5 ммоль) соединения 1 в 2 мл конц. серной кислоты выдерживают при комнатной температуре в течение суток. Затем при охлаждении добавляют 15 мл воды и нейтрализуют насыщенным раствором NaOH. Образующийся красный осадок отфильтровывают, промывают водой, сушат, перекристаллизовывают из водного ДМФА. Выход 0,057 г (30 %). Т. пл.>200 °С.
Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 7,30 м.д. (1Н, т., J 8,9 =7,56; J =6,54, Н 8 ); 7,69 (2Н, м, Н 7 ); 7,86 (4Н, м, Н' 2 , Н' 3 , Н' 5 , Н' 6 ); 7,90 (1H, с, SCH=); 8,13 (1Н, д., J 8,9 =7,56, Н 9 ).
Список литературы Синтез и гетероциклизация 3-(4-бромфенацил)тио-5H-[1,2,4]триазино[5,6-b]индола
- Томчин А.Б. Производные тиомочевины и тиосемикарбазида. Строение, превращения и фармакологическая активность. III. Антигипоксическое и противовоспалительное действие производных 1,2,4-триазино[6,5-й]индола/А.Б. Томчин, О.Ю. Урюпов, А.В. Смирнов.//Химикофармацевтический журнал. -1997. -Вып. 31, № 12. -С. 6-11.
- Томчин А.Б. Семикарбазоны и тиосемикарбазоны гетероциклического ряда. Производные 1,2,4-триазиноиндола с конденсированным имидазольным, тиазольным или триазольным кольцом//Журнал Органической Химии. -1982. -Т. XVIII, вып. 6. -С. 1272-1280.
- Ким Д.Г. Новый синтез [1,3]тиазоло[3',2':2,3][1,2,4]триазино[5,6-й]индольной системы/Д.Г. Ким, А.В. Журавлёва//Химия гетероциклических соединений. -2009. -№ 10. -С. 1590-1592.
- Ким Д.Г. Галогенциклизация 3-аллилтио-5H-[1,2,4]триазино[5,6-й]индола/Д.Г. Ким, А.В. Журавлёва//Химия гетероциклических соединений. -2010. -№ 7. -С. 1107-1109.
- Производные тиомочесвины и тиосемикарбазида. Строение, превращения и фармакологическая активность. 10. Синтез, фармакологические и фармакокинетические свойства нового антигипоксанта и антисурдитанта томпаслина./А.Б. Томчин, Л.В. Пастушенков, А.Л. Пастушенков и др.//Химико-фармацевтический журнал. -2008. -Т. 42, № 5. -С. 14-23.

![Синтез и гетероциклизация 3-(4-бромфенацил)тио-5H-[1,2,4]триазино[5,6-b]индола Синтез и гетероциклизация 3-(4-бромфенацил)тио-5H-[1,2,4]триазино[5,6-b]индола](/file/cover/147160260/sintez-i-geterociklizacija-34-bromfenacil-tio-5h124-triazino-56-b-indola.png)
