Синтез и гетероциклизация 4-метил-3-циннамил-сульфанил-1,2,4-триазола
Автор: Ильиных Е.С., Васильева А.Е.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.17, 2025 года.
Бесплатный доступ
В настоящей работе нами впервые исследовано взаимодействие 4-метил-1,2,4-триазол-3-тиола (1) с транс-циннамилхлоридом (2) в различных системах (i-PrOH-КOH, i-PrOH-Na, MeOH-Na, Me2CO-K2CO3), в результате чего синтезирован индивидуальный 4-метил-3-циннамилсульфанил-1,2,4-триазол (3). Установлено, что селективность реакций алкилирования соединения 1 не зависит от условий проведения реакций (растворитель, основание), однако с наибольшим выходом (89 %) целевой продукт 3 был получен в системе MeOH-Na. Строение синтезированного соединения 3 исследовано и доказано методами масс-спектрометрии (ГХ-МС) и спектроскопии ЯМР ¹Н и ¹³С. Выявлены основные закономерные направления фрагментации молекулярного иона S-производного 3, сопровождающиеся отщеплением метильного, бензильного и триазолилсульфидного радикалов. Доказательством протекания реакции алкилирования по атому серы является наличие в спектре ЯМР 1Н соединения 3 сигналов протонов группы -SCH2- при δ 4,06 м. д. Впервые исследована гетероциклизация 4-метил-3-циннамилсульфанил-1,2,4-триазола 3 под действием йода и брома в различных растворителях (иодирование - в хлороформе, ацетоне, дихлорметане, этаноле; бромирование - в хлороформе, дихлорметане) при соотношениях субстрат : йод (1 : 2) и субстрат : бром (1 : 1,5). Найдено, что независимо от условий реакций взаимодействие с йодом соединения 3 протекает региоселективно, сопровождается линеарным аннелированием тиазиниевого цикла и образованием бициклической конденсированной гетероциклической системы. В результате синтезированы новые иодсодержащие [1,2,4]триазоло[5,1-b][1,3]тиазиниевые системы - полииодид и иодид 6-иод-3-метил-7-фенил-6,7-дигидро-5Н-[1,2,4]триазоло[5,1-b][1,3]тиазиния (4, 5). В отличие от реакций иодирования, взаимодействие циннамилсульфида 3 с бромом в указанных условиях протекает нерегиоселективно: кроме продукта бромциклизации, бромида 6-бром-3-метил-7-фенил-6,7-дигидро-5Н-[1,2,4]триазоло[5,1-b][1,3]тиазиния (6), получен продукт присоединения брома, 3-[(2,3-дибром-3-фенилпропил)сульфанил]-4-метил-1,2,4-триазол (7). Доказательством протекания реакций гетероциклизации соединения 3 является отсутствие в спектрах ЯМР 1Н продуктов гетероциклизации 4, 5 и 6 сигналов протонов циннамильного фрагмента и наличие более сложной картины расщепления сигналов протонов тиазиниевого цикла.
4-метил-1, 2, 4-триазол-3-тиол, алкилирование, 4-метил-3-циннамилсульфа-нил-1, 2, 4-триазол, гетероциклизация, иод- и бромциклизация, иод- и бромсодержащие [1, 2, 4]-триазоло[5, 1-b][1, 3]тиазиниевые системы, хромато-масс-спектрометрия, спектроскопия ямр 1н и 13с, «эффект тяжелого атома»
Короткий адрес: https://sciup.org/147248069
IDR: 147248069 | УДК: 547.792.3+547.792.9 | DOI: 10.14529/chem250210
Текст научной статьи Синтез и гетероциклизация 4-метил-3-циннамил-сульфанил-1,2,4-триазола
Азотсодержащие гетероциклические соединения в настоящее время составляют большинство всех синтезируемых лекарственных веществ [1]. Это является одной из причин устойчивого синтетического и биологического интереса к химии таких классов соединений, как триазолы. 1,2,4-Триазолы, 1,2,4-триазолтиолы и их производные используются в медицине, проявляя бактерицидную, анальгетическую, нейролептическую, гипотензивную, спазмолитическую, противовоспалительную, фунгицидную и другие виды активности [2–7]. Соединения данного класса также нашли применение в качестве ингибиторов коррозии, в сельском хозяйстве (фунгициды, пестициды), электронике и производстве пластификаторов и клеев [8–11].
Наличие атома серы в структуре 1,2,4-триазол-3-тиолов дает возможность использовать эти соединения в органическом синтезе путем их дальнейшей S-функционализации [7, 12–14], в ча- стности, алкилированием алкенил- и алкинилгалогенидами [15–17]. В целом, различные S-непредельные производные азол- и азинтиолов служат удобным синтоном для синтеза конденсированных гетероциклических систем на их основе. В обзоре [18] обобщены данные по электрофильной гетероциклизации ненасыщенных серо- и фосфорсодержащих соединений. Ранее нами исследована электрофильная гетероциклизация ряда S-непредельных производных 4-метил-1,2,4-триазол-3-тиола [15], 5-трифторметил-1,2,4-триазол-3-тиола [16], 1-метилимидазол-2-тиола [19] и бензимидазол-2-тиола [20] под действием галогенов и показано, что региоселектив-ность реакций зависит от структуры исходного субстрата и условий реакций.
Введение в структуру производных азолов и других гетероциклических соединений атомов галогенов является перспективным направлением их модификации. Широкий спектр действия и высокий терапевтический эффект иодсодержащих лекарственных препаратов определяют актуальность физико-химических исследований органических соединений йода и прогнозирования их фармакологической активности [21].
Однако в литературе отсутствуют данные о синтезе 4-метил-3-циннамилсульфанил-1,2,4-триазола и исследовании его гетероциклизации под действием галогенов. Целью настоящей работы является разработка методов синтеза и исследование строения данного соединения и ранее неизвестных иод- и бромсодержащих [1,2,4]триазоло[5,1- b ][1,3]тиазиниевых систем, полученных на его основе.
Экспериментальная часть
Исходные соединения 4-метил-1,2,4-триазол-3-тиол 1 , транс -циннамилхлорид 2 являются коммерческими препаратами фирмы Alfa Aesar. A Johnson Matthey Company.
Синтез 4-метил-3-циннамилсульфанил-1,2,4-триазола (3) ( общая методика для систем (А) i-PrOH–КOH, (В) i-PrOH–Na, (С) MeOH–Na и (D) Me2CO–K2CO3 ). В плоскодонную колбу помещали 0,280 г (5 ммоль) КОН ( метод А ), 0,115 г (5 ммоль) Na ( методы В и С ), 0,690 г (5 ммоль) K 2 CO 3 ( метод D ), приливали 20 мл изопропилового спирта ( методы А и В ), метанола ( метод С ) или ацетона ( метод D ). Далее к полученным растворам ( методы А, В и С ) или суспензии ( метод D ) добавляли 0,575 г (5 ммоль) 4-метил-1,2,4-триазол-3-тиола 1 и 0,70 мл (5 ммоль) транс -циннамилхлорида 2 . Реакционную смесь перемешивали на магнитной мешалке. Через 7 суток отфильтровывали белый осадок, отгоняли растворитель, остаток обрабатывали хлороформом и фильтровали. Получали соединение 3 в виде светло-желтого масла, которое частично кристаллизовалось, выход 0,797 г (69 %) ( метод А ), 0,751 г (65 %) ( метод В ), 1,028 г (89 %) ( метод С ), 0,566 г (49 %) ( метод D ), R f 0,65. Масс-спектр (ЭИ, 70 эВ), m/z ( I отн ., %): 231 [M]+• (45), 117 [M – C 3 H 4 N 3 S]+ (100), 140 [M – C 6 H 5 CH 2 ]+ (30), 91 [M – C 3 H 4 N 3 S – C 2 H 2 ]+ (25). Спектр ЯМР 1Н, δ , м. д. ( J , Гц), СDCl 3 : 3,64 (3Н, с, 4-CH 3 ); 4,06 (2H, д, 3J = 7,5, –SCH 2 –); 6,33 (1Н, м, –СН=); 6,56 (1Н, д, 3J trans = 15,7, =CHPh); 7,23–7,36 (5Н, м, H Ar ); 8,58 (1Н, с, Н-5). Спектр ЯМР 13С, δ , м.д., СDCl 3 : 31,46 (–SСН 2 –); 36,52 (4-CH 3 ); 123,21 (–CH=); 126,49 (C Ar -2, C Ar -6); 128,05 (C Ar -4); 128,63 (=СНPh, C Ar -1, C Ar -3, C Ar -5); 134,43 (С-5); 136,16 (С-3).
Синтез полииодида 6-иод-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]-тиазиния ( 4 ) ( методы А и В ). К раствору 1,016 г (4 ммоль) йода в 5 мл CH 2 Cl 2 ( метод А ) или этанола ( метод В ) добавляли раствор 0,462 г (2 ммоль) 4-метил-3-циннамилсульфанил-1,2,4-триазола 3 в 5 мл CH 2 Cl 2 ( метод А ) или этанола ( метод В ). Через 7 суток получали полииодид 4 в виде темно-коричневых кристаллов, которые отфильтровывали и сушили. Выход 1,164 г ( метод А ), 1,028 г ( метод В ), т. пл. 105 °С. Спектр ЯМР 1Н, δ , м. д. ( J , Гц), ДМСО- d 6 : 3,71 (1H, дд, 2J = 13,6, 3J = 2,7, –SС H А H B –); 3,78 (3Н, с, 3-CH 3 ); 3,92 (1H, дд, 2J = 13,6, 3J = 7,8, –SСH А H B –); 5,21 (1Н, м, Н-6); 6,11 (1Н, д, 3J = 6,3, Н-7); 7,32–7,45 (5Н, м, H Ar ); 9,11 (1Н, с, Н-2). Спектр ЯМР 13С, δ , м.д., ДМСО- d 6 : 20,07 (С-6); 32,92 (С-5); 33,07 (3-CН 3 ); 69,12 (С-7); 127,45 (C Ar -1, C Ar -3, C Ar -5); 128,85 (C Ar -2, C Ar -6); 136,27 (C Ar -4); 144,97 (С-2); 150,15 (С-3а).
Синтез иодида 6-иод-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]тиази-ния ( 5 ) ( методы C и D ). К раствору 1,016 г (4 ммоль) йода в 5 мл CHCl 3 ( метод С ) или ацетона ( метод D ) добавляли раствор 0,462 г (2 ммоль) 4-метил-3-циннамилсульфанил-1,2,4-триазола 3 в 5 мл CHCl 3 ( метод С ) или ацетона ( метод D ). Через 7 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образовавшийся осадок отфильтровывали, промывали ацетоном и сушили. Получали иодид 5 в виде желтого порошка, выход 0,155 г (16 %) ( метод С ), 0,243 г (25 %) ( метод D ), т. пл. 153 °С. Данные ЯМР 1Н и 13С иодида 5 идентичны соответствующим данным ЯМР полииодида 4 .
Синтез бромида 6-бром-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]ти-азиния ( 6 ) ( методы А и В ). К раствору 0,462 г (2 ммоль) 4-метил-3-циннамилсульфанил-1,2,4-триазола 3 в 5 мл CHCl 3 ( метод А ) или CH 2 Cl 2 ( метод В ) добавляли по каплям при температуре 0–5 °С раствор 0,15 мл (3 ммоль) брома. Через 7 суток отгоняли растворитель, остаток обрабатывали ацетоном, отфильтровывали белый порошок бромида 6 , выход 0,219 г (28 %) ( метод А ), 0,258 г (33 %) ( метод В ), т. пл. 143 °С. Спектр ЯМР 1Н, δ , м. д. ( J , Гц), ДМСО- d 6 : 3,66 (1H, дд, 2J = 14,0, 3J = 2,4, –SС H А H B –); 3,83 (3Н, с, 3-CH 3 ); 3,93 (1H, дд, 2J = 14,0, 3J = 7,5, –SСH А H B –); 5,45 (1Н, м, Н-6); 6,26 (1Н, д, 3J = 4,6, Н-7); 7,33–7,46 (5Н, м, H Ar ); 9,29 (1Н, с, Н-2). Спектр ЯМР 13С, δ , м.д., ДМСО- d 6 : 31,10 (С-5); 33,05 (3-CН 3 ); 44,25 (С-6); 67,71 (С-7); 127,08 (C Ar -1, C Ar -3, C Ar -5); 128,98 (C Ar -2, C Ar -6); 135,56 (C Ar -4); 145,42 (С-2); 150,14 (С-3а).
Индивидуальность синтезированных соединений контролировали методом ТСХ на пластинах SilufolUV-254 в системе 2-пропанол-гексан (3 : 1), обнаружение в УФ-свете (254 нм) облучателя хроматографического УФС 254/365.
Температуры плавления установлены на аппарате для определения температуры плавления «ПТП ТУ-25-11-1144-76» и не корректировались.
Масс-спектры (ЭИ, 70 эВ) сняты на хромато-масс-спектрометре фирмы Shimadzu QGMS QP-2010 Ultra.
Спектры ЯМР 1H, 13C записаны на приборе Bruker DRX-400 в ДМСО- d 6 и СDCl 3 , внутренний стандарт ‒ ТМС.
Обсуждение результатов
Теоретически, реакции алкилирования 4-метил-1,2,4-триазол-3-тиола ( 1 ) вследствие его ти-он-тиольной таутомерии могут протекать как по атому серы, так и по атому азота. Согласно литературным данным, использование основания в реакциях данного типа смещает равновесие в сторону более устойчивой тиольной формы, что положительно сказывается на селективности процесса.
В настоящей работе с целью расширения ряда S-алкенильных производных соединения 1 нами впервые осуществлено его алкилирование транс -циннамилхлоридом ( 2 ) с использованием разных основных систем (( А ) i -PrOH–КOH, ( В ) i -PrOH–Na, ( С ) MeOH–Na и ( D ) Me 2 CO–K 2 CO 3 ). В результате во всех системах нами синтезирован индивидуальный продукт S-алкилирования, 4-метил-3-циннамилсульфанил-1,2,4-триазол ( 3 ), в виде закристаллизованного масла светложелтого цвета с выходами 69 % (метод А ), 65 % (метод В ), 89 % (метод С ) и 49 % (метод D ) (схема 1). Варьирование условий реакции позволило определить наиболее эффективную методику (метод С ) для селективного синтеза целевого продукта.
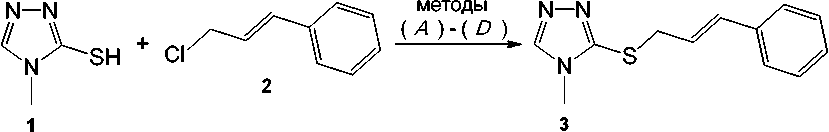
И) /-PrOH-KOH, (S) /-PrOH-Na, (C) MeOH-Na, (D) Me2CO-K2CO3 Выходы 69 % И), 65 % (S), 89 % (C), 49 % (D)
Схема 1. Синтез 4-метил-3-циннамилсульфанил-1,2,4-триазола (3)
Индивидуальность и чистота синтезированного соединения 3 контролировались с помощью тонкослойной хроматографии (ТСХ) ( R f 0,65), а его строение было исследовано и доказано методами масс-спектрометрии (ГХ–МС) и спектроскопии ЯМР ¹Н и ¹³С.
В масс-спектре соединения 3 пик молекулярного иона М+ ˙ с m/z 231 имеет среднюю интенсивность (45 %) и претерпевает различные направления фрагментации (схема 2). Наиболее интенсивный пик иона с m/z 117 принадлежит фрагментному циннамильному катиону, образующемуся в результате фрагментации по связи S–C. Менее интенсивные пики ионов с m/z 140 и 91 принадлежат фрагментным ионам, образующимся в результате выброса бензильного радикала из молекулярного иона и молекулы ацетилена из циннамильного катиона, соответственно.
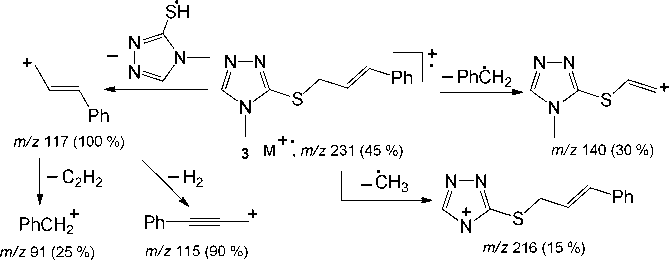
Схема 2. Фрагментация молекулярного иона соединения 3 при ГХ–МС анализе
О протекании алкилирования по атому серы и образовании сульфида 3 свидетельствует наличие в спектре ЯМР 1Н дублета протонов –SCH 2 – при δ 4,06 м. д. Кроме того, при δ 6,33 и 6,56 м. д. наблюдаются мультиплет и дублет протонов –СH= и =СHPh, соответственно. Большое значение КССВ этих двух протонов (3 J trans = 15,7 Гц) свидетельствует о транс -расположении заместителей относительно двойной связи.
В спектре ЯМР 13С соединения 3 сигналы при δ 31,46 и 36,52 м. д. относятся к сигналам атомов углерода групп –SCH2– и –NCH3, соответственно. Самый слабопольный сигнал (при δ 136,16 м.д.) закономерно дает углерод С-3 триазольного цикла, связанный с двумя атомами азота (N-2, N-4) и атомом серы.
Полученный 4-метил-3-циннамилсульфанил-1,2,4-триазол 3 в дальнейшем был использован для исследования его реакций электрофильной гетероциклизации под действием йода и брома с целью синтеза новых представителей [1,2,4]триазоло[5,1-b][1,3]тиазиниевых систем. Ранее [15] нами было показано, что региоселективность реакций гетероциклизации других различных S-непредельных производных 4-метил-1,2,4-триазол-3-тиола 1 зависит от характера заместителя при атоме серы и условий реакций: в разных случаях реакции сопровождались линеарным замы- канием тиазолиевого или тиазиниевого циклов.
Иодирование соединения 3 исследовано нами в различных растворителях (( А ) CH2Cl2, ( В ) EtOH, ( С ) CHCl 3 , ( D ) Me 2 CO) при соотношении субстрат : йод, равном 1 : 2. Установлено, что взаимодействие соединения 3 с двукратным избытком йода в указанных растворителях сопровождается гетероциклизацией искомого циннамилсульфида, замыканием шестичленного цикла и образованием индивидуального продукта гетероциклизации, полииодида 6-иод-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]тиазиния ( 4 ).
В результате реакций, проведенных по методам (А) и (В) , полииодид 4 был выделен в виде блестящих темно-коричневых кристаллов. Полученный в методах (С) и ( D ) полииодид 4 представлял собой темно-коричневое масло, действием на которое NaI в ацетоне был выделен иодид 6-иод-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]тиазиния ( 5 ) в виде желтого порошка с выходами 16 % (метод С ) и 25 % (метод D ) (схема 3).
Строение полииодида 4 (в виде кристаллов) и иодида 5 исследовано и доказано методами ЯМР 1Н и 13С спектроскопии. Спектры ЯМР 1Н и 13С полииодида 4 идентичны соответствующим спектрам иодида 5 . Спектр ЯМР 1Н иодида 5 приведен на рис. 1.
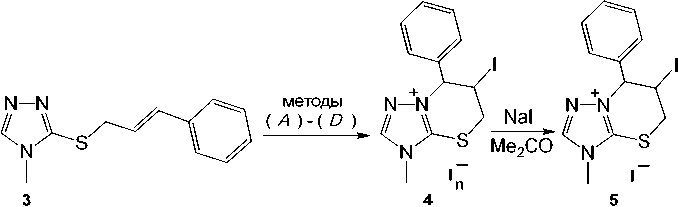
(A) 2I2, CH2CI2, 20-25 °C; (B) 2I2. EtOH, 20-25 °C; (C) 2I2. CHCI3i 20-25 °C; (D) 2I2i Me2CO, 20-25 °C Выходы иодида 5 16 % (С), 25 % (D)
Схема 3. Иодциклизация 4-метил-3-циннамилсульфанил-1,2,4-триазола (3)
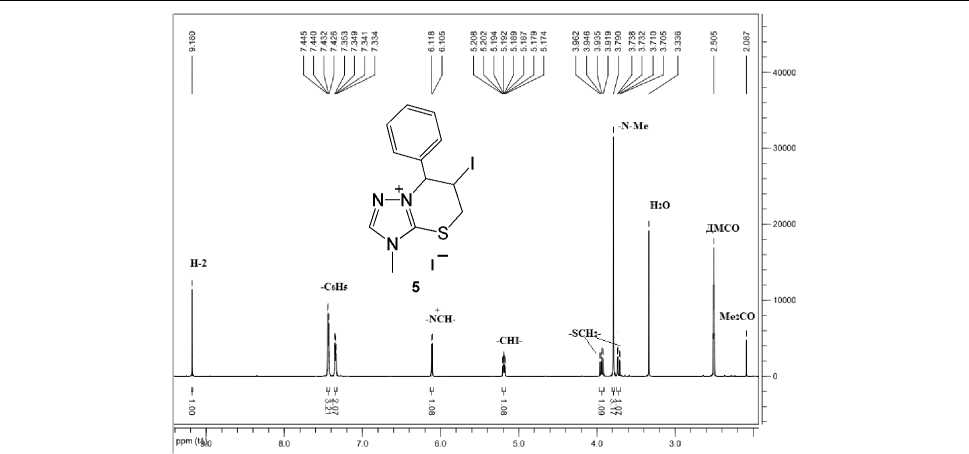
Рис. 1. Спектр ЯМР 1Н иодида 6-иод-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]тиазиния (5)
Док а за т е ль с тв ом п роте к ания реакции гетероциклизации циннамилсульфи д а 3 является отсутствие в спектрах ЯМР 1Н пол и и од и д а 4 и иодида 5 сигналов протонов циннамильного фрагмента и н али чи е б олее с л ожн ой картины расщепления сигналов протонов тиа зи н иевого ц и к л а .
К роме т ого, н аб л ю д ае тс я с мещение сигнала гетероароматического протон а Н -2 триазольного ц и к л а в с п ек тра х п родук тов и од ц и к л иза ц и и в более слабое поле на δ 0,53–0,60 м. д. по сравнению с с оотв е тс тв у ю щ и м с и гна лом п ротона в с п ек тре ис ход н ог о с о е д и н е н и я 3 , что обусловлено образов а н и е м за ряже н н ой к онд е н с и ров а н н ой ге те р оц и кли че с к ой с и с те м ы.
В спектрах ЯМР 13С п ол и и од и д а 4 и иодида 5 самый слабопольный сигнал ( δ 150,15 м. д.) соответс тв уе т уз л ов ом у а тому у гл е род а С-3a, связанному с электроотрицательными атомом серы и двумя атомами азота (N-3, N-8). Несмотря на выраженную электроотрицательность атома йода, сигнал атома углерода С- 6, н епосредственно связанного с йодом, расположен в области достаточно сильного поля ( δ 2 0, 06 м. д.), что обусловлено «эффектом тяжелого атома» [22]. Данный э ф фек т встре ча е т с я в с п ек тра х Я МР 13С различных галогенпроизводных ароматических и гете-роароматических сое д и нен ий [23–27].
Бромирование 4-метил-3-ц и н н а ми лс у ль фа н и л-1,2,4-триазола 3 полуторакратным избытком брома исследовано нами в C HC l 3 (метод (А) ) и CH 2 Cl 2 (метод (В) ) при охлаждении льдом до 0– 5 о С. У с та н ов лено, что в за и мод е й с тв и е сое ди нен ия 3 с бромом в указанных условиях, аналогично его ге те роц ик ли за ц и и п о д д е йствием йода, протекает по пути аннелировани я ти а зи н и е в ого ц и кл а и при в од и т к о б раз ов ани ю б роми да 6-бром-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]-триазоло[5,1- b ][1,3]тиазиния ( 6 ) в виде белого порошка, не растворимого в ацетоне, с выходами 28 % (метод А ) и 33 % (метод В ) (схема 4).
Однак о в отли чи е от ре ак ции с йодом, бромирование циннамилсульф и да 3 является менее се лек ти в н ым п роц ес с ом : п об очн ым п ро д у к том реак ц и й, п о -видимому, является продукт присоеди н е н ия б рома п о д в ой ной с в язи ц и н н а ми льн ого фра гм е н та – 3-[(2,3-дибром-3-фенилпропил)-сульфанил]-4-метил-1,2,4-т ри аз ол (7 ). Соединение 7 , в отличие от бромида 6 , представляет собой мас ло же лто го ц в е та , к от орое хор ош о р а с тв оряе тся в а ц е тон е .
Строение бромида 6 и ссле дов а н о и д о к а за н о ме т о д а ми Я МР 1Н и 13С спектроскопии. Налич ие б оле е с ло жн ой к арт и н ы расщепления сигналов протонов в спектре Я МР 1Н бромида 6 (рис. 2) и о т сутст в и е сигн алов п ротонов циннамильного фрагмента является доказательством протекания реак ц и и ге тероц и к ли за ц и и циннамилсульфида 3 . В частности, сигналы протонов – SСH 2 – ти аз и н и е в ого ц и к ла ра с ще п ляю т с я н а д в а д у б ле та д у б ле тов п ри δ 3,66 и 3,93 м.д., тогда как сигнал протонов –SCH 2 – и сход н ого соед и н е н ия 3 представляет собой дублет при δ 4,06 м. д.
К роме т ого, н аб л ю д ае тс я с ме щ е н ие с и гн ала гетероароматического протона Н-2 триазольного цикла в спектре продукта бром циклизации 6 в более слабое поле на δ 0,71 м. д. по сравнению с соответствующим сигналом п ротон а в спектре исходного соединения 3 , что обусловлено образов ани е м за ряженн ой к он ден с и ров а н н ой ге т е роц и к личе с к ой с ист ем ы .
1. методы
( А ) , ( B )
2. Me 2 CO
( A ) 1,5Br 2, CHCl 3, 0-5 o C; ( B ) 1,5Br 2, CH 2 Cl 2, 0-5 oC; выходы бромида 6 28 % ( A ), 33 % ( B )
Схема 4. Бромирование 4-метил-3-циннамилсульфанил-1,2,4-триазола (3)
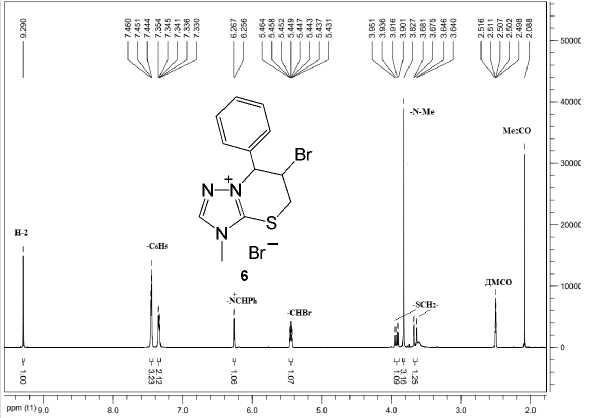
Рис. 2. Спектр ЯМР 1Н бромида 6-бром-3-метил-7-фенил-6,7-дигидро-5 Н -[1,2,4]триазоло[5,1- b ][1,3]тиазиния (6)
В отл и чи е от а то ма й од а, а том брома не дает «эффект тяжелого атома», поэто м у в сп е к тре Я М Р 13С бромида 6 си гн а л ато ма у гле род а С -6, связанного с бромом, расположен закономерно в слабом поле при δ 44,25 м. д . Са м ый с ла б оп оль н ый с и гн а л при δ 150,14 м. д. дает углерод С-3а триазольного ц и к ла , св я за нн ый с э ле кт р оотриц а те ль н ыми а то м ом с е ры и дву м я а то ма м и а з от а (N-3, N-8).
Заключение
У ст ан овл е н о, что на и б ол е е э ффективная методика для селективного синте з а ранее неизвестного 4-метил-3- ци н н а ми лс у ль фа н и л-1,2,4-триазола с выходом 89 % основана на взаимодействии 4-метил-1,2,4-триазол-3-т и ола с транс -циннамилхлоридом в системе MeOH–Na. Гетероциклизация 4-метил-3-ц и н н а ми лс у ль фа н и л-1,2,4-триазола под действием йода (иодциклизация) протека ет ре ги о с е лек ти в н о с а нн е ли рованием исключительно тиазиниевого цикла н е за в и с и мо от у с л овий реакции. В от л и чие от ре ак ций иодирования, взаимодействие синтезированного циннамил-сульфида с б р омом п ротек а е т нерегиоселективно: кроме продукта бромц и к ли за ц и и , п олу че н продукт присоединения брома. Строение новых иод- и бромсодержащих [1,2,4]триазоло[5,1- b ]-[1,3]тиазиниевых систем под роб н о и с с ле д о в а н о и док а за н о методами спектроскопии ЯМР ¹Н и ¹³С, в ыя в ле н ы об щ и е за к он о мер н ос т и и сп е ци фи че с ки е о с об е н н ос ти сп е к тро в полученных соединений.


