Синтез и гетероциклизация 8-R-транс-3-циннамилсульфанил-5H-[1,2,4]триазино[5,6-b]индолов и метил 4-(8-R-5H-[1,2,4]триазин[5,6-b]индол-3-сульфанил)бут-2-еноатов
Автор: Рыбакова Анастасия Владимировна, Старцева Анна Андреевна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.14, 2022 года.
Бесплатный доступ
Конденсацией водного раствора изатина и 5-бромизатина с тиосемикарбазидом получены β-тиосемикарбазон изатина и β-тиосемикарбазон 5-бромизатина, соответственно. Последующей циклизацией полученных тиосемикарбазонов в растворе гидроксида натрия при нагревании осуществлен синтез 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тиона (1а) и 8-бром-5 Н -[1,2,4]триазино[5,6- b ]индол-3-тиона (1b). Соединения 1а и 1b были изучены нами в реакциях алкилирования транс -циннамилхлоридом и метиловым эфиром 4-бромкротоновой кислоты. При этом из соединения 1а были синтезированы неизвестные ранее транс -3-циннамилсульфанил-5 H -[1,2,4]триазино[5,6- b ]индол (2a), метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноат (3a), из соединения 1b - 8 - бром -транс -3-циннамилсульфанил-5 H -[1,2,4]триазино[5,6- b ]индол (2b) и метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноат (3b). В спектрах ЯМР 1Н соединений 2а и 2b протоны S-CH2-группы образуют дублет в области 4,13 и 4,15 м. д. соответственно, в спектрах соединений 3а и 3b аналогичные протоны резонируют при 4,09 и 4,12 м.д. соответственно. Наличие электроноакцепторного атома брома в 8-м положении в структурах 2b и 3b приводит к незначительному смещению сигналов ароматических протонов индольного кольца и сигнала протона NH-группы в область более слабого поля по сравнению с аналогичными сигналами протонов в спектре ЯМР 1Н соединений 2a, 3a, не содержащих атом брома в индольном фрагменте. Реакции гетероциклизации S-производных триазино[5,6- b ]индол-3-тионов под действием иода и брома привели к аннелированию шестичленного тиазинового цикла и образованию новых поликонденсированных систем в виде тригалогенидов 8-R-3-галоген-4-R1-2,3,4,11-тетрагидро[1,3]тиазино[3׀,2׀:2, 3][1,2,4]триазин[5,6- b ]индолия. В структурах синтезированных нами тригалогенидов протоны группы SCH2 находятся рядом с асимметрическим атомом углерода, являются диастереотопными и в спектрах ЯМР 1Н образуют дублеты дублетов в области 3,35-5,36 м.д.
5н-[1, 2, 4]триазино[5, 6-b]индол-3-тион, 8-бром-5н-[1, 2, 4]триазино[5, 6-b]индол-3-тион, транс-3-циннамилсульфанил-5h-[1, 2, 4]триазин[5, 6-b]индол, метил 4-(8-бром-5h-[1, 2, 4]триазин[5, 6-b]индол-3-сульфанил)бут-2-еноат, 8-бром-транс-3-циннамилсульфанил-5h-[1, 2, 4]триазино[5, 6-b]индол и метил 4-(8-бром-5h-[1, 2, 4]триазин[5, 6-b]индол-3-сульфанил)бут-2-еноат, тригалогениды 8-r-3-галоген-4- r1-2, 3, 4, 11-тетрагидро[1, 3]тиазино[3׀, 2׀:2, 3][1, 2, 4]триазин[5, 6-b]индолия
Короткий адрес: https://sciup.org/147238625
IDR: 147238625 | УДК: 547.873 | DOI: 10.14529/chem220310
Текст научной статьи Синтез и гетероциклизация 8-R-транс-3-циннамилсульфанил-5H-[1,2,4]триазино[5,6-b]индолов и метил 4-(8-R-5H-[1,2,4]триазин[5,6-b]индол-3-сульфанил)бут-2-еноатов
Известно, что многие соединения, построенные на 5H-[1,2,4]триазин[5,6-b]индол-3-тионном каркасе, являются фармакологически активными [1–3]. В частности в литературе описывается, что 5H-[1,2,4]триазин[5,6-b]индол-3-тион и его производные обладают широким спектром биологической активности, включая противовоспалительное, противомикробное, обезболивающее, гипотензивное, противоопухолевое, кардиотоническое, нейролептическое, ноотропное, туберкулостатическое, противовирусное, противомалярийное и противопаразитарное действия [3-10]. Некоторые производные 1,2,4-триазиноиндол-3-тиона активны по отношению к кишечным паразитам, а также вызывают нормализацию нейроэндокринных реакций в условиях стресса и гипертермии [11, 12]. Также они могут выступать в качестве модуляторов эстрогеновых рецепторов и ингибиторов циклинзависимых киназ [13-16]. В целом несимметрические триазины применяют в синтезе различных красителей, полимеров, химических покрытий, фотографических материалов и полупродуктов синтеза пластмасс [17-22].
Изучение производных 1,2,4-триазин-3-тиона привело к открытию гиперактивности обонятельных систем крыс. Действие триазиновых гербицидов на животных приводит к дисфункции массы и температуры тела, спаривания и активности. В больших дозах данные вещества могут служить ядами для нежелательных грызунов [23-25].
При анализе активности триазинов было выявлено, что наибольшая активность соединения проявляется в роли ингибитора ферментов, при этом при добавлении алкильных фрагментов в структуру соединения данная биологическая активность уменьшается [25].
Таким образом, производные 1,2,4-триазин-3-тиона являются важнейшим классом органических соединений, применяемых в медицине [1-8], электрохимии [17], в качестве катализаторов [15] и хемосенсоров [18].
Одна из наиболее значимых областей исследования 5 H -[1,2,4]триазин[5,6- b ]индол-3-тиона -это изучение их реакций с различными бифункциональными электрофильными реагентами. Подобные превращения дают возможность получить новые аннелированные поликонденсирован-ные гетероциклические системы [12, 15, 17-20].
В литературе [3–5] имеются данные о синтезе и свойствах некоторых S-алкенильных(алкильных) производных 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тиона (1a) , но бромзамещённый 8-бром-5 Н -[1,2,4]триазино[5,6- b ]индол-3-тион (1b) и его S-производные практически не описаны в литературе.
В настоящей работе осуществлен синтез 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тиона 1a и 8-бром - 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тиона 1b и на их основе получены неизвестные ранее S-производные, для которых изучено дальнейшее взаимодействие с бромом и йодом.
Экспериментальная часть
Спектры ЯМР 1 Н соединений записаны на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС.
5 H -[1,2,4]Триазино[5,6- b ]индол-3-тион 1а и 8-бром-5 Н -[1,2,4]триазино[5,6- b ]индол-3-тион 1b получены конденсацией 1 H -индол-2,3-диона и его бромзамещенного производного с солянокислым тиосемикарбазидом по известной методике [3] с выходом 89 и 71 % соответственно.
Общая методика синтеза 8-R-транс-3-циннамилсульфанил-5H-[1,2,4]триазино[5,6- b]индолов (2а, 2b)
К раствору 1,000 ммоль индолтриазина в 30 мл ДМСО добавляли концентрированный раствор 0,040 г (1 ммоль) NaOH в 0,120 мл воды и 0,140 мл (1 ммоль) транс -циннамилхлорида. Реакционную смесь перемешивали в течение суток. После чего для выделения продукта к реакционной смеси добавляли избыток воды (50 мл), отфильтровывали образующийся осадок и сушили.
Для синтеза транс -3-циннамилсульфанил-5 H -[1,2,4]триазино[5,6- b ]индола 2а брали 0,202 г (1 ммоль) индолтриазина 1а . Выход 0,192 г (69 %). Т пл 235 °С с разложением.
Спектр ЯМР 1 Н (400 МГц, DMSO-d6) 5, м. д. / J , Гц: 4,12 (2H, д, J = 7,1, SCH 2 ); 6,41-6,47 (1H, м, -CH=CHPh); 6,71-6,75 (1H, м, -CH=CHPh); 7,17-7,40 (6H, м, Н-8, С 6 Н 5 ); 7,54-7,56 (1H, м, H-6), 7,61-7,64 (1H, м, H-7); 8,27-8,29 (1H, м, H-9); 12,52 (1Н, уш. с., NH).
Для синтеза 8 - бром -транс -3-циннамилсульфанил-5 H -[1,2,4]триазино[5,6- b ]индола 2b брали 0,281 г (1 ммоль) 8-броминдолтриазина 1b . Жёлтый осадок перекристаллизовывали из смеси ДМСО:вода (1:2). Выход 0,185 г (58 %). Тпл 263-265 °С с разложением.
Спектр ЯМР 1 Н (400 МГц, DMSO-d6) 5, м. д. / J , Гц: 4,15 (2H, д, J = 7,2, SCH 2 ); 6,42-6,46 (1H, м, -CH=CHPh); 6,75-6,79 (1H, м, -CH=CHPh); 7,23-7,45 (6H, м, Н-8, С 6 Н 5 ); 7,55-7,58 (1H, м, H-6), 7,80-7,83 (1H, м, H-7); 8,47-8,49 (1H, м, H-9); 12,83 (1Н, уш. с., NH).
Общая методика синтеза метил 4-(5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноатов (3а, 3b)
К раствору 1,310 ммоль индолтриазина в 30 мл ДМСО добавляли концентрированный раствор 0,052 г (1,3 ммоль) NaOH в 0,120 мл воды и 0,154 мл (1,310 ммоль) метилового эфира 4-бромкротоновой кислоты. Реакционную смесь перемешивали в течение суток. После чего для выделения продукта к реакционной смеси добавляли избыток воды (50 мл), отфильтровывали и сушили осадок.
Для синтеза метил 4-(5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноата (3а) брали 0,265 г (1,3 ммоль) индолтриазина 1а. Выход: 0,215 г (76 %). Т пл 242–244 °С с разложением.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д. / J , Гц: 3,65 (3H, c, ОCH 3 ); 4,12 (2H, д, J =7,0, SCH 2 ); 6,20 (1H, д, J = 15,5, C H -CООМе); 7,05 (1H, м, -CH=); 7,45 (1H, м, H-8); 7,58–7,60 (1H, м, H-6), 7,68–7,70 (1H, м, H-7); 8,30–8,32 (1H, м, H-9); 12,69 (1Н, уш. с., NH).
Для синтеза метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноата (3b) брали 0,240 г (1,2 ммоль) 8-броминдолтриазина 1b . Выход 0,214 (60 %). Тпл 241-243 °С с разложением.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д. / J , Гц: 3,70 (3H, c, ОCH 3 ); 4,12 (2H, д, J = 6,9, SCH 2 ); 5,73 (1H, д, J = 15,1, C H -CООМе); 7,03 (1H, м, -CH=); 7,54–7,57 (1H, м, H-6), 7,83–7,85 (1H, м, H-7); 8,46–8,48 (1H, м, H-9); 12,85 (1Н, уш. с., NH).
Трииодид 3-иод-4-фенил-2,3,4,11-тетрагидро[1,3]тиазин[3|,2|:2,3] [1,2,4]триазино[5,6- b ]индолия 4a
К раствору 0,100 г (0,3 ммоль) транс -3-циннамилсульфанил-5 H -[1,2,4]триазин[5,6- b ]индола в 40 мл хлороформа добавляли раствор 0,159 г (0,6 ммоль) йода в 10 мл хлороформа. Реакционную смесь оставляли до образования темно-бурых кристаллов. Полученные кристаллы отфильтровывали и сушили. Выход 0,112 г (79 %). Т пл 182–184 °С.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,35 (1H, д.д, 2J = 14,5; 3J = 3,1; SCH 2 ); 3,54 (1H, д.д, 2J = 14,5; 3J = 2,2; SCH 2 ), 5,74 (1H, м, CHI); 6,51 (1H, м., -CHPh); 7,32–7,43 (5H, м, С 6 Н 5 ); 7,54–7,58 (1H, м, H-8); 7,73–7,75 (1H, м, H-10); 7,88–7,92 (1H, м, H-9); 8,20–8,23 (1H, H-7).
Трибромид 3-бром-4-фенил-2,3,4,11-тетрагидро[1,3]тиазино[3|,2|:2,3][1,2,4]триазин[5,6- b]индолия 4b
К раствору 0,180 г (0,5 ммоль) транс -3-циннамилсульфанил-5 H -[1,2,4]триазин[5,6- b ]индола в 40 мл ледяной уксусной кислоты добавляли по каплям 0,058 мл (1 ммоль) брома в 10 мл ледяной уксусной кислоты при постоянном охлаждении льдом. Реакционную смесь оставляли на сутки при комнатной температуре, затем полностью испаряли растворитель. Остаток собирают, выход 0,089 г (65 %). Т пл больше 250 °С.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,48 (1H, д. д, 2J = 14,4; 3J = 2,6; SCH 2 ); 3,68 (1H, д. д, 2J = 14,4; 3J = 1,2; SCH 2 ); 5,82 (1H, м, CHBr); 6,56 (1H, м, -CHPh); 7,36–7,43 (5H, м, С 6 Н 5 ); 7,54– 7,56 (1H, м, H-8); 7,78–7,80 (1H, м, H-10); 7,88–7,92 (1H, м, H-9); 8,20–8,22 (1H, м, H-7).
Трииодид 8-бром-3-иод-4-фенил-2,3,4,11-тетрагидро[1,3]тиазин[3|,2|:2,3]
-
[1,2,4] триазино[5,6- b ]индолия (4c)
К раствору 0,218 г (0,5 ммоль) 8-бром- транс -3-циннамилсульфанил-5 H -[1,2,4]триазин[5,6- b ]индола в 40 мл хлороформа добавляли раствор 0,171 г (1 ммоль) иода в 10 мл хлороформа. Реакционную смесь оставляли до образования темно-бурых кристаллов. Полученные кристаллы отфильтровали и сушили. Выход 0,209 г (81%). Т пл 198–201 °С.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,35 (1H, д. д, 2J = 14,5; 3J = 2,0; SCH 2 ); 3,60 (1H, д. д, 2J = 14,5; 3J = 1,8; SCH 2 ), 5,70 (1H, м, CHI); 6,50 (1H, м., -CHPh); 7,34–7,46 (5H, м, С 6 Н 5 ); 7,68-7,72 (1H, м, H-10); 8,95–9,10 (1H, м, H-9); 8,50–8,52 (1H, м, H-7).
Трибромид 8,3-дибром-4-фенил-2,3,4,11-тетрагидро[1,3]тиазин[3|,2|:2,3]
-
[1,2,4] триазино[5,6- b ]индолия (4d)
К раствору 0,062 г (0,15 ммоль) 8-бром- транс -3-циннамилсульфанил-5 H -[1,2,4]триазин[5,6- b ]индола в 40 мл ледяной уксусной кислоты добавляли по каплям 0,016 мл (0,3 ммоль) брома в 10 мл ледяной уксусной кислоты при постоянном охлаждении льдом. Реакционную смесь оставляли на сутки при комнатной температуре, образовавшийся отсадок отфильтровали и сушили. Выход 0,071 г (68 %). Т пл больше 250 °С.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,44 (1H, д. д, 2J = 14,6; 3J = 2,9; SCH 2 ); 3,69 (1H, д. д, 2J = 14,6; 3J = 2,6; SCH 2 ), 5,80 (1H, м, CHI); 6,60 (1H, м., -CHPh); 7,35–7,56 (5H, м, С 6 Н 5 ); 7,70–7,75 (1H, м, H-10); 8,05-8,07 (1H, м, H-9); 8,52–8,54 (1H, м, H-7).
Трииодид 3-иод-4-метилкарбокси-2,3,4,11-тетрагидро[1,3]тиазин[3|,2|:2,3][1,2,4]триазин[5,6-b]индолия (5а)
К раствору 0,030 г (0,1 ммоль) метил 4-(5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноата в 40 мл хлороформа добавляли раствор 0,040 г (0,2 ммоль) иода в 10 мл хлороформа. Реакционную смесь оставляли на сутки. Затем из реакционной смеси испарили растворитель. Остаток - чёрный кристаллический порошок. Выход 0,115 г (52 %). Тпл больше 250 °С.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,87 (3H, c, ОCH 3 ); 4,28 (1H, д. д, 2J = 11,9; 3J = 8,9; SCH 2 ); 5,28 (1H, д. д, 2J = 11,9; 3J = 8,0; SCH 2 ); 5,59–5,64 (2H, м, CHI, С Н СООМе); 7,61 (1H, м, H-8); 7,73 (м, H-10); 7,90 (1H, м, H-9); 8,22 (1H, H-7).
Трибромид 3-бром-4-метилкарбокси-2,3,4,11- тетрагидро[1,3]тиазин[3|,2|:2,3][1,2,4]триазин5,6-b]индолия (5b)
К раствору 0,100 г (0,3 ммоль) метил 4-(5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноата в 40 мл ледяной уксусной кислоты добавляли по каплям 0,034 мл (0,6 ммоль) брома в 10 мл ледяной уксусной кислоты при постоянном охлаждении льдом. Реакционную смесь оставляли на сутки при комнатной температуре. Затем из реакционной смеси испарили растворитель. Остаток – жёлтый порошок. Выход 0,213 г (77 %). Т пл 245–246 °С с разложением.
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,73 (3H, c, ОCH 3 ); 3,84 (1H, д. д, 2J = 11,4; 3J = 8,9; SCH 2 ); 4,20 (1H, д. д, 2J = 11,4; 3J = 8,5; SCH 2 ); 5,59–5,67 (2H, м, CHBr, С Н СООМе); 7,61 (1H, м, H-8); 7,77 (м, H-10); 7,92 (1H, м, H-9); 8,27 (1H, H-7).
Трииодид 8-бром-3-иод-4-метилкарбокси-2,3,4,11- тетрагидро[1,3]тиазин[3|,2|:2,3][1,2,4]триазин[5,6-b]индолия (5c)
К раствору 0,045 г (0,1 ммоль) метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноата в 40 мл хлороформа добавляли раствор 0,045 г (0,2 ммоль) иода в 10 мл хлороформа. Реакционную смесь оставляли на сутки. Затем из реакционной смеси испарили растворитель. Остаток – чёрный кристаллический порошок. Выход 0,202 г (58 %).
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,83 (3H, c, ОCH 3 ); 4,30 (1H, д.д, 2J = 11,6; 3J = 9,4; SCH 2 ); 5,27 (1H, д.д, 2J = 11,6; 3J = 9,0; SCH 2 ); 5,60–5,64 (2H, м, CHI, С Н СООМе); 7,70– 7,73 (1H, м, H-10); 8,04–8,07 (1H, м, H-9); 8,50–8,52 (1H, м, H-7).
Трибромид 3,8-дибром-4-метилкарбокси-2,3,4,11-тетрагидро[1,3]тиазин[3|,2|:2,3][1,2, 4]триазин[5,6- b ]индолия (5d)
К раствору 0,115 г (0,3 ммоль) метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноата в 40 мл ледяной уксусной кислоты добавляли по каплям 0,08 мл (0,6 ммоль) брома в 10 мл ледяной уксусной кислоты при постоянном охлаждении льдом. Реакционную смесь оставляли на сутки при комнатной температуре. Затем из реакционной смеси испарили растворитель. Остаток – коричневый порошок. Выход 0,231 г (80 %).
Спектр ЯМР 1Н (400 MГц, DMSO-d6) δ, м. д.: 3,73 (3H, c, ОCH 3 ); 4,20 (1H, д.д, 2J = 11,3; 3J = 8,6; SCH 2 ); 5,36 (1H, д.д, 2J = 11,3; 3J = 8,2; SCH 2 ); 5,60–5,64 (2H, м, CHI, С Н СООМе); 7,70– 7,73 (1H, м, H-10); 8,04–8,07 (1H, м, H-9); 8,48–8,50 (1H, м, H-7).
Обсуждение результатов
С целью получения новых гетероциклических систем, содержащих индолтриазиниевый фрагмент, нами впервые было осуществлено взаимодействие 5 Н -[1,2,4]триазин[5,6- b ]индол-3-тиона 1a и 8-бром-5 Н -[1,2,4]триазино[5,6- b ]индол-3-тиона 1b с транс -циннамилхлоридом в системе ДМСО-Н 2 О-NaOH и метиловым эфиром 4-бромкротоновой кислоты в системе ДМФА-H2O-NaOH при перемешивании при комнатной температуре в течение суток (схема 1).
По указанной методике выход транс -3-циннамилсульфанил-5 H -[1,2,4]триазин[5,6- b ]индола ( 2а ) и 8 - бром -транс -3-циннамилсульфанил-5 H -[1,2,4]триа-зин[5,6- b ]индола ( 2b ) составляет 69 и 58 % соответственно.
II
————
III
-
1: a: R=H; b: R=Br;
2a, 4a, 4b: R=H, R1= Ph; 2b, 4c, 4d: R=Br, R1=Ph;
3a, 5a, 5b: R=H, R1=COOMe; 3b, 5c, 5d: R=Br, R1=COOMe;
4a, 4c, 5a, 5c: Hal=I; 4b, 4d, 5b, 5d: Hal=Br.
Схема 1. Взаимодействие соединений 1a,b с транс -циннамилхлоридом и метиловым эфиром 4-бромкротоновой кислоты и последующая гетероциклизация соединений 2a,b и 3a,b под действием галогенов
Метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноат ( 3а) и метил 4-(8-бром-5 H -[1,2,4]триазин[5,6- b ]индол-3-сульфанил)бут-2-еноат (3b) также были получены нами с достаточно высокими выходами (76 и 60 % соответственно).
Впервые синтезированные соединения 2a,b и 3a,b были исследованы нами методом ЯМР 1Н. Отметим, что в спектрах ЯМР 1Н структур 2а и 2b протоны S-CH2-группы образуют дублет в области 4,13 и 4,15 м. д. соответственно, в то время как S-CH2 протоны в спектрах ЯМР 1Н соединений 3а и 3b резонируют при 4,09 и 4,12 м. д. соответственно. Также можно наблюдать неболь- шое смещение сигналов ароматических протонов индольного кольца и сигнала протона NH-группы в область более слабого поля при наличии электроноакцепторного атома брома в 8-м положении для структур 2b и 3b по сравнению с аналогичными сигналами в спектрах структур 2a,3a, не содержащих атом брома в индольном фрагменте.
В различных источниках [14, 17] имеется противоречивая информация о гетероциклизации триазинов, так как возможно образование как пяти-, так и шестичленного цикла или протекание реакции как по атому азота N-2, так и по атому азота N-4. В то же время нами ранее на основе рентгеноструктурного анализа было установлено, что внутримолекулярная гетероциклизация 5-фенил- транс -3-циннамилсульфанил[1,2,4]триазина под действием галогенов протекает с анне-лированием шестичленного цикла по атому N-2 [12]. Таким образом, мы предполагаем, что электрофильная внутримолекулярная гетероциклизация соединений 2а, b и 3а, b под действием двукратного избытка брома в ледяной уксусной кислоте при охлаждении льдом или йода в хлороформе при комнатной температуре протекает аналогично с аннелированием шестичленного тиазинового цикла с образованием тригалогенидов 3-галоген-4-R1-8-R-2,3,4,11-тетрагидро[1,3]тиазино[31,2,4][2,3: ׀ 2, ׀ ]триазино[5,6- b ]индолия ( 4, 5 ) (см. схему 1). При этом выходы продуктов 4а–d и 5а–d достаточно высоки и колеблются в интервале от 52 до 81 %.
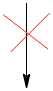
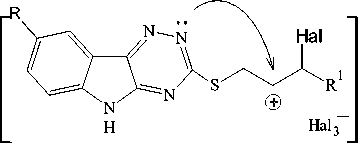
По-видимому, из-за стерических препятствий протекание реакции через образование галоге-нониевого иона I не выгодно, и гетероциклизация осуществляется по карбкатионному механизму через ион II . Атака атомом азота на положительно заряженный углерод в карбкатионе III также будет стерически затрудненной, поэтому соединение 6 не образуется.
В спектрах ЯМР 1Н соединений 4а–d и 5а–d протоны группы SCH2 являются диастереотоп-ными, так как находятся рядом с асимметрическим атомом углерода и образуют два дублета дублетов. Мультиплетность сигналов обусловлена спин-спиновым взаимодействием каждого из SCH2 протонов между собой ( 2J ) и с соседним протоном группы СНHal ( 3J ).
В литературе известно, что трииодиды органических катионов могут быть переведены в соответствующие моноиодиды при действии на них иодида натрия [26] или сульфита натрия [14] в ацетоне. Однако в нашем случае трииодиды 4а, 4с и 5а, 5с при действии на них NaI в ацетоне переходят в исходные сульфиды 2а, 2b и 3a, 3c соответственно, что было установлено нами на основе данных ЯМР 1Н – спектроскопии. По-видимому, моноиодиды IV являются неустойчивыми и разлагаются до продуктов присоединения V , которые в свою очередь могут легко распадаться до исходных соединений.
Заключение
Таким образом, алкилированием 5 Н -[1,2,4]триазин[5,6- b ]индол-3-тиона и 8-бром-5 Н -[1,2,4]триазин[5,6- b ]индол-3-тиона в системе NaOH-ДМСО(ДМФА)-H 2 O нами синтезированы неизвестные ранее S-производные [1,2,4]триазино[5,6- b ]индол-3-тионов. Установлено, что гало-генциклизация полученных соединений 2a, b и 3a, b под действием йода и брома осуществляется с аннелированием шестичленного цикла с участием атома азота N-2 и образованием тригалогенидов 4а–d и 5а–d . Доказано, что полученные трииодиды 4а, 4с, 5а, 5с могут быть обратно переведены в соответствующие исходные S-алкенильные производные под действием NaI в ацетоне.
Список литературы Синтез и гетероциклизация 8-R-транс-3-циннамилсульфанил-5H-[1,2,4]триазино[5,6-b]индолов и метил 4-(8-R-5H-[1,2,4]триазин[5,6-b]индол-3-сульфанил)бут-2-еноатов
- Ligand-Based Virtual Screening Identifies a Family of Selective Cannabinoid Receptor 2 Agonists / M. Gianella-Borradori, I. Christou, C.J.R. Bataille et al. // Bioorganic & Medicinal Chemistry. 2015. Vol. 23, iss. 1. P. 241-26. DOI: 10.1016/j.bmc.2014.11.002.
- Microwave Irradiation for Accelerating each Step for the Synthesis of 1,2,4-Triazino[5,6-b]indole-3-thiolsand their Derivatives from Isatin and 5-Chloroisatin / E.S.H. El Ashry, E.S. Ramadan, H M. Hamid, M. Hagar // Synlett. 2004. Iss. 4. P. 723-725. DOI: 10.1055/s-2004-815437.
- Ким Д.Г., Журавлёва А.В. Синтез [1,3]тиaзоло[3',2':2,3][1,2,4]триaзино[5,6-b]индолиевых систем // Химия гетероциклических соединений. 2009. Т. 45, № 10. С. 1590-1592.
- Gomha S., Abdel-Aziz H. Synthesis of New Functionalized Derivatives of Indo-lo[2,3-ß][1,2,4]triazolo[4,5-b]-1,2,4-triazine / J. of the Serb. Chem. Soc. 2016. Vol. 78, no. 8. P. 11191125. DOI: 10.2298/jsc120914013g.
- Производные тиомочевины и тиосемикарбазида. строение, превращения и фармакологическая активность. 10. Синтез, фармакологические и фармакокинетические свойства нового анти-гипоксанта и антисурдитанта томпаслина / А.Б. Томчин, Л.В. Пастушенков, А.Л. Пастушенков и др. // Химико-фармацевтический журнал. 2008. Т. 42, № 5. С. 14-19.
- Triazino Indole-Quinoline Hybrid: A Novel Approach to Antileishmanial Agents / R. Sharma, A.K. Pandey, R. Shivahare et al. // Bioorganic & Medicinal Chemistry Letters. 2014. Vol. 24, no. 1. P. 298-301. DOI: 10.1016/j.bmcl.2013.11.018.
- Novel Multitarget Directed Triazinoindole Derivatives as Anti-Alzheimer Agents / D.V. Patel, NR. Patel, A.M. Kanhed et al. // ACS Chemical Neuroscience. 2019. Vol. 10, no. 8. P. 36353661. DOI: 10.1021/acschemneuro.9b00226.
- Синтез гетарилсульфанил- и гетарилоксифуроксанов нуклеофильным замещением нитрогруппы в нитрофуроксанах под действием гетероциклических тиолов и спиртов / Л.Л. Ферштат, M.A. Епишина, A.C. Куликов и др. // Химия гетероциклических соединений. 2015. Т. 51, № 2. С. 176-186.
- Li H., Zhou H., Krieger S. Triazine-Based Tool Box for Developing Peptidic PET Imaging Probes: Syntheses, Microfluidic Radiolabeling, and Structureeactivity Evaluation // Bioconjug. Chem. 2014. Vol. 25. P. 761-772. DOI: 10.1021/bc500034n.
- Prokhorov A.M., Kozhevnikov D.N. Triazines, Tetrazines, and Fused Ring Polyaza Systems // Progress in Heterocyclic Chemistry. 2011. Vol. 23. P. 403-425. DOI: 10.1016/B978-0-08-096805-6.00014-0.
- Neunhoeffer H. 1,2,4-Triazines and Their Benzo Derivatives // Compr. Heterocycl. Chem. II. 1996. P. 507-573. DOI: 10.1016/b978-008096518-5.00127-1.
- Halo-heterocyclization of Tra«s-5-phenyl-3-cinnamylsulfanyl[1,2,4]triazine into [1,3]Thiazino[3,2-6][1,2,4]triazine-9-ium Systems / D.G. Kim, A.V. Rybakova, V.V. Sharutin, E.I. Danilina, O.V. Sazhayeva // Mendeleev Communications. 2019. Vol. 73, no. 29. P. 59-60. DOI: 10.14529/chem210107.
- Effect of Newly Synthesized 1,2,4-Triazino[5,6-6]indole-3-thione Derivatives on Olfactory Bulbect-omy Induced Depression in Rats / U.M. Aswar, P.P. Kalshetti, S.M. Shelke et al. // Asian Pacific Journal of Tropical Biomedicine. 2012. Vol. 2, no. 12. Р. 992-998. DOI: 10.1016/S2221-1691(13)60012-X.
- Региоселективная циклизация 3-аллил(пропаргил)сульфанил-5Н-[1,2,4]триазино[5,6-6]индолов / Р.И. Васькевич, А.И. Васькевич, А.В. Туров и др. // Химия гетероциклических соединений. 2011. Т.47, № 8. С. 1258-1263.
- 1,2,4-Triazole-based Palladium Pincer Complexes. A New Type of Catalyst for the Heck Reaction / E. Diez-Barra, J. Guerra, V. Hornillos et al. // Organometallics. 2003. Vol. 22, № 22. Р. 46104612. DOI: 10.1021/om0340600.
- Synthesis of Some Nitrogen Heterocycles under Microwave Irradiation in Solventless System. / H.A. Oskooie, M.M. Heravi, N. Nami, A. Nazari // Heterocyclic Communications. 2005. Vol. 11, no. 1. Р. 101-104. DOI: 10.1515/hc.2005.11.1.101.
- Синтез производных 5Н-тиазоло[2,3-с|[1,2,4]триазина и замещенных 3-(2-ацилвинилтио)-I,2,4-триазин-5-онов из 6-метил-3-тиоксо-1,2,4-триазин-5-она, 1-ацил-2-бромацетиленов и ацетиленовых кетонов. Рентгеноструктурный анализ 3-бензол-6-метил-5Н-тиазоло[2,3-с][1,2,4]триазин-5-она / B.Н. Елохина, А.С. Нахманович, Т.Н. Комарова и др. // Известия академии наук. Серия химическая. 1996. Т.45, № 12. С. 2971-2975.
- Heteropoly Acid Catalyzed Selective Cyclization of 6-Alkyl-3-propargylmercapto-1,2,4-triazin-5(2H)-one / F. Hakim, M.M. Tabatabaee, M. Hheravi et al. // E-Journal of Chemistry. 2011. Vol. 8, № 2. Р. 798-802. DOI: 10.1155/2011/103913.
- Hassan S. Synthesis, Antibacterial and Antifungal Activity of Some New Pyrazoline and Pyra-zole Derivatives // Molecules. 2013. Vol. 18. P. 2683-2711. DOI: 10.3390/molecules18032683.
- Synthesis of Novel Triazinoindole-Based Thiourea Hybrid: A Study on a-Glucosidase Inhibitors and Their Molecular Docking. / M. Taha, F.J. Alshamrani, F. Rahim et al. // Molecules. 2019. Vol. 24. P. 3819-3843. DOI: 10.3390/molecules24213819.
- Saad H.A., Moustafa A.H. Synthesis and Anticancer Activity of Some New Sglycosyl and S-Alkyl 1,2,4-Triazinone Derivatives Agents. // Molecules. 2011. Vol. 16, no. 7. Р. 5682-5700. DOI: 10.3390/molecules16075682.
- Synthesis, Chemical Reactivity and Fungicidal Activity of Pyrido[1,2-b][1,2,4]triazine Derivatives. / M.A. Ibrahim, R.M. Abdel-Rahman, A.M. Abdel-Halim et al. // J. Braz. Chem. Soc. 2009. Vol. 20, no. 7. Р. 1275-1286. DOI: 10.1590/s0103-50532009000700012.
- Cyclocondensation Reaction of Heterocyclic Carbonyl Compounds, Part XIII: Synthesis and Cytotoxic Activity of Some 3,7-Diaryl-5-(3,4,5-Trime-thoxyphenyl)pyrazolo[4,3-e][1,2,4]triazines / T. Gucky, I. Frysova, J. Slouka et al. // Eur. J. Med. Chem. 2009. Vol. 44, no. 2. Р. 891-900. DOI: 10.1016/j.ejmech.2008.05.026.
- Rezaei D., Fazlollahi M. Synthesis, Solvatochromism and Crystal Structure of 5-Methoxy-5,6-diphenyl-4,5-dihydro-2# - 1,2,4-Triazine-3-thione // Chemistry Central Journal. 2015. Vol. 7, no. 1. ID 130. DOI: 10.1186/1752-153X-7-130.
- Condensed 1,2,4-Triazines: I. Fused to Heterocycles with Three-, Four-, and Five-Membered Rings / E.S.H. El Ashry, N. Rashed, M. Taha, E. Ramadan // Advances In Heterocyclic Chemistry. 1994. Vol. 59. P. 39-177. DOI: 10.1016/S0065-2725(08)60007-0.
- Heterocyclization of 3-Propargylsulfanyl-5-phenyl-1,2,4-triazine: Tandem Reactions with Bromine Leading to New Derivatives of 7-Phenyl[1,3]thiazolo[3,2-6][1,2,4]triazinium / A.V. Rybako-va, D.G. Kim et al. // Izvestiya Vysshikh Uchebnykh Zavedeniy Khimiya Khimicheskaya Tekhnolo-giya. 2020. Vol. 63, no. 6. Р. 19-24. DOI: 10.6060/ivkkt.20206306.6102.

![Синтез и гетероциклизация 8-R-транс-3-циннамилсульфанил-5H-[1,2,4]триазино[5,6-b]индолов и метил 4-(8-R-5H-[1,2,4]триазин[5,6-b]индол-3-сульфанил)бут-2-еноатов Синтез и гетероциклизация 8-R-транс-3-циннамилсульфанил-5H-[1,2,4]триазино[5,6-b]индолов и метил 4-(8-R-5H-[1,2,4]триазин[5,6-b]индол-3-сульфанил)бут-2-еноатов](/file/cover/147238625/sintez-i-geterociklizacija-8-r-trans-3-cinnamilsulfanil-5h124-triazino-56-b.png)
