Синтез и гетероциклизация неизвестного ранее S-аллилтиосемикарбазона 11Н-индено[1,2-B]хиноксалин-11-она
Автор: Рыбакова А.В., Ейник А.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Известно, что некоторые производные инденохиноксалина проявляют себя как биологически активные соединения. О синтезе 11 H -индено[1,2- b ]хиноксалин-11-она известно примерно с 1910 г, и с тех пор имеется немало сведений об одном наиболее практически значимом его производном - тиосемикарбазоне индено[1,2- b ]хиноксалин-11-она. Последний был исследован нами в реакции с бромистым аллилом в среде ДМФА-KOH-Н2О при комнатной температуре, что вызывает большой интерес с точки зрения возможности получения S-производных тиосемикарбазона индено[1,2- b ]хиноксалин-11-она, сведения о которых в литературе отсутствуют. Этот факт объясняется тем, что тиосемикарбазон инденохиноксалина ранее изучен в основном в реакциях с бифункциональными соединениями, которые сопровождаются процессом молекулярной циклизации и, минуя S-замещенные продукты, сразу приводят к синтезу (индено[1,2- b ]хиноксалин-11-илиден)гидразин)тиазольных систем. Так, впервые полученный нами S-аллилтиосемикарбазон 11 H -индено[1,2- b ]хиноксалин-11-он в результате дальнейшей электрофильной гетероциклизации под действием галогенов был превращен в галогениды 11 H -индено[1,2- b ]хиноксалин-11-илиден-гидразин-4-(иодметил)-4,5-дигидро-1,3-тиазолия. В спектрах ЯМР 1Н галогенидов индено[1,2- b ]хиноксалинилиден-гидразин-4-(галогенметил)-1,3-тиазолия наблюдаются сигналы протонов SCH2 и CH2X групп (X=I, Br) в области 3,60-4,24 м. д., сигналы протонов -NH- и =N+H- групп при 9,69-10,47 м. д. и мультиплеты ароматических протонов гетероциклического фрагмента - при 7,73-7,76; 7,83-7,84;7,89-7,91; 7,97-7,99; 8,18-8,20; 8,20-8,22; 8,30-8,32 м. д. Однопротонный сигнал =СНN+- группы в случае трииодида образует сигнал при 5,83 м. д., тогда как в случае трибромида аналогичный сигнал протона проявляется при 6,05 м. д.
11h-индено[1, 2-b]хиноксалин-11-он, тиосемикарбазон индено[1, 2-b]хиноксалин-11-она, бромистый аллил, гетероциклизация
Короткий адрес: https://sciup.org/147246057
IDR: 147246057 | УДК: 547.863.11+ | DOI: 10.14529/chem240413
Текст научной статьи Синтез и гетероциклизация неизвестного ранее S-аллилтиосемикарбазона 11Н-индено[1,2-B]хиноксалин-11-она
Производные хиноксалина имеют довольно широкий спектр полезных свойств, таких как: антибактериальные (производные хиноксалин-1,4-диоксида применяются в медицине и ветеринарии в качестве антибактериальных агентов для лечения тяжелых форм инфекционных заболеваний [1]), противораковые (производные 2-(1-алкилбензимидазол-2-ил)хиноксалинов были использованы в разработке многоцелевых подходов к ингибированию клеток рака шейки матки in vitro для создания новых терапевтических целевых агентов [2]) и противогрибковые (проявляют активность в отношении фитопатогенных грибов [1]).
Кроме того, различные антибиотики, такие как эхиномицин, левомицин и актинолеутин, содержат хиноксалиновые циклы в структуре активного соединения, и используются для подавления грамположительных бактерий [3]. Механизм действия хиноксалинов принципиально отличается от других антимикробных лекарственных средств. Хиноксалины характеризуются высокой реакционной активностью и способностью активировать в организме в анаэробных условиях свободнорадикальные процессы. Бактерицидное действие хиноксалинов обусловлено повреждением ДНК микробной клетки, нарушением процесса ее деления и развитием необратимых структурных изменений в ядре и цитоплазме [4]. Некоторые производные инденохиноксалина проявляют себя как ингибиторы N-концевой киназы [5].
Первые упоминания о реакции о -фенилендиамина ( 1 ) с нингидрином ( 2 ), приводящей к синтезу 11 H -индено-[1,2- b ]-хиноксалин-11-она ( 3 ) встречаются в работе [6]. При этом соединение 3 было получено в разбавленной уксусной кислоте при 120°С с выходом 77 %. Аналогичным способом, но в этаноле, был получен 2,3,8-тризамещенный 11 H -индено-[1,2- b ]-хиноксалин-11-он с выходом в 83 % [6] и 3,4,5-тризамещенные 11 H -индено-[1,2- b ]-хиноксалин-11-оны с выходами 35–90 % [7].
При проведении реакции конденсации нингидрина с о -фенилендиамином и его нитропроизводным в смеси этанола и ледяной уксусной кислоты при кипячении в течении 3ч выход соединения 3 и 4-нитро-11 H -индено[1,2- b ]хиноксалин-11-она составил 87 и 82 % соответственно [8]. Кроме того, соединение 3 можно получить при взаимодействии соединений 1 и 2 , но при комнатной температуре в дистиллированной воде [9] или в этаноле в присутствии ацетата натрия (при этом выход продукта незначительно снижается 79 %) [10], а также при кипячении в течение 1 ч в ТГФ в присутствии HCl [9]. Более подробно влияние растворителя, присутствия катализатора и температуры на реакцию конденсации соединений 1 и 2 описано в современной работе [11].
Кроме того, реакцией о -фенилендиамина с 1,2-индандионом в метаноле может быть сначала получен 11 H -индено-[1,2- b ]-хиноксалин, дальнейшее окисление которого бихроматом калия приводит к синтезу соединения 3 [12].
Интересно, что с выходом 55 % можно получить инденохиноксалин-11-он 3 при окислительном дегидрировании 2-инданона и орто -фенилендиамина с использованием молекулярного кислорода в качестве окислителя и триэтиламина в качестве катализатора. Однако в ходе реакции наравне с соединением 3 образуется индено[1,2- b ]хиноксалин с выходом 40 %. При этом увеличение времени реакции не влияет на соотношение продуктов реакции [13].
В литературе также описан метод получения соединения 3 из этилового эфира 3-фенилхиноксалин-2-карбоновой кислоты в две стадии. На первой стадии происходит гидролиз исходного соединения в этаноле в присутствии KOH с образованием 3-фенилхиноксалин-2-карбоновой кислоты с выходом 97 %. На второй стадии по реакции внутримолекулярной циклизации образуется инденохиноксалинон 3 с выходом 46 % [14].
Более специфичным способом получения инденохиноксалиновых систем является превращение бензо[ « ]феназин-5,6-дион-7-оксидов при их обработке метанольным гидроксидом калия при 20-25 °C. При этом реакция сопровождается выделением CO2, сжатием орто -хиноидного кольца, восстановлением N -оксидного фрагмента и приводит к синтезу 3,5-дизамещенных инде-но[1,2- b ]хиноксалин-11-онов с выходом 58-83 % [15].
Химические свойства соединения 3 представлены в литературе различными превращениями, в ходе которых тетрациклическая конденсированная система остается устойчивой даже в случае нарушения ароматичности отдельных циклов [6]. Однако, наиболее характеристичными для соединения 3 являются реакции функционализации по карбонильной группе [16]. Например, его конденсация с тиокарбогидразидом [17], метил К-(4-ацетилфенил)карбаматом [18], гидроксиламином [19, 20], бензогидразонамдами [21] и др. [11]. Кроме того, описываются реакции синтеза спиросоединений на основе 11 H -индено-[1,2- b ]-хиноксалин-11-она [22].
Аналогично по карбонильной группе протекает реакция конденсации инденохиноксалин-11-она 3 с тиосемикарбазидом (4) в смеси этанола и хлороформа при кипячении в течении 8 ч в присутствии безводного сульфата магния. Выход конечного продукта реакции - тиосемикарбазона индено[1,2- b ]хиноксалин-11-она (5) - составляет 74 % [23].
Данная реакция может так же протекать в этаноле при кипячении в присутствии каталитического количества ледяной уксусной кислоты [24], либо в метаноле в присутствии концентрированной H2SO4 [25].
Для тиосемикарбазона 5 характерными являются реакции комплексообразования с ионами металлов [23, 26, 27]. Однако, наиболее часто встречаются в литературе реакции тиосемикарбазона 5 с бифункциональными соединениями, сопровождающиеся, по-видимому, образованием промежуточных S-производных соединения 5 , претерпевающих молекулярную циклизацию [28]. Например, в статье [29] описывается взаимодействие тиосемикарбазона 5 с этилхлорацетатом в кипящем диоксане в присутствии триметиламина, приводящее к образованию 2-(2-(11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразин)тиазол-4(5 H) -она с выходом 78 %. Так же к аннелированию тиазольного цикла приводит взаимодействие тиосемикарбазона 5 с диметилацетилендикарбок-силатом в абсолютном метаноле. В этой реакции атом серы атакует тройные связи и образуется тиолактам, последующий аммонолиз сложноэфирной группы приводит к образованию метил-2-(2-(2-(-11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразинил)-4-оксотиазол-5(4 H) -илиден) ацетата с выходом 86 %. Еще одним примером получения тиазольного кольца является взаимодействие соединения 5 с 3-хлорпентан-2,4-дионом. При этом выделяется 1-(2-(2-(11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразинил)-4-метилтиазол-5-ил)этан-1-он с выходом 79 % [29].
Практически значимым является возможность использования тиосемикарбазона 5 в качестве хемосенсора для быстрого и точного определения содержания ионов F- в среде ацетонитрила (предел обнаружения 6 мкм) [30].
Экспериментальная часть
Спектры ЯМР 1Н и 13С записывали на спектрометрах Bruker DRX-400 (рабочая частота 400 ( ' Н) МГц) и AVANCE-500 (рабочая частота 500 ( ' Н) и 126 (13С) МГц) в ДМСО-d6, внутренний стандарт - ТМС (для ядер 1Н) и сигнал растворителя (для ядер 13С, 39,5 м. д.).
Температуры плавления измерены с помощью прибора для определения температуры плавления ПТП (М) (V ~ 220 В, W = 500 BA).
ИК-спектры соединения 1 записывали на ИК-спектрометре Shimadzu IRAffmity-1S в таблетках KBr в области 4000–400 см–1.
Масс-спектр сняты на хромато-масс-спектрометре фирмы SHIMADZU GCMS-QP2010 Ultra, режим электронной ионизации ЭИ (70 эВ).
Синтез 11 Н -индено[1,2- b ]хиноксалин-11-она (3) . Раствор 0,899 г (5 ммоль) нингидрина в 50 мл этилового спирта смешивают с 2 мл AcOH и 0,541 г (5 ммоль) орто -фенилендиамина. Реакционную смесь нагревают в течение 3 ч. Через 24 ч образовавшийся осадок жёлтооранжевого цвета отфильтровывают и сушат. Выход 11 Н -индено[1,2- b ]хиноксалин-11-она составляет 1,077 г (92 %), Т пл 218–220 °С (Лит. 214–216 °С [11]). ИК-спектр ( ν , см - 1): 422, 462, 484,
526, 542, 552, 571, 609, 633, 648, 702, 731, 756, 766, 868, 887, 939, 957, 1165, 1184, 1199, 1236, 1248, 1308, 1337, 1368, 1396, 1464, 1508, 1549, 1681, 1709, 1722, 1809, 1844, 1911, 1942, 1977, 3023, 3048, 3069, 3424.
1005, 1568,
1044, 1109, 1123,
1605, 1616, 1653,
Синтез тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она
Раствор 0,054 г
(0,6 ммоль) тиосемикарбазида в 50 мл метилового спирта смешивают с 0,132 г (0,6 ммоль) 11 Н -индено[1,2- b ]хиноксалин-11-она. Реакционную смесь нагревают в течение 5 ч. Через 24 ч образовавшийся осадок жёлтого цвета отфильтровывают и сушат. Выход тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она составляет 0,148 г (82 %), Т пл 265 °С (Лит. 263–265°С [29]).
Синтез S-аллилтиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она (6a) . К раствору 0,408 г (1,3 ммоль) тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она в 10 мл ДМФА добавляют раствор 0,073 г (1,3 ммоль) КОН в 1 мкл воды и 0,11 мл аллилбромида (1,3 ммоль) и перемешивают при комнатной температуре. Через 24 ч реакционную смесь отфильтровывают, к фильтрату добавляют раствор 15 мг хлорида кальция в 100 мл воды. Образовавшийся осадок оранжево-коричневого цвета отфильтровывают и сушат. Выход осадка составляет 0,116 г (25 %), Т с разл 190 °С.
Синтез S-металлилтиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она (6b) . К раствору 0,408 г (1,3 ммоль) тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она в 30 мл ДМСО добавляют раствор 0,07 г (1,3 ммоль) КОН в 1 мкл воды и 0,13 мл (1,3 ммоль) хлористого металлила. Через 24 ч реакционную смесь отфильтровывают, к фильтрату добавляют 70 мл воды. Образующийся осадок оранжевого цвета отфильтровывают и сушат. Выход осадка составляет 0,144г (30 %), Т пл 197 °С.
Синтез трииодида 11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразин-2-амино-4-(иодметил)-4,5-дигидро-1,3-тиазолия (10a) . К раствору 0,020 г (0,058 ммоль) S-аллилтиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она в 30 мл CH3Cl приливают раствор 0,030 г I 2 (0,12 ммоль) в 15 мл CH 3 Cl. Через 48 ч растворитель испаряют. Механическим путём коричневый осадок отделяют от красно-коричневого масла. Выход осадка составляет 0,342 г (70 %). Т пл 140 °С.
Синтез моноиодида 11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразин-2-амино-4-(иодметил)-4,5-дигидро-1,3-тиазолия (13a) . 0,300 г (0,36 ммоль) Полученного осадка 7a растворяют в ацетоне и добавляют 15 мг (0,08 ммоль) NaI·2H 2 O. Образовавшийся осадок красного цвета отфильтровывают и сушат. Выход осадка составляет 0,063 г (30 %). Т пл 150 °С.
Синтез трибромида 11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразин-2-амино-4-(бромметил)-4,5-дигидро-1,3-тиазолия (10b) . К раствору 0,020 г (0,058 ммоль) S-аллилтиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она в 30 мл CH3Cl добавляют по каплям раствор 0,01 мл Br2 (0,12 ммоль) в 10 мл CH3Cl при внешнем охлаждении льдом. Реакционную смесь оставляют стоять в течение 24 ч при 7 °С. Через 24 ч осадок бурого цвета отфильтровывают и сушат. Выход осадка составляет 0,020 г (53 %). Т с разл 135 °С.
Синтез монобромида 11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразин-2-амино-4-(бромметил)-4,5-дигидро-1,3-тиазолия (13b) . 0,018 г (0,02 ммоль) Трибромида 7b растворяют в 15 мл ацетона, образующийся осадок серо-коричневого цвета отфильтровывают и сушат. Выход осадка составляет 4 мг (29 %). Т пл 160 °С.
Обсуждение результатов
Взаимодействием орто -фенилендиамина 1 с нингидрином 2 с в системе C2H5OH/AcOH при 80 °С нами был осуществлён синтез 11 Н -индено[1,2- b ]хиноксалин-11-она 3 с выходом 84 %:
В ИК-спектре соединения 3 наблюдается интенсивная полоса поглощения С=О группы при 1722 см-1. В масс-спектре, полученном при прямом вводе пробы, (рис. 1) 11 Н -индено[1,2- b ]хиноксалин-11-она имеется максимально интенсивный (100 %) пик молекулярного иона с m/z 232, что соответствует молекулярной массе соединения 3 .
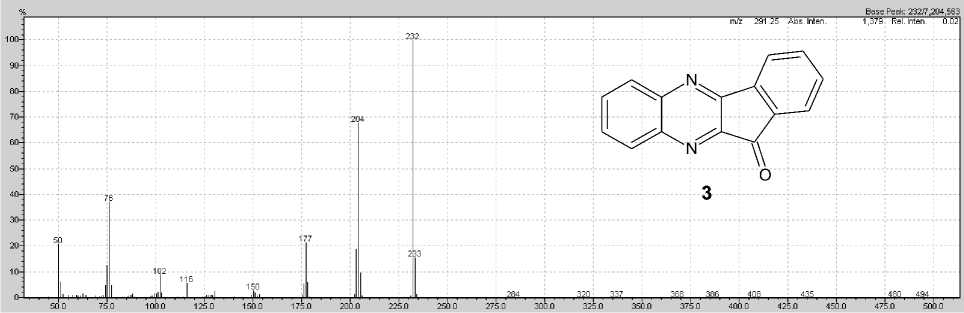
Рис. 1. Масс-спектр (прямой ввод пробы) 11 Н -индено[1,2- b ]хиноксалин-11-она (3)
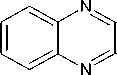
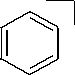
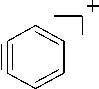
Фрагментация молекулярного иона (схема 1) в первую очередь связана с отщеплением молекулы СО и образованием катион-радикала бензо[3,4]циклобута[1,2- b ]хиноксалина, которому соответствует пик с m/z 204 и интенсивностью 68 %. Далее катион-радикал бен-зо[3,4]циклобута[1,2- b ]хиноксалина претерпевает отщепление 2,3-дидегидрохиноксалина, что может быть связано с появлением в масс-спектре пика с m/z 76 (интенсивность 38 %), соответствующего катион-радикалу циклогекса-1,3-диен-5-ина.
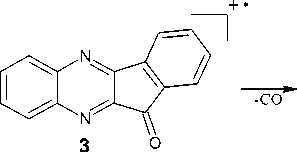
m/z 232 (100%)
+ .
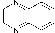
m/z 76 (38%)
m/z 204 (68%)
Схема 1. Фрагментация 11 Н -индено[1,2- b ]хиноксалин-11-она (3) при съёмке масс-спектра
Далее реакцией 11 Н -индено[1,2- b ]хиноксалин-11-она 3 с эквимолярным количеством тиосемикарбазида ( 4 ) в метаноле при 50 °С нами был осуществлён синтез тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она ( 5 ) с выходом 82 %. В спектре ЯМР 1 Н тиосемикарбазона 5 (рис. 2) ароматические протоны резонируют при 7,67; 7,91; 8,10 и 8,17 м. д., а уширенные сигналы при 8,84 и 9,08 м.д можно отнести к сигналам протонов -NH2 группы, уширенный синглет при 12,61 м. д., по-видимому, соответсвует протону -NH-N= группы.
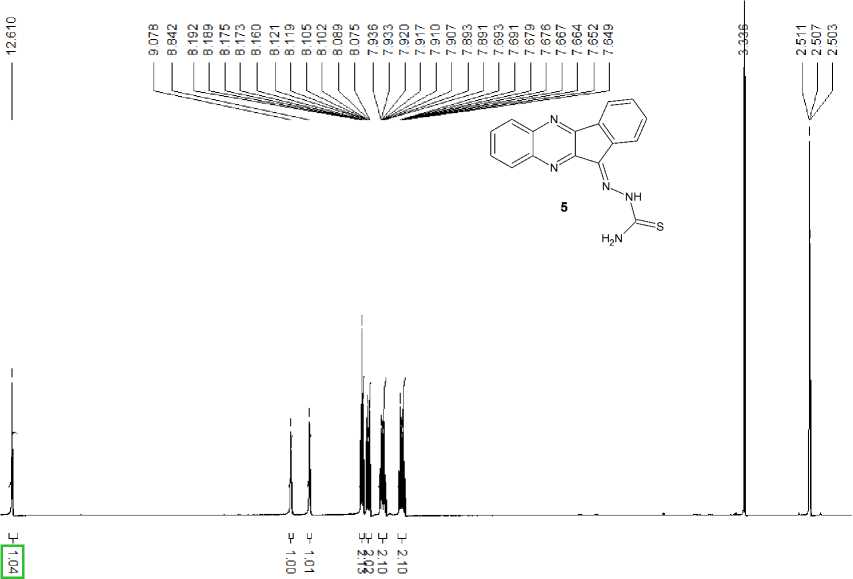
Рис. 2. Спектр ЯМР 1Н тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она (5)
Тиосемикарбазон 5 был исследован в реакции S-алкенилирования под действием эквимолярного количества бромистого аллила и хлористого металлила в системе ДМФА-KOH-Н 2 О при комнатной температуре. При этом из реакционной смеси были выделены S-аллилтиосемикарбазоны 11 H -индено[1,2- b ]хиноксалин-11-она ( 6a,b ) с выходом 25 %:
X=Br, R=H; X=Cl, R=CH
ДМФА-КОН-Н О 23-25 °C, 224ч
6a : R=H; 6b : R=CH
Стоит отметить, что небольшой выход аллилтиосемикарбазонов 6a,b может быть связан с трудностью выделения продукта реакции из реакционной смеси.
В ЯМР 1Н спектре соединения 6а наблюдаются сигнал протонов SCH2 группы при 3,97 м. д., однопротонные сигналы =СН 2 группы – при 5,21 и 5,43 м. д. и мультиплет протона –СН= при 6,03–6,05 м. д. Ароматические протоны гетероциклического фрагмента образуют мультиплеты в характерной для них области слабого поля: 7,64–7,68; 7,82–7,91 и 8,15–8,19 м. д. При 8,90 и 9,06 м. д. проявляются уширенные сигналы, которые, вероятнее всего, можно отнести к протонам амино-группы.
Идентификациию соединения 6b осуществляли методом масс-спектрометрии (прямой ввод пробы). В масс-спектре (рис. 3) наблюдается сигнал молекулярного иона с m/z 359 с небольшой интенсивностью (38 %).
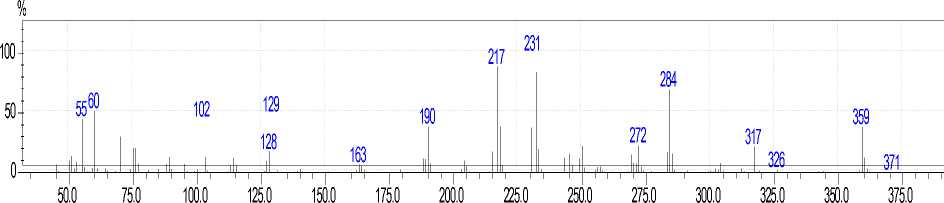
Рис. 3. Масс-спектр (прямой ввод пробы) S-металлилтиосемикарбазона 11 H -индено[1,2- b ]хиноксалин-11-она (6b)
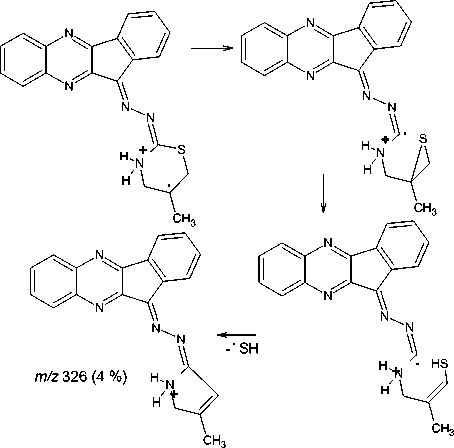
Фрагментация соединения 6b заключается в характеристичном для аллилсульфидов гетероциклического ряда элиминировании радикала ’ SH [31], что подтверждается наличием в масс-спектре соединения 6b соответствующего малоинтенсивного пика с m/z 326 [M-SH]+. Максимально интенсивный пик в масс-спектре можно отнести к катион-радикалу индено[1,2- b ]хиноксалин-11-имина с m/z 231. Имин образуется при отщеплении от молекулярного иона 3-[2-метилпропенилсульфанил]-1 H -диазирена, причем процесс отщепления сопровождается миграцией атома Н:
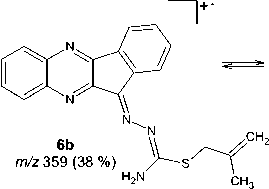
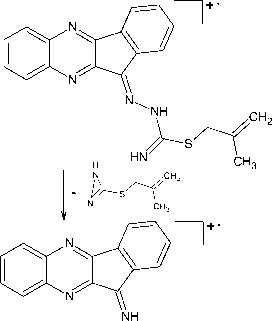
m/z 231 (100 %)
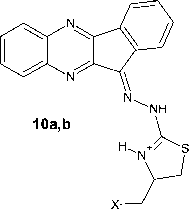
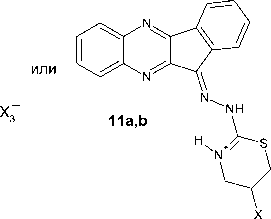
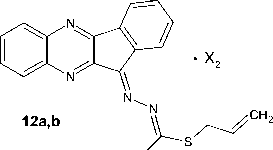
Химические свойства S-аллилтиосемикарбазона 11 H -индено[1,2- b ]хиноксалин-11-она 6а были изучены нами в реакциях с двукратным избытком галогенов, которые были осуществлены в хлороформе при комнатной температуре в случае йода и при охлаждении льдом в случае брома. Теоретически данное взаимодействие может протекать с образованием продуктов присоединения галогенов по кратной связи ( 7a,b ), продуктов аннелирования тиазольного цикла ( 8a,b–11a,b ) или молекулярных комплексов соединения 6а с галогенами ( 12a,b ):
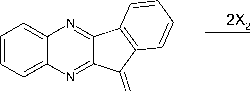
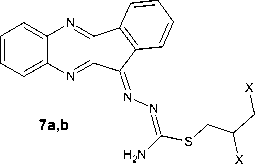
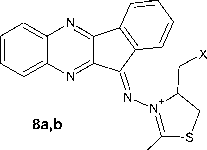
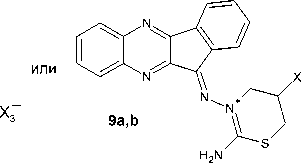
X 3
X 3
HN
7-12a : X= I; 7-12b : X= Br
Аналогично известным в литературе данным о синтезе 2-(2-(11 H -индено[1,2- b ]хиноксалин-11-илиден)гидразин)тиазол-4(5 H )–ониевых систем [29] и на основании согласующихся с ними данных спектров ЯМР 1Н для сигнала протона =N-NH- группы (в области 9,43–9,97 м. д.) нами показано, что при взаимодействии S-аллилтиосемикарбазона 6а с галогенами происходит образование продуктов циклизации с участием атома азота –NH2 группы. При этом аннелирование тиазольного цикла приводит к синтезу тригалогенидов 11 H -индено[1,2- b ]хиноксалин-11-илиден-гидразин-4-(галогенметил)-4,5-дигидро-1,3-тиазолия ( 10a , b ) с выходом 70 и 53 % соответственно для соединений 10a , b . В спектре ЯМР 1Н соединения 10a (рис. 4) наблюдается наложение сигнала протонов SCH 2 и CH 2 I групп и образование трёхпротонного мультиплета при 3,60–3,62 м. д., при этом ещё один сигнал при 4,19 м. д. может быть отнесен к одному из протонов SCH 2 группы. В то же время в спектре ЯМР 1Н соединения 10b подобного наложения сигналов не наблюдается и протоны группы SCH 2 образуют два мультиплета при 3,67–3,70 м. д. и 4,19–4,24 м. д., а протоны группы СH 2 Br – два мультиплета при 3,85–3,88 м. д. и при 3,94–3,99 м. д. (рис. 5). Различное расположение данных сигналов связано, прежде всего, с различным влиянием (экранированием), создаваемым электронами разных атомов галогена. Однопротонный сигнал =СНN+– группы в случае трииодида 10а образует сигнал при 5,83 м. д., тогда как в случае трибромида 10b аналогичный сигнал протона проявляется при 6,05 м. д. Протоны –NH- и =N+H- групп резонируют при 9,69 и 10,41 м. д. соответственно для соединения 10а и при 9,74 и 10,47 м. д. – для соединения 10b . Ароматические протоны гетероциклического фрагмента образуют сложные мультиплеты в области 7,74–7,76; 7,83–7,84;7,89–7,91; 7,97–7,99; 8,18–8,20; 8,20–8,22; 8,30–8,32 м. д. в спектре соединения
10а и в области 7,73–7,75; 7,83–7,84; 7,89–7,91; 7,97–7,99; 8,17–8,19; 8,20–8,22; 8,29–8,30 в спектре соединения 10b.
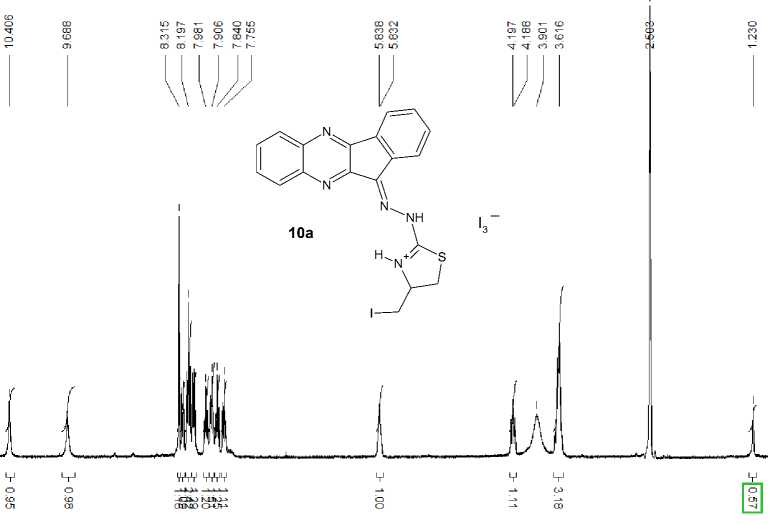
Рис. 4. Спектр ЯМР 1Н трииодида 11 H -индено[1,2- b ]хиноксалин-11-илиден-гидразин-4-(иодметил)-4,5-дигидро-1,3-тиазолия (10a)
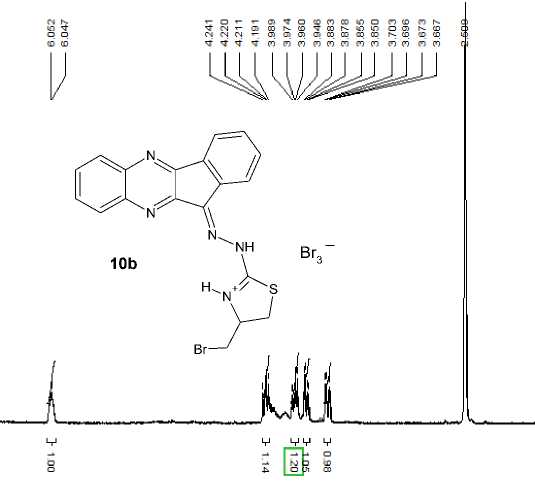
Рис. 5. Фрагмент спектра ЯМР 1Н трибромида 11 H -индено[1,2- b ]хиноксалин-11-илиден-гидразин-4-(бромметил)-4,5-дигидро-1,3-тиазолия (10b) (область сигналов протонов SCH 2 , СH 2 Br и СНN+Н– групп)
Следует отметить, что ввиду отсутствия монокристаллов, подходящих для проведения РСА, образование соединений 10a,b в виде тригалогенидов предложено нами на основе существующих литературных данных аналогичных реакций гетероциклизации при действии двукратного избытка галогенов на различные аллилсульфиды гетероциклического ряда [31, 32]. Однако, в данной работе нами также обнаружено, что трииодид 10a при дальнейшем действии на него NaI·2H2O в ацетоне переходит в соответствующий монойодид 11H-индено[1,2-b]хиноксалин-11-илиден)гидразин-2-амино-4-(галогенметил)-4,5-дигидро-1,3-тиазолия (13a), а трибромид 10b превращается в соответствующий монобромид (13b) при действии на него ацетона, что также является характерным для подобных полигалогенидов [32–34]:
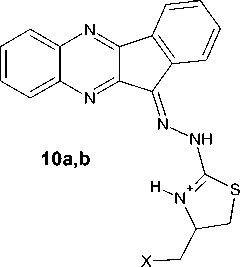
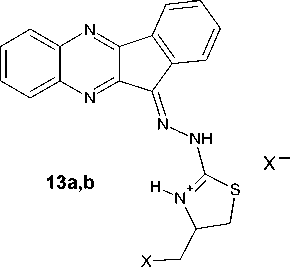
10a, 13a : X=I; 10b,13b : X=Br. 10a : i = Me CO, NaI*2 H O;
10b : i = Me CO
Заключение
Таким образом, в ходе настоящего исследования нами при взаимодействии тиосемикарбазона 11 Н -индено[1,2- b ]хиноксалин-11-она 5 с эквимолярным количеством бромистого аллила и хлористого металлила в системе ДМФА-KOH-Н 2 О при комнатной температуре впервые были получены S-аллил(металлил)тиосемикарбазоны 11 H -индено[1,2- b ]хиноксалин-11-она 6a,b . Также установлено, что дальнейшая гетероциклизация соединения 6a под действием двукратного избытка йода или брома приводит к аннелированию тиазольного цикла и образованию неизвестных ранее внутримолекулярных солей 10a,b, строение которых было установлено методом ЯМР 1Н.
Список литературы Синтез и гетероциклизация неизвестного ранее S-аллилтиосемикарбазона 11Н-индено[1,2-B]хиноксалин-11-она
- Javidi J., Esmaeilpour M. // Materials Research Bulletin. 2016. V. 73. P. 409. D01:10.1016/j.materresbull.2015.10.002
- Pashirova T.N., Zhukova N.A., Lukashenko S.S. et al. // Colloids. Surf., B. 2019. V. 178. P. 317. DOI: 10.1016/j.colsurfb.2019.03.021
- Varma R.R., Pandya J.G., Vaidya F.U. et al. // Journal of Molecular Structure. 2021. V. 1240. № 130529. DOI: 10.1016/j.molstruc.2021.130529
- Desai V., Desai S., Gaonkar S.N. et al. // Bioorganic & Medicinal Chemistry Letter. 2017. V. 27. P. 2174. DOI: 10.1016/j.bmcl.2017.03.059
- Schepetkin I.A., Kirpotina L.N., Khlebnikov A.I. et al. // Mol. Pharmacol. 2012. V. 81, No. 6. P. 832. DOI: 10.1124/mol.111.077446
- Ruhemann S. // J. Chem. Soc. Trans. 1910. V. 97. P. 1438. DOI:10.1039/CT9109701438
- Liakhov S.A., Schepetkin I.A., Karpenko O.S. et al. // Molecules. 2021. V. 26. P. 5688. DOI: 10.3390/molecules26185688
- Tantawy E.S., Amer A.M., Mohamed E.K. et al. // Journal of Molecular Structure. 2020. V. 1210. №128013. DOI: 10.1016/j.molstruc.2020.128013
- Ghalib R.M., Hashim R., Sulaiman O. et al. // Acta Cryst. 2010. E66. o1494. DOI: 10.1107/S1600536810019252
- Alizadeh A., Mohammadi R., Bayat F. et al. // Tetrahedron. 2017. V. 73, No. 30. P. 4433. DOI:10.1016/j.tet.2017.06.010
- Sharma A., Kaur G., Singh D. et al. // Current Organocatalysis. 2022. V. 9. P. 53. DOI: 10.2174/2213337208666210825112301
- Pearson B.D., Mitsch R.A., Cromwell N.H. // J. Org. Chem. 1962. V. 27, No. 5. P. 1674. DOI: 10.1021/JO01052A046
- Zhang C, Xu Z., Zhang L. et al. // Tetrahedron. 2012. V. 68, No. 26. P. 5258. DOI: 10.1016/j.tet.2012.03.020
- Jiao Y.-X., Wei L.-S., Zhao Ch.-Y. et al. // Advanced Synthesis & Catalysis. 2018. V. 360. P. 4446. DOI: 10.1002/adsc.201800928
- Gornostaev L.M., Rukovets T.A., Arnold E.V. et al. // Chemistry of Heterocyclic Compounds. 2015. V. 51. P. 166. DOI: 10.1007/s10593-015-1676-7
- Кутлалиева Э.Н., Шустова Е.А., Великородов А.В. // Прикаспийский вестник медицины и фармации. 2022. Т. 3, № 2. С. 6. DOI: 10.48612/agmu/2022.3.2.6.19
- Selvam P., Clercq E., Pannecouque C. // Int. J. Drug Des. Dis. 2013. V. 4. P. 1017.
- Velikorodov A.V., Stepkina N.N., Shustova E.A. et al. // Russian Journal of Organic Chemistry. 2015. V. 51. P. 674. DOI: 10.1134/S1070428015050164
- Tseng C.-H., Chen Y.-R., Tzeng C.-C. et. al. // European Journal of Medicinal Chemistry. 2016. V. 108. P. 258. DOI: 10.1016/j.ejmech.2015.11.031
- Матвеевская В.В. ^нтез производных ПН-индено[1,2-0]хиноксалин-11-она и индазола как биологически активных соединений и лигандов в арен-рутениевых комплексах: автореф. дис.... канд. хим. наук. Томск. 2021 г. 23 c.
- Gomaa M.A.-M., El-Katatny M.H., and Alia H.A. // Synthetic Communications. 2020. V. 50, No. 18. P. 2819. DOI: 10.1080/00397911.2020.1786122
- Barkov A.Yu., Zimnitskiy N.S., Korotaev V.Yu. et al. // Chemistry of Heterocyclic Compounds. 2017. V. 53, No. 4. P. 451. DOI: 10.1007/s10593-017-2074-0
- Babgia B.A., Bawazeer M., Alzaidi N.A. et al. // Journal of Molecular Structure. 2021. V. 1238. № 130309. DOI: 10.1016/j.molstruc.2021.130309
- Hameed S., Khan K.M., Salar U. et al. // International Journal of Biological Macromolecules. 2022. V. 221. P. 1294. DOI: 10.1016/j.ijbiomac.2022.09.102
- Kumar A., Kumar V., Diwan U. et al. // Sensors and Actuators B: Chemical. 2013. V. 176. P. 420. DOI: 10.1016/j.snb.2012.09.089
- CheX.-Q., WangLi-B. // Wuji Huaxue Xuebao. 2006. V. 22, No. 10. P 1857.
- Che X.-Q., Gao Y.-X. and Wang J.-W. // Acta Crystallographica. Section C: Crystal Structure Communications. 2006. C62. P. m440. DOI: 10.1107/S0108270106027582
- Abdallah A.M., Gomha S.M., Zaki M.E.A. et al. // Journal of Molecular Structure. 2023. 1292. № 136044. DOI: 10.1016/j.molstruc.2023.136044
- Fayed E.A., Ammar Y.A., Ragab A. et al. // Bioorganic Chemistry. 2020. V. 100. № 103951. DOI: 10.1016/j.bioorg.2020.103951
- Sahu S., Sikdar Y., Bag R. et al. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2019. V. 213. P. 354. DOI: 10.1016/j.saa.2019.01.073
- Рыбакова А.В., Ким Д.Г., Столповская Н.В. // Вестник ЮУрГУ. Серия «Химия». 2024. Т. 16, № 1. С. 93. DOI: 10.14529/chem240107
- Рыбакова А.В. // Журнал органической химии. 2016. Т. 52, № 1. С. 106. EDN: VHTGLP.
- Рыбакова А.В., Ким Д.Г., Шарутин В.В., Слепухин П.А. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 93. DOI 10.14529/chem230110.
- Ким Д.Г., Рыбакова А.В., Шарутин В.В. и др. Mendeleev Commun. 2019. V. 29. P. 59. DOI: 10.1016/j.mencom.2019.01.019

![Синтез и гетероциклизация неизвестного ранее S-аллилтиосемикарбазона 11Н-индено[1,2-B]хиноксалин-11-она Синтез и гетероциклизация неизвестного ранее S-аллилтиосемикарбазона 11Н-индено[1,2-B]хиноксалин-11-она](/file/cover/147246057/sintez-i-geterociklizacija-neizvestnogo-ranee-s-alliltiosemikarbazona-11n-indeno.png)
