Синтез и исследование методом масс-спектрометрии 3-аллили 3-металлилхиназолин-4(3Н)-она
Автор: Бахтеева Евгения Игоревна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.10, 2018 года.
Бесплатный доступ
Взаимодействием хиназолин-4( 3Н )-она с аллил(металлил) галогенидами в присутствии карбоната калия в среде безводного диметилформамида (ДМФА), а также в присутствии гидроксида калия в изопропиловом спирте синтезированы 3-аллилхиназолин-4( 3Н )-он (2а), 3-(2-метил-2-пропен-1-ил)хиназолин-4( 3Н )-он (2b). В спектрах ЯМР 1Н полученных соединений имеются сигналы протонов аллильной (металлильной) группы. Сигналы протонов группы -NCH2 для соединений 2а,b располагаются при 4,63 и 4,58 м.д. соответственно. В ИК спектрах синтезированных соединений имеются полосы поглощения карбонильной группы в области 1650-1660 см-1, что является свидетельством протекания реакции по атому азота. Методом хроматомасс-спектрометрии выявлены основные направления фрагментации N-производных хиназолин-4( 3Н )-она. В масс-спектрах соединений 2а,b имеется пик молекулярного иона. Для соединения 2а он составляет 63 %, а для 2b - 18 %. Максимальным для обоих соединений является пик [М-СН3]+, образование которого, на наш взгляд, обусловлено тем, что при элиминировании метильного радикала образуются оксазоло[ 3,2-c ]хиназолиниевые системы, обладающие ароматичностью. Образование пика [M-H]+ также обусловлено образованием ароматического катиона оксазоло[ 3,2-c ]хиназолиниевые системы. Интенсивность пика для 2а составляет 56 %, для 2b - 41 %. В спектрах обоих соединений имеются пики [M-ОН]+, интенсивность которых составляет 20-25 %. По-видимому, происходит изомеризация с образованием катиона-радикала 4-гидрокси-3-(2-метилпропенил)хиназолиния, который после отщепления гидроксильного радикала образует устойчивый катион 1Н -пирроло- [ 3,2-c ]хиназолиния. В масс-спектрах соединений 2а,b присутствуют пики [М-СО]+∙, характерные для шестичленных кетонов. Но они имеют низкую интенсивность: для 2а интенсивность пика составляет 3 %, а для 2b всего лишь 1 %. В спектрах соединений 2a,b присутствует пик с m/z = 145, соответствующий отрыву аллильного (металлильного) радикала и образованию катиона хиназолон-4( 3Н )-она. Пик с m/z 146 обусловлен образованием катион-радикала исходного хиназолона в результате отрыва аллена. В масс-спектрах обоих соединений имеется пик аллильного катиона ( m/z = 1) и металлильного катиона ( m/z = 55) соответственно.
Хиназолин-4(3н)-он, 3-аллилхиназолин-4(3н)-он, 3-(2-метил-2-пропен-1-ил)хиназолин-4(3н)-он, оксазоло[3, 2-c]хиназолин, алкилирование, хроматомасс-спектрометрия, фрагментация
Короткий адрес: https://sciup.org/147160422
IDR: 147160422 | УДК: 547.856.1+543.51 | DOI: 10.14529/chem180202
Текст научной статьи Синтез и исследование методом масс-спектрометрии 3-аллили 3-металлилхиназолин-4(3Н)-она
Неослабевающий интерес к методам синтеза производных хиназолин-4 (3Н) -онов связан с использованием их в медицинской практике и с проявлением ими разнообразной биологической активности. Так, производные хиназолина проявляют бронхолитические, антидепрессантные, антигипертензивные, анальгетические, седативные и бактерицидные свойства [1–4]. Производные хиназолона используются в качестве седативных, снотворных, противосудорожных, бронхолитических средств [5, 6]. Они усиливают действие барбитуратов, анальгетиков, нейролептиков и кодеина. Производные хиназолинонов, содержащие радиоактивный иод, используются в диагностике и лечении раковых заболеваний [7].
В связи с этим синтез новых соединений хиназолинового ряда является актуальной задачей. Целью настоящей работы является синтез аллильных производных хиназолин-4( 3Н )-она и их исследование методом хроматомасс-спектрометрии.
Обсуждение результатов
В литературе известен ряд методов синтеза производных хиназолин-4 (3Н) -онов из антраниловой кислоты: под действием гидразина в присутствии ацетилхлорида [8]; триэтил- и триметилортоформиата с аминами в присутствии катализатора аммоний-церий (IV) нитрата [9]; уксусного ангидрида с дальнейшим взаимодействием полученного N-ацетилпроизводного с различными аминами [10].
3-Замещенные хиназолинонов получают взаимодействием 3-аминохиназолонов с различными реагентами: при нагревании с цианоуксусным эфиром [11], с циннамоилхлоридом в безводном пиридине [12], с фенилизоцианатом или финилизотиоцианатом [13], с п -ацетамидобензенсульфонилхлоридом в щелочной среде [14], с 2-хлорхинолин-3-карбальдегидом в этаноле [15].
4-Триметилсилилоксихиназолин, полученный кипячением хиназолин-4( 3H) -она в избытке гексаметилдисилазана в присутствии каталитических количеств хлорида аммония, алкилируется фенацилбромидом в среде 1,2-дихлорэтана с образованием 3-(2-фенил-2-оксоэтил)хиназолин-4 (3Н) -она [16]. Замещенные производные хиназолонов получают также взаимодействием 2-метил, 6-бром- и 6-нитрохиназолин-4 (3Н) -онов с алифатическими и ароматическими хлорметил-и бромметилкетонами[17].
Установлено, что взаимодействие калиевой соли незамещенного хиназолин-4( 3Н )-она в среде безводного диметилформамида с различными 2-феноксиэтилбромидами протекает селективно по атомуN-3 и не затрагивает другие атомы хиназолиниевой системы [18].
3-алкенил(аллил)производные хиназолин-4( 3Н )-она получают взаимодействием POCl3 с производными 2-аминобензамида в ДМФА [19]. В литературе встречаются методы алкилирования хиназолин-4( 3Н )-она аллил бромидом в толуоле в присутствии КОН и бромида тетрабути-ламмония [20]; взаимодействие хиназолин-4( 3Н )-она с аллил хлоридом в толуоле в присутствии Тетракис(трифенилфосфин)палладия при нагревании [21]. Взаимодействием 4-хлорхиназолина с аллилоксидом натрия в статье [22] получают 4-аллилхиназолин-4( 3Н )-он, из которого нагреванием до 200 °С в атмосфере азота получают 3-аллилхиназоилн-4 (3Н )-он. Авторами статьи [23] приводится метод алкилирования аллилбромидом в толуоле в присутствии бромида тетрабутил-аммония и 3-метилимидазола .
Ранее было показано, что хиназолин-4( 3Н )-он реагирует с аллилбромидом в 2-пропаноле в присутствии гидроксида калия с образованием N-аллильного производного [24].
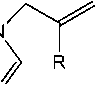
В настоящей работе нами предложен простой способ алкилирования хиназолин-4( 3Н )-она (1) 3-хлор-2-метилпропеном, в 2-пропаноле в присутствии гидроксида калия и аллилбромидом в ДМФА в присутствии К2СО3. При этом алкилирование протекает по атому азота с образованием 3-аллилхиназолин-4( 3Н )-она (2а), 3-(2-метил-2-пропен-1-ил)хиназолин-4( 3Н )-она (2b).
В спектрах ЯМР 1Н соединений 2а,b имеются сигналы протонов аллильной (металлильной) группы. Сигналы протонов группы -NCH 2 для соединений 2а,b располагаются при 4,63 и 4,58 м.д. соответственно.
В ИК-спектрах соединений 2 а,b имеются полосы поглощения карбонильной группы в области 1650–1660 см–1, что является свидетельством протекания реакции по атому азота.
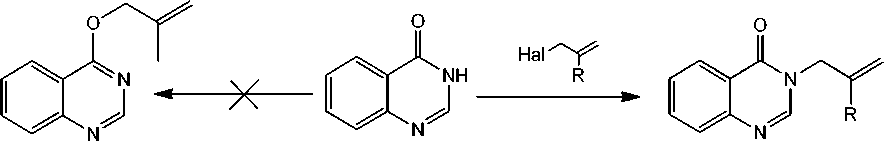
2a: R= Н, Hal - Br; 2b: R= CH3, Hal - Cl
Схема 1. Алкилирование хиназолин-4( 3Н )-она
В масс-спектрах соединений 2а,b (рис. 1 и 2) имеется пик молекулярного иона. Для соединения 2а он составляет 63 %, а для 2b – 18 %. Максимальным в обоих случаях является пик [М-СН3]+, что на наш взгляд, обусловлено тем, что при элиминировании метильного радикала образуются оксазоло[ 3,2-c ]хиназолиниевые системы F 1 , обладающие ароматичностью.
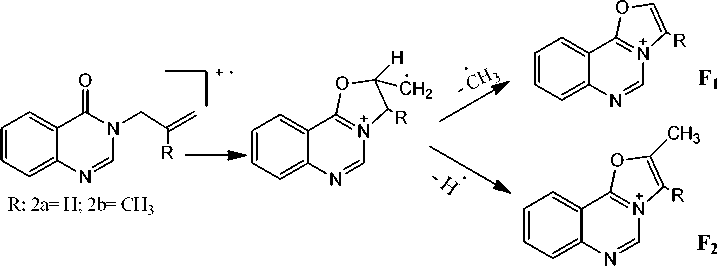
Схема 2. Образование оксазоло[ 3,2-c ]хиназолиниевых систем
Интенсивность пика [M-H]+сравнительно высокая. Так, для 2а составляет 56 %, для 2b – 41 %, что также обусловлено образованием ароматического катиона F2.
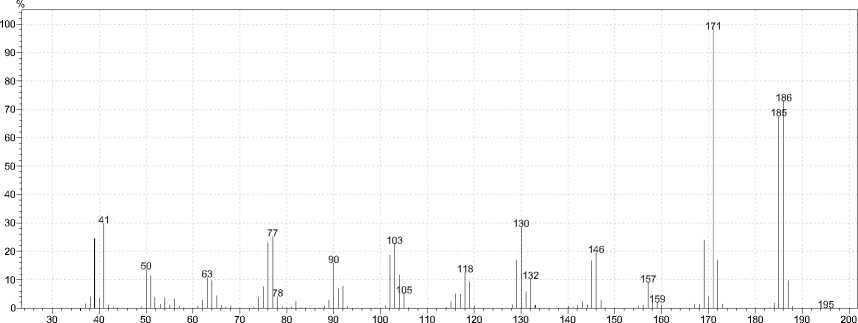
Рис. 1. Масс-спектр 3-аллилхиназолин-4( 3Н )-она
В спектрах обоих соединений имеются пики [M-ОН]+, их интенсивность составляет 20–25 %. По-видимому, происходит изомеризация с образованием катиона-радикала F 3 , который после отщепления гидроксильного радикала образует устойчивый катион 1Н -пирроло[ 3,2-c ]-хиназолиния (F 4 ).
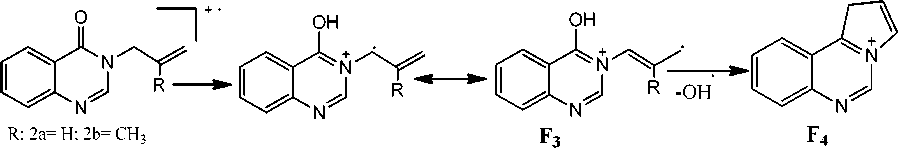
Схема 3. Образование катиона 1Н -пирроло[ 3,2-c ]хиназолиния
Известно, что шестичленные кетоны распадаются с элиминированием СО [25]. В масс-спектрах соединений 2а,b пики [М-СО]+∙ присутствуют, но имеют низкую интенсивность (F5). Для 2а интенсивность пика составляет 3 %, а для 2b всего лишь 1 %.
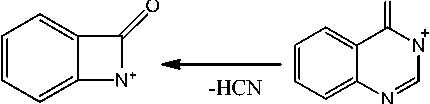
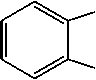
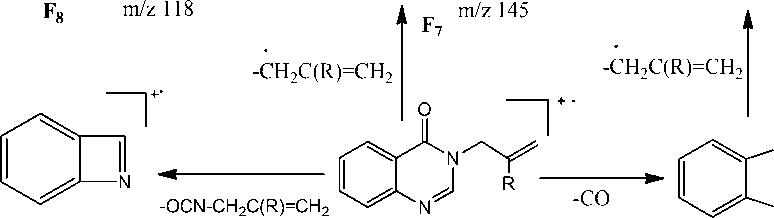
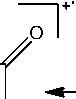
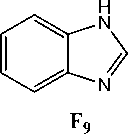
Найдено, что в спектрах соединений 2а,Ь присутствует пик с m/z = 103. На наш взгляд, он принадлежит катион-радикалу азетобензолу (F6), образующемуся в результате отрыва аллилизоцианата. В спектрах обоих соединений присутствует пик с m/z = 145 (F7), соответствующий отрыву аллильного (металлильного) радикала и образованию катиона хиназолон-4(3Н)-она. При отрыве HCN от катиона F7 происходит образование пика F8 с m/z =118. Для соединения 2b интенсивность пика составляет 8 %, а для 2а – 14 %. Появление в спектре пика с m/z = 118 можно объяснить и образованием бензимидазола F9, которое протекает при отщеплении молекулы аллена от катион-радикала F5.
O
---------»-
-CO
N
N+

N
R: 2a= H; 2b= CH3
F6 m/z 103
m/z 117
F 5
- сн2=с=сн2
-CH(R)=C=CH 2
F 11
NH
-HCN
-CO
NH
N
F 10 m/z 146
m/z 119
m/z 118
Схема 4. Фрагментация 3-аллилхиназолин-4 (3Н) -она и 3-(2-метил-2-пропен-1-ил)хиназолин-4 (3Н) -она
Пик с m/z 146 обусловлен образованием катион-радикала исходного хиназолона (F 8 ) в результате отрыва аллена. В масс-спектрах соединений 2а,b имеется пик аллильного катиона ( m/z = 41) и металлильного катиона ( m/z = 55) соответственно.
Рис. 2 Масс-спектр 3-(2-метил-2-пропен-1-ил)хиназолин-4 (3Н) -она
Экспериментальная часть
Масс-спектры продуктов термического превращения гидроксида N-аллилхинолиния снимали на приборе GCMS-QP2010 Ultra фирмы «Shimadzu» при энергии ионизирующих электронов 70 эВ и температуре ионного источника 200 ºС. Спектры ЯМР 1Н полученных соединений записаны в спектрометре Bruker DRX-400 (400 МГц) в ДМСО-d6, внутренний стандарт ТМС. ИК спектры записаны на ИК-спектрометре с Фурье-преобразованием Bruker «Tensor 27», диапазон измерений 400–4000 см–1, разрешение <1 см–1.
3-Аллилхиназолин-4( 3Н ) -он (2а) . К 0,73 г ( 0,005 моль) хиназолин-4( 3Н )-она и 2,78 г (0,02 моль) прокаленного K 2 СО 3 приливают 15 мл ДМФА и нагревают с обратным холодильником в течение 15 мин. К горячему раствору прибавляют 0,87 мл (0,01 моль) аллилбромида. Кипятят с обратным холодильником 3 ч. Фильтруют, растворитель отгоняют на роторном испарителе, остаток перекристаллизовывают из гексана. Выход 0,605 г (65 %), т. пл. 50 °С.
Масс-спектр, m/z ( I отн , %):186 [M] (63), 185 [M-H]+ (56), 172 (13), 171 [M-СH 3 ]+ (100), 169 [M-ОH]+ (20), 157 (7), 146 [M-СH 2 =С=СН 2 ]+∙ (16), 145 [M-С 3 H 5 ]+ (14), 132 (8), 130 (24), 129 (14), 119 [M-CNH-СH 2 =С=СН 2 ]+∙(8), 118 [M-OC-СH 2 =С=СН 2 ]+∙ (11), 103 [M-OCN-СH 2 -СH=СН 2 ]+∙(20), 102 (16), 91 (6), 90 (13), 77 (21), 76 (20), 64 (9), 63 (9), 51 (10), 50 (12), 41[M-C 8 H 5 N 2 O]+∙ (26).
Пики интенсивностью менее 5 % не учитывались.
Спектр ЯМР 1H (500 МГц, ДМСО-d6, м.д., J /Гц): 4.63 (2Н, тд, J 5.45, J 1.46 Гц, NCH 2 ), 5.15 (1Н, ддд, J 17.18, J 2.90, J 1.39 Гц, =СН 2 ), 5.22 (1Н, м, =CH 2 ), 6.02(1Н, м, -СН=), 7.56 (1Н, т, 6-Н), 7.70 (1Н, дд, J 7.70, J 0.45 Гц, 5-Н), 7.85 (1Н, т, 7-Н), 8.17 (1Н, дд, J 1.50, J7.97 Гц, 8-Н), 8.36 (1Н, с, 2-Н).
3-(2-Метил-2-пропен-1-ил)хиназолин-4( 3Н )-она (2b) . К 0,73 г ( 0,005 моль) хиназолин-4( 3Н )-она и 0,56 г (0,01 моль) KОН в 3 мл воды приливают 15 мл 2-пропанола и нагревают. К горячему раствору прибавляют 0,97 мл(0,01 моль) металлилхлорида. Кипятят с обратным холодильником 2 ч. Растворитель отгоняют на роторном испарителе, остаток перекристаллизовывают из гексана. Выход 0,703 г (70 %), т. пл. 39 °С.
Масс-спектр, m/z ( I отн , %): 200 [M] (18), 199 [M-H]+ (41), 186 (13), 185 [M-СH 3 ]+ (100), 184 (9), 183 [M-ОH]+ (22), 171 (7), 145 [M-С 4 H 7 ]+ (6), 130 (19), 129 (14), 103 [M-OCN-СH 2 -С(CH 3 )=СН 2 ]+∙(22), 102 (15), 90 (8), 76 (9), 63 (6), 55 [M-C 8 H 5 N 2 O] +∙ (10), 39 (12).
Пики интенсивностью менее 5 % не учитывались.
Спектр ЯМР 1H (500 МГц, ДМСО-d6, м.д., J /Гц): 1.76 (3Н, с, СН 3 ), 4.58 (2Н, с, NCH 2 ), 4.62 (1Н, с, =CH 2 ), 4.91 (1Н, м, =CH 2 ), 7.57 (1Н, м, 6-Н), 7.72 (1Н, д, J 8.13 Гц, 5-Н), 7.85 (1Н, м, 7-Н), 8.18 (1Н, м, 8-Н), 8.31 (1Н, с, 2-Н).
Выводы
Алкилированием хиназолин-4( 3Н )-она 3-хлор-2-метилпропеном в 2-пропаноле в присутствии гидроксида калия и аллилбромидом в ДМФА в присутствии К2СО3 синтезированы 3-аллилхиназолин-4( 3Н )-он и 3-(2-метил-2-пропен-1-ил)хиназолин-4( 3Н )-он, структура которых подтверждена методами ЯМР 1Н, ИК спектроскопии и хроматомасс-спектрометрии. В масс-спектрах соединений 2а,b имеются пики молекулярных ионов. Фрагментация происходит, главным образом, с элиминированием молекул СО, аллена, аллилизоцианата и радикалов аллила, гидроксила, водорода и метила.
Статья выполнена при финансовой поддержке в рамках государственного задания (номер государственной регистрации 4.9665.2017/8.9).
Список литературы Синтез и исследование методом масс-спектрометрии 3-аллили 3-металлилхиназолин-4(3Н)-она
- Fryer, R.I. Quinazolines and 1,4-benzodiazepines. XXXVII. Synthesis and rearrangements of substituted 5-phenyl-1H-1,4-benzodiazepine/R.I. Fryer, J.V. Earley, L.H. Sternbach//Journal of Organic chemistry. -1967. -№ 32. -P. 3798-3802.
- Antibacterial effect of substituted 4-quinazolylhydrazies and their arylhydrazones determined by a modified microdilution method/S. Jantová, D. Hudecová, S. Stankovský et al.//Folia Microbiol. -1995. -№ 40. -P. 611-614.
- Michael, J.P. Quinoline, quinazoline and acridon alkaloids/J.P. Michael//Natural product reports. -1999. -Vol. 16. -P. 697-709.
- Synthesis, antiviral and cytotoxic activity of 6-bromo-2,3-disubstituted 4(3H)-quinazolinones/M. Dinakaran, P. Selvam, E. DeClercq et al.//Biol. Pharm. Bull. -2003. -V. 26, № 9. -P. 1278-1282.
- Крылов, Ю.Ф. Фармакология/Ю.Ф. Крылов, В.М. Бобырев. -М., 1999. -https://www.rlsnet.ru/books_book_id_4_page_47.htm.
- Recent advances in the structural library of functionalized quinazoline and quinazolinone scaffolds: Synthetic approaches and multifarious applications/I. Khan, A. Ibrar, N. Abbas et al.//European Journal of Medicinal Chemistry. -2014. -№ 76. -P. 193-244.
- Меликян, Г.С. Новый подход к синтезу 3-замещенных хиназолин-4-онов на базе антранилового эфира/Г.С. Меликян, А.А. Ованнисян, Л.А. Аристакесян//Ученые записки ереванского государственного университета. Химия и биология. -2010. -С. 33-37.
- Classical and microwave assisted synthesis of new 4-(3,5-dimethyl-1-phenyl-1H-pyrazol-4-ylazo)-N-(2-substituted-4-oxo-4H-quinazolin-3-yl)benzenesulfonamide derivatives and their antimicrobial activities/N.A. Sojitra, R.B. Dixit, R.K. Patel et al.//Journal of Saudi chemical society. -2016. -Vol. 20. -P. 29-37.
- Wang, М. Synthesis of 3-substituted 4(3Н)-quinazolinones catalysed by ceric ammonium nitrate/M. Wang, Z.G. Song, T.T. Zhang//Chemistry of Heterocyclic Compounds. -2010. -Vol. 46, № 5. -Р. 581-584.
- Хохлов, П.С. Синтез 3-гидрокси и 3-алкокси-2-сульфанилхиназолин-4(3H)-онов и их реакции с алкилирующими и ацилирующими агентами/П.С. Хохлов, В.Н. Осипов, А.В. Рощин//Известия академии наук. Серия химическая. -2011. -№ 1. -С. 146-149.
- Synthesis and antimicrobial activity of some newer 6-iodo-2-methyl-3-substituted-4 (3H) quinazolinones/Y.A. Mohamed, M.A. Aziza, F.M. Salama et al.//Journal Serbian chemical society. -1992. -Vol. 57. -Р. 629-629.
- Synthesis of some new substituted iodoquinazoline derivatives and their antimicrobial screening/A.М. Alafeefy, А.S. El-Azab, M.A. Mohamed et al.//Journal of Saudi Chemical Society. -2011. -№ 15. -С. 319-325.
- Abdallah, M.A. Convenient Synthesis of 6H-Tetrazinoquinazolin-6-ones/M.A. Abdallah//Chemical Monthly. -2001. -№ 132. -С. 959-965.
- Microwave promoted synthesis and antimicrobial activity of 3-thiazole substituted 2-styryl-4 (3H)-quinazolinone derivatives/C.L. Jagani, N.A. Sojitra, S.F. Vanparia et al.//Journal of Saudi Chemical Society. -2012. -Vol. 16, № 4. -C. 363-369.
- Desai, N.C. Synthesis and antimicrobial activity of novel quinazolinone-thiazolidine-quinoline compounds/N.C. Desai, A. Dodiya, N. Shihory//Journal of Saudi Chemical Society. -2013 -Vol. 17. -С. 259-267.
- Alagarsamy, V. Synthesis and pharmacological investigation of novel 1-substituted-4-(4-substituted phenyl)-4H-triazoloquinazolin-5-ones as a new class of H1-antihistamine agents/V. Alagarsamy, R. Giridhar, M.R. Yadav//J. Pharm. Pharmacol. -2006. -V. 58. -P. 1249-1255.
- Синтез алифатических и ароматических кетонов хиназолинового ряда/Е.Г. Глухова, Т.П. Озерова, Г.Н. Солодунова и др.//Волгоградский научно-медицинский журнал. -2014. -№ 1 (41). -С. 23-25.
- Алкилирование производных хиназолин-4(3Н)-она 2-феноксиэтилбромидами/Т.П. Озерова, Е.А. Солодунова, Ю.В. Арчакова и др.//Современные пробл. науки образования. -2011. -№ 6. -5 с.
- Vilsmeier Reagent: An Efficient Reagent for the Transformation of 2-Aminobenzamidesi nto Quinazolin-4 (3 H)-one Derivatives/S. Farzipour, M. Saeedi, M. Mahdavi et al.//Synthetic Communications. -2014. -Vol. 44, № 4. -С. 481-487.
- Synthesis and antifungal bioactivities of 3-alkylquinazolin-4-one derivatives/G. Ouyang, P. Zhang, G. Xu et al.//Molecules. -2006. -Vol. 11, № 6. -С. 383-392.
- Kumar D. Highly chemo-and regioselective allylic substitution with tautomerizable heteroarenes/D. Kumar, S.R. Vemula, G.R. Cook//Green Chemistry. -2015. -Vol. 17, № 8. -С. 4300-4306.
- The demonstration of normal O→ N Claisen rearrangement in purines/D. Ranganathan, R. Rathi, K. Keshavan et al.//Tetrahedron. -1986. -Vol. 42, № 17. -С. 4873-4878.
- Synthesis and Antifungal Activities of N3-Substituted Quinazolin-4-one Catalyzed by 3-Methylimidazole Ionic Liquids/G. Liu, C. P. Liu, C. N. Ji, et al.//Asian Journal of Chemistry. -2013. -Vol. 25. -№ 17. -С. 9853.
- Синтез и свойства аллильных производных 4-оксо(тиоксо)хиназолина/Е.В. Смолина, Е. В. Бондин, Е.В. Подкопаева и др.//Вестник Челябинского государственного университета. Серия «Химия». -2004. -Т. 4. -№ 1. -С. 40-43.
- Лебедев, А.Т. Масс-спектрометрия в органической химии/А.Т. Лебедев -М.: БИНОМ. Лаборатория знаний, 2003. -493 с.


