Синтез и исследование S-аллильных производных 2-тиоурацилов
Автор: Фролова Татьяна Владимировна, Ким Дмитрий Гымнанович, Слепухин Павел Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 11 (187), 2010 года.
Бесплатный доступ
Исследовано взаимодействие натриевых солей 2-тиоурацилов с галоге-налкенами в воде, диметилформамиде, водно-спиртовой среде и при этом синтезированы новые 2-алкенилтио-4(3,Д)-пиримидиноны. Разработан од-нореакторный синтез S-аллильных производных 2-тиоурацилов. Структуры синтезированных соединений исследованы методами рентгено-струк-турного анализа, инфракрасной спектроскопии, хромато-масс-спектромет-рии и ядерного магнитного резонанса.
2-тиоурацилы, 2-алкенилтио-4(зн)-пиримидиноны, галогеналкены, однореакторный синтез, спектры ямр, ик, масс-спектры, рса
Короткий адрес: https://sciup.org/147160165
IDR: 147160165 | УДК: 547.854.1
Текст краткого сообщения Синтез и исследование S-аллильных производных 2-тиоурацилов
Производные 2-тиоурацилов являются предметом пристального внимания исследователей. Они обладают широким спектром физиологической активности. Так, производные 6-метил-2-тиоурацила широко используются как лекарственные препараты для лечения неврологических заболеваний, болезней Альцгеймера, Паркинсона, мигреней, депрессий, нарушений памяти, а также в качестве транквилизаторов и подобных им средств, успокаивающих нервную систему. 2-Тиоурацилы с атомами фтора в 5- и 6-положении применяются при лечении болезней щитовидной железы и образуют наиболее важный класс противораковых и противовирусных лекарственных средств [1-3]. Таким образом, синтез новых S-производных 2-тиоурацилов является актуальной задачей.
В литературе [4, 5] имеются сведения о синтезах S-производных (аллил-, металлил-, пропаргил-, пренил и др.) 6-метил-2-тиоурацила, в то же время практически отсутствуют данные о синтезах S-алкенильных производных 6-трифторметил-2-тиоурацила и 6-метил-5-этил-2-тиоурацила. В настоящей работе с целью синтеза новых представителей 2-алкенилтио-4(3//)-пиримидинонов нами изучено взаимодействие 6-метил-5-этил-2-тиоурацила и 6-трифторметил-2-тиоурацила с 3-бромпропеном, 2-метил-З -хлорпропеном, 1 -хлор-З-метил-2-бутеном, 2,3-дибромпропеном и 1,3-дихлорпропеном.
Экспериментальная часть
Контроль за составом продуктов реакции осуществляли методом ТСХ на пластинках Silufol UV-254, элюент: этилацетат-гексан (1:1). Проявляли хроматограммы УФ-светом или парами иода. Спектры ЯМР !Н растворов веществ в ДМСО-de и CDCI3 получены на спектрометре Broker DRX-400 (400 МГц), внутренний стандарт ТМС. Масс-спектры сняты на приборе ГЖХ/МС фирмы HEWLETT PACKARD, газовый хроматограф НР-5890, серия И, масс-селективный детектор НР-5972. ИК-спектры записывались на приборе Nicolet 3 80 (FT - IR) в таблетках с КВг.
РСА. Исследование соединения ЗЬ проведено для бесцветного кристалла размером 0,48x0,34x0,21 мм при Т = 295(2) К. Набор интенсивностей отражений получен на автоматическом четырёхкружном дифрактометре “Xcalibur 3”, оборудованном CCD-детектором по стандартной процедуре [6]. Длина волны используемого излучения - 0,71073 А (МоКа), графитовый монохроматор, ©-сканирование. Поправка на поглощение не вводилась. Решение и уточнение структуры проведено с использованием пакета программ SHELX [7] полноматричным МНК по F2. Неводородные атомы уточнены в анизотропном приближении. Атом водорода NH-группы выявлен прямым методом и включён в уточнение независимо. Остальные атомы водорода помещены
Органическая химия в рассчитанные положения и включены в уточнение в модели «наездника» в изотропном приближении с зависимыми тепловыми параметрами. Основные кристаллографические данные и параметры дифракционного эксперимента: кристалл триклинный, пр. гр. Р-1, а = 5,0502(12)А, Ь= 10,332(3) А, с = 12,0124(19) А, а = 76,150(18)°, ₽ = 86,073(16)°, у = 86,79(2)°, V = 606,6(2) А3, Z = 2, D(calC)= 1,228 г/см3, ц = 0,244 mm"1,углы сканирования 2,98° < 0 < 28,28°, отражений собрано 3191, из них независимых 2922 (Rjnt = 0,0205), завершённость эксперимента для 0< 28,28 97,1 %. 8= 1,005, для отражений с I>2g(I) Ri = 0,0459, wR2= 0,1076, для всех отражений Ri = 0,1101, wR2 = 0,1142. Максимальный и минимальный пики остаточной электронной плотности 0,220 и -0,178 ёА-3. Вычисленные координаты и тепловые параметры атомов структуры, полные таблицы длин связей и валентных углов, другие данные в виде cif-файла внесены в Кембриджский банк структурных данных под номером CCDC 761 655. Эти данные находятся в свободном доступе и могут быть запрошены по адресу
Натриевые соли 6-метил-2-тиоурацила (1а) и 6-метил-5-этил-2-тиоурацила (1b). К раствору 0,04 моль металлического натрия в 50 мл 2-пропанола добавляют 0,05 моль тиомочевины и 0,04 моль ацетоуксусного эфира (или этил-2-этилацетоацетата). Смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения отфильтровывают осадок и сушат. 1а - выход 90 %, т. пл. 230 °C; lb - 83 %, т. пл. 210 °C.
Натриевая соль 6-трифторметил-2-тиоурацила (1с). К раствору 0,01 моль металлического натрия в 10 мл 2-пропанола добавляют 0,0125 моль тиомочевины и 0,02 моль этил-4,4,4-трифторацетоацетата. Смесь нагревают с обратным холодильником в течение 24 ч. После охлаждения отфильтровывают осадок, промывают хлороформом и сушат на воздухе. Выход: 48 %, т. пл. 240 °C. R/=0,38.
2-Аллилтио- (2а-с), 2-металлилтио-(За-с), 2-(2-бромаллил)тио-(4а-с), 2-пренилтио-(5а-с) и 2-(1-хлораллил)тио- (6,7а-с) -б-метил-(а), -6-метил-5-этил-(Ь), -6-трифторметил-4(ЗД)-пиримидинон (с)
Метод А. К раствору 2 ммоль натриевой соли 2-тиоурацила (1а-с), 2 ммоль NaOH в 5 мл воды прибавляют 20 мг тетрабутиламмоний бромида (ТБАБ) или несколько капель диметилсульфоксида (ДМСО), 2 ммоль галогеналкена (3-бромпропен, 2-метил-З-хлорпропен, 2,3-дибром-пропен, 1 -хлор-3 -метил-2-бутен или 1,3-дихлорпропен) и перемешивают на магнитной мешалке 2 ч. Реакционную смесь нейтрализовывают уксусной кислотой. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из гексана.
Метод Б. К 2 ммоль натриевой соли 2-тиоурацила (la-с), растворенной при 90 °C в 5 мл воды, добавляют 2 ммоль галогеналкена в 2 мл этанола и перемешивают на магнитной мешалке 2 ч. Выпавший осадок отфильтровывают, промывают водой и сушат.
Метод В. К раствору 1 ммоль натриевой соли 2-тиоурацила (la-с) в 5 мл диметилформами-да (ДМФА) добавляют 1 ммоль галогеналкена и перемешивают на магнитной мешалке 2 ч. К реакционной смеси прибавляют 30 мл воды и отфильтровывают выпавший белый осадок.
Метод Г. Однореакторный синтез. К раствору 1 ммоль натрия в 15 мл 2-пропанола добавляют 1 ммоль тиомочевины и 1 ммоль ацетоуксусного эфира (или этил-2-этилацетоацетата, или этил-4,4,4-трифторацетоацетата). Реакционную смесь нагревают с обратным холодильником 2 ч, затем добавляют 1 ммоль 3-бромпропена и перемешивают смесь на магнитной мешалке 1,5 ч. Отфильтровывают образовавшийся белый осадок и перекристаллизовывают из гексана.
Метод конкурирующих реакций. К раствору 1 ммоль натриевой соли 1а и 1 ммоль натриевой соли 1с в 7 мл эквимольного раствора гидроксида калия добавили 1 ммоль 3-бромпропена. Реакционную смесь перемешивают в течение 2 ч, затем нейтрализуют уксусной кислотой. Образовавшийся белый осадок отфильтровывают, промывают водой, сушат и исследуют методом ХМС.
Основные характеристики полученных соединений приведены в табл. 1,2.
Элементный анализ синтезированных соединений 2с, Зс, 4а-с, 5Ь, 5с, 6, 7а-с соответствует расчетным.
Обсуждение результатов
Нами изучено взаимодействие натриевых солей 6-метил-2-тиоурацила, 6-метил-5-этил-2-тиоурацила и 6-трифторметил-2-тиоурацила (la-с) с 3-бромпропеном, 2-метил-З-хлорпропеном,
2,3-дибромпропеном, 1 -хлор-3-метил-2-бутеном и 1,3-дихлорпропеном в воде, диметилформами-де и в водно-спиртовой среде. Во всех случаях реакция протекает с образованием S-производных 2-тиоурацилов, при этом нами впервые синтезированы 2-аллилтио-(2с), 2-металлилтио-(Зс), 2-(2-бромаллил)тио-(4а-с), 2-пренилтио-(5Ь, с) и 2-(1-хлораллил)тио-(6, 7а-е)-6-метил-(а), -6-метил-5-этил-(Ь), -6-трифторметил-4(ЗН)-пиримидинон (с).
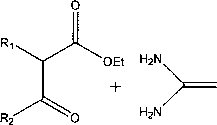
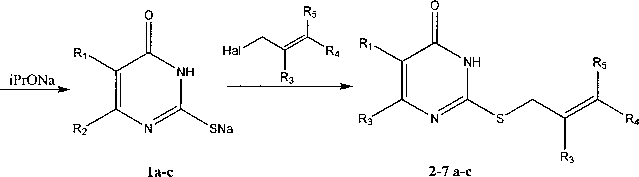
Синтез аллильных производных 2-тиоурацилов:
а - R^H, R2=CH3, b - Ri=C2H5, R2=CH3, c - R^H, R2=CF3; 2 - R3, R4, Rs=H; 3 - R4, Rs=H, R3=CH3;
4 - R4, Rs=H, R3=Br; 5 - R3=H, R4, Rs=CH3; 6 - R3, R4=H, Rs=CI; 7 - R3, Rg=H, R4=CI
Как следует из сравнения выходов продуктов реакции алкилирования 2-тиоурацилов 1а-с, реакция оказывается малочувствительной к условиям проведения. Практически во всех случаях выходы продуктов реакции колебались от умеренных до хороших, независимо от применяемого метода получения. При проведении реакции в воде выход соединений 2-7 закономерно повышается при добавлении к реакционному раствору эквимольного количества щелочи (повышение нуклеофильности субстрата) и межфазного катализатора (ТБАБ или ДМСО).
Аллилирование 6-трифторметил-2-тиоурацила протекает в ДМФА с несколько более высокими выходами (выход 70-75 %), чем в воде (выход 40-50 %), что, вероятно, связано с лучшей растворимостью субстрата в ДМФА, приводящей к протеканию реакции в гомогенных условиях.
Таблица 1
Характеристики синтезированных соединений
|
Соединение |
Выход, % |
Т. пл., °C |
Rf |
||
|
Метод А |
Метод Б |
Метод В |
|||
|
2а |
70 |
40 |
55 |
ПО |
0,40 |
|
2Ь |
65 |
37 |
46 |
120 |
0,38 |
|
2с |
50 |
33 |
75 |
90 |
0,50 |
|
За |
64 |
40 |
58 |
123 |
0,44 |
|
ЗЬ |
58 |
36 |
45 |
115 |
0,33 |
|
Зс |
48 |
30 |
70 |
110 |
0,56 |
|
4а |
37 |
26 |
54 |
90 |
0,30 |
|
4Ь |
58 |
40 |
60 |
130 |
0,55 |
|
4с |
50 |
35 |
70 |
70 |
0,48 |
|
5а |
33 |
— |
40 |
150 |
0,30 |
|
5Ь |
30 |
40 |
162 |
0,68 |
|
|
5с |
40 |
58 |
70 |
0,44 |
|
|
6,7а |
55 |
— |
45 |
125 |
0,43 |
|
6,7b |
63 |
— |
57 |
100 |
0,40 |
|
6,7с |
37 |
— |
70 |
90 |
0,53 |
Следует отметить, что 6-трифторметил-2-тиоурацил, имеющий сильную электроно-акцепторную трифторметильную группу, в конкурентных условиях более активен, чем 6-метил-2-тиоурацил, в котором метильная группа обладает электронодонорными свойствами. Это подтверждено методом конкурирующих реакций названных веществ с 3-бромпропеном в воде в присутствии гидроксида калия. По данным хромато-масс-спектрометрии выход соединений 2а и 2с составляет 22 и 78 % соответственно. Очевидно, что электроноакцепторная трифторметильная группа способствует стабилизации нуклеофильной частицы и нуклеофильному замещению в реакциях с галогеналкенами.
Органическая химия
Нами разработан однореакторный способ получения соединений 2а-с. Сущность метода заключается в том, что тиомочевину, ацетоуксусный эфир (этил-2-этилацетоацетат или этил-4,4,4-трифторацетоацетат) и изопропилат натрия в изопропиловом спирте кипятят с обратным холодильником в течение 2 часов (образование натриевой соли 2-тиоурацила), а затем к реакционной смеси добавляют 3-бромпропен.
Структуры синтезированных веществ исследованы методами хромато-масс-спектрометрии (ХМС), инфракрасной спектроскопии (ИКС), ядерного магнитного резонанса (ЯМР) и рентгеноструктурного анализа (PCА).
Таблица 2
Спектральные данные полученных соединений
|
Соединение |
Спектр ЯМР *Н, 8, м.д. (7, Гц) |
ИК-спектр, V (С=О), см"1 |
|
2Ь |
1,09 (ЗН, т, СН3-СН2, 7=7,50), 2,29 (ЗН, с, СН3-6), 2,51 (2Н, к, СН3-СН2, 7=7,50), 3,85 (2Н, д, SCH2, 7=6,96), 5,16 (Ш, дд, =СНН, 27=1,20, 37=9,97), 5,33 (1Н, дд, =СНН, 27=1,20, 37= 16,95), 5,93 (1Н, м, =СН) |
1660 |
|
2с |
3,89 (2Н, д, SCH2, 7=7,08), 5,20 (1Н, дд, =СНН, 27=1,15, 37=9,99), 5,39 (Ш, дд, =СНН, 27=1,15,37=16,92) , 5,92 (1Н, м, =СН), 6,56 (Ш, с, Н-5) |
1670 |
|
Зс |
1,84 (ЗН, с, СН3), 3,91 (2Н, с, SCH2), 4,94 (1Н, м, =СНН), 5,09 (1Н, м, =СНН), 6,57 (Ш, с, Н-5), 12,86 (1Н, с, NH) |
1673 |
|
4а |
2,26 (ЗН, с, СН3-6), 4,24 (2Н, с, SCH2), 5,56 (1Н, д, =СН, 7=1,92), 5,98 (1, м, =СН), 6,09 (1Н, с, Н-5) |
1644 |
|
4Ь |
1,1 (ЗН, т, СН3-СН2, 7=7,50), 2,29 (ЗН, с, СН3-6), 2,52 (2Н, к, СН3-СН2, 7=7,48), 4,22 (2Н, с, SCH2), 5,56 (1Н, д, =СН, 7=1,85), 5,99 (1Н, м, =СН) |
1639 |
|
4с |
4,26 (2Н, с, SCH2), 5,59 (Ш, д, =СН, 7=2,02), 6,01 (1Н, м, =СН), 6,59 (1Н, с, Н-5) |
1644 |
|
5а |
1,72 (6Н, с, два СНз), 2,26 (ЗН, с, СН3-6), 3,85 (2Н, д, SCH2, 7=7,92), 5,31 (1Н, м, =СН), 6,04 (1Н, с, Н-5) |
1643 |
|
5Ь |
1,06 (ЗН, т, СН3-СН2, 7=7,48), 1,74 (6Н, с, два СН3), 2,29 (ЗН, с, СН3-6), 2,51 (2Н, к, СН3-СН2, 7=7,47), 3,82 (2Н, д, SCH2,7=7,87), 5,31 (1Н, м, =СН) |
1638 |
|
5с |
1,74 (6Н, с, два СНз), 3,88 (2Н, д, SCH2, 7=7,84), 5,31 (1Н, м, =СН), 6,53 (Ш, с, Н-5) |
1677 |
|
6а |
2,30 (ЗН, с, СНз-6), 4,01 (2Н, д, SCH2, 7=7,45), 6,04 (1Н, м, =СН), 6,10 (1Н, с, Н-5), 6,20 (1Н, д, =СНС1,7=7,23) |
1645 |
|
6Ь |
1,1 (ЗН, т, СН3-СН2, 7=7,50), 2,33 (ЗН, с, СН3-6), 2,52 (2Н, к, СН3-СН2,7=7,61), 3,99 (2Н, д, SCH2,7=7,40), 6,04 (1Н, м, =СН), 6,19 (Ш, д, =СНС1,7=7,05) |
1643 |
|
6с |
4,03 (2Н, д, SCH2, 7=7,46), 6,08 (Ш, м, =СН), 6,26 (Ш, д, =СНС1,7=7,06), 6,57 (1Н, с, Н-5) |
1673 |
|
7а |
2,30 (ЗН, с, СНз-6), 3,85 (2Н, д, SCH2, 7=7,71), 6,04 (1Н, м, =СН), 6,10 (Ш, с, Н-5), 6,30 (Ш, д, =СНС1,7=12,80) |
1645 |
|
7Ь |
1,1 (ЗН, т, СН3-СН2, 7=7,50), 2,33 (ЗН, с, СН3-6), 2,52 (2Н, к, СН3-СН2,7=7,61), 3,84 (2Н, д, SCH2,7=7,70), 6,04 (1Н, м, =СН), 6,33 (Ш, д, =СНС1,7=13,24) |
1643 |
|
7с |
3,88 (2Н, д, SCH2, 7=7,86), 5,99 (1Н, м, =СН), 6,37 (1Н, д, =СНС1,7=13,19), 6,57 (1Н, 2с, Н-5(см. схему)) |
1673 |
Теоретически моноалкилирование 2-тиоурацилов может протекать по атомам азота, кислорода и серы. Направление реакции по атому серы легко может быть доказано методом ЯМР 1Н.
В спектрах ЯМР !Н синтезированных соединений имеются сигналы протонов 8СН2-группы, которые образуют либо дублеты в соединениях 2, 5, 6, 7, либо синглеты в соединениях 3 и 4 в области 3,80-4,20 м.д.. В случае же образования N- или О-производных следовало бы ожидать сигналы NCH2 или ОСН2-групп в области 4,5-5,0 м.д.
По данным ЯМР !Н, в реакции 1,3-дихлорпропена (смесь цис- и транс-изомеров) с соединением 1а и 1b соотношение изомеров {цис- и транс-) составляет 1:1, а с соединением 1с — 2:1. Та кое соотношение цис- и транс-изомеров также подтверждается данными масс-спектров.
Теоретически S-производные 2-тиоурацилов могут существовать в следующих таутомерных
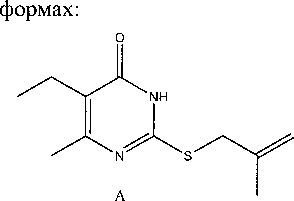
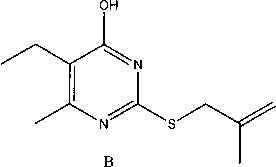
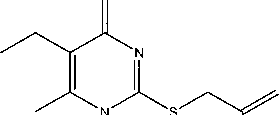
Таутомеры 2-металлилтио-6-метил-5-этил-4-пиримидинона
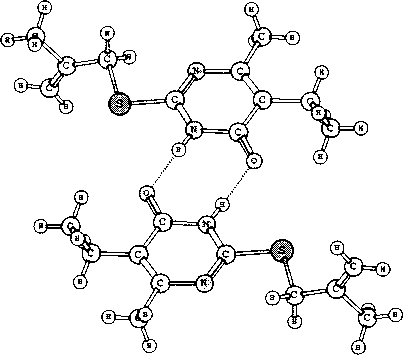
Методом PC А нами исследовано строение 2-металлилтио-6-метил-5-этил-4(37/)-пиримиди-нона и установлено, что в кристаллическом состоянии соединение находится в таутомерной форме с протоном у атома N-3 (таутомер А, рис. 1). Алкенильный фрагмент соединения характеризуется разупорядоченностью позиций атомов С(11) и С(10) с коэффициентами заселённости 0,5. При этом тепловые эллипсоиды атомов С(11) и С(10) перекрываются с тепловыми эллипсоидами фрагментов разупорядочения С(10А) и С(11А) соответственно, что привело к необходимости введения ограничений в расчет тепловых колебаний данных атомов (введение функции ISOR 0,01 в файл .ins программы уточнения). В кристаллической упаковке молекула образует димеры с межмолекулярной водородной связью (рис. 2) NH-группы с атомом 0(1) [-х+1, -у, -z+2]. Параметры ММВС: N(l)-H(l) = 0,88(2) А, Н(1)..О(1)= 1,88(2) A, В ИК-спектре димера полоса карбонильной группы проявляется при 1642 см"1. Рис. 1. Общий вид молекулы ЗЬ по результатам РСА и принятая в структурном эксперименте нумерация атомов В ИК-спектрах синтезированных соединений 2-7 полоса карбонильной группы находится в широкой области 1630-1680 см-1. По-видимому, в зависимости от условий реакций и природы реагентов, образующиеся S-производные 2-тиоурацилов могут быть как вовлечёнными в ММВС (полоса колебаний С=О около 1640 см-1), так и находиться в свободном состоянии (полоса колебаний около 1680 см-1). В масс-спектрах соединений 4а-с отсутствуют пики молекулярных ионов и имеются два пика [М-НВг]. Это обусловлено тем, что в условиях съемки хромато-масс-спектров происходит дегидробромирование в инжекторе (температура 200-250 °C) и образуются тиазолопиримидиновые структуры с экзо- и эндоциклической двойной связью. Органическая химия Рис. 2. Фрагмент структуры кристалла 2-металлилтио-6-метил-5-этил-4(ЗН)-пиримидинона Заключение Установлено, что б-метил-2-тиоурацил, 6-трифторметил-2-тиоурацил и б-метил-5-этил-2-тиоурацил реагируют с галогеналкенами в воде, диметилформамиде, этаноле с образованием соответствующих S-производных, при этом впервые синтезированы 2-аллилтио-(2с), 2-металлилтио-(Зс), 2-(2-бромаллил)тио-(4а-с), 2-пренилтио-(5Ь, с) и 2-(1-хлораллил)-(6, 7а-с) -б-метил-(а), -6-метил-5-этил-(Ь) -6-трифторметил-4(ЗЯ)-пиримидинон (с). Разработан однореакторный синтез 2-аллилтио-4(ЗЯ)-пиримидинонов. Методом конкурирующих реакций показано, 6-трифторметил-2-тиоурацил является более реакционноспособным, чем 6-метил-2-тиоурацил в реакции с 3-бромпропеном. Найдено, что 2-(2-бромаллил)тио-4(377)-пиримидиноны претерпевают при 200-250 °C превращения с образованием тиазолопиримидиновых структур. Работа выполнена при финансовой поддержке программы «УМНИК».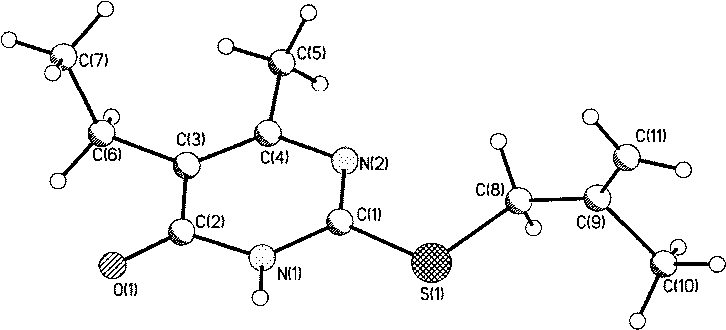
Список литературы Синтез и исследование S-аллильных производных 2-тиоурацилов
- Рахимов, А.И. Особенности синтеза 2-алкил(арилалкил)тио-6-метилпиримидин-4(3-онов и 2-алкил(арилалкил)окси-6-метилпиримидинов/А.И. Рахимов, Е.С. Титова//Журнал органической химии. -2007. -Т. 43. -Вып. 1. -С. 92-98.
- Miller, W.H. The synthesis of some 6-substituted -2-thiouracils/W.H. Miller, M. Alice//Contribution from the Chemotherapy Division. -1948. -Feb. -C. 500-502.
- Ondi, L. Brominated 4-(trifluoromethyl)pyrimidines: A Convenient Access to Versatile Intermediates/L. Ondi, O. Lefebire, M. Schlosser//Eur. J. Org. Chem. -2004. -C. 3714-3718.
- Ким, Д.Г. Иодциклизация 2-аллилтио-4(3,£/)-пиримидинов/Д.Г. Ким, В.И. Шмыгарев//Химия гетероциклических соединений. -1995. -№ 2. -С. 211-213.
- Сливка, Н.Ю. Галогенциклизация замещенных 2-(алкенилтио) пиримидин-6-онов/Н.Ю. Сливка, Ю.И. Геваза, В.И. Станинец//Химия гетероциклических соединений. -2004. -№ 5. -С. 776-783.
- CrysAlis CCD, Version 1.171.29.9, release 23-03-2006. -Oxford Diffraction Ltd., 2006. Sheldrick, G.M.//Acta Cryst -2008. -A64. -P. 112.


