Синтез и исследование строения 2-алкенилсульфанил-1-метилимидазолов
Автор: Ильиных Е.С., Игнатьева И.Ю.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.15, 2023 года.
Бесплатный доступ
Производные 1-метилимидазол-2-тиола (1) с заместителями различного рода являются перспективными лигандами для моделирования различных ферментативных систем и структур, обладающих фармакологической активностью. Они широко используются в качестве промежуточных продуктов в синтезе органических соединений, обладающих биологической активностью (противоопухолевой, противомикробной, антидиабетической, антитиреоидной, антигистаминной, антипротозойной и противовирусной), а также как агрохимикаты, красители, фотохимические вещества, ингибиторы коррозии, эпоксидные отвердители, клеи и пластические модификаторы. В настоящей работе нами впервые исследовано взаимодействие 1-метилимидазол-2-тиола 1 с пренилбромидом (2a), транс -циннамилхлоридом (2b) и бутенилбромидом в различных условиях. Установлено, что селективность реакций алкилирования соединения 1 зависит от условий проведения реакций (алкилирующий агент, растворитель, основание). Синтез индивидуальных 1-метил-2-пренил-сульфанилимидазола (3a) (с выходом 78-86 %), 1-метил-2-циннамилсульфанилимидазола (3b) (с выходом 94-97 %) и 2-(3-бутенил)сульфанил-1-метилимидазола (4) (с выходом 33-75 %) был осуществлен нами алкилированием 1-метилимидазол-2-тиола 1 пренилбромидом 2a, транс -циннамилхлоридом 2b и бутенилбромидом соответственно в следующих системах: i -PrOH- i -PrONa, K2CO3-Me2CO (для 3а), MeOH-MeONa, i -PrOH- i -PrONa, K2CO3-Me2CO, K2CO3-MeCN и i -PrOH- i -PrOК (для 3b), MeOH-MeONa, i -PrOH- i -PrONa, K2CO3-Me2CO, K2CO3-MeCN, i -PrOH- i -PrOК и КОН-H2O-ТЭБАХ (для 4). Строение синтезированных соединений 3a,b и 4 исследовано и доказано методами масс-спектрометрии (ГХ-МС) и спектроскопии ЯМР ¹Н и ¹³С. Выявлены общие закономерные направления фрагментации молекулярных ионов S-производных 3a,b и 4, сопровождающиеся отщеплением метильного/фенильного и тиольного радикалов. Доказательством протекания реакций алкилирования по атому серы является наличие в спектрах ЯМР 1Н соединений 3a,b и 4 сигналов протонов группы -SCH2- в области δ 3,12-3,84 м. д. По данным ЯМР 1Н найдено, что использование иных условий при алкилировании 1-метилмимидазол-2-тиола 1 вследствие его тион-тиольной таутомерии приводит к образованию побочных продуктов в минорном количестве - N-алкенильных и S,N-диалкенильных производных.
1-метилимидазол-2-тиол, метимазол, алкилирование, 1-метил-2-пренилсульфанилимидазол, 1-метил-2-циннамилсульфанилимидазол, 2-(3-бутенил)сульфа-нил-1-метилимидазол, хромато-масс-спектрометрия, спектроскопия ямр 1н и 13с
Короткий адрес: https://sciup.org/147241844
IDR: 147241844 | УДК: 547.781 | DOI: 10.14529/chem230307
Текст научной статьи Синтез и исследование строения 2-алкенилсульфанил-1-метилимидазолов
Предметом многих исследований являются имидазолы и их производные в связи с широким спектром их фармакологической активности. Они широко используются в качестве промежуточных продуктов в синтезе таких органических соединений, как агрохимикаты, красители, фотохимические вещества, ингибиторы коррозии, эпоксидные отвердители, клеи и пластические модификаторы [1]. 1-Метилимидазол-2-тиол (метимазол, тирозол, тиамазол, мерказолил) является синтетическим антитиреоидным препаратом, который применяется при терапии гипертиреоза Грейвса (возникает по статистике у 3 % женщин и 0,5 % мужчин). Основное фармакологическое действие метимазола заключается в уменьшении синтеза тироксина в щитовидной железе [2–5]. Кроме того, производные 1-метилимидазол-2-тиола применяются при лечении воспалительных заболеваний кишечника и центральной нервной системы, артрита, аллергии или астмы [6].
Алкилирование 1-метилимидазола-2-тиола является одним из наиболее рациональных и удобных способов синтеза его производных. В большинстве случаев при проведении реакции алкилирования 1-метилимидазол-2-тиола алкил- и арилгалогенидами наблюдается образование S-производных, что объясняется большей нуклеофильностью атома серы [7–23].
Наряду с этим, в литературе практически не исследованы S-алкенильные производные 1-метилимидазол-2-тиола. Примером является синтез 2-винилсульфанил-1-метилимидазола реакцией исследуемого тиола и карбида кальция [24].
Ранее нами был осуществлен синтез S-непредельных производных другого представителя класса имидазолов, бензимидазол-2-тиола – 2-аллилсульфанилбензимидазола [25] и 2-пропаргил-сульфанилбензимидазола [26]. Целью данной работы является разработка методов синтеза и исследование строения ранее неизвестных S-алкенильных производных 1-метилимидазол-2-тиола.
Экспериментальная часть
Спектры ЯМР 1H, 13C записаны на приборе Bruker DRX-400 в ДМСО- d 6 и СDCl 3 , внутренний стандарт – ТМС. ГХ-МС анализ проведен на приборе GC-MS SHIMADZU QP2010 Ultra в режиме электронной ионизации ЭИ (70 эВ). Исходные соединения 1-метилимидазол-2-тиол ( 1 ), пренил-бромид ( 2a ), транс -циннамилхлорид ( 2b ) и бутенилбромид – коммерческие препараты фирмы Alfa Aesar. A Johnson Matthey Company.
Синтез 1-метил-2-пренилсульфанилимидазола (3a) (общая методика для систем (А) i -PrOH– i -PrONa и (С) K 2 CO 3 –Me 2 CO)
В плоскодонную колбу помещали 0,115 г (5 ммоль) Na (метод А) или 0,690 г (5 ммоль) K 2 CO 3 (метод С), приливали 15 мл изопропилового спирта (метод А) или ацетона (метод С). Далее добавляли 0,570 г (5 ммоль) 1-метилимидазол-2-тиола 1 и 0,58 мл (5 ммоль) пренилбромида 2а . Реакционную смесь перемешивали на магнитной мешалке. Через 3 суток отфильтровывали белый осадок, отгоняли растворитель, остаток обрабатывали хлороформом и фильтровали. Получали соединение 3a в виде светло-оранжевого масла, выход 0,710 г (78 %) (метод А), 0,783 г (86 %) (метод С). Масс-спектр (ЭИ, 70 эВ), m/z ( I отн . , %): 182 [M]+• (2), 165 (2), 156 (2), 149 (3), 139 (2), 131 (4), 120 (1), 114 (30), 108 (1), 100 (3), 91 (2), 81 (5), 69 (24), 65 (4), 53 (17), 40 (100), 38 (3). Спектр ЯМР 1Н, δ , м. д. ( J , Гц): 1,51 (3Н, с, –СH 3 ); 1,69 (3Н, с, –СH 3 ); 3,61 (3Н, с, –NСН 3 ); 3,62 (2Н, д, 3J = 9,6, –SСH 2 –); 5,30 (1Н, м, –СН=); 6,93 (1Н, с (с расщеплением), 3J = 1,3, Н-4); 7,07 (1Н, с (с расщеплением), 3J = 1,3, Н-5). Спектр ЯМР 13С, δ, м. д.: 17,19 (–СH 3 cis ); 25,62 (–СH 3 trans ); 33,20 (–SСH 2 –); 33,31 (–NСН 3 ); 118,86 (–СН=); 122,12 (C-5); 129,30 (C-4); 136,93 (= C (CH 3 ) 2 ); 141,32 (C-2).
Синтез 1-метил-2-циннамилсульфанилимидазола (3b) (общая методика для систем (А) i -PrOH– i -PrONa, (В) MeOH–MeONa, (С) K 2 CO 3 –Me 2 CO и (D) i -PrOH– i -PrOК)
В плоскодонную колбу помещали 0,115 г (5 ммоль) Na (методы А и В), 0,690 г (5 ммоль) K2CO3 (метод С) или 0,280 г (5 ммоль) КОН (метод D), приливали 15 мл изопропилового спирта (методы А и D), метанола (метод В) или ацетона (метод С). Далее добавляли 0,570 г (5 ммоль) 1-метилимидазол-2-тиола 1 и 0,70 мл (5 ммоль) транс -циннамилхлорида 2b . Реакционную смесь перемешивали на магнитной мешалке. Через 3 суток отфильтровывали белый осадок, отгоняли растворитель, остаток обрабатывали хлороформом и фильтровали. Получали соединение 3b в виде оранжевого масла, которое частично кристаллизовалось, выход 1,093 г (95 %) (метод А), 1,104 г (96 %) (метод В), 1,081 г (94 %) (метод С), 1,116 г (97 %) (метод D). Масс-спектр (ЭИ, 70 эВ), m/z ( I отн . , %): 230 [M]+• (6), 219 (1), 207 (41), 197 (7), 191 (6), 177 (2), 163 (1), 154 (1), 147 (6), 139 (12), 118 (13), 117 (100), 96 (7), 91 (37), 77 (8), 73 (41), 59 (4), 44 (27), 40 (49). Спектр ЯМР 1Н, δ , м. д. ( J , Гц): 3,62 (3Н, с, –NСH 3 ); 3,84 (2Н, д, 3J = 6,8, –SСН 2 –); 6,25–6,37 (2Н, д и м, 3 J trans = 14,5, –СН=, =СHPh); 6,93 (1Н, с (с расщеплением), 3J = 1,1, Н-4); 7,14 (1Н, с (с расщеплением), 3J = 1,1, Н-5); 7,30–7,32 (5Н, м, –Ph). Спектр ЯМР 13С, δ , м. д.: 37,06 (–NСH 3 ); 39,82 (–SСН 2 –); 121,67 (C-5); 124,29 (= C HPh); 128,55 (C-4, C Ar -4); 128,65 (C Ar -2, C Ar -6); 128,73 (C Ar -3, C Ar -5); 135,98 (–CH=); 137,04 (C Ar -1); 138,45 (C-2).
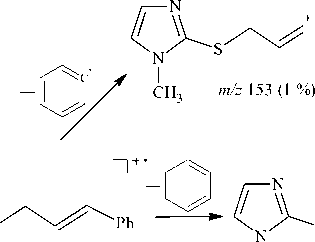
Синтез 2-(3-бутенил)сульфанил-1-метилимидазола (4) (общая методика для систем (А) i -PrOH– i -PrONa, (В) MeOH–MeONa, (С) K 2 CO 3 –Me 2 CO и (D) i -PrOH– i -PrOК)
В плоскодонную колбу помещали 0,115 г (5 ммоль) Na (методы А и В), 0,690 г (5 ммоль) K2CO3 (метод С) или 0,280 г (5 ммоль) КОН (метод D), приливали 15 мл изопропилового спирта (методы А и D), метанола (метод В) или ацетона (метод С). Далее добавляли 0,570 г (5 ммоль) 1-метилимидазол-2-тиола 1 и 0,51 мл (5 ммоль) бутенилбромида. Реакционную смесь перемешивали на магнитной мешалке. Через 3 суток отфильтровывали белый осадок, отгоняли растворитель, остаток обрабатывали хлороформом и фильтровали. Получали соединение 4 в виде оранжевого масла, которое частично кристаллизовалось, выход 0,630 г (75 %) (метод А), 0,588 г (70 %)
(метод В), 0,277 г (33 %) (метод С), 0,462 г (55 %) (метод D). Масс-спектр (ЭИ, 70 эВ), m/z ( I отн . , %): 168 [M]+• (12), 165 (1), 153 (6), 142 (1), 135 (42), 127 (7), 121 (13), 114 (100), 107 (2), 95 (11), 86 (12), 81 (28), 72 (40), 69 (13), 55 (27), 53 (11), 42 (50), 37 (1). Спектр ЯМР 1Н, δ, м. д. ( J , Гц): 2,41 (2Н, кв, 3J = 7,1, –СH 2 –); 3,12 (2Н, т, 3J = 7,3, –SСH 2 –); 3,62 (3Н, с, –NСН 3 ); 5,04 (1Н, м, =СH 2 ); 5,08 (1Н, м, =СH 2 ); 5,81 (1Н, м, –СН=); 6,92 (1Н, с, Н-4); 7,06 (1Н, с, Н-5). Спектр ЯМР 13С, δ , м. д.: 33,22 (–СH 2 –); 33,64 (–SСH 2 –); 33,89 (–NСН 3 ); 116,33 (=СH 2 ); 122,06 (С-5); 129,25 (С-4); 136,09 (–СН=); 141,64 (С-2).
Синтез 2-(3-бутенил)сульфанил-1-метилимидазола (4) (методика для системы (Е) КОН–H 2 O–ТЭБАХ)
В плоскодонную колбу помещали 0,280 г (5 ммоль) КОН, приливали 15 мл дистиллированной воде. Далее добавляли 0,570 г (5 ммоль) 1-метилимидазол-2-тиола 1 , на кончике шпателя ТЭБАХ и 0,51 мл (5 ммоль) бутенилбромида. Реакционную смесь перемешивали на магнитной мешалке. Через 3 суток получали прозрачный раствор с желтыми каплями масла (эмульсию «вода–масло»). Проводили экстракцию масла хлороформом (3 раза по 5 мл), экстракт сушили хлоридом кальция, фильтровали и отгоняли растворитель. Получали соединение 4 в виде светлооранжевого масла, выход 0,395 г (47 %).
Обсуждение результатов
Теоретически, реакции алкилирования 1-метилимидазола-2-тиола ( 1 ) в основной среде вследствие его тион-тиольной таутомерии и образования амбидентного аниона его натриевой или калиевой соли могут протекать как по атому серы, так и по атому азота. С одной стороны, это может быть использовано для синтеза различных алкильных производных 1-метилимидазол-2-тиола 1 , но, с другой стороны, может снижать селективность самих реакций алкилирования.
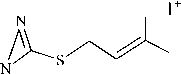
С целью получения новых S-алкенильных производных соединения 1 нами впервые было осуществлено его алкилирование в системах i -PrOH– i -PrONa, MeOH–MeONa, K 2 CO 3 –Me 2 CO, K 2 CO 3 –MeCN, i -PrOH– i -PrOК и КОН–H 2 O–ТЭБАХ (схема 1). В качестве алкилирующих реагентов были использованы пренилбромид (1-бром-3-метилбутен-2) ( 2а ), транс -циннамилхлорид ([(1 E )-3-хлорпропен-1-ил]бензол) ( 2b ) и бутенилбромид (4-бромбутен-1) (см. таблицу).
R1
1 g 2a,b 2 г N Br CH 2 г N
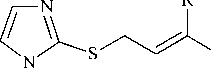
-
R2 N SHN
CH CHCH
-
3 3a,b 1 3
-
2, 3 a R1 = R2 = CH 3 , b R1 = H, R2 = Ph; 2 a Hlg = Br, b Hlg = Cl
Схема 1. Синтез 2-алкенилсульфанил-1-метилимидазолов (3a, b, 4)
Таблица
Выход 2-алкенилсульфанил-1-метилимидазолов (3a,b, 4) в различных основных системах
|
Соединение Условия реакции |
Выход, % |
||||
|
(A) i -PrOH– i -PrONa |
(B) MeOH– MeONa |
(C) K 2 CO 3 – Me 2 CO |
(D) i -PrOH– i -PrOК |
(E) КОН–H 2 O– ТЭБАХ |
|
|
3a |
78 |
– |
86 |
– |
– |
|
3b |
95 |
96 |
94 |
97 |
– |
|
4 |
75 |
70 |
33 |
55 |
47 |
«–» в составе смеси соединений.
При взаимодействии 1-метилимидазол-2-тиола 1 с пренилбромидом 2а в системах (A) i -PrOH– i -PrONa и (C) Me 2 CO–K 2 CO 3 синтезирован индивидуальный продукт, 1-метил-2-пренилсульфанилимидазол ( 3a ) (см. схему 1), строение которого исследовано и доказано методами ЯМР 1Н, 13С и хромато-масс-спектрометрии (ГХ-МС).
О протекании алкилирования по атому серы и образовании сульфида 3а свидетельствует наличие в спектре ЯМР 1 Н дублета протонов -SCH2- при 5 3,62 м. д. Неэквивалентные протоны двух групп -СН3, расположенных в цис - и транс -положении относительно двойной связи, резонируют в виде двух синглетов при § 1,51 и 1,69 м. д.
В спектре ЯМР 13С соединения 3a сигналы в сильном поле при 5 17,19 и 25,62 м. д. относятся к сигналам двух атомов углерода метильных групп в цис - и транс -положении, соответственно. Самый слабопольный сигнал (при 5 141,32 м. д.) закономерно дает углерод С-2 имидазольного цикла, связанный с двумя атомами азота (N-1, N-3) и атомом серы.
В масс-спектре соединения 3a пик молекулярного иона М+ " с m/z 182 имеет крайне низкую интенсивность (2 %) и претерпевает различные направления фрагментации (схема 2). Так, при отщеплении от исходного молекулярного иона молекулы 2-метилбутадиена-1,3 образуется катион-радикал 1-метилимидазол-2-тиола, о чем свидетельствует наличие в масс-спектре пика с m/z 114 (30 %).
I
CH m/z 154 (1 %)
N
C+
N
I
CH m/z 81 (5 %)
CH3 m/z 156 (2 %)
H2C CH2
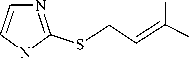
CH3 M m/z 182 (2 %) 3a
HS
I
CH3
m/z 114 (30 %)
H

SH
II
CH2
m/z 113 (7 %)
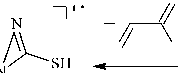
I
CH3 m/z 88 (1 %)
C SH
HC CH
I
CH3
m/z 156 (2 %)

CH3
+
N
\\
N m/z 43 (4 %)
H3C
H2C+ HC CH H C+
2 CH3
m/z 69 (25 %) m/z 43 (5 %)
H2CCH
H2C+CH m/z 41 (43 %)
Схема 2. Фрагментация молекулярного иона соединения 3a при ГХ-МС анализе
Два других ключевых направления фрагментации молекулярного иона соединения 3a заклю-
чаются в предварительном выбросе этилена с последующим отщеплением метильного и тиоль-
ного радикалов (схема 3).
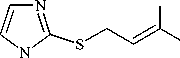
CH 3 M m/z 182 (2 %) 3a
H2C CH2
S
CH
CH3
CH3
m/z 139 (7 %)

I
CH3
I
CH 3 m/z 154 (1 %)
I
CH3

SH
I
CH3
m/z 121 (1 %)
Схема 3. Другие направления фрагментации молекулярного иона соединения 3a при ГХ-МС анализе
По данным ЯМР 1Н найдено, что при использовании других основных систем ((B) MeOН– MeONa, (D) i -PrOH– i -PrOК и (F) K 2 CO 3 –MeCN) селективность реакции алкилирования исходного тиола 1 пренилбромидом 2а снижается. Нами была получена смесь целевого продукта 3а и минорных количеств побочных продуктов алкилирования – 1-метил-3-пренилимидазол-2-тиона (в системах D и F) и бромида 1-метил-3-пренил-2-пренилсульфанилимидазолия (в системе В). В спектрах ЯМР 1 Н, кроме сигналов протонов соединения 3а , присутствуют, в частности, сигналы протонов –NCH 2 – в более слабом поле (δ 4,60–5,10 м. д.).
Образование N-алкенильного производного объясняется тион-тиольной таутомерией исходного соединения 1 , а бромид, по-видимому, образуется в минорном количестве при последующем алкилировании основного продукта 3a .
Синтез индивидуального 1-метил-2-циннамилсульфанилимидазола ( 3b ) с высокими выходами осуществлен взаимодействием 1-метилимидазол-2-тиола 1 с транс- циннамилхлоридом 2b в основных системах (А) i -PrOH– i -PrONa, (В) MeOH–MeONa, (C) Me 2 CO–K 2 CO 3 и (D) i -PrOH– i -PrOК (см. схему 1). Строение продукта 3b исследовано и доказано методами ЯМР 1Н, 13С и хромато-масс-спектрометрии (ГХ-МС).
О протекании алкилирования по атому серы и образовании сульфида 3b свидетельствует наличие в спектре ЯМР 1Н дублета протонов –SСH 2 – при δ 3,84 м. д. При этом наблюдается небольшое смещение (на δ 0,22 м. д.) данного сигнала в более слабое поле по сравнению с сигналом протонов -SCH 2 - в спектре пренилсульфида 3а вследствие дезэкранирующего влияния фенильной группы. Кроме того, в области δ 6,25–6,37 м. д. наблюдаются мультиплет и дублет протонов –СH= и =СHPh соответственно. Большое значение КССВ этих двух протонов (3 Jtrans = 14,5 Гц) свидетельствует о транс -расположении заместителей относительно двойной связи.
В спектре ЯМР 13С соединения 3b сигналы при δ 37,06 и 39,82 м. д. относятся к сигналам атомов углерода групп –NCH3 и –SCH2–, соответственно. Самый слабопольный сигнал (при δ 138,45 м. д.) закономерно дает углерод С-2 имидазольного цикла, связанный с двумя атомами азота (N-1, N-3) и атомом серы.
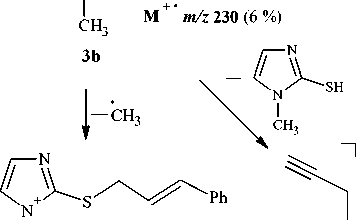
В масс-спектре соединения 3b , как и в случае продукта 3а , пик молекулярного иона М + " с m/z 230 имеет крайне низкую интенсивность (6 %), причиной чего является его значительная фрагментация (схема 4). Самым интенсивным пиком в масс-спектре является пик циннамильного иона PhС 3 Н 3 + с m/z 117 (100 %), который образуется в результате фрагментации молекулярного иона по связи С–S.
+
H2C+ Ph
m/z 91 (36 %)
HC CH
+
H2C+
+ H 2
H2C+

m/z 115 (65 %)
N
CH3
m/z 114 (3 %)
N
Ph
m/z 117 (100 %)
+ H2C+
m/z 39 (12 %)
Ph
N
CH3
N
S
m/z 215 (2 %)
Ph m/z 116 (15 %)
CH m/z 152 (1 %)
CH
C6H5 + m/z 77 (8 %)
Схема 4. Фрагментация молекулярного иона соединения 3b при ГХ-МС анализе
Отличительной особенностью фрагментации молекулярного иона соединения 3b является выброс бензильного и тиольного радикалов (схема 5).
HC
N
N+
+ N+
N
S
N
S
S
Ph
+ N+
CH M m/z 230 (2 %) 3b
Ph CH
N
Ph
CH
CH3
CH3
m/z 139 (12 %)
Ph
Ph
N+
N
S
CH3
CH3
CH3
CH3 m/z 197 (7 %)
Схема 5. Другие направления фрагментации молекулярного иона соединения 3b при ГХ-МС анализе
Алкилирование 1-метилимидазол-2-тиола 1 транс -циннамилхлоридомом 2b было исследовано нами также в системах (E) KOH–H 2 O–ТЭБАХ и (F) MeCN–K 2 CO 3 , первая из которых предполагает использование в реакции метода межфазного катализа (МФК) и бензилтриэтиламмония хлорида (ТЭБАХ) в качестве межфазного катализатора [27]. Использование водной фазы для проведения реакций алкилирования характеризуется рядом преимуществ: экологичность, доступность, экономичность и нетоксичность.
Однако по данным ЯМР 1Н установлено, что в результате алкилирования соединения 1 транс -циннамилхлоридом 2b в указанных основных системах (E) и (F) образуется смесь S- и N-алкенильных производных – 1-метил-2-циннамилсульфанилимидазол 3b и изомерный ему 1-метил-3-циннамилимидазол-2-тион в соотношении ~ 1,0 : 0,1.
Примечательно, что взаимодействие 1-метилимидазол-2-тиола 1 с бутенилбромидом во всех используемых основных системах (А) i -PrOH– i -PrONa, (В) MeOH–MeONa, (C) Me 2 CO–K 2 CO 3 , (D) i -PrOH– i -PrOК и (Е) KOH–H 2 O–ТЭБАХ протекает исключительно по атому серы и приводит к образованию индивидуального продукта, 2-(3-бутенил)сульфанил-1-метилимидазола ( 4 ) (см. схему 1). Строение соединения 4 исследовано и доказано методами ЯМР 1Н, 13С и хромато-масс-спектрометрии (ГХ-МС).
О протекании алкилирования по атому серы и образовании сульфида 4 свидетельствует наличие в спектре ЯМР 1Н триплета протонов –SСH 2 – при δ 3,12 м. д. При этом наблюдается смещение данного сигнала на δ 0,50 и 0,72 м. д. в более сильное поле по сравнению с сигналами протонов -SCH 2 - в спектрах пренилсульфида 3а и циннамилсульфида 3b соответственно вследствие экранирующего влияния метиленового фрагмента. Кроме того, в области сильного поля при δ 2,41 м. д. находится квартет, соответствующий двум протонам группы –СН 2 –. В более слабом поле в области δ 5,04–5,81 м. д. закономерно наблюдаются сигналы протонов –СН= и =СH 2 .
В спектре ЯМР 13С соединения 4 сигналы в сильном поле при δ 33,22, 33,64 и 33,89 м. д. относятся к сигналам атомов углерода групп –CH 2 –, –SCH 2 – и –NCH 3 соответственно. Самый слабопольный сигнал (при δ 141,64 м. д.) дает углерод С-2 имидазольного цикла, связанный с двумя атомами азота (N-1, N-3) и атомом серы.
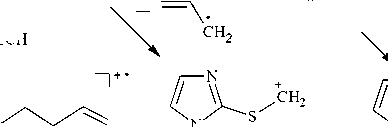
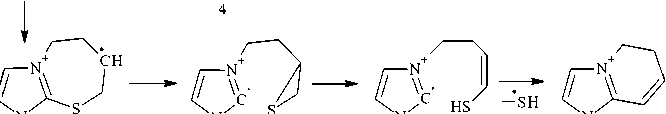
В масс-спектре бутенилсульфида 4 , в отличие от масс-спектров соединений 3а и 3b , пик молекулярного иона М + " с m/z 168 имеет чуть большую интенсивность (12 %), но также претерпевает значительную фрагментацию (схема 6). При отщеплении от молекулярного иона молекулы бутадиена-1,3 образуется катион-радикал 1-метилимидазол-2-тиола, о чем свидетельствует наличие в масс-спектре интенсивного пика с m/z 114 (100 %).
NS
N
CH3
m/z 82 (29 %)
HC CH
N
N m/z 56 (18 %) CH3
CH
H
N
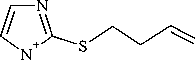
m/z 153 (6 %)
CH
N
N

N
S
N

SH
HC CH
N

CH3
N
+
N m/z 41 (11 %)
N
CH
m/z 55 (27 %)
N
CH3 m/z 114 (100 %)
CH M m/z 168 (12 %) 4
SH
N
C+
N
N m/z 142 (1 %)
CH3
m/z 127 (7 %)
S
CH

N
N
S
m/z 127 (7 %)
CH3 m/z 81 (29 %)
Схема 6. Фрагментация молекулярного иона соединения 4 при ГХ-МС анализе
Два других ключевых направления фрагментации молекулярного иона соединения 4 , аналогичные фрагментации молекулярного иона пренилсульфида 3а , заключаются в отщеплении метильного и тиольного радикалов (схема 7).
CH3
CH
3 M m/z 168 (12 %)
N
N
CH3
CH3
N
CH3
N
HC
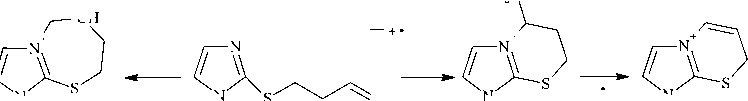
CH
N
N
CH3
N
CH 3 N
CH3
m/z 153 (6 %)
m/z 135 (42 %) CH3
Схема 7. Другие направления фрагментации молекулярного иона соединения 4 при ГХ-МС анализе
Заключение
Установлено, что селективность реакций алкилирования 1-метилимидазол-2-тиола пренил-бромидом, транс -циннамилхлоридом и бутенилбромидом зависит от условий проведения (алкилирующий агент, растворитель, основание). Синтез индивидуальных 1-метил-2-пренилсульфанил-имидазола, 1-метил-2-циннамилсульфанилимидазола и 2-(3-бутенил)сульфанил-1-метилимидазола осуществлен не во всех исследуемых основных системах. При этом определенной зависимости между полярностью выбранных растворителей, селективностью реакций алкилирования и выходом продуктов не выявлено. Строение синтезированных соединений подробно исследовано и доказано методами масс-спектрометрии (ГХ-МС) и спектроскопии ЯМР ХН и 13С, выявлены общие закономерности и специфические особенности спектров целевых соединений.
Список литературы Синтез и исследование строения 2-алкенилсульфанил-1-метилимидазолов
- Xavier R.J. // Spectrochim. Acta Part A: Mol. Biomol. Spectrosc. 2014. V. 118. P. 999. DOI: 10.1016/j.saa.2013.09.120.
- Tonacchera M. // J. Endocrin. Invest. 2019. V. 43. P. 728. DOI: 10.1007/s40618-019-01148-w.
- Zhao X., He Y., Wang Y. et al. // Food Chem. 2019. P. 1. DOI: 10.1016/j.foodchem.2019.125787.
- Giuliani C., Bucci I., Napolitano G. // Med. Hypothes. 2021. V. 146, No. 7. P. 1. DOI: 10.1016/j.mehy.2020.110473.
- Hitoshi I. // Cell Tissue Res. 2019. V. 378, No. 2. P. 175. DOI: 10.1007/s00441-019-03047-1.
- Methimazole derivatives and tautomeric cyclic thiones to inhibitor cell adhesion: pat. WO 2005/094819 A1 Canada; appl. 16.03.2004; publ. 13.10.2005. 98 p.
- Hattan C.M., Shojaie J., Lau S.S. et al. // Synth. Commun. 2013. V. 43. P. 1. DOI: 10.1080/00397911.2011.587078.
- Asgharian-Sheykhia F., Hassanabadib A., Akhgara M.R. et al. // J. Chem. Res. 2013. P. 523. DOI: 10.1002/chin.201411054.
- Abele R., Abele E., Rubina K. et al. // Chem. Heterocycl. Compd. 2002. V. 38, No. 7. P. 867. DOI: 10.1023/A:1020650224525.
- Correa A., Carril M., Bolm C. // Chem. Int. Ed. 2008. V. 47, No. 15. P. 2880. DOI: 10.1002/anie.200705668.
- Chen C.-K., Chen Y.-W., Lin C.-H. et al. // Chem. Commun. 2010. V. 46, No. 2. P. 282. DOI: 10.1039/b918117b.
- Rajesh N., Sarmab R., Prajapati D. // RSC Adv. 2014. V. 4, No. 15. P. 7834. DOI: 10.1002/chin.201445050.
- Liu G., Kong L., Shen J. et al. // Org. Biomol. Chem. 2014. V. 12, No. 14. P. 2310. DOI: 10.1039/c4ob00103f.
- Rajesh N., Prajapati D. // RSC Adv. 2014. V. 4, No. 61. P. 32108. DOI: 10.1039/C4RA04359F.
- Rodygin K.S., Ananikov V.P. // Mendeleev Commun. 2015. V. 25, No. 6. P. 415. DOI: 10.1016/j.mencom.2015.11.004.
- O’Brien R.A., Zayas M.S., Nestor S.T. et al. // New J. Chem. 2016. V. 40, No. 9. P. 7795. DOI: 10.1039/C6NJ00657D.
- Loughlin W.A., Haynes R.K. // Aust. J. Chem. 1995. V. 48. P. 651. DOI: 10.3762/bjoc.19.44.
- Gencer H.K., Cevik U.A., Cavusoglu B.K. et al. // J. Enzyme Inhib. Med. Chem. 2017. V. 32, No. 1. P. 732. DOI: 10.1080/14756366.2017.1310726.
- Tan B.Y.-H., Teo Y.-C. // TETRAB. 2016. V. 72, No. 42. P. 6646. DOI: 10.1016/j.tet.2016.08.085.
- Lin Y.-Y., Wang Y.-J., Lin C.-H. et al. // Am. Chem. Soc. 2012. V. 77, No. 14. P. 6100. DOI: 10.1021/jo3008397.
- Bates C.G., Saejueng P., Doherty M.Q. et al. // Org. Lett. 2004. V. 6, No. 26. P. 5005. DOI: 10.1021/ol0477935.
- Kao H.-L., Lee C.-F. // Org. Lett. 2011. V. 13, No. 19. P. 5204. DOI: 10.1021/ol2020863.
- Baut L. // Eur. J. Med. Chem. 1983. V. 18, No. 5. P. 441.
- Abele E., Dzenitis O., Rubina K. et al. // Chem. Heterocycl. Compd. 2002. V. 38, No. 6. P. 682. DOI: 10.1023/A:1019913218413.
- Il’inykh E.S., Kim D.G. // Bull. S. Ural State University, Ser. Chemistry. 2015. V. 7, No. 3. P. 19. EDN: UATWBR.
- Ильиных Е.С., Ким Д.Г. // Вестн. ЮУрГУ. Сер. Химия. 2023. Т. 15, № 1. С. 83. DOI: 10.14529/chem230109.
- Островский В.А. // Соросовский образовательный журнал. 2000. Т. 6, № 11. С. 30.


