Синтез и исследование строения органических соединений сурьмы(V) с непредельными карбоновыми кислотами Ph3Sb[OC(O)R]2
Автор: Малеева Алевтина Игоревна, Гущин Алексей Владимирович, Калистратова Ольга Сергеевна, Андреев Павел Валерьевич, Сомов Николай Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.11, 2019 года.
Бесплатный доступ
Взаимодействием трифенилсурьмы с карбоновыми кислотами в присутствии пероксидов в эфире или ТГФ синтезированы дикарбоксилаты трифенилсурьмы: Ph3Sb[OC(O)CH=CH2]2, Ph3Sb[OC(O)C(CH3)=CH2]2, Ph3Sb[OC(O)CH=CHCH3]2, Ph3Sb[OC(O)CH=CHC4H3O]2, Ph3Sb[OC(O)CH=CHPh]2, Ph3Sb[OC(O)CH=CHC6H4NO2- m ]2, Ph3Sb[OC(O)CH=CHC6H4OMe- p ]2, Ph3Sb[OC(O)CH=CHCH=CHCH3]2. Выходы дикарбоксилатов трифенилсурьмы составили 59-86 %. Строение полученных продуктов подтверждено данными элементного анализа, ИК, 1Н-ЯМР спектроскопии. По данным РСА, атом сурьмы может находиться в тригонально-бипирамидальной, тетрагонально-пирамидальной и «промежуточной» конфигурации. Во всех соединениях наблюдается дополнительная координация атома сурьмы на карбонильные атомы кислорода, причем наиболее выраженным этот эффект является у м -нитроциннамата трифенилсурьмы. В случае искаженной тригонально-бипирамидальной конфигураци два угла в экваториальной плоскости изменяются в пределах 104,03(4)-112,59(9), третий угол значительно превышает эти значения 135,43(9)-149,81(8). Данный факт связан с расположением карбонильных атомов кислорода O2 и O4 между фенильными заместителями. Сумма углов в экваториальной плоскости составляет 360º. Интервалы изменения длин связей Sb-O и Sb-C составляют 2,104(2)-2,162(7) Å и 2,100(16)-2,128(1) Å. Валентные углы O1-Sb-O3 составляют 172,18(6)-178,00(4)º. Внутримолекулярные расстояния Sb…O2 и Sb…O4 равны 2,583-3,060 Å. Карбоксилатный остаток ненасыщенных карбоновых кислот имеет плоское строение, все валентные углы близки к 120º, что подтверждает участие всех атомов углерода и кислорода в образовании единой сопряженной системы C=C-C(O)OSb. При этом кратные связи укорочены, а одинарные удлинены по сравнению с кислотами. Выявлены межмолекулярные взаимодействия в акрилате, метакрилате, кротонате и сорбате трифенилсурьмы с участием двойных связей С=С ненасыщенных карбоксилатных фрагментов соседних молекул. В ряде соединений присутствует сокристаллизовавшийся растворитель, который входит в упаковку молекул.
Кристаллическое строение, трифенилсурьма, диакрилат трифенилсурьмы, диметакрилат трифенилсурьмы, дикротонат трифенилсурьмы, бисфурилакрилат трифенилсурьмы, дициннамат трифенилсурьмы, ди-мета-нитроциннамат трифенилсурьмы, ди-пара-метоксициннамат трифенилсурьмы, дисорбат трифенилсурьмы, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147233137
IDR: 147233137 | УДК: 546.864+547.53.024 | DOI: 10.14529/chem190308
Текст научной статьи Синтез и исследование строения органических соединений сурьмы(V) с непредельными карбоновыми кислотами Ph3Sb[OC(O)R]2
В настоящее время получен и исследован достаточно широкий ряд производных трифенилсурьмы с непредельными карбоновыми кислотами типа Ph3Sb[OC(O)R]2 [1, 2]. Интерес к такому типу соединений связан с большими возможностями их применения. Некоторые комплексы Sb(V) проявляют противоопухолевую активность [3–5], используются для лечения лейшманиоза [6–8] или в качестве компонентов высокочувствительных молекулярных органометаллических УФ-резистов [9]. Активно развивается химия полимеров, содержащих сурьму. В литературе имеются данные о введении в полиметилметакрилат, полиакриловую кислоту, в поливинилацетат металлических сурьмы и висмута в коллоидном состоянии [10, 11]. Сурьмаорганические производные могут встраиваться как в основную цепь макромолекул [12, 13], так и в качестве заместителей в боковой цепи. Акрилаты, метакрилаты, винилбензоаты и другие производные сурьмы, способные к полимеризации, уже использованы для синтеза металлосодержащих полимеров на основе метилметакрилата, стирола, винилацетата, акриловой кислоты, проявляющих фунгицидную и биоцидную активность [14, 15]. Добавки таких соединений в полимерные материалы улучшают их термическую [16], радиационную стойкость, а также поглощение рентгеновского излучения [17].
Экспериментальная часть
Диакрилат трифенилсурьмы Ph 3 Sb[OC(O)CH=CH 2 ] 2 (I). К смеси 3,53 г (0,01 моль) трифенилсурьмы и 2,16 г (0,03 моль) акриловой кислоты в 10 мл диэтилового эфира прибавляли 1,2 мл 29%-ного водного раствора пероксида водорода (0,01 моль) в 40 мл диэтилового эфира и выдерживали 12 ч при комнатной температуре. Образовавшиеся кристаллы фильтровали, сушили. Выход продукта 63 %. Т. пл. 153 °С.
ЯМР 1Н (CDCl 3 ): 8,03 (dd, J = 6,5; 3,0 Hz, 6H); 7,52–7,45 (m, 9H), 6,16 (dd, J = 17,3; 1,8 Hz, 2H); 5,97 ( dd , J = 17,3; 10,2 Hz, 2H); 5,61 (d, J = 11,9 Hz, 2H).
ИК-спектр (ν, см–1, таблетка KBr): 3055 (Ph–H); 2974, 1637 (C=C); 1616 (СOO); 1481, 1405, 1310 (COO); 1239, 975, 736, 691, 580 (Sb–O), 459 (Sb–C).
Аналогично осуществляли синтез дикарбоксилатов сурьмы (II) – (V) .
Диметакрилат трифенилсурьмы Ph 3 Sb[OC(O)C(CH 3 )=CH 2 ] 2 (II) – бесцветные кристаллы, выход 79 %, Т. пл. 156 °С.
Найдено, %: C 59,94; H 4,95; Sb 23,27. Для C 26 H 25 O 4 Sb вычислено, %: С 59,68; H 4,82; Sb 23,27.
ЯМР 1Н (CDCl 3 ): 8,02 ( dd , J = 6,5; 3,0 Hz, 6H); 7,49–7,45 (m, 9H), 5,93 (s, 2H); 5,36 (s, 2H); 1,79 (s, 6H).
ИК-спектр (ν, см–1, таблетка KBr): 3056 (Ph–H); 2974 (CH3); 1647(C=C), 1603 (СOO); 1480, 1435, 1356 (COO), 1195, 936, 735, 689, 586 (Sb–O); 464 (Sb–C).
Дикротонат трифенилсурьмы Ph 3 Sb[OC(O)CH=CHCH 3 ] 2 (III) – бесцветные кристаллы, выход 69 %. Т. пл. 153 °С.
Найдено, %: C 59,71; H 4,79; Sb 21,10. Для C 26 H 25 O 4 Sb вычислено, %: С 59,68; H 4,82; Sb 23,27.
ЯМР 1Н (CDCl 3 ): 8,01 (dd, J = 6,5; 3,1 Hz, 6H); 7,56–7,38 (m, 9H); 6,47 (dq, 2H); 5,70 (d, 2H); 1,75 (dd, 6H).
ИК-спектр (ν, см–1, таблетка KBr): 3054 (Ph–H), 2971 (CH 3 ), 1664 (C=C), 1590 (СOO); 1481, 1436, 1350 (COO), 1187, 963, 740, 690, 575 (Sb–O), 454 (Sb–C).
Бис-2-фурилакрилат трифенилсурьмы Ph 3 Sb[OC(O)CH=CHC 4 H 3 O] 2 (IV) – желтооранжевые кристаллы, выход 71 %. Т. пл. 197 °С.
ЯМР 1H (CDCl 3 ): δ 8,06 (dd, J = 6,3; 2,8 Hz, 6H); 7,54–7,44 (m, 9H); 7,22 ( d , J = 15,7 Hz, 2H), 6,48 ( d , J = 3,1 Hz, 2H), 6,40 (s, 2H), 6,22 (d, J = 15,7 Hz, 2H).
ИК-спектр (ν, см–1, таблетка KBr): 3063 (Ph–Н), 1648 (С=С), 1604 (СOO), 1481, 1438, 1321 (СOO), 1280, 1226, 1188, 1073, 1014, 883, 734, 690, 591 (Sb–O), 463 (Sb–C).
Дициннамат трифенилсурьмы Ph 3 Sb[OC(O)CH=CHPh] 2 (V) – белые кристаллы, выход 80 %. Т. пл. 199 °С.
ЯМР 1H (CDCl 3 ): δ 8,10 (dd, J = 6,4; 2,8 Hz, 6H); 7,50 (dd, J = 6,6; 4,6 Hz, 10H); 7,43 (dd, J = 6,6; 2,9 Hz, 5H); 7,35–7,29 (m, 6H); 6,34 (d, J = 15,9 Hz, 2H).
ИК-спектр (ν, см–1, таблетка KBr): 3053 (Ph–Н), 1642 (С=С), 1580 (СOO), 1481, 1435, 1357 (СOO), 970, 747, 691, 588 (Sb–O), 459 (Sb–C).
Ди- м -нитроциннамат трифенилсурьмы Ph 3 Sb[OC(O)CH=CHC 6 H 4 NO 2 - m ] 2 (VI) – белые кристаллы, выход 59 %. Т. пл. 193 °С.
ЯМР 1H (CDCl 3 ): 8,28 (s, 2H); 8,17–8,08 (m, 8H); 7,71 (d, J = 7,7 Hz, 2H); 7,55–7,48 (m, 12H); 7,44 (s, 1H), 6,45 (d, J = 15,9 Hz, 2H).
ИК-спектр (ν, см–1, таблетка KBr): 3069 (Ph–H); 1651 (C=C), 1611 (COO); 1479, 1436, 1355 (COO); 1217, 1162, 984, 735, 686, 596 (Sb–O), 458 (Sb–C).
Ди- п -метоксициннамат трифенилсурьмы Ph 3 Sb[OC(O)CH=CHC 6 H 4 OMe- p ] 2 (VII). К раствору 0,7 мл 31,2%-ного водного пероксида водорода (6 ммоль) и 2,46 г п -метоксикоричной кислоты (12 ммоль) в 35 мл тетрагидрофурана добавляли раствор 2,2 г (6 ммоль) трифенилсурьмы. Смесь выдерживали в течение 12 ч при комнатной температуре. Образовавшиеся бесцветные кристаллы отфильтровывали, сушили, получали 1,63 г (35 %) ди- п -метоксициннамата трифенилсурьмы. Продукт дважды перекристаллизовывали из смеси хлороформ-гексан (1:4), т. пл. 178 °С.
ИК-спектр (v, см-1, таблетка KBr): 3049 (Ph-H); 2937 (CH 3 ), 1687 (C=C); 1643 (COO); 1482, 1436, 1325 (COO); 1257, 1171, 976, 688, 565 (Sb–O); 460 (Sb–C).
Аналогично осуществляли синтез дикарбоксилатов сурьмы ( VI ), ( VII ).
Дисорбат трифенилсурьмы Ph3Sb[OC(O)CH=CHCH=CHCH3]2 (VIII). К смеси 0,883 г (2,5 ммоль) трифенилсурьмы и 0,56 г (5,1 ммоль) сорбиновой кислоты в 5 мл тетрагидрофурана прибавляли по каплям 0,24 мл 98%-ного t-BuOOH (5,1 ммоль). Смесь выдерживали сутки. Образовавшиеся желтоватые кристаллы фильтровали, сушили. Выход продукта – 86 %. Т. пл. 121 °С.
ЯМР 'll (CDCI 3 ): 8,02 (s, 6H); 7,47 (s, 9H); 7,04 (dd, J = 14,8; 10,7 Hz, 2H); 6,20-5,85 (m, 4H); 5,69 ( t , J = 26,3 Hz, 2H); 1,79 (d, J = 5,5 Hz, 6H).
ИК-спектр (v, см-1, таблетка KBr): 3058 (Ph-Н), 2942, 1650 (C=C), 1632 (COO), 1481, 1436, 1334 (СOO), 1263, 1150, 993, 736, 694, 598 (Sb–O), 458 (Sb–C).
Физико-химические методы анализа
ИК-спектры записывались на приборе IR Prestige-21, Shimadzu, Япония в диапазоне 4000400 см–1.
ЯМР 'll снимали в дейтерохлороформе на ЯМР-спектрометре Agilent DD2 400. Для расшифровки и моделирования спектров использовали программу MestReNowa 9.0.2 (демонстрационная версия).
Рентгено-структурный анализ выполнен на дифрактометре Xcalibur, Sapphire3, Gemini S. Кристаллы размером 0,5–1 мм выращены из смеси бензола и петролейного эфира.
Обсуждение результатов
Дикарбоксилаты трифенилсурьмы получали методом окислительного присоединения из карбоновой кислоты, трифенилсурьмы и трет -бутилгидропероксида или пероксида водорода [18]:
Ph 3 Sb + 2RCOOH + R’OOH → Ph 3 Sb[OC(O)R] 2 + R’OH
R= Vin (I) , C(CH 3 )=CH 2 (II) , CH=CHCH 3 (III) , CH=CHC 4 H 3 O (IV) , CH=CHPh (V) , CH=CHC 6 H 4 NO 2 - m (VI) , CH=CHC 6 H 4 OMe- p (VII) , СН=СНСН=СНСН з (VIII) .
R’= H, t -Bu
Реакции проводили в диэтиловом эфире ( I - V ) или тетрагидрофуране ( VI - VIII ) при комнатной температуре в течение 12–24 ч с выходами дикарбоксилатов трифенилсурьмы до 86 %. Выбор растворителя реакции окислительного присоединения обусловлен строением пероксида и карбоновой кислоты. Взаимодействие трифенилсурьмы с карбоновыми кислотами с участием пероксида водорода проводили, как правило, в смеси диэтилового эфира и изопропилового спирта. Реакции с фурилакриловой и коричными кислотами, не растворимыми в эфире, проводили в ТГФ, а пероксид водорода заменяли на трет- бутилгидропероксид. Глубина протекания реакций определялась при помощи тонкослойной хроматографии (элюент – смесь этилацетата и петролейного эфира, 1:4). Строение всех соединений было подтверждено методами ИК- и ЯМР-спектроскопии. Следует отметить, что соединение VIII получено и охарактеризовано впервые (CCDC № 1055084).
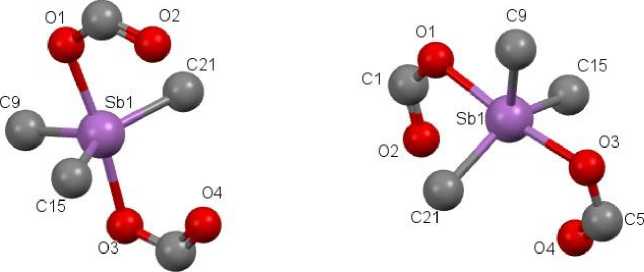
Было проведено подробное исследование кристаллических структур соединений (I)-(VIII) методом РСА. Для более точного описания координационного окружения атома Sb(V) использован параметр τ [19], который определяется как (α–β)/60 (α > β), где α и β представляют собой значения двух наибольших углов между заместителями атома Sb. Для идеальной тетрагональной пирамиды τ = 0, так как α = β, в случае идеальной тригональной бипирамиды аксиальный угол α = 180°, экваториальный β = 120° (τ = 1). Значение параметра τ для исследуемых соединений представлено в табл. 1. В соответствии с этим в комплексе IV координационное окружение атома сурьмы имеет искажённую тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях и фенильными кольцами в экваториальной плоскости (рис. 1), в то время как в соединении VII - сильно искаженную тетрагонально-пирамидальную с карбоксилатными и двумя фенильными лигандами в экваториальных положениях и фенильной группой в аксиальной плоскости (рис. 1). В остальных комплексах I-III, V, VI, VIII координация является «промежуточной» между тригонально-бипирамидальной и тетрагонально-пирамидальной.
Таблица 1
Валентные углы в дикарбоксилатах типа Ph 3 Sb[OC(O)R] 2
|
Соединение |
φ O1–Sb–O3, град. |
φ C9–Sb–C15, град. |
φ C9–Sb–C21, град. |
φ C15–Sb–C21, град. |
τ |
|
I |
175,28 (7) |
105,7 (1) |
108,4 (1) |
145,8 (1) |
0,49 |
|
II |
176,70 (6) |
105,14 (9) |
105,05 (9) |
149,81 (8) |
0,45 |
|
III |
176,03 (7) |
105,7 (1) |
108,4 (1) |
145,8 (1) |
0,50 |
|
IV |
172,81 (4) |
111,98 (9) |
112,59 (9) |
135,43 (9) |
0,62 |
|
V |
176,55 (5) |
105,97 (7) |
106,57 (8) |
147,40 (6) |
0,49 |
|
VI |
178,00 (4) |
105,97 (7) |
106,57 (8) |
147,40 (6) |
0,51 |
|
VII |
173,07 (4) |
104,03 (4) |
104,03 (4) |
148,62 (13) |
0,41 |
|
VIII |
172,18 (6) |
112,33 (6) |
107,48 (6) |
140,19 (6) |
0,53 |
Cl
C5
а) б)
Рис. 1. Тригонально-бипирамидальная (а) и тетраганально-пирамидальная (б) конфигурация фрагмента структуры дикарбоксилатов трифенилсурьмы
Тригонально-бипирамидальная координация IV является несколько искаженной. Три угла C– Sb–C в экваториальном положении отличаются от идеального значения 120º, причем два из них, C9–Sb–C15, C9–Sb–C21, меньше этого значения на 8º, а третий угол C15–Sb–C21 превышает на 15,4º. Это связано с тем, что карбонильные атомы кислорода O2 и О4 расположены друг против друга между фенильными заместителями, что и приводит к значительному увеличению валентного угла. В отличие от этого в молекуле трифенилсурьмы те же углы близки к 90° [20]. Сумма углов в экваториальной плоскости составляет 360º (см. табл. 1). Валентный аксиальный угол O1–Sb1–O3 отличается от идеального значения 180º на 7,19°.
В случае соединения VII валентные углы в экваториальной плоскости наиболее близки к идеальному значению 90º, причем один из них О1–Sb1–C15 меньше этого значения на 0,57°, а три других: O1–Sb1–C21, O3–Sb1–C15 и O3–Sb1–C21 – превышают это значение на 1–3°. Конфигурация в данном случае сильно искажена, так как присутствует значительная разница в углах O1–Sb1–O3 и C15–Sb1–C21. Разница такова, что два атома С15 и С21 лежат ниже атома Sb, чем два атома O1 и O3. Сумма углов в экватериальной плоскости отличается от 360° на 4°. Осевая связь Sb1–C9 практически не отличается от остальных четырех, которые варьируются в переделах 2,103–2,123 Å.
Для атома сурьмы в соединениях I–III, V, VI, VIII характерна «промежуточная» конфигурация.
Представленные в табл. 2 значения длин экваториальных связей Sb–C для дикарбоксилатов трифенилсурьмы в целом близки к значениям аналогичных связей в молекуле трифенилсурьмы (2,143; 2,153; 2,151 Å) [20], однако асимметрия расположения фенильных групп значительно более ярко выражена и интервал величин шире (2,100–2,191 Å).
Таблица 2
|
Соединение |
d Sb–C, Å |
d Sb–O1(O3), Å |
d Sb–O2(O4), Å |
|
I |
2,116 (3) 2,112 (3) 2,113 (3) |
2,120 (2) 2,122 (2) |
2,797 (9) 2,813 (8) |
|
II |
2,104 (2) 2,107 (2) 2,107 (2) |
2,131 (16) 2,109 (16) |
2,677 (2) 2,861 (2) |
|
III |
2,106 (16) 2,109 (15) 2,123 (17) |
2,104 (16) 2,151 (16) |
2,768 (2) 2,806 (2) |
|
IV |
2,121 (2) 2,100 (2) 2,108 (2) |
2,118 (15) 2,115 (15) |
3,060 (2) 2,987 (2) |
|
V |
2,117 (2) 2,119 (2) 2,117 (2) |
2,154 (10) 2,154 (10) |
2,627 (2) 2,627 (2) |
|
VI |
2,114 (1) 2,128 (1) 2,114 (1) |
2,163 (7) 2,163 (7) |
2,583 (2) 2,583 (2) |
|
VII |
2,103 (16) 2,104 (15) 2,117 (16) |
2,105 (11) 2,124 (11) |
2,937 (1) 2,900 (1) |
|
VIII |
2,108 (17) 2,116 (17) 2,118 (18) |
2,115 (9) 2,123 (9) |
2,869 (2) 2,870 (1) |
Длины связей в дикарбоксилатах типа Ph 3 Sb[OC(O)R] 2
Длины аксиальных связей Sb–O1 и Sb–O3 варьируют от 2,104–2,162 Å, что близко к сумме ковалентных радиусов атомов Sb и O (2,14 Å [21]).
Установлено, что карбоксилатный остаток имеет плоское строение, все валентные углы близки к 120º, что подтверждает участие всех атомов углерода и кислорода в образовании единой сопряженной системы C–C=C–COOSb. Нами была установлена следующая закономерность: кратные связи С=С, С=О в карбоксилатном остатке укорочены, а одинарные С–С, С–О удлинены по сравнению с кислотами (табл. 3). Данный факт позволяет говорить о том, что в дикарбоксилатах трифенилсурьмы сопряжение C=C–C(=O)–OSb менее выражено, чем в соответствующих им кислотах, что связано с активной координацией сурьмы на карбонильный атом кислорода, при этом возникает препятствие С=О группе к сопряжению с двойной связью.
Длины связей С–О, С=О, С–С, С=С в дикарбоксилатах трифенилсурьмы и соответствующих им карбоновых кислотах
Таблица 3
|
Соединение |
d C–O, Å |
d C=O, Å |
d C–C, Å |
d C=C, Å |
Литература |
|
I |
1,124 |
1,235 |
1,479 |
1,288 |
[22] |
|
1,127 |
1,232 |
1,482 |
1,306 |
||
|
Акриловая кислота |
1,280 |
1,260 |
1,469 |
1,304 |
[23] |
|
II |
1,300 |
1,273 |
1,482 |
1,366 |
[24] |
|
1,303 |
1,234 |
1,475 |
1,475 |
||
|
Метакриловая кислота |
1,273 |
1,241 |
1,482 |
1,356 |
[23] |
|
III |
1,308 |
1,211 |
1,474 |
1,206 |
[25] |
|
1,308 |
1,212 |
1,474 |
1,209 |
||
|
Кротоновая кислота |
1,288 |
1,264 |
1,468 |
1,293 |
[26] |
|
IV |
1,300 |
1,218 |
1,482 |
1,305 |
[27] |
|
1,305 |
1,217 |
1,487 |
1,307 |
||
|
Фурилакриловая кислота |
1,301 |
1,240 |
1,461 |
1,325 |
[28] |
Окончание табл. 3
|
Соединение |
d C–O, Å |
d C=O, Å |
d C–C, Å |
d C=C, Å |
Литература |
|
V |
1,300 |
1,245 |
1,474 |
1,341 |
[29] |
|
1,300 |
1,245 |
1,74 |
1,341 |
||
|
Коричная кислота |
1,279 |
1,259 |
1,471 |
1,321 |
[30] |
|
VI |
1,299 1,299 |
1,243 1,243 |
1,480 1,480 |
1,338 1,338 |
[29, 31] |
|
м -Нитрокоричная кислота |
1,278 |
1,244 |
1,459 |
1,322 |
[32] |
|
VII |
1,308 |
1,214 |
1,468 |
1,314 |
[33] |
|
1,311 |
1,222 |
1,473 |
1,323 |
||
|
п -Метоксикоричная кислота |
1,271 |
1,266 |
1,467 |
1,323 |
[30] |
|
VIII |
1,301 1,303 |
1,220 1,220 |
1,468 1,475 |
1,318 1,314 |
– |
|
Сорбиновая кислота |
1,323 |
1,231 |
1,465 |
1,336 |
[34] |
Анализ внутримолекулярных взаимодействий выявил 5 типов контактов, которые реализуются в карбоксилатных комплексах трифенилсурьмы: O…Sb, O…H, O…C, C…H, H…H.
Наибольший интерес представляют контакты между атомом сурьмы и атомами кислорода карбонильной группы Sb…O2 и Sb...O4, расстояния их составляют 2,583–3,060 Å, что намного больше расстояний ковалентных связей Sb–O1 и Sb–O3, но существенно меньше суммы вандерваальсовых радиусов атомов О и Sb 3,7 Å (табл. 4 [21]). При этом наблюдается так называемая «гипервалентность» – дополнительная координация карбонильных атомов кислорода на атом металла. Наиболее сильно данное взаимодействие проявляется в комплексе VI . Согласно систематической классификации N–X–L Перкина [35] для металлов, проявляющих свойства гипервалентности (N показывает число валентных электронов, X – центральный атом металла, а L – число связанных с ним лигандов), это соединение относится к типу 14–Sb–7, все остальные исследованные в данной работе соединения принадлежат к типу 10–Sb–5, т.к. данный тип взаимодействия проявляется очень слабо.
Таблица 4
Вандерваальсовы радиусы атомов [21]
|
Атом |
Sb |
C |
O |
H |
|
Радиус, Å |
2,20 |
1,70 |
1,50 |
1,20 |
Координационное взаимодействие атомов Sb…O2 и Sb...O4 приводит к увеличению экваториального угла С15–Sb–С21 (со стороны контакта) до 135,43–149,81º и уменьшению величин углов С9–Sb–С15 до 104,14–112,33º по сравнению с идеальным значением в 120°.
Интересным для изученных соединений является анализ взаимного расположения двойных связей С=С ненасыщенных карбоксилатных фрагментов соседних молекул. Это может оказывать влияние на возможность полимеризации соединений в твердом состоянии. Известно, что термические превращения непредельных карбоксилатов металлов представляют собой многостадийный процесс, сопровождающийся термической полимеризацией в твердой фазе с образованием металлополимерных продуктов [36–38]. Возможность протекания твердофазной полимеризации определяется расстояниями между реакционноспособными группами соседних молекул, которые не должны превышать некоторой величины, равной, согласно [39], 4,0 Å для взаимодействий С=С. Мономеры, в кристалле которых расстояния между активными атомами углерода соседних молекул составляет 4,3–4,7 Å, не способны полимеризоваться в твердой фазе. На основании этих данных в качестве примерной оценки максимального расстояния R между атомами А и В соседних молекул, при котором полимеризация в кристалле еще возможна, была предложена величина R = R A + R B + 0,5 (А), где R A и R B - вандерваальсовы радиусы атомов А и В [40]. В соответствии с этим подходом для атомов углерода R = 3,9 Å [21].
Анализ взаимного расположения молекул кротоната сурьмы Ph3Sb(O2CCH=CHCH3)2 в кристаллах показал наличие тесных межмолекулярных контактов двойных связей С=С ненасыщенных карбоксилатных фрагментов соседних молекул. Молекулы складываются в упаковку таким образом, что кратные связи находятся непосредственно друг под другом, расстояния между параллельно расположенными С=С связями составляют 3,67 Å (рис. 2). В этом кротонат подобен акрилату и метакрилату трифенилсурьмы, имеющими такие контакты (3,642 и 3,67 Å соответственно). Согласно литературным данным, π...π взаимодействия могут быть реализованы на таких расстояниях [41]. В сорбате трифенилсурьмы VIII карбоксильные лиганды соседних молекул в структуре кристаллов располагаются плоскопараллельно, расстояния между С=С фрагментами в обеих парах близки и составляют около 4,00 Å. Такое расположение молекул способствует похождению реакции полимеризации в кристаллах. Так, нагревание кристаллов I до 140 °С и выдерживание их при этой температуре в течение 30 мин в атмосфере сухого азота приводило к полимеризации по С=С связи акрилатных фрагментов [42]. Было показано [43, 44], что плавление дикротоната трифенилсурьмы и дикротоната трифенилвисмута сопровождается полимеризацией, расчетные значения температуры плавления составляют 420,3 и 402,2 К соответственно.
Подобный тип упаковки характерен и для кристаллов олигомеров, таких как диметакрилаты пирокатехина и гидрохинона [45]. В стопках метакрилатные фрагменты соседних молекул параллельны друг другу. Минимальные расстояния между центрами двойных связей соседних метакрилатных фрагментов в кристаллах диметакрилата пирокатехина и диметакрилата гидрохинона составляют 4,621 и 4,269 Å, что несколько превышает допустимую величину R для С…С взаимодействия. Однако это не мешает проведению фотополимеризации расплавов. Предельная конверсия для них равна 20 % (25 и 40 ºС) и 10 % (95 ºС) соответственно.
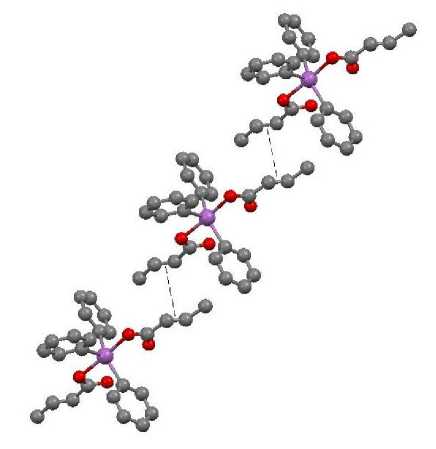
Рис. 2. Межмолекулярные взаимодействия связей С=С в кристалле дикротоната трифенилсурьмы III
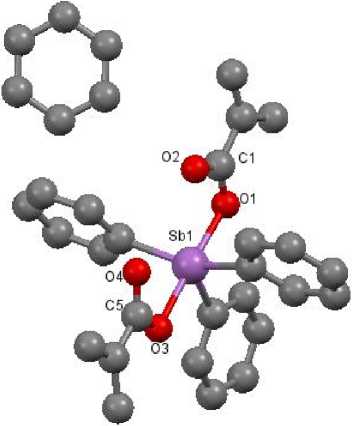
Рис. 3. Общий вид сольвата соединения II с бензолом
В противоположность этому у остальных исследованных дикарбоксилатов трифенилсурьмы IV–VII подобные контакты не наблюдаются, и расстояния превышают 5 Å, что можно объяснить стерическими затруднениями за счет заместителей у кратной связи, которые препятствуют такому взаимодействию. В комплексах V и VI карбоксилатные фрагменты располагаются в упаковке практически параллельно, при этом в VI они сильно смещены друг относительно друга.
Кристаллы некоторых исследуемых соединений могут содержать в себе молекулы растворителя, из которого эти кристаллы были получены или синтезированы. Поскольку выращивание кристаллов проводилось в бензоле, в ряде соединений присутствует сокристаллизовавшийся бензол, который входит в упаковку молекул и имеет слабые межмолекулярные взаимодействия с атомами основного вещества (рис. 3). Молекулы растворителя в своих кристаллах имеют соединения II, IV, VI, VII .
Выводы
Таким образом, в работе рассмотрены особенности синтеза дикарбоксилатных производных трифенилсурьмы Ph 3 Sb[OC(O)CH=CH 2 ] 2 , Ph 3 Sb[OC(O)C(CH 3 )=CH 2 ] 2 , Ph 3 Sb[OC(O)CH=CHCH 3 ] 2 , Ph 3 Sb[OC(O)CH=CHC 4 H 3 O] 2 , Ph 3 Sb[OC(O)CH=CHPh] 2 , Ph 3 Sb[OC(O)CH=CHC 6 H 4 NO 2 - m ] 2 ,
Ph 3 Sb[OC(O)CH=CHC 6 H 4 OMe- p h, Ph 3 Sb[OC(O)CH=CHCH=CHCH 3 ] 2 по реакции трифенилсурь-мы с пероксидами (H 2 O 2 , t- BuOOH) и непредельными карбоновыми кислотами.
По данным РСА, в комплексах I–III, V, VI, VIII координация является «промежуточной» между тригонально-бипирамидальной и тетрагонально-пирамидальной. Атомы сурьмы в IV имеет искаженную тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях и фенильными кольцами в экваториальных позициях, в то время как комплекс VII представляет собой сильно искаженную тетрагональную бипирамиду.
Карбоксилатный остаток ненасыщенных карбоновых кислот имеет плоское строение, все валентные углы близки к 120º, что подтверждает участие всех атомов углерода и кислорода в образовании единой сопряженной системы C=C–C(O)OSb. При этом кратные связи укорочены, а одинарные удлинены по сравнению с кислотами.
Во всех соединениях наблюдается дополнительная координация атома сурьмы на карбонильные атомы кислорода, причем наиболее выраженным этот эффект является у м- нитроциннамата трифенилсурьмы.
Выявлены межмолекулярные взаимодействия в акрилате, метакрилате, кротонате и сорбате трифенилсурьмы с участием двойных связей С=С ненасыщенных карбоксилатных фрагментов соседних молекул.
Работа выполнена при финансовой поддержке государственного задания 4.5706.2017/БЧ.
Список литературы Синтез и исследование строения органических соединений сурьмы(V) с непредельными карбоновыми кислотами Ph3Sb[OC(O)R]2
- Шарутин, В.В. Строение органических соединений сурьмы(V) R3SbX2 (X - электроотрицательный лиганд) / В.В. Шарутин, О.К. Шарутина // Бутлеровские сообщения. - 2007. - Т. 12, № 6. - С. 34-57.
- Молекулярные и кристаллические структуры карбоксилатов три- и тетраарилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина, О.В. Чагарова // Вестник ЮУрГУ. Серия «Химия». - 2011. - Вып. 6. - С. 47-60.
- Synthesis, Structural Characterization and in vitro Antitumour Properties of Triorganoantimony(V) Disalicylates: Crystal and Molecular Structures of [5-Y-2-(ho)-C6H3COO]2SbMe3 (Y = H, Me, MeO) / C. Silvestru, I. Haiduc, R.T. Tiekink et al. // Appl. Organomet. Chem. - 1995. - V. 9, № 7. - P. 597-607. DOI: 10.1002/aoc.590090715
- Synthesis, Characterization and in vitro Antitumor Activity of Some Arylantimony Ferrocenecarboxylates and Crystal Structures of C5H5FeC5H4CO2SbPh4 and (C5H5FeC5H4CO2)2Sb(4-CH3C6H4)3 / R.C. Liu, Y.Q. Ma, L. Yu et al. // Appl. Organomet. Chem. - 2003. - V. 17, № 9. - P. 662-668. DOI: 10.1002/aoc.491
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Derivatives of Analogues of Demethylcantharimide / G.C. Wang, J. Xiao, L. Yu et al. // J. Organomet. Chem. - 2004. - V. 689, № 9. - P. 1631-1638. DOI: 10.1016/j.jorganchem.2004.02.015
- Mishra, J. Chemotherapy of Leishmaniasis: Past, Present and Future / J. Mishra, A. Saxena, S. Singh // Curr. Med. Chem. - 2007. - V. 14, № 10. - P. 1153-1169.
- DOI: 10.2174/092986707780362862
- Novel Triphenylantimony(V) and Triphenylbismuth(V) Complexes with Benzoic Acid Derivatives: Structural Characterization, in vitro Antileishmanial and Antibacterial Activities and Cytotoxicity against Macrophages / A. Islam, J.G. Da Silva, F.M. Berbet et al. // Molecules. - 2014. - V. 19, № 5. - P. 6009-6030.
- DOI: 10.3390/molecules19056009
- Anti-leishmanial Activity of Heteroleptic Organometallic Sb(V) Compounds / M.I. Ali, M.K. Rauf, A. Badshah et al. // Dalton Trans. - 2013. - V. 42, № 48. - P. 16733-16741.
- DOI: 10.1039/c3dt51382c
- High-Sensitivity Molecular Organometallic Resist for EUV (MORE) / J. Passarelli, M. Murphy, R.D. Re et al. // Adwances in Patterning Materials and Processes XXXII. - 2015. - V. 9425, № 94250T.
- DOI: 10.1117/12.2086599
- Cardenas-Trivino, G. Synthesis and Molecular Weights of Metal Poly(methyl methacrylates) / G. Cardenas-Trivino, C. Retamal, K.J. Klabunde // Polym. Bull. - 1991. - V. 25, № 3. - P. 315-318.
- DOI: 10.1007/BF00316900
- Cardenas-Trivino, G. Thermogravimetric Studies of Metal Poly(Methylmethacrylates) / G. Cardenas-Trivino, C. Retamal, L.H. Tagle // Thermochim. Acta. - 1991. - V. 176. - P. 233-240.
- DOI: 10.1016/0040-6031(91)80278-Q
- Naka, K. Ring-Collapsed Radical Alternating Copolymerization of Phenyl-Substituted Cyclooligostibine and Acetylenic Compounds / K. Naka, A. Nakahashi, Y. Chujo // Macromolecules. - 2006. - V. 39. № 24. - P. 8257-8262.
- DOI: 10.1021/ma061220l
- Naka, K. Periodic Terpolymerization of Cyclooligoarsine, Cyclooligostibine, and Acetylenic Compound / K. Naka, A. Nakahashi, Y. Chujo // Macromolecules. - 2007. - V. 40, № 5. - P. 1372-1376.
- DOI: 10.1021/ma0622332
- Котон, М.М. Металлоорганические соединения и радикалы / М.М. Котон. - М.: Наука, 1985. - С. 13.
- Карраер, Ч. Металлоорганические полимеры / Ч. Карраер, Дж. Шитс, Ч. Питтмен. - М.: Мир, 1981. - 352 с.
- Диакрилаты трифенилвисмута и трифенилсурьмы в синтезе металлосодержащего полиметилметакрилата / В.А. Додонов, А.В. Гущин, Ю.Л. Кузнецова, В.А Моругова // Вестник ННГУ. Серия химия. - 2004. - Вып. 1(4). - С. 86-94.
- Kensuke, N. Ring-Collapsed Radical Alternating Copolymerization of Phenyl-Substituted Cyclooligostibine and Acetylenic Compounds / N. Kensuke, N. Akiko, C. Yoshiki // Macromolecules. - 2006. - V. 39(24). - P. 8257-8262.
- DOI: 10.1021/ma061220l
- Brief Note Improved Methods for the Synthesis of Antimony Triacetate, Triphenylantimony Diacetate, and Pentaphenylantimony / T.C. Thepe, R.I. Garascia, M.A. Selvoski, A.N. Pattel // Ohio S. Sci. - 1977. - V. 77, № 3. - P. 134-135.
- Synthesis, Structure, and Spectroscopic Properties of Copper(II) Compounds Containing Nitrogen-Sulphur Donor Ligands; the Crystal and Molecular Structure of Aqua[l,7-bis(N-methylbenzimidazol-2'-yl)- 2,6-dithiaheptane]copper(II) Perchlorate / A.W. Addison, T.N. Rao, J. Reedijk et al. // J. Chem. Soc., Dalton Trans. - 1984. - № 7. - P. 1349-1356.
- DOI: 10.1039/DT9840001349
- Adams, E.A. Structure of Triphenylstibine / E.A. Adams, J.W. Kolis, W.T. Pennington // Acta Crystallogr., Sect. C: Struct. Chem. - 1990. - C46(5). P. 917-919.
- DOI: 10.1107/S0108270189012862
- Batsanov, S.S. Van der Waals Radii of Elements / S.S. Batsanov // Inorg. Mater. - 2001. - V. 37, № 9. - P. 871-885.
- Синтез и строение диакрилата трифенилсурьмы / А.В. Гущин, Л.К. Прыткова, Д.В. Шашкин и др. // Вестник ННГУ. - 2010. - Т. 3, Вып. 1. - С. 95-99.
- Oswald, I.D.H. Polymorphism and Polymerisation of Acrylic and Methacrylic Acid at High Pressure / I.D.H. Oswald, A.J. Urquhart // CrystEngComm. - 2011. - V. 13. - P. 4503-4507.
- DOI: 10.1039/c1ce05295k
- Synthesis and Structure of Triphenylantinony Dimethacrylate / A.V. Gushchin, D.V. Shashkin, L.K. Prytkova et al. // Russ. J. Gen. Chem. - 2011. - V. 81, № 3. - P. 493-396.
- DOI: 10.1134/S107036321103008X
- Синтез и строение дикротоната трифенилсурьмы / А.В. Гущин, О.С. Калистратова, Р.А. Верховых и др. // Вестник ННГУ. - 2013. - № 1(1). - С. 86-90.
- Topochemical Studies. III. The Crystal and Molecular Structures of Crotonic Acid, CH3CH= CHCOOH, and Crotonamide, CH3CH=CHCONH2 / S. Shimizu, S. Kekka, S. Kashino, M. Haisa // Bull. Chem. Soc. Jpn. - 1974. - V. 47, iss. 7. - P. 1627-1631.
- DOI: 10.1246/bcsj.47.1627
- Synthesis and Structure of Bis[(2E)-3-(2-furyl)prop-2-enoato]triphenylantimony Ph3Sb[O2CCH=CH(C4H3O)]2 / O.S. Kalistratova, P.V. Andreev, A.V. Gushchin et al. // Crystallogr. Rep. - 2016. - V. 61, № 3. - P. 391-394.
- DOI: 10.1134/S1063774516030135
- Filippakis, S.E. Topochemistry. Part XVI. The Crystal Structure of trans-β-2-Furylacrylic Acid / S.E. Filippakis, G.M.J. Schmidt // J. Chem. Soc. (B). - 1967. - P. 229-232.
- DOI: 10.1039/J29670000229
- Experimental Study of Electron Density Distribution in Crystals of Antimony(V) Dicarboxylate Complexes / G.K. Fukin, M.A. Samsonov, O.S. Kalistratova, A.V. Gushchin // Struct. Chem. - 2016. - V. 27, № 1. - P. 357-365.
- Bryan, R.F. Crystal Structures of α-Trans- and p-Methoxy-cinnamic Acids and Their Relation to Thermal Mesomorphism / R.F. Bryan, D.P. Freyberg // J. Chem. Soc., Perkin Trans. 2 - 1975. - P. 1835-1840.
- DOI: 10.1039/P29750001835
- Cинтез нового производного трифенилсурьмы с мета-нитрокоричной кислотой и исследование его строения методами ИК-, ЯМР-спектроскопии / А.В. Гущин, О.С. Калистратова, Р.А. Верховых и др. // Вестник ННГУ. - 2013. - № 2(1). - С. 69-70.
- 3-Nitrocinnamic Acid / K.U. Lakshmi, S. Thamotharan, M. Srinivasan et al. // Acta Crystallographica. Section E. - 2005. - E. 61. - P. 3636-3638.
- DOI: 10.1107/S1600536805031879
- Bis[(E)-3-(4-methoxyphenyl)prop-2-enoato]triphenylantimony(V) Benzene Monosolvate / P.V. Andreev, N.V. Somov, O.S. Kalistratova et al. // Acta Crystallogr., Sect. E: Crystallogr. Commun. - 2013. - V. 69, № 3. - m167.
- DOI: 10.1107/S1600536813004674
- Cox, P.J. Sorbic Acid / P.J. Cox // Acta Crystallogr., Sect. C: Struct. Chem. - 1994. - C50. - P. 1620-1622.
- DOI: 10.1107/S0108270194002891
- Suzuki, H. Organobismuth Chemistry / H. Suzuki, Y. Matano // Amsterdam, Elsever, 2001. - 619 p.
- Розенберг, А.С. Формирование наноразмерных частиц при твердофазных термических превращениях карбоксилатов металлов / А.С. Розенберг, Г.И. Джардималиева, А.Д. Помогайло // Докл. Акад. наук. - 1997. - Т. 356, № 1. - С. 66-69.
- Preparation and Reactivity of Metal-Containing Monomers. 21. Spontaneous Polymerization of Acrylamide Coordinated to Metal Nitrates / V.S. Savost'yanov, V.N. Vasilets, O.V. Ermakov et al. // Russ. Chem. Bull. - 1992. - V. 41, iss. 9. - P. 1615-1620.
- Исследование термической полимеризации акрилатов кобальта (II) и никеля (II) методом диэлектрической спектроскопии / Г.Ф. Новиков, И.А. Чернов, Г.И. Джардималиева, А.Д. Помогайло // Конденсированные среды и межфазные границы. - 2005. - Т. 7, № 3. - С. 239-248.
- Hirschfeld, F.L. Topochemical Control of Solid-State Polymerization / F.L. Hirschfeld, G.M.J. Schmidt // J. Polymer Sci. - 1964. - V. 2, Iss. 5. - P. 2181-2190.
- DOI: 10.1002/pol.1964.100020513
- Shklover, V.E. Structural Aspects of Solid-phase Polymerisation / V.E. Shklover, N.G. Bokii, Y.T. Struchkov // Russ. Chem. Rev. - 1977. - V. 46, Iss. 8. - P. 706-721.
- DOI: 10.1070/RC1977v046n08ABEH002167
- Janiak, C. A Critical Account on π-π Stacking in Metal Complexes with Aromatic Nitrogen-Containing Ligands / C. Janiak // J. Chem. Soc., Dalton Trans. - 2000. - № 21. - P. 3885-3896.
- DOI: 10.1039/b003010o
- Experimental and Theoretical Distribution of Electron Density and Thermopolimerization in Crystals of Ph3Sb(O2CCH=CH2)2 Complex / G.K. Fukin, M.A. Samsonov, A.V. Arapova et al. // J. Solid State Chem. - 2017. - V. 254. - P. 32-39.
- DOI: 10.1016/j.jssc.2017.06.030
- Калориметрическое изучение диакрилата и диметакрилата трифенилсурьмы / И.А. Летянина, А.В. Маркин, Н.Н. Смирнова, А.В. Гущин // Вестник ННГУ. Серия химия. - 2012. - № 3(1). - С. 105-110.
- Calorimetric Study of Organic Compounds of Antimony and Bismuth Ph3Sb(O2CCH=CHCH3)2 and Ph3Bi(O2CCH=CHCH3)2 / I.A. Letyanina, A.V. Markin, N.N. Smirnova et al. // J. Therm. Anal. Calorim. - 2016. - V. 125, iss. 1. - P. 339-349.
- DOI: 10.1007/s10973-016-5401-2
- Molecular and Crystalline Structure of Pyrocatechol and Hydroquinone Dimethacrylates and Their Reactivity in Melts / S.A. Chesnokov, G.K. Fukin, Yu.V. Chechet et al. // Polym. Sci., Part A. - 2006. - V. 48, № 6. - P. 606-611.
- DOI: 10.1134/S0965545X06060083

![Синтез и исследование строения органических соединений сурьмы(V) с непредельными карбоновыми кислотами Ph3Sb[OC(O)R]2 Синтез и исследование строения органических соединений сурьмы(V) с непредельными карбоновыми кислотами Ph3Sb[OC(O)R]2](/file/cover/147233137/sintez-i-issledovanie-stroenija-organicheskih-soedinenij-surmy-v-s-nepredelnymi.png)
