Синтез и исследование структуры иодсодержащих имидазо[2,1-b][1,3]тиазиниевых систем
Автор: Ильиных Е.С., Шарутин В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
Впервые исследована гетероциклизация S-алкенильных производных 1-метил-имидазол-2-тиола (1-метил-2-пренилсульфанилимидазола (1), 1-метил-2-циннамилсульфанилимидазола (4) и 2-(3-бутенил)сульфанил-1-метилимидазола (7)) под действием йода (иодциклизация) в различных растворителях (хлороформ, дихлорметан, ледяная уксусная кислота) и при варьировании соотношения субстратата и йода (1 : 1, 1 : 2). Установлено, что независимо от условий реакций взаимодействие с йодом соединений 1, 4 и 7 протекает региоселективно, сопровождается линеарным аннелированием тиазиниевого цикла и образованием бициклической конденсированной гетероциклической системы. В результате синтезированы новые иодсодержащие имидазо[2,1- b ][1,3]тиазиниевые системы - полииодид/иодид 6-иод-1,5,5-триметил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния (2, 3), трииодид/иодид 6-иод-1-метил-5-фенил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния (5, 6) и иодид 6-иодметил-1-метил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния (9). Строение синтезированных соединений исследовано и доказано методами спектроскопии ЯМР 1Н и 13С. Доказательством протекания реакций гетероциклизации алкенилсульфидов 1, 4 и 7 является отсутствие в спектрах ЯМР 1Н продуктов гетероциклизации сигналов протонов алкенильных фрагментов и наличие более сложной картины расщепления сигналов протонов тиазиниевого цикла. Методом РСА однозначно установлены и охарактеризованы структуры полииодида 2 и трииодида 5. Согласно данным РСА, в ячейке полииодида 2 содержатся два гетероциклических катиона, трииодид-анион и иодид-анион. В кристалле трииодида 5 гетероциклическим катионам соответствуют два типа кристаллографически независимых трииодид-анионов: в одной ячейке содержатся восемь молекул гетероциклического катиона и восемь трииодид-анионов. Структурная организация кристаллов формируется посредством коротких контактов между атомами: I(4)∙∙∙H(3) (2,95 Å), I(4)∙∙∙I(1) (3,57 Å), H(8a)∙∙∙I(2) (3,13 Å) (в кристалле полииодида 2), I(2)∙∙∙I(4) (3,95 Å), I(5)∙∙∙H(5) (3,14 Å), I(4)∙∙∙H(7a) (3,12 Å), I(4)∙∙∙H(7b) (3,17 Å) (в кристалле трииодида 5). Ключевые слова: 1-метил-2-пренилсульфанилимидазол, 1-метил-2-циннамилсульфанилими-дазол, 2-(3-бутенил)сульфанил-1-метилимидазол, гетероциклизация, иодциклизация, иодсодержащие имидазо[2,1- b ][1,3]тиазиниевые системы, спектроскопия ЯМР 1Н и 13С, «эффект тяжелого атома», рентгеноструктурный анализ
1-метил-2-пренилсульфанилимидазол, 1-метил-2-циннамилсульфанилими-дазол, 2-(3-бутенил)сульфанил-1-метилимидазол, гетероциклизация, иодциклизация, иодсодержащие имидазо[2, 1-b][1, 3]тиазиниевые системы, спектроскопия ямр 1н и 13с,
Короткий адрес: https://sciup.org/147243263
IDR: 147243263 | УДК: 547.781 | DOI: 10.14529/chem240108
Текст научной статьи Синтез и исследование структуры иодсодержащих имидазо[2,1-b][1,3]тиазиниевых систем
Имидазолы и их производные представляют определенный научный интерес в связи с широким спектром их фармакологической активности [1–5]. Известно также об их использовании в качестве агрохимикатов, красителей, фотохимических веществ, ингибиторов коррозии, эпоксидных отвердителей и пластических модификаторов [6].
Различные S-непредельные производные азол- и азинтиолов служат удобным синтоном для их дальнейшей функционализации и синтеза конденсированных гетероциклических систем на их основе. В обзоре [7] обобщены данные по электрофильной гетероциклизации ненасыщенных серо- и фосфорсодержащих соединений. Ранее нами исследована электрофильная гетероциклизация ряда S-непредельных производных 1,2,4-триазол-3-тиолов [8, 9] и бензимидазол-2-тиола [10] под действием галогенов и показано, что региоселективность реакций зависит от структуры исходного субстрата и условий реакций: при образовании конденсированных гетероциклических систем возможно замыкание как пятичленного (тиазолиевого), так и шестичленного (тиазиниевого) циклов.
Введение в структуру производных азолов и других гетероциклических соединений атомов галогенов является перспективным направлением их модификации. Широкий спектр действия и высокий терапевтический эффект иодсодержащих лекарственных препаратов, а также применение препаратов на основе молекулярного иода в качестве антисептиков определяют актуальность физико-химических исследований органических соединений иода и прогнозирования их фармакологического и бактерицидного действия [11].
Статья [12] посвящена исследованию нуклеофильной циклизации 2-пропаргилсульфанил-бензимидазолов, стимулируемой йодом, N-бром/иодсукцинимидом и другими электрофилами. Однако в литературе отсутствуют данные о гетероциклизации 2-алкенилсульфанил-1-метил-имидазолов под действием галогенов. Целью данной работы является разработка методов синтеза и исследование строения ранее неизвестных иодсодержащих имидазо[2,1- b ][1,3]тиазиниевых систем.
Экспериментальная часть
Синтез исходных 2-алкенилсульфанил-1-метилимидазолов ( 1 , 4 , 7 ) описан в работе [13].
Синтез полииодида 6-иод-1,5,5-триметил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 2 ) ( методы (А) и (В) ). К раствору 1,016 г (4 ммоль) йода в 5 мл CH 2 Cl 2 ( метод (А) ) или лед. AcOH ( метод (В) ) добавляли раствор 0,364 г (2 ммоль) 1-метил-2-пренилсульфанилимидазола 1 в 5 мл CH 2 Cl 2 ( метод (А) ) или лед. AcOH ( метод (В) ). Через 4 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образования осадка иодида не наблюдали, поэтому к реакционной смеси приливали избыток воды. Выпавший кристаллический осадок отфильтровывали и сушили. Получали трииодид 2 в виде темно-коричневых кристаллов ромбовидной формы, выход 0,066 г (5 %) ( метод (А) ), 0,106 г (8 %) ( метод (В) ), т. пл. 185 °С. Спектр ЯМР 1 Н, δ , м. д. ( J , Гц): 1,69 (3Н, с, 5-СH 3 ); 1,76 (3Н, с, 5-СH 3 ); 3,68 (3Н, с, 1-СН 3 ); 3,83 (1Н, дд, 2J = 14,0, 3J = 6,5, –SС H А H B –); 4,08 (1Н, дд, 2J = 14,0, 3J = 3,0, –SСH А H B –); 5,22 (1Н, м, –СНI–); 7,79 (1Н, д, 3J = 2,2, Н-2); 7,98 (1Н, д, 3J = 2,2, Н-3). Спектр ЯМР 13 С, δ , м. д.: 26,42 (5-СH 3 ); 28,91 (5-СH 3 ); 30,51 (С-6); 33,10 (C-7); 34,43 (1-СH 3 ); 61,41 (C-5); 119,93 (C-2); 123,33 (C-3); 139,95 (C-8a).
Синтез иодида 6-иод-1,5,5-триметил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 3 ) ( метод (С) ). К раствору 0,508 г (2 ммоль) йода в 5 мл лед. AcOH добавляли раствор 0,364 г (2 ммоль) 1-метил-2-пренилсульфанилимидазола 1 в 5 мл лед. AcOH. Через 4 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образовавшийся осадок отфильтровывали, промывали ацетоном и сушили. Получали иодид 3 в виде коричневого порошка, выход 0,131 г (15 %), т. пл. 167 °С. Данные ЯМР 1 Н и 13 С иодида 3 идентичны соответствующим данным ЯМР полииодида 2 .
Синтез трииодида 6-иод-1-метил-5-фенил - 6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 5 ) ( метод (А) ). К раствору 1,016 г (4 ммоль) йода в 5 мл CHCl 3 добавляли раствор 0,460 г (2 ммоль) 1-метил-2-циннамилсульфанилимидазола 4 в 5 мл CHCl3. Через 4 суток получали трииодид 5 в виде темно-коричневых кристаллов, которые отфильтровывали, промывали хлороформом и сушили. Выход 0,513 г (35 %), т. пл. 140 °С. Данные ЯМР 1 Н и 13 С трииодида 5 идентичны соответствующим данным ЯМР иодида 6 .
Синтез иодида 6-иод-1-метил-5-фенил - 6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 6 ) ( методы (B) и (C) ). К раствору 1,016 г (4 ммоль) йода в 5 мл CH 2 Cl 2 ( метод (В) ) или лед. AcOH ( метод (С) ) добавляли раствор 0,460 г (2 ммоль) 1-метил-2-циннамилсульфанилимидазола 4 в 5 мл CH 2 Cl 2 ( метод (В) ) или лед. AcOH ( метод (С) ). Через 4 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образовавшийся осадок отфильтровывали, промывали ацетоном и сушили. Получали иодид 6 в виде жёлтого порошка, выход 0,242 г (25 %), т. пл. 130 °С. Спектр ЯМР 1 Н, δ , м. д. ( J , Гц): 3,43 (1Н, дд, 2J = 13,8, 3J = 2,7, –SС H А H B –); 3,72 (1Н, дд, 2J = 13,8, 3J = 6,5, –SСH А H B –); 3,76 (3Н, с, 1-СН 3 ); 5,30 (1Н, м, –СНI–); 6,07 (1Н, д, 3J = 5,2, –СН(Ph)–); 7,26–7,28 (2Н, м, H Ar ); 7,45–7,47 (4Н, м, H Ar , Н-2); 7,78 (1Н, д, 3J = 2,2, Н-3). Спектр ЯМР 13 С, δ , м. д.: 20,60 (С-6); 31,93 (C-7); 34,52 (1-СH 3 ); 66,50 (C-5); 122,79 (C-2); 123,71 (C-3); 126,83 (С Ar -2, С Ar -6); 129,17 (С Ar -3, С Ar -4, С Ar -5); 136,98 (С Ar -1); 140,74 (C-8a).
Синтез иодида 6-иодметил-1-метил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 9 ) ( методы (А), (B), (С) и (D) ). К раствору 1,016 г (4 ммоль) йода в 5 мл CHCl 3 ( метод (А) ), CH 2 Cl 2 ( метод (В) ) или к раствору 0,508 г (2 ммоль) йода в 5 мл CH 2 Cl 2 ( метод (С) ), лед. AcOH ( метод (D) ) добавляли раствор 0,336 г (2 ммоль) 2-(3-бутенил)сульфанилимидазола 7 в 5 мл CHCl 3 ( метод (А) ), CH 2 Cl 2 ( методы (В) и (С) ) или лед. AcOH ( метод (D) ). Через 4 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образовавшийся осадок отфильтровывали, промывали ацетоном и сушили. Получали иодид 9 в виде жёлтого порошка, выход 0,540 г (64 %) ( метод (А) ), 0,490 г (58 %) ( метод (В) ), 0,219 г (26 %) ( метод (С) ), 0,093 г (11 %) ( метод (D) ), т. пл. 192 °С. Спектр ЯМР 1 Н, δ , м. д. ( J , Гц): 2,33 (1Н, м, –CH 2 –); 2,48 (1Н, м, –CH 2 –); 3,52 (2Н, м, –CH 2 I); 3,67 (3Н, с, 1-СН 3 ); 3,81 (1Н, дд, 2J = 11,0, 3J = 3,4, –SС H А H B –); 3,90 (1Н, дд, 2J = 11,0, 3J = 6,3, –SСH А H B –); 4,49 (1Н, м, –N + СН–); 7,77 (1Н, д, 3J = 2,1, Н-2); 7,95 (1Н, д, 3J = 2,1, Н-3). Спектр ЯМР 13 С, δ , м. д.: 8,67 (–CH 2 I); 22,75 (C-6); 27,46 (C-7); 34,26 (1-СH 3 ); 54,94 (C-5); 121,63 (C-2); 122,85 (C-3); 141,46 (C-8a).
Температуры плавления установлены на аппарате для определения температуры плавления «ПТП ТУ-25-11-1144-76» и не корректировались.
Спектры ЯМР 1H, 13C записаны на приборе Bruker DRX-400 в ДМСО- d 6 , внутренний стандарт ‒ ТМС.
Рентгеноструктурный анализ (РСА) кристаллов соединений 2 и 5 проводили на дифрактометре Bruker D8 Quest (Mo Kα-излучение, λ 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [14]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [15] и OLEX2 [16]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в таблице. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ ССDС 2051648 для соединения 2, № ССDC 2076851 для соединения 5; ; .
Таблица
Кристаллографические данные, параметры эксперимента и уточнения структур 2 и 5
|
Параметр |
2 |
5 |
|
Формула |
C 9 H 14 I 3 N 2 S |
C 13 H 14 I 4 N 2 S |
|
М |
562,98 |
737,92 |
|
Сингония |
Триклинная |
Моноклинная |
|
Пр. группа |
P -1 |
C 2/ c |
|
a , Å |
7,028(9) |
17,675(13) |
|
b , Å |
8,970(9) |
8,306(5) |
|
c , Å |
13,179(16) |
26,99(3) |
|
α, град. |
82,69(6) |
90 |
|
β, град. |
76,85(7) |
92,66(4) |
|
γ, град. |
72,07(4) |
90 |
|
V , Å3 |
768,2(16) |
3959(6) |
|
Z |
2 |
8 |
|
ρ (выч.), г/см3 |
2,434 |
2,476 |
|
μ, мм–1 |
6,215 |
6,396 |
|
F (000) |
514,0 |
2672,0 |
|
Размер кристалла, мм |
0,46 × 0,31 × 0,1 |
0,65 × 0,5 × 0,46 |
|
Область сбора данных по 2Θ, град. |
5,906–56,928 |
5,598–56,994 |
|
Интервалы индексов отражений |
–9 ≤ h ≤ 9, –11 ≤ k ≤ 11, –17 ≤ l ≤ 17 |
–23 ≤ h ≤ 23, –11 ≤ k ≤ 11, –36 ≤ l ≤ 36 |
|
Измерено отражений |
22073 |
45322 |
|
Независимых отражений |
3848 ( R int = 0,0273) |
5009 ( R int = 0,0833) |
|
Переменных уточнения |
151 |
185 |
|
GOOF |
1,027 |
1,031 |
|
R -факторы по I>=2σ(I) |
R 1 = 0,0426, wR 2 = 0,0891 |
R 1 = 0,0807, wR 2 = 0,1748 |
|
R -факторы по всем отражениям |
R 1 = 0,0533, wR 2 = 0,0957 |
R 1 = 0,1000, wR 2 = 0,1842 |
|
Остаточная электронная плотность (max/min), e/Å3 |
0,52/–0,56 |
2,68/–2,06 |
Обсуждение результатов
В настоящей работе с целью синтеза новых представителей имидазо[2,1- b ][1,3]тиазиниевых систем впервые исследована электрофильная гетероциклизация 1-метил-2-пренилсульфанил-имидазола, 1-метил-2-циннамилсульфанилимидазола и 2-(3-бутенил)сульфанил-1-метилимидазола под действием йода в различных растворителях и при разном соотношении субстрата и йода. Синтез и исследование структуры указанных S-алкенильных производных 1-метилимидазол-2-тиола осуществлены нами ранее и описаны в работе [13].
Следует отметить, что электрофильная гетероциклизация с участием 1-метилимидазол-2-тиола и его S-алкенильных и алкинильных производных может протекать с высокой степенью региоселективности с образованием конденсированных гетероциклических систем исключительно линеарного строения вследствие наличия в структуре только одного нуклеофильного центра (свободного атома азота N-3).
В литературе рассматриваются три возможных механизма электрофильной гетероциклизации под действием галогенов (галогенциклизации) [17–21]: механизм «присоединение – циклизация», синхронный механизм и галогенониевый механизм.
Авторы работ [20, 21], основываясь на электрофильном механизме присоединения галогенов к алкенам, сделали вывод, что галогенциклизация протекает через промежуточное образование гетероциклического интермедиата – галогенониевого иона (галогенониевый механизм) (схема 1).
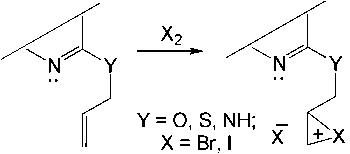
Схема 1. Галогенониевый механизм галогенциклизации
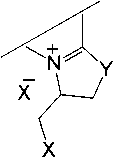
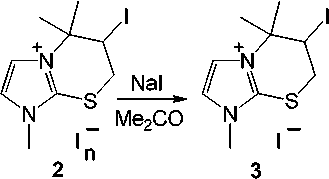
Реакции иодирования 1-метил-2-пренилсульфанилимидазола ( 1 ) исследованы нами в CH2Cl2 и в лед. AcOH при варьировании соотношения реагирующих компонетов. Установлено, что взаимодействие соединения 1 с двукратным избытком йода в CH 2 Cl 2 ( метод (А) ), а также иодирование в лед. AcOH при соотношении субстрат : йод, равном 1 : 2 ( метод (В) ) и 1 : 1 ( метод (С) ), сопровождается гетероциклизацией искомого пренилсульфида и образованием индивидуального продукта гетероциклизации, полииодида 6-иод-1,5,5-триметил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 2 ).
В результате реакций, проведенных по методам (А) и (В) , полииодид 2 был выделен в виде темно-коричневых кристаллов ромбовидной формы. Полученный в методе (С) полииодид 2 представляет собой темно-фиолетовое масло, действием на которое NaI в ацетоне был выделен иодид 6-иод-1,5,5-триметил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 3 ) в виде коричневого порошка с выходом 15 % (схема 2).
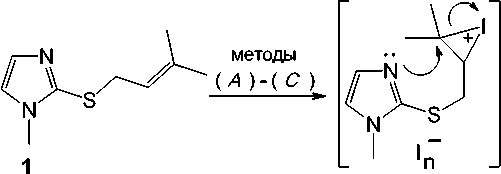
/ д\ О| р|_| р| on ос Op- /о\ oi ПАЛ Д^ГМ-1 ЭЛ OR ОГ'- (Г'Х | ПАЛ ДпГ^Ы ЭЛ OR °C ^/1 ^'2 '~/1|2^12 ^U-^0 w, \о) ^^2 / 'СчЛ|, ^U—^Э w, ^tv^ I2 ^гЦ- rACLJii, ^U~^O I/
Схема 2. Иодциклизация 1-метил-2-пренилсульфанилимидазола (1)
Строение полииодида 2 (в виде кристаллов) и иодида 3 исследовано и доказано методами ЯМР 1 Н и 13 С спектроскопии. Спектры ЯМР 1 Н и 13 С полииодида 2 идентичны соответствующим спектрам иодида 3 .
Доказательством протекания реакции гетероциклизации пренилсульфида 1 является отсутствие в спектрах ЯМР 1 Н полииодида 2 и иодида 3 сигналов протонов пренильного фрагмента и наличие более сложной картины расщепления сигналов протонов тиазиниевого цикла.
Кроме того, наблюдается смещение сигналов гетероароматических протонов Н-2 и Н-3 имидазольного цикла в спектрах продуктов иодциклизации в более слабое поле на δ 0,82 м. д. по сравнению с соответствующими сигналами протонов в спектре исходного соединения 1 , что обусловлено образованием заряженной конденсированной гетероциклической системы.
В спектрах ЯМР 13 С полииодида 2 и иодида 3 в сильном поле присутствуют сигналы атомов углерода двух 5-CH 3 -групп при δ 26,42 и 28,91 м. д. Самый слабопольный сигнал ( δ 139,95 м. д.) соответствует узловому атому углерода С-8a, связанному с электроотрицательными атомом серы и двумя атомами азота (N-1, N-4). Несмотря на выраженную электроотрицательность атома йода, сигнал атома углерода С-6, непосредственно связанного с йодом, расположен в области сильного поля ( δ 30,56 м. д.), что обусловлено «эффектом тяжелого атома» [22]. Данный эффект встречается в спектрах ЯМР 13 С различных галогенпроизводных ароматических и гетероароматических соединений [23–27].
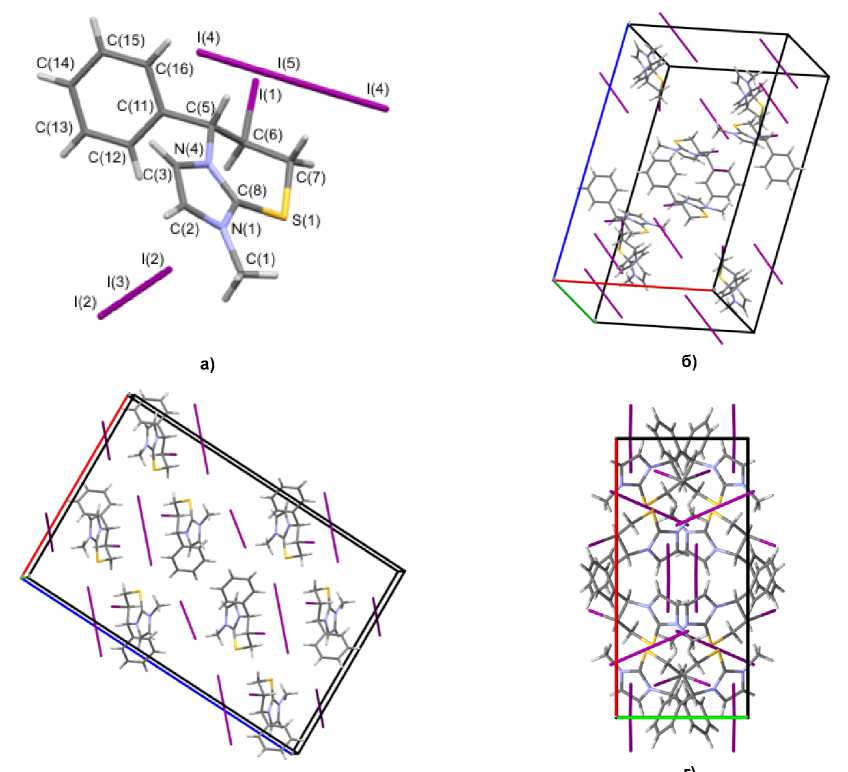
Методом РСА однозначно установлена и охарактеризована структура полииодида 2 (рис. 1), выделенного в кристаллическом виде. Согласно данным РСА, в ячейке полииодида 2 содержатся два гетероциклических катиона, трииодид-анион и иодид-анион.
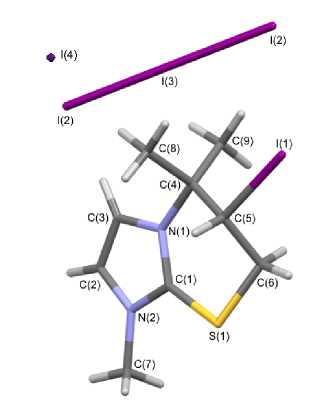
а)
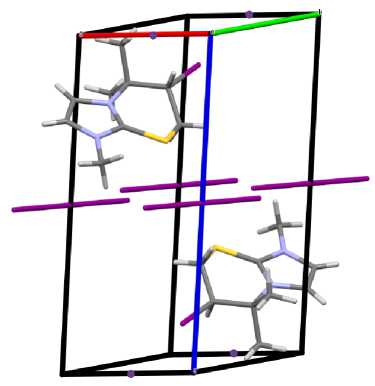
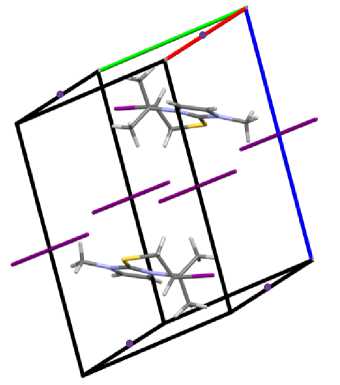
в)
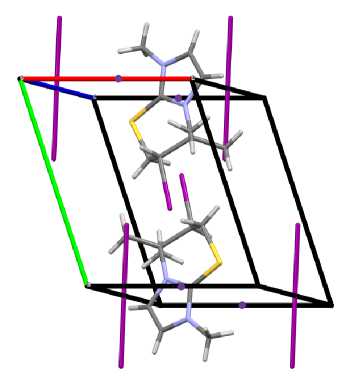
Рис. 1. Общий вид молекулы (а) и упаковка кристалла полииодида 6-иод-1,5,5-триметил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния (2): проекция вдоль оси a (б), оси b (в), оси c (г)
Атомы С(4), N(1), C(1) и S(1) тиазиниевого цикла располагаются практически в одной плоскости, которую образуют атомы имидазолиевого цикла. Плоскость, в которой находятся атомы углерода С(8) и С(9) двух метильных групп, образует угол 120,8(7)º с плоскостью гетероцикла и атомом С(4) тиазиниевого цикла. Выход атомов углерода С(5) и С(6) тиазиниевого цикла из плоскости составляет 2,250 и 1,487 Å, соответственно. Трииодид-анионы образуют монослои между гетероциклическими катионами, а иодид-анионы располагаются на гранях кристаллической ячейки. При этом структурная организация кристалла формируется посредством коротких контактов между атомами: I(4)∙∙∙H(3) (2,95 Å), I(4)∙∙∙I(1) (3,57 Å) и H(8a)∙∙∙I(2) (3,13 Å). Кристаллографические данные, параметры эксперимента и уточнения структуры полииодида 2 представлены в таблице.
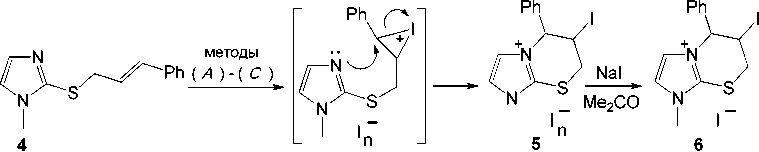
Иодирование 1-метил-2-циннамилсульфанилимидазола ( 4 ) двукратным избытком йода исследовано нами в различных растворителях – CHCl 3 ( метод (А) ), CH 2 Cl 2 ( метод (В) ), лед. AcOH ( метод (С) ). Установлено, что взаимодействие циннамилсульфида 4 с йодом в указанных условиях, аналогично гетероциклизации соединения 1 под действием йода, протекает по пути анне-лирования тиазиниевого цикла и приводит к образованию индивидуального продукта иодцик-лизации, полииодида 6-иод-1-метил-5-фенил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 5 ).
При проведении реакции в CHCl3 ( метод (А) ) полииодид 5 был выделен в виде темнокоричневых кристаллов, пригодных для РСА. Полученный в методах (В) и (С) полииодид 5 представляет собой темно-фиолетовое масло, действием на которое NaI в ацетоне был выделен иодид 6-иод-1-метил-5-фенил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 6 ) в виде порошка желтого цвета с выходом 25 % (схема 3).
/д\ ni СЫС1 ОГ\ OR ОС- fD\ 91 CH Cl ОГ\ OR 0C- ZC\ 91 ПРЛ A^CI-I 9Л OR ОС Zl2, LrilLrlg ZU-ZO Lr, \D) Zl2, С'П2^125 ZU-ZO Lr, yUy Zl2, J lc'u'- ACLJn, ZU-ZO Lr
Схема 3. Иодциклизация 1-метил-2-циннамилсульфанилимидазола (4)
Строение полииодида 5 (в виде кристаллов) и иодида 6 исследовано и доказано методами ЯМР 1 Н и 13 С спектроскопии. Спектры ЯМР 1 Н и 13 С полииодида 5 идентичны соответствующим спектрам иодида 6 .
Наличие более сложной картины расщепления сигналов протонов в спектрах ЯМР 1 Н полииодида 5 и иодида 6 и отсутствие сигналов протонов циннамильного фрагмента является доказательством протекания реакции гетероциклизации циннамилсульфида 4 . В частности, сигналы протонов –SСH 2 – тиазиниевого цикла расщепляются на два дублета дублетов при δ 3,43 и 3,72 м. д., тогда как сигнал протонов –SCH 2 – исходного соединения 4 представляет собой дублет.
Кроме того, наблюдается смещение сигналов гетероароматических протонов Н-2 и Н-3 имидазольного цикла в спектрах продуктов иодциклизации в более слабое поле на δ 0,64 м. д. по сравнению с соответствующими сигналами протонов в спектре исходного соединения 4 , что обусловлено образованием заряженной конденсированной гетероциклической системы.
В спектрах ЯМР 13 С полииодида 5 и иодида 6 , как и в случае иодсодержащих имидазотиази-ниевых систем 2 и 3 , также наблюдается «эффект тяжелого атома»: сигнал атома углерода С-6, связанного с йодом, резонирует в области сильного поля ( δ 20,60 м. д.). Самый слабопольный сигнал при δ 140,74 м. д. соответствует узловому атому углерода С-8a, связанному с электроотрицательными атомом серы и двумя атомами азота (N-1, N-4). Слабопольные сигналы закономерно дают атомы углерода фенильного фрагмента и гетероароматические атомы углерода С-2 и С-3.
Методом РСА однозначно установлена и охарактеризована структура полииодида 5 (рис. 2), выделенного в кристаллическом виде. Согласно данным РСА, в кристалле полииодида 5 гетероциклическим катионам соответствуют два типа кристаллографически независимых трииодид-анионов: в одной ячейке содержатся восемь молекул гетероциклического катиона и восемь трии-одид-анионов.
Атомы С(5), N(4), C(8) и S(1) тиазиниевого цикла располагаются практически в одной плоскости, которую образуют атомы имидазолиевого цикла. Плоскость, в которой расположено кольцо фенильного заместителя, ангулярна плоскости гетероцикла и атома С(5) и образует относительно нее угол 140º. Выход атомов углерода С(6) и С(7) тиазиниевого цикла из плоскости составляет 2,176 и 1,756 Å соответственно. Структурная организация кристалла формируется посредством коротких контактов между атомами: I(2)∙∙∙I(4) (3,95 Å), I(5)∙∙∙H(5) (3,14 Å), I(4)∙∙∙H(7a) (3,12 Å), I(4)∙∙∙H(7b) (3,17 Å). Кристаллографические данные, параметры эксперимента и уточнения структуры трииодида 5 представлены в таблице.
в)
Рис. 2. Общий вид молекулы (а) и упаковка кристалла трииодида 6-иод-1-метил-5-фенил-6,7-дигидро-5 Н -имидазо[2,1- b ][1,3]тиазиния (5): проекция вдоль оси a (б), оси b (в), оси c (г)
Реакции иодирования 2-(3 - бутенил)сульфанил-1-метилимидазола ( 7 ) исследованы нами в различных растворителях п ри варьировании соотношения реагирующих ком пон е н тов . У становлено, что взаимодействие соед и н е н и я 7 с двукратным избытком йода в CHCl3 ( метод (А) ) и в CH 2 Cl 2 ( метод (В) ), а также и оди рование при соотношении субстрат : йод, равном 1 : 1, в CH 2 Cl 2 ( метод (С) ) и в лед. AcOH ( метод (D) ) сопровождается гетероциклизацией искомого бутенил-сульфида и образ ов а н и ем и н д и в и д у а льн ого продукта, иодида 5-иодметил-1-метил-6,7-дигидро-5 Н -имидазо[2,1- b ][ 1, 3] тиа зи н и я (9 ) (схема 4). Иодид 9 в виде жёлтого порошка выделен с выхо да ми от 1 1 д о 64 % д е й с т в и е м и о дида натрия в ацетоне на первоначально обр а зующ и й с я п оли и одид 5-иодметил-1-метил-6,7- ди ги д ро-5 Н -имидазо[2,1- b ][1,3]тиазиния ( 8 ), представляющий собой масло темно-коричневого цвета.
ме т оды
( А )-( D )
S ^^^^^™
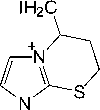
NaI
Me 2 CO
^^^^^™
I n
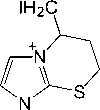
( A )2I 2, CHCl 3, 20-25 oC; ( B ) 2 I 2, CH 2 Cl 2, 20-25 oC; ( C ) I 2, CH 2 Cl 2, 20-25 oC; ( D ) I 2, лед. AcOH, 20-25 oC
Схема 4. Иодциклизация 2-(3-бутенил)сульфанил-1-метилимидазола (7)
Строение иодида 9 исследовано и доказано методами ЯМР 1 Н и 13 С спектроскопии. Доказательством протекания реакции гетероциклизации является отсутствие в спектре ЯМР 1 Н иодида 9 сигналов протонов бутенильного фрагмента и наличие более сложной картины расщепления сигналов. В частности, протоны –SСH2– тиазиниевого цикла расщепляются на два дублета дублетов при δ 3,81 и 3,90 м. д. в отличие от триплета (δ 3,12 м. д.) протонов –SCH 2 – в спектре исходного соединения 7 . Спиновая система протонов –CH2I является более сжатой, чем спиновая система протонов –SCH2–, однако у обеих систем наблюдается выраженный «эффект крыши»: интенсивности центральных линий в составе мультиплетов больше, чем интенсивности крайних линий.
Кроме того, образование заряженной конденсированной гетероциклической системы приводит к дезэкранированию протонов имидазольного цикла продукта иодциклизации 9 и к смещению их сигналов в более слабое поле на δ 0,84 м. д. по сравнению с соответствующими сигналами протонов в спектре исходного соединения 7 .
Результат спин-орбитального взаимодействия («эффект тяжелого атома») приводит к регистрации сигнала атома углерода фрагмента –CH 2 I в спектре ЯМР 13 С иодида 9 в сильном поле ( δ 8,67 м. д.). Самый слабопольный сигнал при δ 141,46 м. д. соответствует узловому атому углерода С-8a, связанному с электроотрицательными атомом серы и двумя атомами азота (N-1, N-4).
Заключение
Установлено, что гетероциклизация 1-метил-2-пренилсульфанилимидазола, 1-метил-2-цин-намилсульфанилимидазола и 2-(3-бутенил)сульфанил-1-метилимидазола под действием йода (иодциклизация) протекает региоселективно с аннелированием исключительно тиазиниевого цикла независимо от условий реакции (соотношение реагентов, растворитель). Строение синтезированных иодсодержащих имидазо[2,1- b ][1,3]тиазиниевых систем подробно исследовано и доказано методами спектроскопии ЯМР ¹Н и ¹³С, выявлены общие закономерности и специфические особенности спектров полученных соединений. Структуры двух продуктов иодциклизации установлены и охарактеризованы методом РСА.
Список литературы Синтез и исследование структуры иодсодержащих имидазо[2,1-b][1,3]тиазиниевых систем
- Tonacchera M., Chiovato L., Bartalena L. et al. // J. Endocrinol. Invest. 2020. V. 43. P. 257. DOI: 10.1007/s40618-019-01148-w.
- Zhao X., He Y, Wang Y. et al. // Food Chem. 2020. V. 309. '25787. DOI: 10.1016/j.foodchem.2019.125787.
- Giuliani C., Bucci I., Napolitano G. // Med. Hypotheses. 202L V. M6. П0473. DOI: 10.1016/j.mehy.2020.110473.
- Iwamura H., Kondo K., Kikuta S. et al. // Cell Tissue Res. 20'9. V. 378. P. П5. DOI: 10.1007/s00441-019-03047-1.
- Methimazole derivatives and tautomeric cyclic thiones to inhibitor cell adhesion: pat. WO 2005/0948^ A' Canada; appl. '6.03.2004; publ. ВЛ0.2005. 98 p.
- Xavier R.J., Dinesh P. // Spectrochim. Acta, Part A. 20M. V. П8. P. 999. DOI: '0.'0'6/j.saa.20'3.09.'20.
- Gevaza Yu.I., Staninets V.I. // Chem. Heterocycl. Compd. '986. V. 22, No. 3. P. 23L DOI: 10.1007/BF00514985.
- Il'inykh E.S., Kim D.G. // Chem. Heterocycl. Compd. 20П. V. 47, No. 5. P. 636. DOI: ШЛ007Ы0593-0П-0809-х.
- Il'inykh E.S., Kim D.G., Kodess M.I. et al. // J. Fluorine Chem. 20B. V. M9. P. 24. DOI: 10.1016/j.jfluchem.2013.01.025.
- Il'inykh E.S., Kim D.G. // Bull. S. Ural State University, Ser. Chemistry. 20И. V. 7, No. 3. P. EDN: UATWBR.
- Chernov'yants M.S., Burykin I.V. // Russ. Chem. Bull. 2009. V. 58, No. 9. P. П72. DOI: ШЛ007ЫП72-009-0243-8.
- ShakerR.M. // ARKIVOC. 2006. No. (ix). P. 59-П2. DOI: '0.3998/ark.5550'90.0007.904.
- Ильиных Е.С., Игнатьева И.Ю. // Вестник ЮУрГУ. Сер. Химия. 2023. Т. И, № 3. С. Ш. DOI: '0.'4529/chem230307.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42, No. 2. P. 339. DOI: 10.1107/S0021889808042726.
- Геваза Ю.И., Станинец В.И., Зефиров Н.С. Электрофильная внутримолекулярная циклизация олефинов. Киев: Наукова думка, 1990. 156 с.
- Staninets V.I., Shilov E.A. // Russ. Chem. Rev. 1971. V. 40, No. 3. P. 272. DOI: 10.1070/RC 1971v040n03ABEH001918.
- Rodinovskaya L.A., Sharanin Yu.A., Shestopalov A.M. et al. // Chem. Heterocycl. Compd. 1988. V. 24, No. 6. P. 658. DOI: 10.1007/BF00475603.
- Undheim K. // Heterocycles. 1981. V. 15, No. 2. P. 1349. DOI: 10.3987/S-1981-02-1349.
- Cardillo G., Orena M. // Tetrahedron. 1990. V. 46, No. 10. P. 3221. DOI: 10.1016/S0040-4020(01)81510-6.
- Solov'ev K.N., Borisevich E.A. // Physics-Uspekhi. 2005. V. 48, No. 3. P. 231. DOI: 10.1070/PU2005v048n03ABEH001761.
- Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. М.: Мир, 2009. 439 с.
- Ионин Б.И., Ершов Б.А.., Кольцов А.И. ЯМР-спектроскопия в органической химии. Ленинград: Химия, 1983. 272 с.
- Нифантьев И.Э., Ивченко П.В. Практический курс спектроскопии ядерного магнитного резонанса. Методическая разработка. М.: МГУ, 2006. 199 с.
- Гюнтер Х. Введение в курс спектроскопии ЯМР. М.: Мир, 1984. 465 с.
- Structure Elucidation by NMR in Organic Chemistry. A Practical Guide / ed. E. Breitmaier. West Sussex, England: John Wiley & Sons Ltd, 2002. 258 p.

![Синтез и исследование структуры иодсодержащих имидазо[2,1-b][1,3]тиазиниевых систем Синтез и исследование структуры иодсодержащих имидазо[2,1-b][1,3]тиазиниевых систем](/file/cover/147243263/sintez-i-issledovanie-struktury-iodsoderzhashhih-imidazo-21-b-13-tiazinievyh.png)
