Синтез и исследование структуры несимметричного двуядерного комплекса дифторида бора
Автор: Пузырьков Захар Николаевич, Грибова Виктория Викторовна, Гузова Анастасия Андреевна, Свистунова Ирина Валентиновна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.12, 2020 года.
Бесплатный доступ
Получен разнолигандный двуядерный комплекс дифторида бора (1), в котором два дикетонатных цикла соединены атомом серы через центральные атомы углерода (g). В одном цикле в качестве b-заместителей присутствует две метильных группы - ацетилацетонатный фрагмент ( acac ), во втором - метильная и фенильная группы - бензоилацетонатный фрагмент ( bzac ). Полученный комплекс охарактеризован методами ИК и ПМР спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, структура полученного комплекса повторяет структуру ароматических сульфидов. Рассмотрено взаимодействие заместителей, стоящих у g- и b-углеродных атомов. 1 С15H14O4B2F4S, M 387,94, T 293(2) K, моноклинная, P 21/c, a = 7,893(12), b = 23,41(4), c = 9, 393(13) Å, a = 90, b = 103,32(6), g = 90 град., V = 1689(5) Å3, Z = 4, ρ = 1,525 г/см3, µ = 0,252 мм-1, F (000) = 792,0, размер кристалла 0,6×0,23×0,23 мм, 2q = 5,66-82,24 град., интервалы индексов -14 ≤ h ≤ 14, -36 ≤ k ≤ 36, -12 ≤ l ≤ 12, всего отражений 37642, независимых отражений 6665, GOOD 1,320, независимых переменных 238, Rint = 0,0843, R 1 = 0,1198, wR 2 = 0,3542. Сведения о структуре полученного комплекса (таблицы координат атомов, длин связей и валентных углов) депонированы в Кембриджском банке структурных данных № 1911543, deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Ацетилацетонат дифторида бора, бензоилацетонат дифторида бора, двухядерные комплексы, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147233152
IDR: 147233152 | УДК: 546.27+546.22+548.1+542.913 | DOI: 10.14529/chem200102
Текст научной статьи Синтез и исследование структуры несимметричного двуядерного комплекса дифторида бора
Получен разнолигандный двуядерный комплекс дифторида бора (1), в котором два дикетонатных цикла соединены атомом серы через центральные атомы углерода (γ). В одном цикле в качестве β-заместителей присутствует две метильных группы – ацетилацетонатный фрагмент (acac), во втором – метильная и фенильная группы – бензоилацетонатный фрагмент (bzac). Полученный комплекс охарактеризован методами ИК и ПМР спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, структура полученного комплекса повторяет структуру ароматических сульфидов. Рассмотрено взаимодействие заместителей, стоящих у γ- и β-углеродных атомов. 1 С15H14O4B2F4S, M 387,94, T 293(2) K, моноклинная, P21/c, a = 7,893(12), b = 23,41(4), c = 9, 393(13) Å, α = 90, β = 103,32(6), γ = 90 град., V = 1689(5) Å3, Z = 4, ρ= 1,525 г/см3, µ = 0,252 мм-1, F(000) = 792,0, размер кристалла 0,6×0,23×0,23 мм, 2θ = 5,66-82,24 град., интервалы индексов –14 ≤ h ≤ 14, –36 ≤ k ≤ 36, –12 ≤ l ≤ 12, всего отражений 37642, независимых отражений 6665, GOOD 1,320, независимых переменных 238, Rint = 0,0843, R1 = 0,1198, wR2 = 0,3542. Сведения о структуре полученного комплекса (таблицы координат атомов, длин связей и валентных углов) депонированы в Кембриджском банке структурных данных № 1911543, ; .
Дикетонаты дифторида бора являются популярными объектами исследования благодаря своей доступности, устойчивости и наличию люминесцентных свойств [1–10]. Исследование фотофизи-ческих свойств дикетонатных комплексов бора, растворенных в органических растворителях, показало значительную зависимость спектральных свойств от молекулярной архитектуры и в первую очередь от наличия заместителей, сопряженных с хелатным циклом. Для кристаллических комплексов бора спектральные свойства зависят от межмолекулярных взаимодействий даже таких слабых, как водородные связи, пи-стекинг взаимодействия, силы Ван-дер-Ваальса, приводящих к межмолекулярной самоорганизации, образованию эксимеров и эксиплексов [11–16]. Поэтому мы попытались получить и исследовать комплекс, в котором к борнохелатному циклу присоединены два заместителя, содержащих π (p) электроны: это фенильная группа и атом серы, соединенный с борноацетилацетонатным циклом, что должно привести к увеличению цепи сопряжения в комплексе. Кроме того, наличие двух борнохелатных групп в одном соединении могло обеспечить усиление межмолекулярного взаимодействия с образованием эксимеров и эксиплексов.
Предметом настоящей работы являлось получение и исследование структуры двуядерного комплекса дифторида бора, в котором два борнохелатных фрагмента соединены атомом серы через γ атомы углерода. Ранее уже было исследовано строение двуядерных комплексов дифторида бора, в которых ацетилацетонатные фрагменты соединены цепочкой из 4 атомов углерода – F2B(acacC4H8acac)BF2 [17] и дисульфидной группой – F2B(acacS2acac)BF2 [18]. В работе [19] описано получение комплекса F2B(acacSacac)BF2. Особенностью всех этих комплексов является, то что оба борнохелатных фрагмента образованы на основе одного лиганда – ацетилацетона, в котором отсутствуют ароматические заместители. Получение и исследование двуядерных комплексов с разными лигандами, в том числе с лигандами, содержащими ароматические заместители, не представлялось возможным, ввиду отсутствия методов получения подобных соединений. Синтез ацетилацетонатов дифторида бора, содержащих различные дикетоновые группировки, присоединенные через атом серы [20], сделал возможным получение двуядерных комплексов, в которых борноацетилацетонатный фрагмент может быть соединен с борнохелатным фрагментом на основе других лигандов, в том числе содержащих ароматические группы. Предполагалось получить двуядерный комплекс, в котором борноацетилацетонатный и борнобензоилацетонатный циклы соединены атомом серы через центральные атомы углерода. Исследование молекулярной структуры подобного вещества представляет дополнительный интерес тем, что структура бен-зоилацетонатных комплексов дифторида бора, содержащих заместитель у γ-углеродного атома, совершенно не изучена, в отличие от структуры γ-замещенных ацетилацетонатных комплексов.
Экспериментальная часть
Синтез F 2 B( acac S bzac )BF 2 (1). Смесь 0,680 г (2 ммоль) F 2 B( acac S bzac )H, 0,430 г (3 ммоль) эфирата трехфтористого бора, 0,460 г (2 ммоль) трибутилбората и 6 мл дихлорэтана кипятили в течение 7 ч, после чего реакционную смесь упаривали в вакууме. Остаток промывали тремя порциями гексана и перекристаллизовывали из смеси дихлорэтан-петролейный эфир. Были получены бесцветные кристаллы, т. пл. 181–183 °C (с разл.). Выход 49 %. Вычислено для C 15 H 14 B 2 F 4 O 4 S, %: C, 46,44; S, 8,27. Найдено: C, 46,63; S, 8,34 %. ИК, ν , cm–1: 1597, 1580, 1553 (C=O), 1501, 1474 (C=C), 1458 (C=C), 1422, 1364, 1354, 1221 (B-F), 1184, 1163 (B-F), 1107 (B-O), 1053. ПМР, δ , м.д.: 2,24 (6H, s, CH 3 ( acac )), 2,68 (3H, s, CH 3 ( bzac )), 7,56, 7,70, 7,77 (5H, t, t, d, C 6 H 5 ).
ИК-спектр был записан в диапазоне 4000–550 см–1 на спектрометре Infralum FT-801 в таблетке KBr. ПМР-спектр был получен на приборе Bruker WH 400, растворитель – CDCl3, внутренний стандарт тетраметилсилан (TMS: δ = 0 ppm). Рентгеноструктурный анализ проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [21]. Все расчеты по определению и уточнению структуры выполнены с помощью программ SHELXL/PC [22], OLEX2 [23]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, основные длины связей и валентные углы – в табл. 2. Строение молекулы полученного комплекса показано на рисунке. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1911543, ; .
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры
|
Параметр |
Значение |
|
Формула |
C 15 H 14 B 2 F 4 O 4 S |
|
М |
387,94 |
|
Температура, К |
293,15 |
|
Сингония |
monoclinic |
|
Пр. группа |
P2 1 /c |
|
a , Å |
7,893(12) |
|
b , Å |
23,41(4) |
|
c, Å |
9,393(13) |
|
α , град. |
90,00 |
|
β, град. |
103,32(6) |
|
γ , град. |
90,00 |
|
V , Å3 |
1689(5) |
|
Z |
4 |
|
ρ (выч.), г/см3 |
1,525 |
|
- 1 µ , мм |
0,252 |
|
F (000) |
792,0 |
|
Размер кристалла, мм |
0,6 × 0,23 × 0,23 |
|
Область сбора данных по θ , град. |
5,66–82,24 |
|
Интервалы индексов отражений |
–14 ≤ h ≤ 14, –36 ≤ k ≤ 36, –12 ≤ l ≤ 12 |
Окончание табл. 1
|
Параметр |
Значение |
|
Измерено отражений |
37642 |
|
Независимых отражений |
6665 ( R int = 0,0843) |
|
Переменных уточнения |
238 |
|
GOOF |
1,320 |
|
R -факторы по F 2> 2 σ ( F 2) |
R 1 = 0,1198, wR 2 = 0,3542 |
|
R -факторы по всем отражениям |
R 1 = 0,2002, wR 2 = 0,3990 |
|
Остаточная электронная плотность (min/max), e/A3 |
1,42/–1,02 |
Таблица 2
|
Связь, d, Å |
Угол, ω , град. |
||
|
S(1)–C(8) |
1,745(4) |
C(8) S(1) C(3) |
102,42(2) |
|
S(1)–C(3) |
2,080(5) |
C(2) O(1) B(1) |
133,0(3) |
|
F(4)–B(2) |
1,482(5) |
C(9) O(3) B(2) |
123,5(3) |
|
F(3)–B(2) |
1,570(6) |
C(7) O(4) B(2) |
130,7(3) |
|
O(1)–C(2) |
1,496(7) |
B(1) O(2) C(4) |
125,3(4) |
|
O(1)–B(1) |
1,641(7) |
C(11) C(10) C(9) |
105,5(4) |
|
F(1)–B(1) |
1,439(7) |
C(9) C(10) C(15) |
126,5(3) |
|
O(3)–C(9) |
1,280(5) |
O(3) C(9) C(10) |
111,4(3) |
|
O(3)–B(2) |
1,322(5) |
O(3) C(9) C(8) |
127,4(3) |
|
O(4)–C(7) |
1,269(5) |
C(10) C(9) C(8) |
121,1(3) |
|
O(4)–B(2) |
1,384(5) |
C(9) C(8) S(1) |
127,2(3) |
|
F(2)–B(1) |
1,296(7) |
C(7) C(8) S(1) |
121,6(3) |
|
O(2)–B(1) |
1,401(6) |
C(7) C(8) C(9) |
110,7(3) |
|
O(2)–C(4) |
1,501(6) |
C(2) C(3) S(1) |
121,3(3) |
|
C(10)–C(9) |
1,314(5) |
C(2) C(3) C(4) |
105,2(4) |
|
C(9)–C(8) |
1,328(5) |
C(4) C(3) S(1) |
133,0(3) |
|
C(8)–C(7) |
1,213(5) |
O(1) C(2) C(1) |
124,1(4) |
|
C(3)–C(2) |
1,325(5) |
C(3) C(2) O(1) |
122,7(4) |
|
C(3)–C(4) |
1,487(6) |
C(3) C(2) C(1) |
113,1(5) |
|
C(2)–C(1) |
1,561(8) |
F(1) B(1) O(1) |
114,8(4) |
|
C(7)–C(6) |
1,364(6) |
F(2) B(1) O(1) |
121,5(5) |
|
C(4)–C(5) |
1,350(6) |
F(2) B(1) F(1) |
100,9(5) |
|
F(2) B(1) O(2) |
103,5(4) |
||
|
O(2) B(1) O(1) |
97,2(4) |
||
|
O(2) B(1) F(1) |
119,7(4) |
||
|
O(4) C(7) C(6) |
121,7(4) |
||
|
C(8) C(7) O(4) |
122,2(3) |
||
|
C(8) C(7) C(6) |
116,1(4) |
||
|
C(3) C(4) O(2) |
133,6(3) |
||
|
C(5) C(4) O(2) |
115,1(4) |
||
|
C(5) C(4) C(3) |
111,3(4) |
||
|
F(4) B(2) F(3) |
118,9(3) |
||
|
O(3) B(2) F(4) |
97,6(4) |
||
|
O(3) B(2) F(3) |
117,9(3) |
||
|
O(3) B(2) O(4) |
102,9(3) |
||
|
O(4) B(2) F(4) |
115,1(3) |
||
|
O(4) B(2) F(3) |
103,9(4) |
||
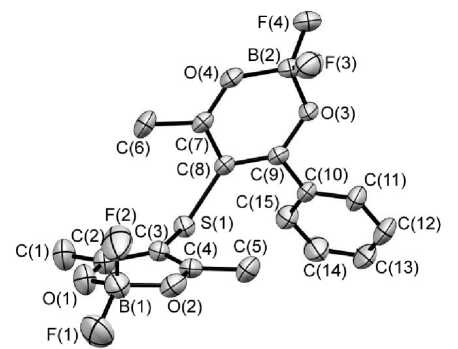
Структура и нумерация атомов в F 2 B( acac S bzac )BF 2
Обсуждение результатов
Для получения двуядерного комплекса мы использовали замещенный ацетилацетонат бора, содержащий свободную бензоилацетонатную группу. При обработке этого соединения избытком эфирата трехфтористого бора в присутствии трибутилбората был получен комплекс, содержащий два борнохелатных фрагмента.
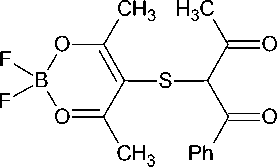
BF3*OEt2
B(OBu) 3
Попытка провести реакцию в эфире оказалась неудачной, после нескольких часов кипячения исходный комплекс возвращается в неизменном виде. Возможно, это обусловлено плохой растворимостью F 2 B( acac S bzac )H в эфире. Замена эфира на дихлорэтан или толуол позволила получить двуядерный комплекс с умеренным выходом.
В отличие от одноядерных комплексов, содержащих заместители у у -углеродного атома, комплекс 1 имеет пониженную летучесть, поэтому для его исследования нельзя применять методы газовой хроматографии. В ПМР спектре комплекса 1 , по сравнению со спектром F 2 B( acac S bzac )H, исчезает сигнал протона, стоявшего при у -углеродном атоме бензоилацетонового фрагмента, а положение сигналов остальных протонов – метильных групп в ацетилацетоновом фрагменте, метильной и фенильной групп в бензоилацетонатном фрагменте – меняется мало, на сотые доли м.д. ИК-спектр является типичными для замещенных дикетонатых комплексов бора: в области 1600–1500 см–1 лежит интенсивная полоса поглощения хелатированной группы C=O. В области 1500–1400 см–1 находится более интенсивная полоса, обусловленная колебаниями группы С=С. Она расщеплена на две полосы, что, возможно, обусловлено наложением колебаний двойной связи в ацетилацетонатном и бензоилацетонатном циклах.
Строение комплекса 1 определяется геометрией сульфидной связи: хелатные циклы располагаются под углом 102,42 ° (величина угла C y -S-C y ), при этом ацетилацетонатный и бензоилацето-натный циклы повернуты вдоль продольных осей на 55,96 и 61,00 ° относительно плоскости образуемой сульфидной группой (атомы C y -S-C y) . Подобное строение является обычным для диа-рилсульфидов, содержащих в орто -положении заместители. Так в димезителенсульфиде, который по своей структуре наиболее близок к комплексу 1 , величина угла C-S-C составляет 106 ° , а бензольные циклы повернуты относительно плоскости, в которой лежат эти атомы, на 54 ° [24]. Разворот хелатных циклов вдоль продольной оси, позволяет р -заместителям разных циклов расположиться на наибольшем удалении друг от друга.
Таким образом, по своему строению органические сульфиды, содержащие в качестве радикалов борнохелатные группы, мало отличаются от ароматических аналогов.
Строение хелатных циклов повторяет строение незамещенного ацетилацетона дифторида бора [25]: хелатные циклы не являются плоскими, в них имеется два изгиба по линии O…O и по линии Cp---Cp. Величина этих изгибов составляет для ацетилацетонатного цикла 12,87 и 6,08 ° , а для бен-зоилацетонатного - 11,94 и 7,69 ° . Следует отметить, что в незамещенном бензоилацетонате дифторида бора подобных изгибов нет и хелатный цикл является практически плоским [26].
Еще одним существенным отличием в строении бензоилацетнатного фрагмента в комплексе 1 от незамещенного бензоилацетоната является разворот плоскости бензольного цикла, относительно плоскости хелатного цикла (плоскости, образуемой атомами Cp...O...O...Cp в бензоил-ацетонатном фрагменте), который составляет 50,01 ° . Расположение бензольного цикла в плоскости хелатного кольца в F 2 B( bzac H) является энергетически выгодным, так как обеспечивает сопряжение п электронных систем обоих циклов. Очевидно, что поворот в -заместителя и отказ от сопряжения в комплексе 1 обусловлен необходимостью уменьшить отталкивание между двумя расположенными рядом объемными заместителями – тиоацетилацетонатной и фенильной группами. То есть присутствие объемного заместителя у центрального атома углерода хелатного цикла препятствует сопряжению ароматических в -заместителей с хелатным циклом.
В кристалле комплекса 1 присутствует большое количество коротких контактов. В основном взаимодействие осуществляется между атомами фтора обоих халатных циклов с метильными группами и в -углеродными атомами соседних молекул. Хелатные и бензольные циклы отдельных молекул не располагаются в параллельных плоскостях, что исключает образование эксимеров и эксиплексов для кристаллов этого двуядерного комплекса.
Выводы
В результате проделанной работы предложен способ получения двуядерных дикетонатных комплексов дифторида бора, содержащих разные лиганды. Установлено, что наличие объемных заместителей у центрального атома углерода препятствует сопряжению электронных системы хелатного цикла и ароматических заместителей, находящихся у в -углеродных атомов.
Выражаем благодарность проф. В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и исследование структуры несимметричного двуядерного комплекса дифторида бора
- Stabilization and Optical Switching of Liquid Crystal Blue Phase Doped with Azobenzene-Based Bent-Shaped Hydrogen-Bonded Assemblies / J. Wang, Y. Shi, K. Yang et al. // RSC Adv. - 2015. - V. 5. - P. 67357-67364. DOI: 10.1039/C5RA12256B
- NIR Light-Directing Self-Organized 3D Photonic Superstructures Loaded with Anisotropic Plasmonic Hybrid Nanorods / L. Wang, K.G. Gutierrez-Cuevas, H.K. Bisoyi et al. // Chem. Commun. - 2015. - V. 51. - P. 15039-15042. DOI: 10.1039/C5CC06146F
- Ariga, K. Mechanical Control of Nanomaterials and Nanosystems / K. Ariga, T. Mori, J.P. Hill // Adv. Mater. - 2012. - V. 24. - P. 158-176. DOI: 10.1002/adma.201102617
- An Easily Coatable Temperature Responsive Cholesteric Liquid Crystal Oligomer for Making Structural Colour Patterns / P. Zhang, A.J.J. Kragt, A.P.H.J. Schenning et al. // J. Mater. Chem. - 2018. - V. 6. - P. 7184-7187. DOI: 10.1039/C8TC02252F
- A Modular Approach Towards Functional Supramolecular Aggregates - Subtle Structural Differences Inducing Liquid Crystallinity / M. Pfletscher, C. Wölper, J.S. Gutmann et al. // Chem. Commun. - 2016. - V. 52. - P. 5849-5852. DOI: 10.1039/C6CC03966A
- Twisted D-π-A Solid Emitters: Efficient Emission and High Contrast Mechanochromism / Y. Gong, Y. Tan, J. Liu et al. // Chem. Commun. - 2013. - V. 49. - P. 4009-4011.
- DOI: 10.1039/C3CC39243K
- Lehn, J.-M. Supramolecular Chemistry: Concepts and Perspectives / J.-M. Lehn. - John Wiley & Sons, 2011.
- A New Ligand and Its Complex with Multi-Stimuli-Responsive and Aggregation-Induced Emission Effects / B. Xu, Z. Chi, X. Zhang et al. // Chem. Commun. - 2011. - V. 47. - P. 11080-11082.
- DOI: 10.1039/C1CC13790E
- White Light Emission from a Single Component System: Remarkable Concentration Effects on the Fluorescence of 1,3-Diaroylmethanatoboron Difluoride / A. Sakai, M. Tanaka, E. Ohta et al. // Tetrahedron Lett. - 2012. - V. 53. - P. 4138-4141.
- DOI: 10.1016/j.tetlet.2012.05.122
- Кристаллическая структура и эксимерная флуоресценция анизоилбензоилметаната и дианизоилметаната дифторида бора / А.Г. Мирочник, Б.В. Буквецкий, Е.В. Федоренко, В.Е. Карасев // Известия Академии наук. Серия химическая. - 2004. - № 2. - С. 279. DOI: 10.1023/B:RUCB.0000030800.71663.7a.
- Luminescence and Crystal Structure of 2,2-Difluoro-4-(9-Anthracyl)-6-Methyl-1,3,2-Dioxaborine / E.V. Fedorenko, B.V. Bukvetskii, A.G. Mirochnik et al. // J. Lumin. - 2010. - V. 130. - P. 756-761.
- DOI: 10.1016/j.jlumin.2009.11.027
- Safonov, A.A. Structures and Binding Energies of the (Dibenzoylmethanato)Boron Difluoride Complexes with Aromatic Hydrocarbons in the Ground and Excited States. Density Functional Theory Calculations / A.A. Safonov, A.A. Bagaturyants, V.A. Sazhnikov // High Energy Chem. - 2014. - V. 48. - P. 43-48.
- DOI: 10.1134/S0018143914010111
- The Structure and Decay Dynamics of Exciplexes Derived from Dibenzoylmethanatoboron Difluoride and Alkylbenzenes in Cyclohexane / Y.L. Сhow, Z.L. Liu, C.I. Johansson, J. Ishiyama // Chem. Eur. J. - 2000. - V. 6. - P. 2942-2947. :163.0.CO;2-#.
- DOI: 10.1002/1521-3765(20000818)6
- Chow, Y.L. Exciplex Binding Energy and Kinetic Rate Constants of the Interaction Between Singlet Excited State Dibenzoylmethanatoboron Difluoride and Substituted Benzenes / Y.L. Chow, C.I. Johansson // J. Phys. Chem. - 1995. - V. 99. - P. 17558-17572.
- DOI: 10.1021/j100049a016
- Low-Dimensional Nanostructures Fabricated from Bis(Dioxaborine)Carbazole Derivatives as Fluorescent Chemosensors for Detecting Organic Amine Vapors / X. Liu, X. Zhang, R. Lu et al. // J. Mater. Chem. - 2011. - V. 21. - P. 8756-8765.
- DOI: 10.1039/C0JM04274A
- Luminescence and Crystal Structure of 2,2-Difluoro-4-(9-Anthracyl)-6-Methyl-1,3,2-Dioxaborine / E.V. Fedorenko, B.V. Bukvetskii, A.G. Mirochnik et al. // J. Lumin. - 2010. - V. 130, № 5. - P. 756-761.
- DOI: 10.1016/j.jlumin.2009.11.027
- Crystal Structure of (Z,Z)-3,8-Bis[L-(Difluoroboryloxy)Ethylidene]Decane2,9-Dione, C10H14O2(C2H3OBF2)2 / K. Peters, E.-M. Peters, M. Seefelder, H. Quast // Z. Kristallogr. - New Cryst. Struct. - 1999. - V. 214, № 4. - P. 537-538.
- Буквецкий, Б.В. Исследование кристаллической структуры двухядерного ацетилацетоната дифторида бора / Б.В. Буквецкий, И.В. Свистунова, Н.А. Гельфанд // Журн. структ. химии. - 2014. - Т. 55, № 2. - С. 310-314.
- DOI: 10.1134/S0022476614020140
- Свистунова, И.В. / a-Замещенные ацетилацетонаты дифторида бора / И.В. Свистунова, Е.В. Федоренко // Журн. общей химии. - 2008. - Т. 78, вып. 8. - С. 1280-1288.
- DOI: 10.1134/S1070363208080094
- Svistunova, I.V. Reactions of Sulfenyl- and Selenylchlorides of Boron Difluoride Acetylacetonate with C-H Acids / I.V. Svistunova, G.O. Tretyakova, K.A. Gaivoronskaya // Phosphorus Sulfur Silicon Relat. Elem. - 2017. - V. 192, № 11. - P. 1177-1188.
- DOI: 10.1080/10426507.2017.1354210
- Bruker. SMART and SAINT-Plus Data Collection and Processing Software for the SMART System Versions 5.0, Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data Versions 5.10, Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov, O.V. OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341.
- DOI: 10.1107/S0021889808042726
- Grilli, S. Conformational Studies by Dynamic NMR. 81. Cogwheeling Circuit for the Enantiomerization of the Propeller Antipodes of 2,2',6,6'-Tetramethyldiphenyl Sulfide / S. Grilli, L. Lunazzi, A. Mazzanti // J. Org. Chem. - 2001. - V. 66, № 12. - P. 4444-4446.
- DOI: 10.1021/jo010187s
- Кристаллическая структура и люминесценция ацетилацетоната дифторида бора / А.Г. Мирочник, Б.В. Буквецкий, Е.В. Гухман и др. // Журн. общ. химии. - 2002. - 72, № 5. - С. 790-793.
- Hanson, A.W. The Crystal Structure of Benzoylacetonato Boron Difluoride / A.W. Hanson, E.W. Macaulay // Acta Crystallogr., Sect. B: Struct. Crystallogr. Cryst. Chem. - 1972. - V. 28, № 6. - P. 1961-1967.
- DOI: 10.1107/S0567740872005308


