Синтез и исследование свойств 5-r-2-пропаргилсульфанилбензимидазолов
Автор: Ильиных Елена Сергеевна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.15, 2023 года.
Бесплатный доступ
Синтез новых лекарственных веществ и биологически активных соединений, в частности гетероциклических, является неотъемлемой частью развития современной фармакологии. В этом состоит одна из причин устойчивого синтетического и биологического интереса к химии имидазолов и бензимидазолов. Нами алкилированием бензимидазол-2-тиола (1a) и 5-метилбензимидазол-2-тиола (1b) пропаргилбромидом в системе KOH-ДМФА впервые осуществлен синтез 2-пропаргилсульфанилбензимидазола (2a) (с выходом 85 %) и 5-метил-2-пропар-гилсульфанилбензимидазола (2b) (с выходом 56 %) соответственно. Структура синтезированных соединений 2a,b исследована методами спектроскопии ЯМР ¹Н и ¹³С, а также масс-спектрометрии (ГХ-МС). Найдено, что пропаргилсульфиды 2а,b при хроматографировании в условиях анализа методом ГХ-МС ввиду высокой температуры в инжекторе (> 200 оС) претерпевают ацетилен-алленовую перегруппировку и последующие химические превращения. В литературе имеются сведения о синтезе галоген- и селенопроизводных [1,3]тиазинобензимидазола на основе 2-про-паргилсульфанилбензимидазолов. Нами гетероциклизацией соединений 2a,b в условиях ацетилен-алленовой перегруппировки (при нагревании в системе КОН-ДМСО или MeONa-MeOH) получены трициклические конденсированные [1,3]тиазоло[3,2- a ]бензими-дазолиевые системы. По данным ЯМР 1Н установлено, что реакции пропаргилсульфидов 2а,b с двукратным избытком йода в хлороформе сопровождаются образованием иодида 3-иодметилено-2,3-дигидро-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия и полииодида 3-иодметилено-6-метил-2,3-дигидро-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия соответственно. При смене растворителя на более полярный и осуществлении иодирования соединения 2а в ледяной уксусной кислоте при том же соотношении исходных реагентов (1:2) наблюдается изомеризация продукта гетероциклизации с экзоциклической двойной связью в продукт гетероциклизации с эндоциклической двойной связью в тиазолиевом цикле. В результате выделен индивидуальный полииодид 3-иодметил-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия, структура которого доказана методом спектроскопии ЯМР¹
Бензимидазол-2-тиол, 5-метилбензимидазол-2-тиол, 2-пропаргил-сульфанилбензимидазол, 5-метил-2-пропаргилсульфанилбензимидазол, ацетилен-алленовая перегруппировка, [3, 3]-сигматропная перегруппировка, гетероциклизация, иодциклизация, [1, 3]тиазоло[3, 2-a]бензимидазол, [1, 3]тиазоло[3, 2-b]бензимидазол
Короткий адрес: https://sciup.org/147239549
IDR: 147239549 | УДК: 547.781 | DOI: 10.14529/chem230109
Текст научной статьи Синтез и исследование свойств 5-r-2-пропаргилсульфанилбензимидазолов
Интенсивное развитие современной фармакологии невозможно без постоянного появления новых лекарственных веществ и биологически активных соединений в первую очередь гетероциклических. В этом одна из причин устойчивого синтетического и биологического интереса к химии имидазолов и бензимидазолов. Структурный фрагмент бензимидазола входит в состав различных лекарственных препаратов (дибазол, омепразол, мебендазол, афобазол и другие). Для многих производных имидазола, бензимидазола и, в частности, бензимидазол-2-тиола зарегистрирован широкий спектр биологической активности (сосудосуживающая, антимикробная, антибактериальная, противоопухолевая, антифунгицидная, противовирусная, противоязвенная, противотуберкулезная и др.) [1–11].
Вместе с тем в литературе практически не исследованы S-алкинильные производные бенз-имидазол-2-тиолов. Например, среди пропаргильных (пропинильных) производных, имеющих свободный терминальный протон в пропинильном заместителе, известны только 2-пропаргил-сульфанилбензимидазол [12] и 5-метил-2-пропаргилсульфанилбензимидазол [2]. Серия других синтезированных 2-пропаргилсульфанилбензимидазолов содержит различные алкильные или арильные заместители в пропинильном фрагменте [13, 14].
Синтез трициклических [1,3]тиазоло- и [1,3]тиазинобензимидазолиевых систем на основе 2-пропаргилсульфанилбензимидазолов является перспективным направлением их модификации. Авторы статей [13, 14] сообщают о гетероциклизации указанных соединений под действием N-галогенсукцинимидов и дифенилдиселенидов, в результате чего получен ряд галоген- и селенопроизводных [1,3]тиазинобензимидазола соответственно. Однако реакции гетероциклизации 2-пропаргилсульфанилбензимидазолов в условиях ацетилен-алленовой перегруппировки, а также под действием йода в литературе не изучены.
Ранее нами было исследовано бромирование S-алкенильного производного бензимидазол-2-тиола – 2-аллилсульфанилбензимидазола [15]. Целью данной работы является исследование реакций иодирования 2-пропаргилсульфанилбензимидазола и 5-метил-2-пропаргилсульфанил-бензимидазола и их алкин-алленовой перегруппировки.
Экспериментальная часть
Температуры плавления определены на аппарате для определения температуры плавления «ПТП ТУ-25-11-1144-76» и не корректировались. Спектры ЯМР 1H, 13C записаны на приборе «Bruker DRX-400» в ДМСО- d 6 , внутренний стандарт – ТМС. ГХ–МС анализ проведен на приборе «GC-MS SHIMADZU QP2010 Ultra» в режиме электронной ионизации ЭИ (70 эВ).
Исходные соединения бензимидазол-2-тиол ( 1a ), 5-метилбензимидазол-2-тиол ( 1b ), пропаргил-бромид (3-бромпропен) – коммерческие препараты фирмы Alfa Aesar. A Johnson Matthey Company.
Синтез 5-R-2-пропаргилсульфанилбензимидазолов (2a,b) (общая методика)
В плоскодонную колбу помещали 0,280 г (5 ммоль) КОН, приливали каплю дистиллированной воды и 10 мл ДМФА. Далее добавляли 0,750 г (5 ммоль) бензимидазол-2-тиола 1a или 0,820 г (5 ммоль) 5-метилбензимидазол-2-тиола 1b и 0,38 мл (5 ммоль) пропаргилбромида. Реакционную смесь перемешивали на магнитной мешалке. Через 4 суток добавляли к реакционной смеси 50 мл дистиллированной воды при внешнем охлаждении льдом. Образовавшиеся осадки отфильтровывали, промывали водой и сушили.
2-Пропаргилсульфанилбензимидазол ( 2а ). Белый кристаллический порошок, выход 0,799 г (85 %), т. пл. 162 °С. Масс-спектр (ЭИ, 70 эВ), m/z ( I отн . , %): 188 [M]+• (100), 186 (45), 161 (5), 155 [M–SH]+ (10), 143 (5), 134 (10), 129 (15), 102 (13), 94 (12), 75 (7), 63 (5), 59 (7), 51 (3), 39 (7). Спектр ЯМР 1Н, δ , м.д. ( J , Гц): 3,21 (1H, т, 4J = 2,5, ≡C‒H); 4,15 (2Н, д, 4 J = 2,5, –SCH 2 –); 7,14 (2H, м, H-5, H-6); 7,48 (2H, уш. с, H-4, H-7); 12,65 (1H, уш. с, NH). Спектр ЯМР 13С, δ , м.д.: 19,73 (–S C H 2 –); 74,05 (≡ C ‒H); 80,06 (– С ≡C‒H); 117,55 (C-4, C-7); 121,29 (C-6); 121,86 (C-5); 135,48 (C-3a, C-7a); 148,35 (C-2).
5-Метил-2-пропаргилсульфанилбензимидазол ( 2b ). Светло-коричневый порошок, выход 0,566 г (56 %), т. пл. 120 °С. Масс-спектр (ЭИ, 70 эВ), m/z ( I отн . , %): 202 [M]+• (100), 168 (3), 157 (3), 143 (5), 116 (5), 101 (10), 89 (10), 77 (5), 71 (2), 63 (5), 51 (3), 40 (10). Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 2,39 (3H, с, 5-CH 3 ); 3,20 (1H, т, 4J = 2,5, ≡C‒H); 4,11 (2Н, д, 4 J = 2,5, –SCH 2 –); 6,96 (1H, д, 3J = 8,2, Н-7); 7,30 (2H, м, H-4, H-6); 12,50 (1H, уш. с, NH). Спектр ЯМР 13С, δ, м.д.: 19,81 (–S C H 2 –); 21,20 (5-CH 3 ); 74,05 (≡ C ‒H); 80,08 (– С ≡C‒H); 122,91 (С-4, С-5, C-6, С-7); 130,76 (C-3a, C-7a); 147,66 (C-2).
Термическое воздействие на 5-метил-2-пропаргилсульфанилбензимидазол ( 2b ) без растворителя. В пробирку помещали 0,082 г (0,5 ммоль) 5-метил-2-пропаргилсульфанилбензими-дазола 2b и нагревали на плитке при температуре около 200 °C в течение 1,5 ч. Остаток далее обрабатывали ацетоном, отфильтровывали, из фильтрата отгоняли растворитель. Получали масло темно-оранжевого цвета, которое исследовали методом ГХ–МС. Выход 0,056 г.
Синтез 3-метил[1,3]тиазоло[3,2- a ]бензимидазола (9a). В круглодонную колбу помещали 0,056 г (1 ммоль) КОН, 15 мл ДМСО и 0,188 г (1 ммоль) 2-пропаргилсульфанилбензимидазола 2a . Реакционную смесь нагревали на водяной бане с обратным холодильником в течение 1,5 ч, при этом наблюдали изменение цвета с желтого на темно-желтый. Затем добавляли к реакционной смеси 50 мл воды, отфильтровывали осадок, промывали водой и сушили. Получали порошок светло-желтого цвета, выход 0,105 г (56 %), т. пл. 150 °С. Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 2,74 (3H, с (с расщ.), 4J = 1,3, 3-СН 3 ); 6,86 (1Н, м, 4J = 1,3, –SCH=); 7,25 (1H, м, Н-6); 7,34 (1H, м, Н-7); 7,69 (1H, д, 3J = 8,1, Н-8); 7,96 (1H, д, 3J = 8,1, Н-5).
Реакция 5-метил-2-пропаргилсульфанилбензимидазола (2b) в системе ДМСО‒КОН. В круглодонную колбу помещали 0,056 г (1 ммоль) КОН, 15 мл ДМСО и 0,202 г (1 ммоль) 5-метил-2-пропаргилсульфанилбензимидазола 2b . Реакционную смесь нагревали на водяной бане с обратным холодильником в течение 1,5 ч, при этом наблюдали изменение цвета с желтого на желто-оранжевый. Затем добавляли к реакционной смеси 50 мл воды, отфильтровывали осадок, промывали водой и сушили. Получали смесь 3,7-диметил[1,3]тиазоло[3,2- a ]бензимидазола 9b и 3,6-диметил[1,3]тиазоло[3,2- a ]бензимидазола 8 в виде порошка светло-коричневого цвета, выход 0,186 г.
3,7-Диметил[1,3]тиазоло[3,2- a ]бензимидазол (9b). Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 2,55 (3H, с, 7-СН 3 ); 2,73 (3H, с, 3-СН 3 ); 6,71 (1Н, м, –SCH=); 7,12 (1H, д, 3J = 8,2, Н-5); 7,51 (1H, уш. с, Н-8); 7,74 (1H, д, 3J = 8,2, Н-6).
3,6-Диметил[1,3]тиазоло[3,2- a ]бензимидазол (8). Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 2,48 (3H, с, 6-СН 3 ); 2,71 (3H, с, 3-СН 3 ); 6,71 (1Н, м, –SCH=); 7,01 (1H, д, 3J = 8,2, Н-8); 7,43 (1H, уш. с, Н-5); 7,68 (1H, уш. с, Н-7).
Взаимодействие 5-R-бензимидазол-2-тиолов (1a,b) с пропаргилбромидом в системе MeONa–MeOH (общая методика). К раствору 0,150 г (1 ммоль) бензимидазол-2-тиола 1a или 0,164 г (1 ммоль) 5-метилбензимидазол-2-тиола 1b в 4 мл метанола добавляли при перемешивании раствор 0,08 мл (1 ммоль) пропаргилбромида в 4 мл метанола и 0,023 г (1 ммоль) металлического натрия. Реакционную смесь нагревали на водяной бане с обратным холодильником в течение 3 ч, после чего растворитель отгоняли, а остаток обрабатывали ацетоном и фильтровали. После испарения ацетона в случае реакции соединения 1а получали смесь 2-(1,2-пропадиенил)-cульфанилбензимидазола 3а и тиазолобензимидазола 9a в виде масла желто-красного цвета с выходом 0,078 г, а в случае реакции соединения 1b – смесь тиазолобензимидазолов 9b , 8 и минорного количества 5-метил-2-(1,2-пропадиенил)cульфанилбензимидазола 3b в виде масла коричневого цвета с выходом 0,113 г.
2-(1,2-Пропадиенил)cульфанилбензимидазол (3а). Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 5,30 (2Н, д, 4J = 6,4, =CH 2 ); 6,63 (1H, т, 4J = 6,4, ‒SCH=); 7,14 (2H, м, H-5, H-6); 7,47 (2H, м, H-4, H-7).
Синтез иодида 3-иодметилено-2,3-дигидро-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия (11). К раствору 0,508 г (2 ммоль) йода в 10 мл хлороформа добавляли раствор 0,188 г (1 ммоль) 2-пропаргилсульфанилбензимидазола 2a в 10 мл хлороформа. Через 7 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образовавшийся осадок отфильтровывали, промывали ацетоном и сушили. Получали порошок светло-коричневого цвета, выход 0,088 г (20 %), т. пл. 130 °С. Спектр ЯМР 1Н, δ, м.д. ( J , Гц): 4,61 (2Н, д, 4J = 2,4, –SCH 2 –); 6,85 (1H, т, 4J = 2,4, =CHI); 7,27 (2H, м, Н-7, Н-8); 7,49 (1H, м, Н-6); 7,90 (1H, м, Н-5).
Синтез полииодида 3-иодметилено-6-метил-2,3-дигидро-9 Н -[1,3]тиазоло[2,3- b ]бензими-дазолия (10b). К раствору 0,508 г (2 ммоль) йода в 10 мл хлороформа добавляли раствор 0,202 г (1 ммоль) 5-метил-2-пропаргилсульфанилбензимидазола 2b в 10 мл хлороформа. Через 7 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образования осадка иодида не наблюдали, поэтому к реакционной смеси приливали избыток воды. Выпавший осадок отфильтровывали и сушили. Получали кристаллы черного цвета, выход 0,031 г, т. пл. 94 °С. Спектр ЯМР 1Н, δ , м.д. ( J , Гц): 2,45 (3Н, с, 6-СН 3 ); 4,60 (2Н, д, 4J = 2,1, –SCH 2 –); 6,84 (1H, т, 4J = 2,1, =CHI); 7,07 (1H, м, Н-8); 7,36 (1H, м, Н-7); 7,75 (1H, м, Н-5).
Синтез полииодида 3-иодметил-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия (12). К раствору 0,508 г (2 ммоль) йода в 10 мл ледяной уксусной кислоты добавляли раствор 0,188 г (1 ммоль)
2-пропаргилсульфанилбензимидазола 2a в 10 мл ледяной уксусной кислоты. Через 7 суток отгоняли растворитель, получали масло темно-коричневого цвета, растворяли его в 10 мл ацетона и добавляли иодид натрия. Образования осадка иодида не наблюдали, поэтому к реакционной смеси приливали избыток воды. Выпавший осадок отфильтровывали и сушили. Получали кристаллы черного цвета, выход 0,106 г, т. пл. 98 °С. Спектр ЯМР 1Н, δ , м.д. ( J , Гц): 4,54 (2Н, с, –CH 2 I); 7,24 (1H, уш. с, –SCH=); 7,35 (2H, м, Н-7, Н-8); 7,50 (1H, м, Н-6); 7,72 (1H, м, Н-5).
Обсуждение результатов
Известные ранее методы синтеза 2-пропаргилсульфанилбензимидазола ( 2a ) и 5-метил-2-пропаргилcульфанилбензимидазола ( 2b ) основаны на реакциях бензимидазол-2-тиола ( 1а ) и 5-метилбензимидазол-2-тиола ( 1b ), соответственно, с 3-бромпропином (пропаргилбромидом) в различных системах. Соединение 2а было получено в системах NaOH–H2O (выход целевого продукта составил 64 %) [12], MeONa–MeOH (66 %) [2], K 2 CO 3 –Me 2 CO (77 %), EtOH–NH 4 OH (79 %) [16], HTr–EtOH (HTr – гидротальцит) при MW облучении (82 %) [17], а соединение 2b – только в системе NaOH–H 2 O (51 %) [2].
Нами впервые осуществлен синтез 2-пропаргилсульфанилбензимидазола 2a и 5-метил-2-пропаргилсульфанилбензимидазола 2b алкилированием бензимидазол-2-тиола 1a и 5-метил-бензимидазол-2-тиола 1b , соответственно, пропаргилбромидом в системе KOH–ДМФА (схема 1).
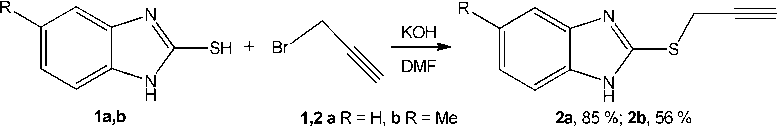
Схема 1. Синтез 5-R-2-пропаргилсульфанилбензимидазолов (2a,b)
Структура синтезированных соединений 2a,b исследована методами спектроскопии ЯМР ¹Н и ¹³С, а также масс-спектрометрии (ГХ–МС).
Теоретически алкилирование бензимидазол-2-тиолов 1a,b может протекать как по атому серы, так и по атому азота. Доказательством протекания реакций по направлению S-алкилирования является наличие в спектрах ЯМР 1Н пропаргилсульфидов 2a и 2b сигналов протонов –SCH2‒ при δ 4,15 и 4,11 м.д. соответственно. В случае образования продуктов алкилирования по атому азота протоны –NCH 2 – резонировали бы в спектрах в более слабом поле (δ 4,60–5,00 м. д.).
На хроматограммах, полученных в результате анализа растворов соединений 2a и 2b методом ГХ–МС, имеются несколько пиков с различным временем удерживания: кроме пиков целевых продуктов 2a и 2b присутствуют также пики изомерных им соединений.
Согласно данным ГХ–МС, эти пики принадлежат соединениям с одинаковой молекулярной массой, о чем свидетельствует присутствие в масс-спектрах сигналов соответствующих молекулярных ионов [M]+• с m/z 188 для 2a и с m/z 202 для 2b .
По-видимому, пропаргилсульфиды 2а и 2b при хроматографировании в условиях анализа методом ГХ–МС ввиду высокой температуры в инжекторе (> 200 °С) претерпевают ацетиленалленовую перегруппировку и последующие химические превращения [18–20], которые теоретически могут протекать с образованием нескольких возможных структур (схема 2).
Поскольку ацетилен-алленовая перегруппировка протекает при нагревании, первоначально образующиеся аллены ( 3a,b ) в подобных системах способны претерпевать дальнейшую [3,3]-сигматропную перегруппировку в N-аллены ( 4a,b , 5 ). Кроме того, наличие свободного атома водорода –NH– имидазольного цикла в структуре алленов делает возможным их дальнейшую внутримолекулярную циклизацию с замыканием тиазолиевого цикла и образованием конденсированных [1,3]тиазолобензимидазолиевых систем ( 6a,b , 9a,b ). Очевидно, что в случае соединения 2b , где R = CH 3 и атомы азота являются неравноценными, возможно образование двух дополнительных продуктов циклизации ( 7 , 8 ).
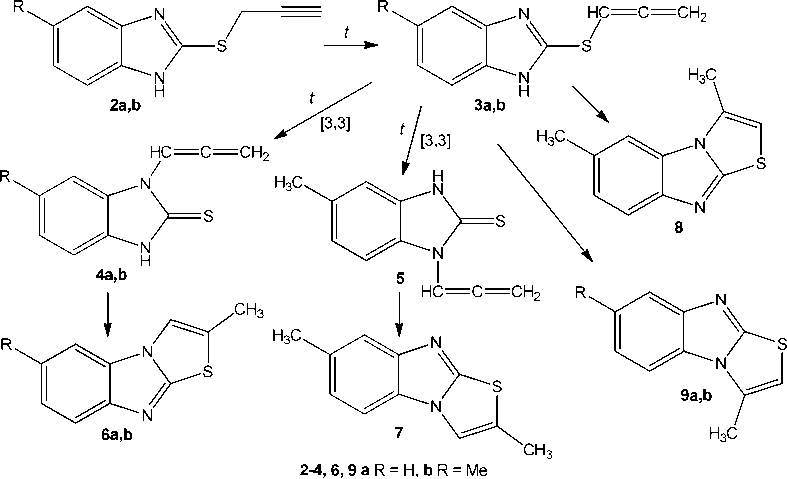
Схема 2. Алкин-алленовая перегруппировка 5-R-2-пропаргилсульфанилбензимидазолов (2a,b) и последующие химические превращения
С целью дальнейшего исследования в этом направлении и поиска путей синтеза производных [1,3]тиазолобензимидазола в условиях ацетилен-алленовой перегруппировки нами были осуществлены следующие эксперименты:
-
1) термическое воздействие (до 200 °С) на соединение 2b без растворителя;
-
2) реакции соединений 2a,b в системе KOH–ДМСО;
-
3) взаимодействие бензимидазолтиолов 1a,b с пропаргилбромидом в системе MeONa–MeOH.
Остаток, полученный после термической обработки 5-метил-2-пропаргилсульфанил-бензимидазола 2b без растворителя при температуре около 200 °C в течение 1,5 ч, был обработан ацетоном, и выделенное после фильтрования масло исследовано методом ГХ–МС. Согласно данным ГХ–МС анализа, исследуемое масло содержало исходный пропаргилсульфид 2b , который прореагировал не полностью, однако относительное количество изомерных ему продуктов, образующихся, вероятно, в результате ацетилен-алленовой перегруппировки и последующих превращений, увеличилось.
Нами также были исследованы реакции соединений 2a,b в системе КОН–ДМСО, при этом для S-пропаргильного производного 2b реакция была изучена нами впервые. По данным ЯМР 1Н, в случае 2-пропаргилсульфанилбензимидазола 2a в результате данной реакции наблюдается внутримолекулярное замыкание цикла и образование трициклической системы 3-метил-[1,3]тиазоло[3,2- a ]бензимидазола ( 9a ) с выходом 56 % (схема 3).
В спектре ЯМР ¹Н соединения 9а присутствуют синглеты (с небольшим расщеплением вследствие дальнего спин-спинового взаимодействия) протонов СН 3 -группы и ароматического протона тиазолиевого цикла при δ 2,74 и 6,86 м.д. соответственно. Полученные нами спектральные данные ЯМР ¹Н полностью совпадают с данными в работах [21, 22]. Кроме того, в работе [22] соединение 9а было синтезировано взаимодействием бензимидазол-2-тиола 1а с 1,3-дихлор-ацетоном и исследовано методом РСА.
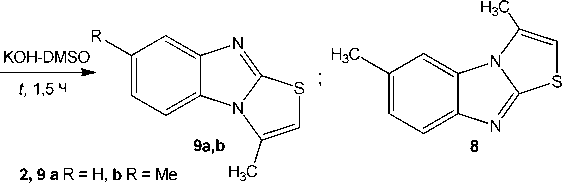
Схема 3. Гетероциклизация 5-R-2-пропаргилсульфанилбензимидазолов (2a,b) в системе KOH–ДМСО
Найдено, что в отличие от соединения 2а 5-метил-2-пропаргилcульфанилбензимидазол 2b при нагревании в системе КОН–ДМСО претерпевает внутримолекулярную циклизацию с образованием смеси продуктов ангулярного и линеарного строения: 3,7-диметил[1,3]тиазоло[3,2- a ]-бензимидазола ( 9b ) и 3,6-диметил[1,3]тиазоло[3,2- a ]бензимидазола ( 8 ) в соотношении ≈ 1,0 : 1,0.
В спектре ЯМР ¹Н смеси тиазолобензимидазолов 9b и 8 присутствует два набора сигналов протонов. В частности, два синглета протонов –SCH= при δ 6,71 м.д. и синглеты протонов двух групп 3-СH 3 , образующихся в результате циклизации, при δ 2,71 ( 8 ) и 2,73 ( 9b ) м.д.
Исследование взаимодействия бензимидазолтиолов 1a,b c пропаргилбромидом в системе MeONa–MeOH было осуществлено нами с использованием условий, ранее описанных в статье Ярошенко и соавторов [12]. По данным авторов этой работы, в результате реакции соединения 1а c пропаргилбромидом в системе MeONa–MeOH был выделен устойчивый в кристаллическом виде аллен – 2-(1,2-пропадиенил)cульфанилбензимидазол ( 3а ).
Однако нами в этой же реакции была получена смесь продуктов: образующиийся аллен 3а частично претерпевает внутримолекулярную гетероциклизацию с образованием тиазолобензи-мидазола 9а (схема 4). По данным ЯМР 1Н, соотношение аллена 3а и продукта замыкания цикла 9а в смеси составляет ≈ 1,0 : 0,5. Доказательством образования аллена 3а является наличие в спектре ЯМР 1Н дублета метиленовых протонов =CH 2 при δ 5,30 м.д. и триплета протона –SCH= при δ 6,62 м.д., что согласуется с данными, приведенными в работе [12], и со справочными данными [23]. Второй набор сигналов протонов в спектре представлен сигналами, соответствующими структуре трициклической системы 9а и содержит, в частности, синглеты (с расщеплением) протонов СН 3 -группы и тиазольного протона –SCH= при δ 2,74 и 6,86 м.д. соответственно.
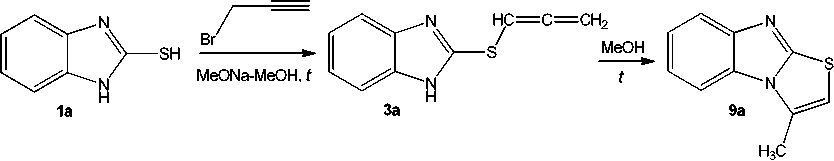
Схема 4. Взаимодействие бензимидазол-2-тиола (1а) с пропаргилбромидом в системе MeONa–MeOH
Реакция 5-метилбензимидазол-2-тиола 1b c пропаргилбромидом в системе MeONa–MeOH (схема 5) исследована нами впервые, в результате чего, по данным ЯМР 1Н, получена смесь двух продуктов гетероциклизации, 3,7-диметил[1,3]тиазоло[3,2- a ]бензимидазола 9b и 3,6-диметил-[1,3]тиазоло[3,2- a ]бензимидазола 8 в соотношении ≈ 1,0 : 1,0.
В смеси также присутствует минорное количество аллена – 5-метил-2-(1,2-пропадиенил)cульфанилбензимидазола ( 3b ). Об этом свидетельствует наличие в спектре ЯМР 1Н, кроме двух наборов сигналов протонов продуктов гетероциклизации 9b и 8 , дублета метиленовых протонов =CH 2 при δ 5,30 м.д. и триплета протона –SCH= при δ 6,60 м.д. аллена 3b .
В литературе описаны примеры гетероциклизации 2-пропаргилсульфанил- и 5-метил-2-пропаргилсульфанилбензимидазолов 2a,b в различных условиях [16, 17, 24, 25], однако реакции их гетероциклизации под действием галогенов ранее не были изучены.
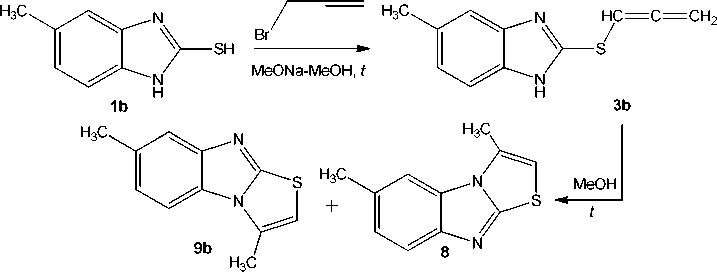
Схема 5. Взаимодействие 5-метилбензимидазол-2-тиола (1b) с пропаргилбромидом в системе MeONa–MeOH
Нами впервые исследовано иодирование соединений 2a,b в хлороформе и соединения 2a в ледяной уксусной кислоте при соотношении исходных реагентов, равном 1:2.
Установлено, что реакция 2-пропаргилсульфанилбензимидазола 2a с двукратным избытком йода в хлороформе сопровождается образованием маслянистого полииодида 3-иодметилено-2,3-дигидро-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия ( 10а ), действием на который иодида натрия в ацетоне выделен индивидуальный иодид ( 11 ). Иодированием 5-метил-2-пропаргилсульфанил-бензимидазола 2b в аналогичных условиях синтезирован кристаллический полииодид 3-иод-метилено-6-метил-2,3-дигидро-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия ( 10b ) (схема 6).
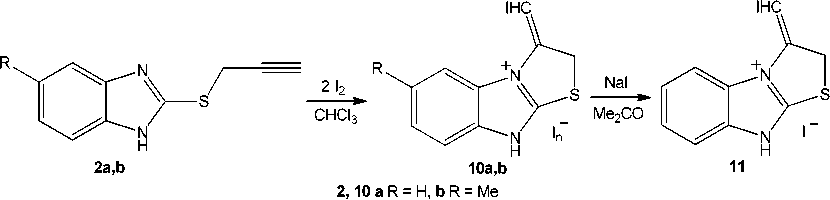
Схема 6. Иодциклизация 5-R-2-пропаргилсульфанилбензимидазолов (2a,b) в CHCl 3
Структура иодида 11 и полииодида 10b доказана методом ЯМР 1Н. Картина расщепления сигналов протонов в их спектрах идентичная: синглеты протонов –SCH 2 – с характерным дублетным расщеплением (4J = 2,4 Гц) вследствие дальнего спин-спинового взаимодействия расположены при δ 4,61 ( 11 ) и 4,60 ( 10b ) м.д., а синглеты протонов =CHI имеют характерное триплетное расщепление (4J = 2,4 Гц) и резонируют при δ 6,85 ( 11 ) и 6,84 ( 10b ) м.д.
Неожиданный результат реакции наблюдался при смене растворителя и осуществлении иодирования 2-пропаргилсульфанилбензимидазола 2а в ледяной уксусной кислоте при том же соотношении исходных реагентов (1:2). Первоначально образующийся полииодид 10а полностью изомеризуется в продукт гетероциклизации с эндоциклической двойной связью – полииодид 3-иодметил-9 Н -[1,3]тиазоло[2,3- b ]бензимидазолия ( 12 ) (схема 7).
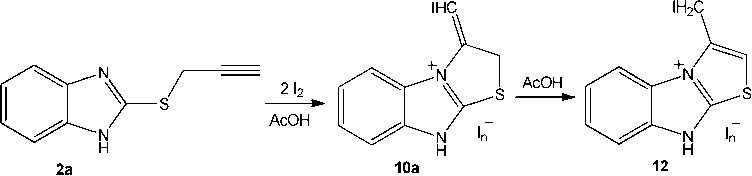
Схема 7. Иодциклизация 2-пропаргилсульфанилбензимидазола (2a) в AcOH
Структура кристаллического полииодида 12 , выделенного нами в индивидуальном виде, доказана методом ЯМР 1Н. В спектре, в частности, имеются сигналы протонов группы –CH 2 I и протона –SCH= тиазольного цикла при δ 4,54 и 7,24 м.д. соответственно. Кроме того, вследствие образования заряженной конденсированной системы сигналы ароматических протонов бензимида-зольного цикла закономерно смещены в более слабое поле по сравнению с сигналами искомых протонов в спектре исходного соединения 2а .
Заключение
Установлено, что гетероциклизация 2-пропаргилсульфанилбензимидазола и 5-метил-2-про-паргилсульфанилбензимидазола в условиях ацетилен-алленовой перегруппировки (при нагревании, в системе КОН–ДМСО или MeONa–MeOH) является удобным методом синтеза конденсированных [1,3]тиазолобензимидазолиевых систем. Иодирование целевых соединений в хлороформе и в ледяной уксусной кислоте позволяет синтезировать иодсодержащие аналоги указанных систем, при этом выявлена зависимость структуры продуктов иодциклизации от природы (полярности) растворителя.
Список литературы Синтез и исследование свойств 5-r-2-пропаргилсульфанилбензимидазолов
- Машковский М.Д. Лекарственные средства. М.: Новая волна, 2021. 1216 с.
- Synthesis of novel benzimidazole and benzothiazole derivatives bearing a 1,2,3-triazole ring system and their acetylcholinesterase inhibitory activity / L. Faraji, S. Shahkarami, H. Nadri et al. // J. Chem. Res. 2017. Vol. 41, no. 1. P. 30-35. DOI: 10.3184/174751917X14836231670980.
- One pot click chemistry: a three component reaction for the synthesis of 2-mercapto-benzimidazole linked coumarinyl triazoles as anti-tubercular agents / A. Anand, M.V. Kulkarni, S.D. Joshi et al. // Bioorg. Med. Chem. Lett. 2016. Vol. 26, no. 19. P. 4709-4713. DOI: 10.1016/j.bmcl.2016.08.045.
- Narasimhan B., Sharma D., Kumar P. Benzimidazole: a medicinally important heterocyclic moiety // Med. Chem. Res. 2012. Vol. 21. P. 269-283. DOI: 10.1007/s00044-010-9533-9.
- Bansal Y., Silakari O. The therapeutic journey of benzimidazoles: a review // Bioorg. Med. Chem. 2012. Vol. 20, no. 21. P. 6208-6236. DOI: 10.1016/j.bmc.2012.09.013.
- Yadav G., Ganguly S. Structure activity relationship (SAR) study of benzimidazole scaffold for different biological activities: a mini-review // Eur. J. Med. Chem. 2015. Vol. 97. P. 419-443. DOI: 10.1016/j.ejmech.2014.11.053.
- Antihelminthic activity of some newly synthesized 5(6)-(un)substituted-1#-benzimidazol-2-ylthioacetylpiperazine derivatives / A.T. Mavrova, K.K. Anichina, D.I. Vuchev et al. // Eur. J. Med. Chem. 2006. Vol. 41, no. 12. P. 1412-1420. DOI: 10.1016/ j.ejmech.2006.07.005.
- Desai K.G., Desai K.R. Green route for the heterocyclization of 2-mercapto-benzimidazole into P-lactum segment derivatives containing -CONH- bridge with benzimidazole: screening in vitro antimicrobial activity with various microorganisms // Bioorg. Med. Chem. 2006. Vol. 14, no. 24. P. 82718279. DOI: 10.1016/j.bmc.2006.09.017.
- Susceptibility in vitro of clinically metronidazole-resistant Trichomonas vaginalis to nitazox-anide, toyocamycin, and 2-fluoro-2'-deoxyadenosine / J.M. Wright, L.A. Dunn, Z. Kazimierczuk et al. // Parasitol. Res. 2010. Vol. 107. P. 847-853. DOI: 10.1007/s00436-010-1938-3.
- Proline 6is-amides as potent dual orexin receptor antagonists / J.M. Bergman, A.J. Roecker, S.P. Mercer et al. // Bioorg. Med. Chem. Lett. 2008. Vol. 18. P. 1425-1430. DOI: 10.1016/j.bmcl.2008.01.001.
- Derivatives of benzimidazole pharmacophore: synthesis, anticonvulsant, antidiabetic and DNA cleavage studies / R.V. Shingalapur, K.M. Hosamani, R.S. Keri et al. // Eur. J. Med. Chem. 2010. Vol. 45, no. 5. P. 1753-1759. DOI: 10.1016/j.ejmech.2010.01.007.
- Interaction of benzimidazole-2-thione with propargyl bromide and 1,3-dibromopropyne / T.I. Yаroshenko, A.S. Nakhmanovich, L.I. Larina et al. // Chem. Heterocycl. Compd. 2008. Vol. 44, no. 9. P. 1129-1134. DOI: 10.1007/s10593-008-0166-6.
- Study on halogen promoted cyclization of 2-alkynylthiobenzimidazoles / I. Misiunaite, R. Buksnaitiene, J. Posiunas et al. // J. Heterocycl. Chem. 2022. Vol. 59, no. 10. P. 1712-1722. DOI: 10.1002/jhet.4499.
- Cyclization of thiopropargyl benzimidazoles by combining iron(III) chloride and diorganyl dis-elenides / T.A.C. Goulart, J.A.G. Kazmirski, D.F. Back et al. // J. Org. Chem. 2019. Vol. 84, no. 21. P. 14113-14126. DOI: 10.1021/acs.joc.9b02276.
- Il'inykh E.S., Kim D.G. Study on reaction of 2-allylthiobenzimidazole with bromine // Bulletin of the South Ural State University, Ser. Chemistry. 2015. Vol. 7, no. 3. P. 19-24.
- Pd-Cu catalyzed heterocyclization during Sonogashira coupling: synthesis of 3-benzyl-thiazolo[3,2-a]benzimidazole / M.M. Heravi, A. Keivanloo, M. Rahimizadeh et al. // Tetrahedron Lett. 2004. Vol. 45, no. 29. P. 5747-5749. DOI: 10.1016/j.tetlet.2004.05.094.
- The activity of magnesium/aluminum «Memory Effect» reconstructed hydrotalcites in the microwave-assisted synthesis of 2-benzimidazolethiol and its alkylated derivatives / D.Y. Cruz-Gonzalez, R. Gonzalez-Olvera, D. Angeles-Beltran et al. // Synthesis. 2013. Vol. 45, no. 23. P. 3281-3287. DOI: 10.1055/s-0033-1339763.
- Balasubramanian K.K., Venugopalan B. Studies in Claisen rearrangement. Claisen rearrangement of 2-propargylthiobenzimidazoles // Tetrahedron Lett. 1974. Vol. 15, no. 31. P. 2643-2644. DOI: 10.1016/S0040-4039(01)92315-9.
- Трофимов Б.А., Гусарова Н.К. Ацетилен: новые возможности классических реакций // Успехи химии. 2007. Т. 76, № 6. С. 550-570. DOI: 10.1070/RC2007v076n06 ABEH003712.
- Темникова Т.И., Семенова С.Н. Молекулярные перегруппировки в органической химии. Ленинград: Химия, 1983. 41 с.
- Потапов В.А., Малинович Д.А., Амосова С.В. Разработка эффективных методов синтеза новых гетероциклических соединений, содержащих азот и халькогены, с потенциальной биологической активностью // Бюллетень ВСНЦ СО РАМН. 2012. Т. 88, № 6. С. 74-76.
- Mechanism of formation of 3-methyl derivatives of imidazo[2,1-6]thiazoles and their benzo analogs in the reactions of 2-mercaptoimidazole and 2-mercaptobenzimidazole with 1,3-dichloroacetone under phase-transfer catalysis conditions / T. Beresneva, S. Belyakov, E. Abele et al. // Chem. Hetero-cycl. Compd. 2011. Vol. 46, no. 11. P. 1400-1404. DOI: 10.1007/s10593-011-0678-3.
- Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. М.: Мир, 2009. 439 с.
- A palladium iodide-catalyzed cyclocarbonylation approach to thiadiazafluorenones / L. Veltri, V. Paladino, P. Plastina et al. // J. Org. Chem. 2016. Vol. 81, no. 14. P. 6106-6111. DOI: 10.1021/acs.joc.6b01028.
- Palladium catalyzed cyclocarbonylation approach to thiadiazafluorenones: a correction / L. Veltri, R. Amuso, C. Cuocci et al. // J. Org. Chem. 2019. Vol. 84, no. 13. P. 8743-8749. DOI: 10.1021/acs.joc.9b01043.


