Синтез и исследование свойств 7-замещенных теофиллинов
Автор: Петрова Ксения Юрьевна, Ким Дмитрий Гымнанович, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.12, 2020 года.
Бесплатный доступ
В настоящей работе впервые алкилированием теофиллина алкенилгалогенидами в ДМФА в присутствии K2CO3 при нагревании на водяной бане (100 ºС) получены 7-(2-бромаллил)- и 7-циннамилтеофиллины. Методом масс-спектрометрии на газовых хромато-масс-спектрометрах GCMS-QP2010 UltraShimadzu и Agilent 6890 N проведен анализ спектров полученных алкенилтеофиллинов и изучено поведение при электронной ионизации, выявлены закономерности фрагментации молекул. Максимальной интенсивностью в масс-спектре 7-циннамилтеофиллина обладает пик, принадлежащий циннамил-катиону, пик с m/z 91 свидетельствует об образовании тропилий-катиона. В случае 7-(2-бромаллил)теофиллина максимальной интенсивностью обладает катион, обусловленный элиминированием бром-радикала. 7-(2,2,3-Трибромпропил)теофиллин и 7-(2,3-дибром-3-фенилпропил)теофиллин получены присоединением брома по двойной связи 7-(2-бромаллил)- и 7-циннамилтеофиллина в CHCl3 при комнатной температуре. Структуры продуктов реакции подтверждены методами протонного магнитного резонанса и масс-спектрометрии. Структура 7-(2,2,3-трибромпропил)теофиллина подтверждена методом РСА, в кристалле присутствуют по два типа кристаллографически независимых молекул, геометрические параметры которых незначительно отличаются. В масс-спектрах галогенсодержащих соединений проявляется характерное распределение изотопных пиков молекулярного иона: дублет с соотношением интенсивностей приблизительно 1:1 для соединения с одним атомом брома, триплет пиков в случае наличия двух атомов брома, а также квартет в соотношении 1:3:3:1 для трибромсодержащих производных. Взаимодействие 7-пропаргилтеофиллина с бромом в CHCl3 при комнатной температуре останавливается на стадии присоединения одной молекулы, в результате получен 2,3-дибромаллилтеофиллин, что доказано методами протонного магнитного резонанса и масс-спектрометрии. Взаимодействие 7-(2,3-дибромпропил)теофиллина с о -фенилендиамином в ацетонитриле при комнатной температуре приводит к аннелированию хиноксалинового кольца. В спектре ЯМР 1Н характерным является появление сигналов ароматического кольца при 6,85-7,05 м.д.
Теофиллин, 7-(2-бромаллил)теофиллин, 7-циннамилтеофиллин, 7-(2, 2, 3-трибромпропил)теофиллин, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147233162
IDR: 147233162 | УДК: 546.865 | DOI: 10.14529/chem200111
Текст научной статьи Синтез и исследование свойств 7-замещенных теофиллинов
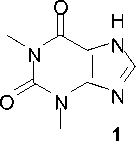
Известно, что производные ксантина обладают широким спектром биологической активности, в частности среди них найдены вещества, обладающие антибактериальной, противоаллергической, противовоспалительной, противогрибковой, антиокислительной и инсектицидной активностью [1–6]. Ранее в литературе алкилированием теофиллина ( 1 ) получены различные N7-замещенные производные, в том числе 7-аллил- ( 2a ) [7–11] и 7-пропаргилтеофиллин ( 2d ) [9, 12– 16]. Нами ранее в работе [17] проведен анализ масс-спектров и изучено поведение при электронной ионизации теофиллинов 2a и 2d .
Обсуждение результатов
В настоящей работе алкилированием теофиллина 1 в ДМФА в присутствии K 2 CO 3 при нагревании на водяной бане (100 ºС) впервые получены 7-(2-бромаллил)теофиллин ( 2b ) и 7-циннамилтеофиллин ( 2c ) (схема 1).
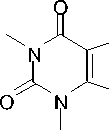
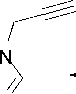
N
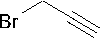
2d
K 2 CO 3 , DMF

R 1
K2CO3, DMF
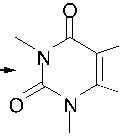
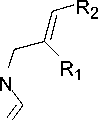
N
2a-c
Схема 1
a R 1 = H, R 2 = H; b R 1 = Br, R 2 = H, c R 1 = H, R 2 = Ph
В масс-спектрах соединений 2b , c присутствуют пики молекулярных ионов. В случае бро-маллилтеофиллина 2b он обладает характерной мультиплетностью. Максимальной интенсивностью в масс-спектре циннамилтеофиллина 2c обладает пик с m/z 117, принадлежащий цин-намил-катиону A , при этом пик с m/z 91 свидетельствует об образовании тропилий-катиона B (схема 2).
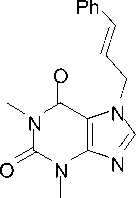
- C 7 H 7 N 4 O 2
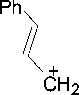
- C 2 H 2
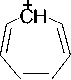
2c m/z 296
A m/z 117
B m/z 91
Схема 2
В случае бромаллилтеофиллина 2b максимальной интенсивностью обладает катион C , обусловленный элиминированием бром-радикала. Пики с m/z 162 ( D ) и 134 ( E ) свидетельствуют о дальнейшем элиминировании метилизоцианата и СО (схема 3).
NN
N
+
.
- Br
N
N - CH 3 NCO
C m/z 219
Схема 3
O< C
N
2b
m/z 298
N
N N - CO N N
D m/z 162
E m/z 134
Ранее нами в работах [17, 18] было показано, что взаимодействие 7-алкенил-8-хлортеофиллинов и 7-аллилтеофиллина с бромом протекает с образованием продуктов присоединения по двойной связи – 7-(2,3-дибромалкил)теофиллинов. В частности реакция теофиллина 2a с бромом приводит к образованию 7-(2,3-дибромпропил)теофиллина ( 3a ). В работе [19] показано, что бром реагирует с 1-аллилтебромином с образованием продукта присоединения по двойной связи, а с 1-металлилтеобромином – смеси оксазолопуринов линеарного и ангулярного строения и 1-(2,3-дибром-2-метилпропил)теобромина.
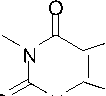
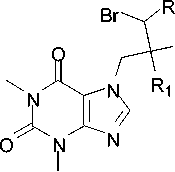
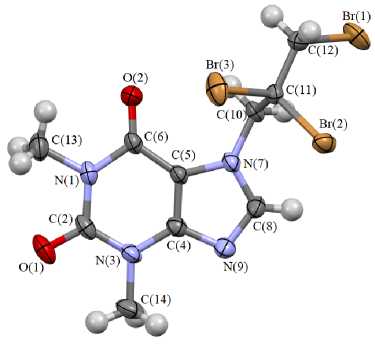
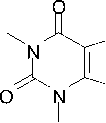
В настоящей работе нами взаимодействием аллилтеофиллинов 2b , c с бромом получены 7-(2,2,3-трибромпропил)теофиллин ( 3b ) и 7-(2,3-дибром-3-фенилпропил)теофиллин ( 3с ) (схема 4). Структура соединения 3b подтверждена методом РСА (см. рисунок).
2a-c
Br2
CHCl3
3a-c
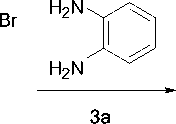
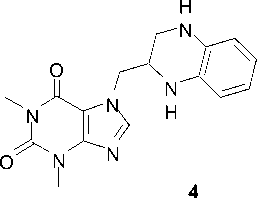
Схема 4
a R 1 = R 2 = H, b R 1 = Br, R 2 = H, c R 1 = H, R 2 = Ph
В кристалле соединения 3b присутствуют по два типа кристаллографически независимых молекул, геометрические параметры которых незначительно отличаются.
Строение соединения 3b
Строение дибромпропилтеофиллина 3а подтверждается превращением в 7-((1,2,3,4-тетрагидрохиноксалин-2-ил)метил)теофиллин ( 4 ) при его взаимодействии с о -фенилендиамином в ацетонитриле при комнатной температуре (схема 4). В спектре ЯМР 1Н характерным является появление сигналов ароматического кольца при 6,85–7,05 м.д.
Теоретически взаимодействие пропаргилтеофиллина 2d с бромом может приводить к образованию как 2,3-дибромаллилтеофиллина ( 3d ), так и 2,2,3,3-тетрабромпропилтеофиллина ( F ). Методами ЯМР 1Н и ХМС нами доказано, что реакция останавливается на образовании соединения 3d (схема 5), в спектре ЯМР характерным является однопротонный триплет =СHBr при 7,24 м.д.
2d
Br 2
CHCl 3
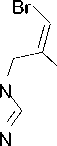
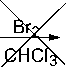
3d
Схема 5
Экспериментальная часть
Спектры ЯМР 1Н (500 МГц) соединений 3b , 3d записаны на приборе Bruker AVANCE-500. Спектры ЯМР 1Н (400 МГц) соединений 2b , c , 3c , 4 записаны на приборе Bruker DRX-400. Внутренний стандарт – ТМС, растворитель – ДМСО-d6.
Масс-спектры соединений 2b , c , 3c сняты на газовом хромато-масс-спектрометре Agilent 6890 N (ЭУ, 70 эВ). Масс-спектры электронного удара соединений 3b сняты на газовом хро-мато-масс-спектрометре GCMS-QP2010 UltraShimadzu (ЭУ, 70 эВ).
Рентгеноструктурное исследование соединения 3b проведено на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [20]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [21]. Структура соединения определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полный набор рентгеноструктурных данных депонирован в Кембриджском банке структурных данных (CCDC 1905740).
Синтез соединений 2b, c. Общая методика
К раствору 276 мг (2 ммоль) безводного карбоната калия в 10 мл ДМФА добавляли 360 мг (2 ммоль) теофиллина, смесь нагревали на водяной бане с обратным холодильником в течение 30 минут. К полученному раствору добавили раствор 2 ммоль алкилирующего агента в 1 мл ДМФА. Полученную смесь нагревали на водяной бане с обратным холодильником в течение 6 ч. Полученный осадок отфильтровывали, фильтрат испаряли. Продукт экстрагировали хлороформом, растворитель испаряли.
7-(2-Бромаллил)теофиллин (2b). Выход 514 мг (86 %), белый порошок, т. пл. 95–97 °С. Спектр ЯМР 1Н (ДМСО- d 6 ), δ, м.д.: 3,21 с (3Н, N1CH 3 ), 3,43 с (3Н, N3CH 3 ), 5,19 c (2Н, NCH 2 ), 5,70 д (1H, =CHH, 2 J 1,9 Гц), 5,85 д (1Н, =CHH, 2 J 1,9 Гц), 8,14 c (1Н, Н 8 ). Масс-спектр, m/z ( I отн. , %): 300 [M+2]+ (6,8), 298 [M]+• (7,5), 220 (12,6), 219 [M–Br]+ (100), 162 [M–Br–CH 3 NCO]+ (17,7), 135 (7,0), 134 [M–Br–CH 3 NCO–CO]+ (24,6), 107 [M–Br–CH 3 NCO–CO–HCN]+ (23,1), 95 (9,2), 94 [C 4 H 4 N 3 ]+ (17,0), 81 [C 5 H 7 N]+• (5,7), 68 (10,1), 67 (24,4), 66 (7,4), 53 [C 2 HN 2 ]+ (6,2), 42 (10,8), 41 [C 2 H 3 N]+• (6,2), 40 (8,3), 39 (20,2).
7-Циннамилтеофиллин (2c). Выход 440 мг (74 %), белый порошок, т. пл. 94–95 °С. Спектр ЯМР 1Н (ДМСО- d 6 ), δ, м.д.: 3,23 с (3Н, N1CH 3 ), 3,43 с (3Н, N3CH 3 ), 5,07 д (2H, NCH 2 , 3 J 5,6 Гц), 6,49 дт (1H, =СН, 3 J 15,9 Гц, 3 J 5,6 Гц), 6,58 д (1H, =СНC 6 H 5 , 3 J 15,9 Гц), 7,21–7,42 м (5H, C 6 H 5 ), 8,14 с (1H, Н8). Масс-спектр, m/z ( I отн. , %): 296 [M]+• (28,0), 117 [C 9 H 9 ]+ (100), 91 [C 7 H 7 ]+ (14,3). ИК-спектр, ν, см - 1: 3099 (=CH 2 ), 1705 (C=O), 1666 (C=O), 1598 (С-С ар ), 1475 (С-С ар ), 923 (=CH).
Синтез соединений 3b-d . Общая методика . К раствору 0,5 ммоль 7-органилтеофиллина в 4 мл хлороформа добавляли раствор 0,052 мл (1 ммоль) Br 2 в 2 мл хлороформа. Полученную смесь перемешивали на магнитной мешалке в течение 1 ч и оставляли на сутки. Полученный осадок отфильтровывали и сушили.
7-(2,2,3-Трибромпропил)теофиллин (3b). Выход 93 мг (62 %), желтые кристаллы, т. пл. 160–162 °С. Спектр ЯМР 1Н (ДМСО- d 6 ), δ, м.д.: 3,26 с (3Н, N1CH 3 ), 3,50 с (3Н, N3CH 3 ), 4,40 с (2H, СН 2 Br), 5,35 с (3H, NСH 2 ), 8,18 c (1Н, Н 8 ). Масс-спектр, m/z ( I отн. , %): 462 (10,8), 460 (27,0), 458 (29,8), 456 [ M ]+• (10,9), 381 (49,7), 379 (100), 377 [ M -Br]+ (50,0), 299 (8,1), 297 [ M -Br 2 ]+• (8,2), 219 [ M -Br 3 ]+ (77,0), 218 [ M -Br 2 -HBr]+• (29,7), 193 [ M -Br 3 -HCN]+ (52,7), 180 [C 7 H 8 N 4 O 2 ]+• (27,0), 162 (18,9), 152 (16,2), 134 (28,4), 128 (32,4), 109 (28,4), 107 (29,7), 95 (43,2), 94 (54,0), 81 (25,0), 67 (62,1), 53 (12,2), 42 (24,5), 39 (39,2).
7-(2,3-Дибром-3-фенилпропил)теофиллин (3с). Выход 96 мг (70 %), белый порошок, т. пл. 146–148 °С. Спектр ЯМР 1Н (ДМСО- d 6 ), δ, м.д: 3,27 с (3Н, N1CH 3 ), 3,44 с (3Н, N3CH 3 ), 4,66 дд (1H, NCHH, 3 J 10,7 Гц, 2 J 14,4 Гц), 5,25 дд (1H, NCHH, 3 J 3,0 Гц, 2 J 14,4 Гц), 5,38 тд (1H, СНBr, 3 J 10,7 Гц, 3 J 3,0 Гц, 3 J 10,0 Гц), 5,72 д (1H, СНBrC 6 H 5 , 3 J 10,0 Гц), 7,34 д (1Н, пара -Ph, 3 J 7,3 Гц), 7,41 т (2Н, мета -Ph, 3 J 7,3 Гц), 7,51 д (2Н, орто -Ph, 3 J 7,3 Гц), 8,14 c (1Н, Н 8 ). Масс-спектр, m/z ( I отн. , %): 456 [M]+• (4,9), 378 (6,7), 377 [M–Br]+ (31,6), 376 (6,7), 375 (35,3), 296 [M–Br 2 ]+• (6,6), 193 (34,8), 118 (10,6), 117 [C 9 H 9 ]+ (100), 116 (41,3), 115 (88,8), 109 (6,2), 94 (5,0), 91 [C 7 H 7 ]+ (23,1), 81 (7,3), 67 (5,1), 32 (13,3), 28 (37,9).
7-(2,3-Дибромаллил)теофиллин (3d). Выход 132 мг (70 %), оранжевые кристаллы, т. пл. 176–177 °С. Спектр ЯМР 1Н (ДМСО- d 6 ), δ, м.д: 3,22 с (3Н, N1CH 3 ), 3,44 с (3Н, N3CH 3 ), 5,36 д (2Н, NСH 2 , 4 J 1,2 Гц) , 4,88 т (1Н, =CHBr, 4 J 1,2 Гц), 8,16 c (1Н, Н 8 ).
7-((1,2,3,4-Тетрагидрохиноксалин-2-ил)метил)теофиллин (4). К раствору 300 мг (0,79 ммоль) 7-(2,3-дибромпропил)теофиллина в 10 мл ацетонитрила добавить раствор 85 мг (0,79 ммоль) о -фенилендиамина в 5 мл ацетонитрила. Полученную смесь перемешивали на магнитной мешалке в течение 4 ч. Растворитель испаряли и экстрагировали продукт этиловым спиртом. Вещество выделяют в виде коричневого масла. Выход 50 мг (20 %). Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 ): 3,21 с (3Н, N1CH 3 ), 3,42 с (3H, N3CH 3 ), 3,99 д (2Н, NCH 2 , 3 J 5,4 Гц), 4,59 дд (1Н, NHCHH, 2 J 14,3 Гц, 3 J 9,1 Гц), 4,79 дд (1Н, NHCHH, 2 J 14,3 Гц, 3 J 4,7 Гц), 4,87 м (1Н, NHCH, 3 J 5,4 Гц, 3 J 9,1 Гц, 3 J 4,7 Гц), 6,89–7,01 м (4Н, C 6 H 4 ), 8,14 с (1Н, Н 8 ).
Выводы
Таким образом, алкилирование теофиллина алкенил(пропаргил)галогенидами протекает с образованием 7-алкенил(пропаргил)теофиллинов. Взаимодействие 7-алкенил(пропаргил)теофил-линов с бромом протекает с образованием дибромалкилтеофиллинов, а реакция 7-(2,3-дибромпропил)теофиллина с о-фенилендиамином приводит к аннелированию хиноксалинового кольца.
Список литературы Синтез и исследование свойств 7-замещенных теофиллинов
- Synthesis and Biological Activities of Novel Methyl Xanthine Derivatives / Y. Chen, B. Wang, Y. Guo et al. // Chem. Res. Chin. Univ. - 2014. - V. 30, № 1. - P. 98-102. DOI: 10.1007/s40242-014-3173-4
- Synthesis and Antiaggregant Activity of 8-Substituted 1-Alkyl-3-Methyl-7-(1-Oxothietan-3-yl)Xanthines / Yu.V. Shabalina, F.A. Khaliullin, A.A. Spasov et al. // Pharm. Chem. J. - 2013. - V. 47, № 3. - P. 151-153. DOI: 10.1007/s11094-013-0915-4
- The Synthesis and the Biological Evaluation of New Thiazolidin-4-one Derivatives Containing a Xanthine Moiety / F.G. Lupascu, O.M. Dragostin, L. Foia et al. // Molecules. - 2013. - V. 8, № 18. - P. 9684-9703. DOI: 10.3390/molecules18089684
- Synthesis and Antiallergic Activity of 7-Substituted Theophylline Derivatives / R.G. Glushkov, I.M. Ovcharova, V.B. Nikitin et al. // Pharm. Chem. J. - 1989. - V. 23, № 10. - P. 849-852. DOI: 10.1007/bf00764818
- Design and Synthesis of Some New Theophylline Derivatives with Bronchodilator and Antibacterial Activities / A.M. Hayallah, W.A. Elgaher, O.I. Salem et al. // Arch. Pharmacal Res. - 2011. - V. 34, № 1. - P. 3-21. DOI: 10.1007/s12272-011-0101-8
- Hayallah, A.M. Design and Synthesis of New 8-Anilide Theophylline Derivatives as Bronchodilators and Antibacterial Agents / A.M. Hayallah, A.A. Talhouni, M.A. Alim // Arch. Pharmacal Res. - 2012. - V. 35, № 8. - P. 1355-1368.
- DOI: 10.1007/s12272-012-0805-4
- Tanabe, T. The N-Alkylation of Xanthine Derivatives with Trialkyl Phosphates / T. Tanabe, K. Yamauchi, M. Kinoshita // Bull. Chem. Soc. Jpn. - 1976. - № 49. - P. 3224-3226.
- DOI: 10.1246/bcsj.49.3224
- Solid Liquid Phase Transfer Catalysis: Alkylation of Theophylline / G. Bram, Y. Bensaid, C. Combet-Farnoux et al. // Pharmazie. - 1986. - V. 41, № 6. - P. 431-432.
- Daly, J.W. Analogs of Caffeine and Theophylline: Effect of Structural Alterations on Affinity at Adenosine Receptors / J.W. Daly, W.L. Padgett, M.T. Shamim // J. Med. Chem. - 1986. - V. 29, № 7. - P. 1305-1308.
- DOI: 10.1021/jm00157a035
- Caffeine-Based Gold(I) N-Heterocyclic Carbenes as Possible Anticancer Agents: Synthesis and Biological Properties / B. Bertrand, L. Stefan, M. Pirrotta et al. // Inorg. Chem. - 2014. - V. 53, № 4. - P. 2296-2303.
- DOI: 10.1021/ic403011h
- Lysakowska, M. Design, Synthesis, Antiviral, and Cytostatic Evaluation of Novel Isoxazolidine Analogs of Homonucleotides / M. Lysakowska, J. Balzarini, D.G. Piotrowska // Arch. Pharm. - 2014. -V. 347, № 5. - P. 341-353.
- DOI: 10.1002/ardp.201300382
- Design, Synthesis, Anticancer, Antimicrobial Activities and Molecular Docking Studies of Theophylline Containing Acetylenes and Theophylline Containing 1,2,3-Triazoles with Variant Nucleoside Derivatives / R.R. Ruddarraju, A.Ch. Murugulla, R. Kotla et al. // Eur. J. Med. Chem. - 2016. - V. 123. - P. 379-396.
- DOI: 10.1016/j.ejmech.2016.07.024
- ‘Click Synthesis' of 1H-1,2,3-Triazolyl-Based Oxiconazole (=(1Z)-1-(2,4-Dichlorophenyl)-2-(1H-imidazol-1-yl)ethanone O-[(2,4-Dichlorophenyl)methyl]oxime) Analogs / M.N. Soltani Rad, M. Navid, A. Zeinab et al. // Helv. Chim. Acta. - 2011. - V. 94, № 12. - P. 2194-2206.
- DOI: 10.1002/hlca.201100189
- Click Reaction Based Synthesis, Antimicrobial, and Cytotoxic Activities of New 1,2,3-Triazoles / M.R. Sayed Aly, S. Hosam Ali, M. Mosselhi et al. // Bioorg. Med. Chem. Lett. - 2015. - V. 25, № 14. - P. 2824-2830.
- DOI: 10.1016/j.bmcl.2015.04.096
- 1,4-Dihydroxyanthraquinone-copper(II) Nanoparticles Immobilized on Silica Gel: a Highly Efficient, Copper Scavenger and Recyclable Heterogeneous Nanocatalyst for a Click Approach to the Three-Component Synthesis of 1,2,3-Triazole Derivatives in Water / H. Sharghi, A. Khoshnood, M.M. Doroodmand et al. // J. Iran. Chem. Soc. - 2012. - V. 9, № 2. - P. 231-250.
- DOI: 10.1007/s13738-011-0046-3
- Copper/Graphene/Clay Nanohybrid: A Highly Efficient Heterogeneous Nanocatalyst for the Synthesis of Novel 1,2,3-Triazolyl Carboacyclic Nucleosidesvia‘Click'Huisgen1,3-Dipolar Cycloaddition / M.N. Soltani Rad, S. Behrouz, J. Hoseini et al. // Helv. Chim. Acta. - 2015. - V. 98, № 9. - P. 1210-1224.
- DOI: 10.1002/hlca.201500149
- Исследование N-алкильных производных теофиллина методом хроматомасс-спектрометрии / К.Ю. Ошеко, Д.Г. Ким, А.Ф. Алзамили, Т.Д. Еременко // Вестник ЮУрГУ. Серия "Химия". - 2018. - Т. 10, № 4. - С. 12-24.
- Синтез и исследование свойств 7-алкенил(пропаргил)-8-хлортеофиллинов / К.Ю. Петрова, Д.Г. Ким, В.В. Шарутин и др. // ЖОХ. - 2019. - Т. 89, № 11. - С. 1679-1685.
- Взаимодействие 1-аллил(металлил)теобромина с галогенами / К.Ю. Ошеко, Д.Г. Ким, О.С. Ельцов, Т.Д. Еременко // ЖОХ. - 2019. - Т. 89, № 4. - С. 561-565.
- Bruker (2000) SMART. Bruker Molecular Analysis Research Tool, Versions 5.625, Bruker AXS, Madison, Wisconsin, USA.
- Bruker (2000) SAINTPlus Data Reduction and Correction Program Versions 6.02a, Bruker AXS, Madison, Wisconsin, USA.


