Синтез и исследование свойств производных 2-хинолона
Автор: Вершинина Евгения Анатольевна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 31 (207), 2010 года.
Бесплатный доступ
Осуществлен двухстадийный синтез ди- и тризамещенных 2-хинолонов. На примере 4-метил-2-хинолона исследованы реакции нитрования и гало-генирования. Изучено взаимодействие полученных 2-хинолонов с бромистым аллилом.
2-хинолоны, бромистый аллил, n-аллил-2-хинолоны, 2-аллилоксихинолины, нитрохинолоны, бром-, хлор- и иодхинолоны
Короткий адрес: https://sciup.org/147160167
IDR: 147160167 | УДК: 547.83.7
Текст обзорной статьи Синтез и исследование свойств производных 2-хинолона
Производные хинолонов могут выступать в качестве предшественников для синтеза различных соединений, обладающих фармакологической активностью, поэтому они вызывают широкий интерес для исследования [1] и являются объектом изучения многих групп ученых [2]. В литературе имеются данные о нитровании и галогенировании 2-хинолона [3-6], но в то же время мало исследованы реакции электрофильного замещения его производных [5, 7]. Нами получены различные замещенные 2-хинолона и рассмотрены особенности реакции 4-метил-2-хинолона с нитрующей смесью и галогенами. Изучено взаимодействие полученных соединений с бромистым аллилом.
Экспериментальная часть
Контроль за индивидуальностью синтезированных соединений осуществляли методом ТСХ на пластинках Silufol UV-254, элюент: этилацетат - гексан (1:1). Проявляли хроматограммы УФ-светом и парами иода. Спектры ЯМР1 Н полученных соединений записаны на спектрометре Bruker DRX-400 (400 МГц) в ДМСО-йб, внутренний стандарт ТМС. Масс-спектры (ЭУ, 70 эВ) сняты на приборе ГЖХ/МС фирмы HEWLETT PACKARD, газовый хроматограф НР-5890, серия II, масс-селективный детектор НР-5972.
Получение ацетоацетанилидов la-f (общая методика). Свежеперегнанный ацетоуксусный эфир (или этилацетоуксусный эфир) в количестве 0,15 моль растворяют в 25 мл о-ксилола, добавляют раствор 1 ммоль Na в 2 мл этанола и нагревают в перегонной колбе. После начала перегонки постепенно по каплям прибавляют 0,1 моль анилина (или о-, м-, и-толуидина). Прибавление вещества ведется со скоростью, равной скорости отгона. Затем реакционную смесь нагревают еще 30 мин. После сильного охлаждения выпавший осадок соединения 1 отфильтровывают и сушат.
Характеристики соединений 1a-f
Таблица 1
|
Соединение |
Название |
Структурная формула |
Т. пл., °C |
Выход, % |
|
1 |
2 |
3 |
4 |
5 |
|
1а |
Ацетоацетанилид (N-фенил-З-оксобутанамид) |
^^nhcoch2coch3 |
86 |
40 |
|
1b |
Ацетоацет-и-толуидид (Н-(4-метилфенил)-3 -оксобутанамид ) |
^^/NHCOCH2COCH3 |
87 |
57 |
|
1с |
Ацето-2-этилацетанилид (2-Этил-Ы-фенил-3 -оксобутанамид) |
^^^NHCOCH(Et)COCH3 |
93 |
59 |
Окончание табл. 1
|
1 |
2 |
3 |
4 |
5 |
|
Id |
Ацетоацет-о-толуидид (М-(2-метилфенил)-3 -оксобутанамид) |
^^,nhcoch2coch3 |
110 |
63 |
|
1е |
Ацето-2-этилацет-и-толуидид (2-Этил-П-(4-метилфенил)-3 -оксобутанамид) |
^^/NHCOCH(Et)COCH3 |
83 |
61 |
|
If |
Ацето-2-этилацет-л/-толуидид (2-Этил-М(3-метилфенил)-3-оксобутанамид) |
Нзс .^^NHCOCHCB^ |
65 |
50 |
Получение 2-хинолонов 2a-f (общая методика). 10 г ацетоацетанилида 1 постепенно растворяют в 9 мл концентрированной серной кислоты (р=1,84 г/мл). Смесь нагревают до 90-95 °C в течение 20 мин. После охлаждения до 60 °C реакционную массу выливают в двадцатикратное количество воды той же температуры. При охлаждении выпадает осадок соединения 2, который отфильтровывают, промывают водой и сушат.
Таблица 2 Характеристики соединений 2a-f
|
Соединение |
Название |
Структурная формула |
Т. пл., °C |
Выход, % |
|
2а |
4-Метил-2-хинолон |
сн3 н |
223 |
73 |
|
2Ь |
4,6-Диметил-2-хинолон |
сн3 н3сх/^/-к н |
247 |
72 |
|
2с |
4-Метил-3-этил-2-хинолон |
СК н |
223 |
54 |
|
2d |
4,8-Диметил-2-хинолон |
сн3 1 н сн3 |
221 |
58 |
|
2е |
4,6-Диметил-З-этил-2-хинолон |
сн3 н3с.. н |
235 |
67 |
|
2f |
4,7-Диметил-З-этил-2-хинолон |
сн3 3 н |
165 |
69 |
Нитрование соединения 2а. К раствору 0,636 г (4 ммоль) соединения 2а в 5 мл концентрированной серной кислоты (р=1,84 г/мл) маленькими порциями при перемешивании прибавляют смесь 2 мл концентрированной азотной кислоты (р=1,35 г/мл) и 2 мл концентрированной серной кислоты. Реакционную смесь выливают в воду, выпавший осадок отфильтровывают, промывают водой и сушат. Полученную смесь обрабатывают ацетоном. Нерастворившееся в ацетоне соединение 4а отфильтровывают, сушат. С фильтрата растворитель отгоняют и получают соединение За.
4а - выход 59 %, т. пл. >300 °C; За - выход 15 %, т. пл. >300 °C.
Бромирование соединения 2а в соотношении 1:1 и 1:3. К раствору 0,159 г (1 ммоль) соединения 2а в 5 мл ледяной уксусной кислоты при перемешивании прибавляют соответственно эквимольное количество (0,05 мл) и трехкратный избыток (0,15 мл) брома. Выпавший осадок отфильтровывают, сушат. Затем к осадку прибавляют ацетон, перемешивают несколько минут и снова отфильтровывают. 4Ь - выход 67 %, т. пл. 197 °C.
Хлорирование соединения 2а. Через раствор соединения 2а в 5 мл ледяной уксусной кислоты пропускают ток газообразного хлора до прекращения выпадения осадка. Разбавляют реакционную смесь водой. Выпавший осадок соединений 5с и 6с отфильтровывают, промывают водой и сушат.
Иодирование соединения 2а. К раствору 0,159 г (1 ммоль) соединения 2а в 10 мл ледяной уксусной кислоты прибавляют 0,8 мл концентрированной серной кислоты (р=1,84 г/мл) и 0,254 г (1 ммоль) иода. Смесь растворяют при нагревании, и затем к охлажденному до комнатной температуры раствору добавляют по каплям 0,2 мл концентрированной азотной кислоты (р=1,35 г/мл) и оставляют на ночь. Реакционную смесь выливают в воду, обрабатывают выпавший осадок соединений 3-4d раствором тиосульфата, отфильтровывают, промывают водой и сушат.
Алкилирование соединений 2a-f (общая методика). К 1 ммоль 2-хинолона 2 прибавляют 1,5 ммоль NaOH, растворенного в 0,5 мл воды, и 10 мл 2-пропанола и нагревают до полного растворения вещества. Затем добавляют 1,5 ммоль бромистого аллила в 2 мл 2-пропанола и кипятят в течение 3 ч. Выпавший осадок NaBr отфильтровывают, 2-пропанол отгоняют и выделяют смесь N- и О-аллильных производных 2-хинолонов. Смесь обрабатывают гексаном (3x5 мл). Не растворившийся в гексане осадок растворяют в 15 мл эфира, отфильтровывают и после отгонки растворителя выделяют М-аллил-2-хинолоны 7. С гексанового экстракта растворитель отгоняют и получают 2-аллилоксихинолины 8 в виде бесцветной маслянистой жидкости.
7а - выход 50 %, т. пл. 67 °C; 7Ь - выход 68 %, т. пл. 52 °C; 7с - выход 73 %, т. пл. 48 °C; 7е - выход 83 %, т. пл. 68 °C; 8d - выход 57 %; 8f- выход 65 %.
Алкилирование соединений За; 4а, b; 5Ь, с (общая методика). Смесь 1 ммоль соединения За (или 4а, b; 5Ь, с) и 1,5 ммоль NaOH в 0,5 мл воды растворяют в 10 мл ДМСО, затем добавляют 1,5 ммоль бромистого аллила и нагревают на водяной бане в течение 30 мин. Реакционную смесь выливают в воду, выпавший осадок отфильтровывают, промывают водой и сушат.
9Ь - выход 63 %, т. пл. 142 °C.
Обсуждение результатов
В настоящей работе нами для получения замещенных 2-хинолонов 2a-f был осуществлен синтез по Кнорру [8], включающий 2 этапа: 1) конденсацию анилина и о-, м- и и-толуидинов с ацетоуксусным и этилацетоуксусным эфиром; 2) циклизацию полученных ацетоацетанилидов под действием концентрированной H2SO4:
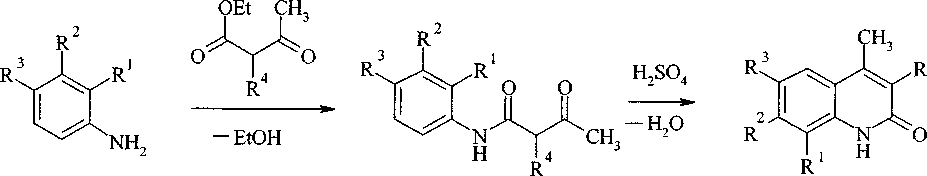
la-f 2a-f
2а R1, R2, R3, R4 = Н; 2b R1, R2, R4 = Н, R3 = СН3; 2с R1, R2, R3 = Н, R4 = С2Н5;
2d R2, R3, R4 = Н, R1 = СН3; 2е R1, R2 = Н, R3 - СН3, R4 = С2Н5;
2f R1, R3 = Н, R2 = СН3, R4 = С2Н5.
В [9] при получении ацетоацетанилидов в качестве катализатора используются органические амины. Нами найдено, что более эффективным катализатором являются алкоголяты металлов.
В случае циклизации соединения If образование С-С связи может осуществляться в о- и «-положениях к аминогруппе. Нами обнаружено, что реакция приводит к образованию единственного продукта 2f, строение которого однозначно доказано данными ЯМР ТН спектра: протон Н-8 дает синглет при 7,08 м.д., а протоны Н-5 и Н-6 - дублеты при 7,62 м.д. и 6,98 м.д. соответственно. Селективное протекание реакции можно объяснить стерическим эффектом метильных групп анилида If:
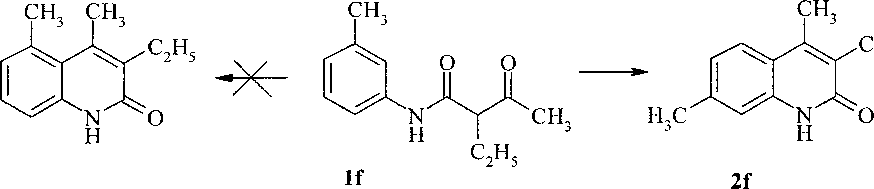
На примере 4-метил-2-хинолона (2а) нами изучено взаимодействие с различными электрофильными реагентами. В литературе описано, что нитрование 2-хинолона концентрированной азотной кислотой протекает с образованием 6-нитро-2-хинолона [3, 10], а в присутствии серной кислоты преимущественно по положению 8 и только после этого по положению 6 [3, 4]. Авторы работы [5] сообщают о получении единственного продукта взаимодействия 4-метил-2-хинолона с азотной кислотой - 6-нитро-4-метил-2-хинолона, при этом отсутствуют данные ЯМР 1Н спектров. Описан синтез 1-метил-3,6,8-тринитро-2-хинол она нитрованием 1-метил-2-хинолона концентрированной азотной кислотой [11].
Нами найдено, что обработка соединения 2а нитрующей смесью приводит к образованию смеси 3-нитро-4-метил-2-хинолона (За) и 6-нитро-4-метил-2-хинолона (4а) с преобладанием соединения 4а. Дальнейшее нитрование смеси За и 4а ведет к получению 3,6-динитро-4-метил-2-хинолона (5а):
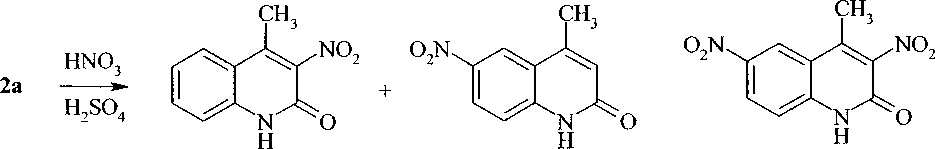
За 4а 5а
В спектре ЯМР ’Н соединения 4а протоны хинолинового цикла из-за электроноакцепторных свойств нитро-группы смещены в более слабое поле по сравнению с сигналами 4-метил-2-хинолона (2а), при этом протон Н-5 дает синглет при 8,50 м.д. Идентичный характер и последовательность сигналов протонов бензольного кольца соединений 4а и 2Ь подтверждает то, что замещение протекает в положение 6.
В работе [6] найдено, что взаимодействие незамещенного 2-хинолона с молекулярным бромом протекает в положение 6, а в работе [7] показано, что бромирование 4-метил-2-хинолона N-бромсукцинимидом идет в положение 3, если оно свободно. Если положение 3 занято, то замещение идет в боковую цепь.
Нами выявлено, что бромирование 4-метил-2-хинолона в растворе ледяной уксусной кислоты в зависимости от соотношения исходных реагентов протекает с разной степенью замещения. По данным хромато-масс-спектрометрии при соотношении 1:1 образуется 6-бром-4-метил-2-хинолон (4Ь) и 3-бром-4-метил-2-хинолон (ЗЬ), а при соотношении 1:3 - 3,6-дибром-4-метил-2-хинолон (5Ь) и наблюдается небольшое содержание 3,6,8-трибром-4-метил-2-хинолона (6Ь).
Хлорирование 4-метил-2-хинолона в растворе ледяной уксусной кислоты избытком хлора протекает также как и с бромом, при этом образуются 3,6-дихлор-4-метил-2-хинолон (5с) и 3,6,8-трихлор-4-метил-2-хинолон (6с).
Нами установлено, что иодирование соединения 2а элементным иодом в растворе ледяной уксусной кислоты приводит к смеси 3- и 6-иод-4-метил-2-хинолонов (3-4d). Дальнейшее иодиро- вание с образованием 3,6-дииод-4-метил-2-хинолона не протекает, что обусловлено более слабой электрофильностью иода по сравнению с бромом и хлором:
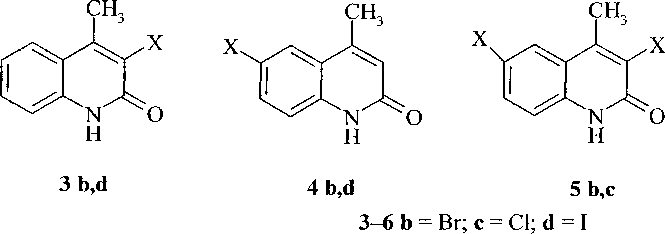
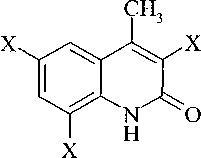
6 Ь,с
Масс-спектры изомерных соединений За и 4а практически не отличаются, различно только время удерживания 7,96 мин и 9,39 мин соответственно. Имеются пики молекулярных ионов, а также пик с m/z = 158, что соответствует элиминированию КОг-группы.
Теоретически алкилирование в щелочной среде должно протекать с образованием смеси N- и О-производных. Тем не менее, в работе [12] авторы ошибочно полагают, что образуется только N-аллильное производное. Нами изучено взаимодействие соединений 2a-f с бромистым аллилом в 2-пропаноле в присутствии щелочи и установлено, что во всех случаях образуются смесь N- и О-аллильных производных. При аллилировании 4-метил-2-хинолона (2а) образуется смесь продуктов N- и О-алкилирования в соотношении 3:1, которая может быть разделена колоночной хроматографией с оксидом алюминия и элюентом бензолом. 1-Аллил-4-метил-2-хинолон (7а) может быть частично отделен перекристаллизацией смеси из гексана:
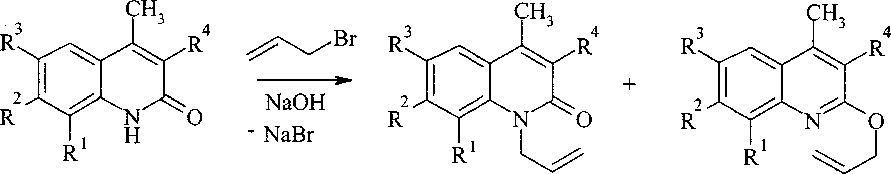
2 a-f 7 a-f 8 a-f
Выявлено, что направление реакции алкилирования зависит от стерического влияния заместителей в положениях 3 и 8. Наличие этильной группы в случае соединений 2с, 2е, 2f препятствует протеканию реакции по атому кислорода. Об этом говорит соотношение образующихся продуктов N- и О-алкилирования. Наличие заместителя в положении 8 соединения 2d затрудняет алкилирование по атому азота.
Таблица 3
Соотношение продуктов реакции алкилирования соединений 2a-f по данным ХМС
|
Исходное соединение |
Соотношение продуктов N- и О-алкилирования |
|
2а |
3:1 |
|
2Ь |
4:1 |
|
2с |
9:1 |
|
2d |
1:7 |
|
2е |
21:1 |
|
2f |
1:13 |
Масс-спектры N-алл ил-2-хинолонов (7a-f) и 2-аллилоксихинолинов (8a-f) очень близки, но различается время удерживания, при этом для всех соединений характерно наличие пиков [М]+, [М-15]+, [М-29]+, [М-М0]+.
В спектрах ЯМР 'И соединений 8а, d характерно незначительное смещение сигналов в более слабое поле по сравнению с соединениями 7а, d, при этом синглет Н-3 смещен на 0,30 м.д., что обусловлено соседством с оксиаллильной группой.
Нами изучено взаимодействие нитро-, бром- и хлорпроизводных соединения 2а с бромистым аллилом в суперосновной среде. Установлено, что алкилирование соединений За; 4а, b и 5Ь, с, также как 2a-f, приводит к образованию смеси N- и О-производных. При этом преобладающим продуктом реакции во всех случаях является продукт алкилирования по атому азота. Наличие заместителя в 3 положении соединения За повышает выход N-производного по сравнению с 4а:
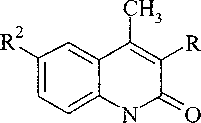

NaOH
— NaBr
За; 4а, b; 5Ь, с
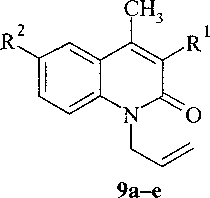
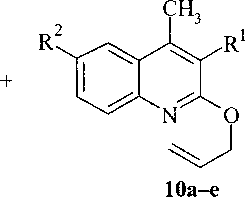
За, 9а, 10а R1 = NO2, R2 = Н; 4а, 9b, 10b R1 = Н, R2 = NO2; 4b, 9с, Юс R1 = Н, R2 = Вг;
5b, 9d, 10d R1 = R2 = Br; 5c, 9e, lOe R1 = R2 = CI.
В масс-спектрах соединений 9-10 имеются пики [М]+, [М-15]+, [М-29]+, [М-На1]+.
Следует отметить, что присутствие МО2-группы в соединении 11а не сдвигает сигналы аллильной группы в спектре ЯМР *11 по сравнению с 7а, а приводит к смещению сигналов протонов хинолинового кольца в более слабую область.
Таблица 4 Спектральные данные синтезированных соединений
|
Соединение |
Спектр ЯМР ' Н, 6, м.д. (J, Гц) |
|
2а |
2,42 (ЗН, с, СН3); 6,36 (1Н, с, 3-Н); 7,19, 7,30, 7,50, 7,71 (4Н, бензольное кольцо), 11,59(1Н, с, NH-) |
|
2е |
1,03 (ЗН, т, СН3-СНт-); 2,36 (ЗН, с, СН3-6); 2,39 (ЗН, с, СН3-4); 2,65 (2Н, к, СНз-СНт-); 7,17 (1Н, д, 7-Н); 7,23 (Ш, д, 8-Н); 7,50 (Ш, с, 5-Н); 11,39 (1Н, с, NH-) |
|
2f |
1,03 (ЗН, т, СНз-СНт-Г 2,36 (ЗН, с, СН3-4); 2,39 (ЗН, с, СН3-7); 2,63 (2Н, к, СНз-СНт-); 6,98 (Ш, д, 6-Н); 7,08 (1Н, с, 8-Н); 7,62 (1Н, д, 5-Н); 11,52 (1Н, с, NH-) |
|
4а |
2,42 (ЗН, с, СН3); 6,57 (1Н, с, 3-Н); 7,43 (1Н, д, 8-Н); 8,34 (1Н, д, 7-Н); 8,50 (Ш, с, 5-Н); 12,17 (Ш, с, NH-) |
|
7а |
2,45 (ЗН, с, СНз); 4,89 (2Н, д, N-CH2-); 4,95 (Ш, д, СН2=); 5,13 (1Н, д, СН2=); 5,92 (Ш, м, СН=); 6,56 (Ш, с, 3-Н); 7,28, 7,44, 7,60, 7,80 (4Н, бензольное кольцо) |
|
7Ь |
2,39 (ЗН, с, СН3-6); 2,44 (ЗН, с, СНН); 4,86 (2Н, д, N-CH2-); 4,92 (1Н, д, СН2=); 5,12 (1Н, д, СН2=); 5,91 (1Н, м, СН=); 6,52 (1Н, с, 3-Н); 7,32 (Ш, д, 8-Н); 7,41 (Ш, д, 7-Н); 7,59 (1Н, с, 5-Н) |
|
7с |
1,05 (ЗН, т, СНз-СН2-); 2,46 (ЗН, с, СН3); 2,72 (2Н, к, СН3-СН7-); 4,94 (ЗН, м, N-CH2-, СН2=); 5,12 (1Н, д, СН2=); 5,92 (Ш, м, СН=); 7,27, 7,41, 7,54, 7,84 (4Н, бензольное кольцо) . |
|
7d |
2,42 (ЗН, с, С113^); 2,67 (ЗН, с, СН3-8); 4,76 (Ш, д, СН2=); 4,97 (2Н, д, N-CH2-); 5,08 (1Н, д, СН2=); 6,00 (Ш, м, СН=); 6,55 (Ш, с, 3-Н); 7,19 (1Н, т, 6-Н); 7,41 (Ш, д, 7-Н); 7,64 (Ш, д, 5-Н) |
|
7е |
1,05 (ЗН, т, СНз-СН2-); 2,38 (ЗН, с, СН3-6); 2,44 (ЗН, с, СН3-4); 2,70 (2Н, к, СН3-СН2); 4,92 (ЗН, м, N-CH2-, СН2=); 5,11 (1Н, д, СН2=); 5,92 (Ш, м, СН=); 7,31 (2Н, м, 7-Н, 8-Н); 7,63 (1Н, с, 5-Н) |
|
8а |
2,61 (ЗН, с, СНз); 4,95 (2Н, д, О-СН2-); 5,27 (1Н, д, СН2=); 5,44 (1Н, д, СН2=); 6,15 (1Н, м, СН=); 6,89 (1Н, с, 3-Н); 7,46, 7,67, 7,77, 7,95 (4Н, бензольное кольцо) |
|
8d |
2,60 (ЗН, с, СН3-4); 2,62 (ЗН, с, СН3-8); 4,98 (2Н, д, О-СН2-); 5,27 (1Н, д, СН2=); 5,45 (1Н, д, СН2=); 6,16 (1Н, м, СН=); 6,91 (1Н, с, 3-Н); 7,33 (1Н, т, 6-Н); 7,53 (1Н, д, 7-Н); 7,80 (Ш, д, 5-Н) |
|
9b |
2,60 (ЗН, с, СН3); 4,94 (ЗН, м, N-СНт-, СН2=); 5,16 (1Н, д, СН2=); 5,95 (Ш, м, СН=); 6,75 (1Н, с, 3-Н); 7,63 (Ш, д, 8-Н); 8,56 (Ш, д, 7-Н); 8,79 (1Н, с, 5-Н) |
Заключение
По методу Кнорра осуществлен синтез 4,6-диметил-2-хинолона, 4-метил-3-этил-2-хинолона, 4,8-диметил-2-хинолона, 4,6-диметил-3-этил-2-хинолона и 4,7-диметил-3-этил-2-хинолона. Установлено, что бромирование и хлорирование 4-метил-2-хинолона избытком галогена протекает с образованием смеси 4,6-дигалоген- и 4,6,8-тригалоген-4-метил-2-хинолонов. Взаимодействие 4-метил-2-хинолона с бромом и иодом в соотношении 1:1 приводит к смеси 3- и 6-галоген-4-метил-2-хинолонов. Найдено, что взаимодействие 4-метил-2-хинолона с нитрующей смесью протекает в положения 6 и 3, а дальнейшее нитрование смеси нитропроизводных ведет к 3,6-динитро-4-метил-2-хинолону. Найдено, что реакция производных 2-хинолонов с бромистым аллилом протекает по двум реакционным центрам: по атому азота и по атому кислорода, при этом соотношение образующихся продуктов зависит от стерического влияния окружающих заместителей.
Список литературы Синтез и исследование свойств производных 2-хинолона
- El-Ashry, E.S.H. Fused Heterocyclo-Quinolines Containing One Nitrogen Atom at Ring Junction: Part 1. Four and Five Membered Heterocyclo-Quinolines/E.S.H. El-Ashry, E.S.I. Ibrahim//Advances in heterocyclic chemistry. -2003. -Vol. 84. -P. 71-190.
- Бромирование незамещенных в положении 3 N-аллил-4-гидрокси-2-оксо-1,2-дигидрохинолинов и пиридинов/И.В. Украинец, Н.Л. Березнякова, А.В. Туров, С.В. Слободзян//Химия гетероциклических соединений. -2007. -Т. 43, № 9. -С. 1365-1373.
- Джоуль, Дж. Основы химии гетероциклических соединений/Дж. Джоуль, Г. Смит. -М.: Мир, 1975.-398 с.
- Русинов, В.Л. Нитроазины/В.Л. Русинов, О.Н. Чупахин. -Новосибирск: Наука, 1994. -350 с.
- Hamada, Y. Quinoline derivatives/Y. Hamada, H. Sugihara//The pharmauceutical Society of Japan. -1962. -Vol. 82, № 7. -P. 937-942.
- Некаталитическое галогенирование карбостирила в растворе уксусной кислоты//РЖ Химия. -1966. -ЗБ736.
- Paolo L., Gianborenro M.//Ricerca Scientifica. -1964. -Parte 2. -Ser. A, №2.-P. 309-314.
- Bromination Studies of alkyl-substituted 2-pyridones and 2-quinolones/D.J. Cook, R.E. Bowen, P. Sorten, E. Daniels//J. Org. Chem. -1961. -Vol. 26, № 12. -P. 4949-4955.
- Li, Jie-Jack. Name reactions in heterocyclic chemistry/Jie-Jack Li, E.J. Corey. -New Jersey: Wiley Interscience, 2005. -558 p.
- Михайлов, Т.Н. 4-Метил-2-хинолон (2-оксилепидин)/Г.Н. Михайлов//Журнал общей химии. -1936.-Т. 6, №4.-С. 511.
- Эльдерфилд, Р. Гетероциклические соединения/Р. Эльдерфилд. -М.: Из-во ИЛ, 1955. -Т. IX.-538 с.
- Novel functionalization of 1 -metyl-2-quinolone; dimerization and denitration of trinitroquinole/N. Nishiwaki, M. Sakashita, M. Azuma et al.//Tetrahedron. -2002. -Vol. 58. -P. 473-478.
- Гюльбудагян, Л.В. Некоторые превращения N-аллильных производных 2-оксо(тиоксо)-4-метилхинолинов/Л.В. Гюльбудагян, И.Л. Алексанян, А.А. Аветисян//Армянский химический журнал. -1989. -Т. 42, №10.-С. 636-641.


