Синтез и исследование свойств замещенного фенилазороданина
Автор: Куликов М.А.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Химические науки
Статья в выпуске: 9-3 (96), 2024 года.
Бесплатный доступ
В работе рассмотрен синтез замещенного фенилазороданина, содержащего в бензольном фрагменте сульфамидную группу. Приведена методика и условия его синтеза, исследован ряд физико-химических свойств. Строение рассматриваемого соединения изучено по данным электронной и инфракрасной спектроскопии, а также по результатам квантовохимических расчетов. Проведен скрининг спектра биологической активности с использованием цифровых технологий. Полученные в работе результаты могут быть использованы при исследовании других производных роданина.
Роданин, сульфаниламид, азосочетание, квантовохимический расчет, прогнозирование биологической активности
Короткий адрес: https://sciup.org/170207211
IDR: 170207211 | DOI: 10.24412/2500-1000-2024-9-3-206-210
Текст научной статьи Синтез и исследование свойств замещенного фенилазороданина
Роданин (2-тиоксо- 1,3-тиазолидин-4-он) (I) привлекает внимание исследователей высокой реакционной способностью и ценными прикладными свойствами. На его основе получают фармацевтические субстанции [1, 2], материалы для сорбции ионов тяжелых металлов [3, 4] ингибиторы коррозии [5] и другие продукты. Также роданин используется в качестве субстрата при синтезе гетероциклических структур [6, 7]. Таким образом, комплексный анализ научной информации показывает актуальность и перспективность исследований роданина и его производных.
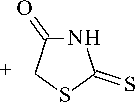
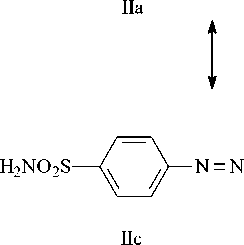
Одним из путей модификации свойств роданина является синтез на его основе азосоединений. В представленной работе объектом исследования служит фенилазороданин (II), В его структуре присутствует сульфамидная группа, обладающая известной биологической активностью [8, 9]. Соединение (II) получено сочетанием диазосульфаниламида с роданином по схеме на рисунке 1.
NH 2 O 2 S
+ _ N N Cl
I
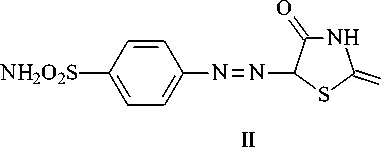
Рис. 1. Химизм получения соединения (II)
Экспериментальная часть. Диазотирование сульфаниламида проводилось нитритом натрия в водном растворе соляной кислоты при охлаждении внесением льда в реакционную массу. Сочетание диазосульфаниламида с роданином осуществляли в щелочном растворе, поддерживая слабощелочную среду (рН 8-9) и охлаждая смесь внесением льда. Время сочетания составило 30 минут. Затем к реакционной массе добавили соляную кис- лоту до слабокислой реакции, осадок отфильтровали, промыли водой и высушили при температуре 90 °С.
Продукт сочетания представляет собой твердое вещество темно-желтого цвета, слаборастворим в воде, хорошо растворим в водных растворах щелочей и полярных органических растворителях; плавится с разложением при температуре 235 ° С. Выход продукта 80%.
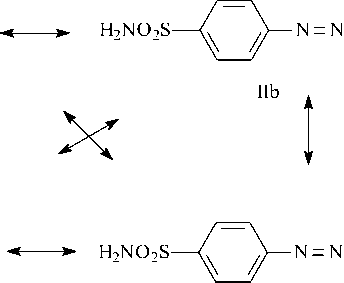
Электронные спектры поглощения (ЭСП) соединения (II) получены в следующих растворителях: вода, изопропиловый спирт, 0,1н водный раствор NaOH, концентрированная серная кислота. Для каждого использованного растворителя в области 300-550 нм в спектрах присутствует одна полоса поглощения, характеризующая π→π * электронные переходы в пределах хромофорной системы (рис. 2).
Положение полос определяется природой растворителя (табл. 1).
Положение λ max в воде и изопропиловом спирте наблюдается вблизи 400 нм и различается незначительно. В среде концентрированной серной кислоты происходит протонирование молекулы по гетероатомам, в результате чего усиливается ее поляризация. Как результат – батохромное смещение λ max .
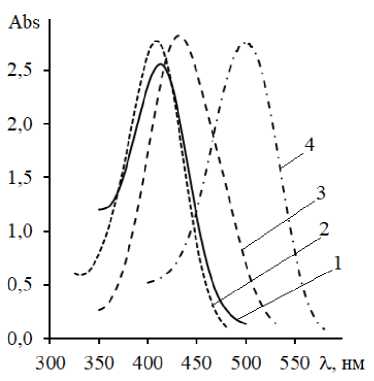
Рис. 2. ЭСП: 1 – вода; 2 – изопропиловый спирт; 3 – конц. H 2 SO 4 ; 4 – 0,1н NaOH
Таблица 1. Положение λ max в ЭСП
|
Растворитель |
λ max , нм |
|
вода |
413 |
|
изопропиловый спирт |
409 |
|
конц. H 2 SO 4 |
432 |
|
0,1н NaOH |
500 |
Еще большее батохромное смещение λ max наблюдается в водном растворе гидроксида натрия. Под действием щелочи кето-форма переходит в енольную, что способствует ионизации молекулы и приводит к изменениям основного хромофора.
В инфракрасном спектре продукта выделены и охарактеризованы по литературным данным [10] следующие полосы (в см–1): st N–H 3247, st С–H бензола 3045, st С–H роданина 2923, st С=О 1699, ar C=C, С–С 1600, 1489, st N=N 1409, st Ar–SO 2 –N
1327, 1153, ar С–H δ ip 1226, 1047, st С=S 1097, ar С–H δ oop 830, δ NH 756.
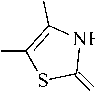
Теоретическое исследование. Молекула соединения (II) может существовать в нескольких таутомерных формах, как представлено на рисунке 3. По данным ЭСП установлено, что в щелочной среде форма IIa переходит в форму IIb. Поэтому в теоретической части работы рассмотрим именно эти две формы.
NN
H 2 NO 2 S
O
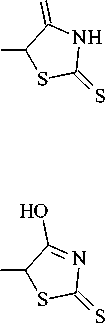
IId
Рис. 3. Таутомерные формы молекулы (II)
HO
S
O
SH
На первом этапе выполнен квантовохимический расчет молекул IIа и IIb полуэм-пирическими методами. На рисунке 4 представлены 3D модели, построенные по результатам расчета, с указанием нумера- ции атомов. Модели показывает, что обе формы подвержены определенным стерическим искажениям, затрагивающим остов молекул. Подтверждают это и рассчитанные величины торсионных углов (табл. 2).
Таблица 2. Расчетные значения валентных и
|
IIа |
IIb |
||
|
Торсионный угол |
Величина, ° |
Торсионный угол |
Величина, ° |
|
C 3 –C 1 –N 11 –N 12 |
-33 |
C 3 –C 1 –N 11 –N 12 |
34 |
|
C 2 –C 1 –N 11 –N 12 |
150 |
C 2 –C 1 –N 11 –N 12 |
-149 |
|
C 1 –N 11 –N 12 –C 13 |
180 |
C 1 –N 11 –N 12 –C 13 |
180 |
|
C 14 –C 13 –N 12 –N 11 |
-131 |
C 14 –C 13 –N 12 –N 11 |
-180 |
|
S 16 –C 13 –N 12 –N 11 |
114 |
S 16 –C 13 –N 12 –N 11 |
-1 |
|
O 18 –C 14 –C 13 –N 12 |
65 |
O 19 –C 14 –C 13 –N 12 |
-1 |
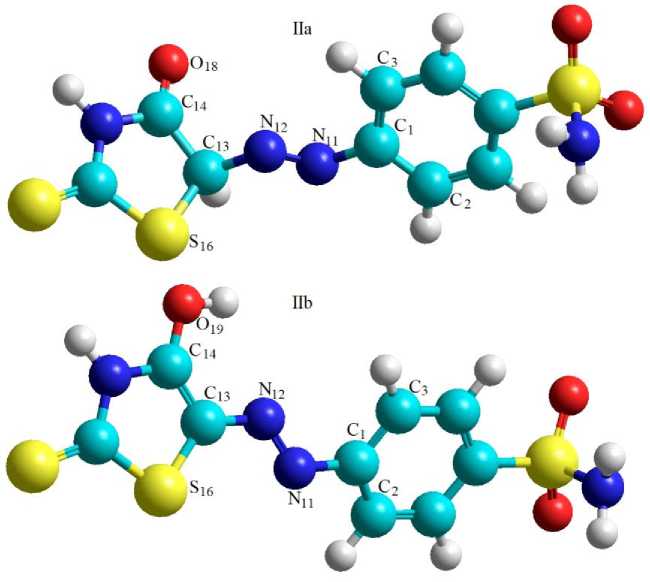
Рис. 4. 3D модели по результатам расчета
На следующем этапе проведен скрининг спектра биологического действия таутомерных форм IIa и IIb на интернет-платформе PASS Online. Результаты скри- нинга представлены вероятностями наличия (Pa) активности определенного вида (табл. 3 для Pa > 0,5).
Таблица 3. Результаты прогнозирования биологического действия
|
Активность |
Ра (IIa) |
Pa (IIb) |
|
Cl - транспортирующий ингибитор АТФазы |
0,825 |
0,806 |
|
Ингибитор хлоридпероксидазы |
0,792 |
0,724 |
|
Ингибитор фосфолипид-транслоцирующей АТФазы |
0,743 |
0,715 |
|
Ингибитор НАДФН-пероксидазы |
0,593 |
0,723 |
|
Ингибитор фталат-4,5-диоксигеназы |
0,531 |
0,588 |
|
Ингибитор тиоловой протеазы |
0,506 |
0,604 |
Полученные данные показывают, что обе формы с большей долей вероятности проявляют себя как ингибиторы ферментативных процессов различной направленности. Поэтому их можно рекомендовать для дальнейших лабораторных исследований.
Заключение. В работе представлен синтез азосоединения на основе роданина и диазосульфаниламида. Продукт получен ства темно-желтого цвета. Определена его температура плавления, изучен ряд физико-химических свойств. Получены данные по электронным и инфракрасным спектрам соединения. С использованием цифровых технологий выполнен расчет молекулярной геометрии и сделан прогноз относительно потенциальной биологической активности. Результаты, приведенные в работе, рекомендуется использовать при с высоким выходом в виде твердого веще- изучении других производных роданина.
Список литературы Синтез и исследование свойств замещенного фенилазороданина
- Synthesis, Antidiabetic, Antimicrobial, and Molecular Docking Studies of Some New Rhodanine Acetic Acid Derivatives / Honavar P.M. [et al.] // Indian Journal of heterocyclic Chemistry. - 2020. - Vol. 30. - Iss. 2. - P. 211-216.
- Синтез и противовирусная активность бис-спироциклических производных роданина / С.В. Курбатов [и др.] // Известия Академии наук. Серия химическая. - 2014. - № 5. - С. 1130-1136. EDN: TAKUDH
- Увайсова С.М., Бабуев М.А. Концентрирование ионов кадмия модифицированным сорбентом на основе анионита АН-31 и п-карбоксибензолазороданина // Известия Дагестанского государственного педагогического университета. Естественные и точные науки. - 2019. - Т. 13. - № 3. - С. 101-105. -. DOI: 10.31161/1995-0675-2019-13-3-101-105 EDN: UOGUJW
- Увайсова С. М., Бабуев М. А. Определение условий модификации анионитов АН-31 и АРА-8п иммобилизацией 5-(4-карбоксифенил-азо)-роданина // Сорбционные и хроматографические процессы. - 2019. - Т. 19. - № 3. - С. 344-351. -. DOI: 10.17308/sorpchrom.2019.19/751 EDN: ITGQEY
- Бережная А.Г., Чернявина В.В., Астахова Л.М. Новые ингибиторы для защиты низкоуглеродистой стали в солянокислых средах // Коррозия: материалы, защита. - 2020. - № 2. - С. 33-38. EDN: LYXCSO
- Synthesis, characterization and DFT calculations of linear and NLO properties of novel (Z)-5-benzylidene-3-N(4-methylphenyl)-2-thioxothiazolidin-4-one / Bensafi T. [et al.] // Journal of sulfur Chemistry. - 2021. - Vol. 42. - Iss. 6. - P. 645-663. -. DOI: 10.1080/17415993.2021.1951729 EDN: LFMXXP
- Синтез и и спектральные свойства новых фотохромных дитиенилперфторциклопентенов с роданиновыми фрагментами / М.М. Краюшкин [и др.] // Известия Академии наук. Серия химическая. - 2010. - № 11. - С. 2072-2074. EDN: TNBIHV
- Прошин С.Н., Михайлов И.Б. Фармакология. - Санкт-Петербург: СпецЛит, 2018. - 541 с.
- Синтез и исследование антибактериальной активности полуаминалей и оснований Шиффа на основе сульфаниламида / С.Г. Степин [и др.] // Вестник фармации. - 2019. - № 3 (85). - С. 88-93. EDN: GNFZLO
- Tasumi M., Sakamoto A.Introduction to Experimental Infrared Spectroscopy. Fundamentals and Practical Methods. - Wiley, 2015. - 389 p.


