Синтез и электрофильная гетероциклизация 3-алкенилсульфанил-5-фенил-1,2,4-триазинов под действием иода и брома
Автор: Рыбакова Анастасия Владимировна, Ким Дмитрий Гымнанович, Шарутин Владимир Викторович, Слепухин Павел Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.15, 2023 года.
Бесплатный доступ
Производные 1,2,4-триазин-3-тиона являются интересными объектами для исследования в связи с широкой областью их применения: лекарственные препараты, оптические вещества, прекурсоры для синтеза новых пиридиновых систем по реакции Дильса-Альдера. В настоящей работе алкилированием 5-фенил-2,3-дигидро-1,2,4-триазин-3-тиона (1) 3-хлор-2-метил-пропеном, 2,3-дибромпропеном-1, 1-бром-3-метилбут-2-еном и 4-бромбут-1-еном нами получены неизвестные ранее 3-(2-метилпроп-1-енил)-, 3-(2-бромпроп-1-енил)-, 3-пренилсульфанил- и 3-бутенилсульфанил-5-фенил-1,2,4-триазины (2a-d). В спектре ЯМР 1Н соединения 2b наблюдается смещение сигнала протонов SCH2-группы и сигнала протонов винильной группы в слабое поле на 0,48 м.д. и 0,60 м.д по сравнению с аналогичными сигналами в спектре 3-аллилсульфанил-5-фенил-1,2,4-триазина. Это может быть связано с содержанием в аллильном фрагменте атома брома. Самый слабопольный сигнал в спектрах ЯМР 13С соединений 2а-d в области 171,86-173,68 м.д. относится к ароматическому углеродному атому триазинового цикла в третьем положении (С-3), связанному с атомом серы и двумя атомами азота. Электрофильной гетероциклизацией металлил-, бромаллил-, пренил- и бутенилсульфидов 2a-d осуществлен синтез новых конденсированных гетероциклических систем ионного типа с мостиковым атомом азота. При этом гетероциклизацией соединений 2a, 2b получены галогениды [1,3]тиазоло[3,2- b ][1,2,4] триазиния, гетероциклизацией соединений 2с, 2d - галогениды [1,3]тиазино[3,2- b ][1,2,4]триазиния. В спектрах ЯМР 1Н галогенидов триазиния наблюдается характерное смещение сигнала ароматического протона Н-6 в область слабого поля по сравнению с аналогичным сигналом в спектре исходных сульфидов 2а-d. В спектрах ЯМР 13С галогенидов триазиния наблюдается смещение сигнала ароматического атома углерода, связанного с атомом серы и двумя атомами азота (в область 162,56-172,42 м.д.), что можно объяснить появлением в их структуре положительно заряженного атома азота.
5-фенил-2, 3-дигидро-1, 2, 4-триазин-3-тион, 3-алкенилсульфанил-5-фенил-1, 2, 4-триазины, гетероциклизация, галогениды 7-галоген-8, 8-диметил-6, 7-дигидро[1, 3]тиазино[3, 2-b][1, 2, 4]триазиния, галогениды 8-галогенметил-7, 8-дигидро-6н-[1, 3]тиазино[3, 2-b][1, 2, 4]триазиния
Короткий адрес: https://sciup.org/147239551
IDR: 147239551 | УДК: 546.831.4, | DOI: 10.14529/chem230110
Текст научной статьи Синтез и электрофильная гетероциклизация 3-алкенилсульфанил-5-фенил-1,2,4-триазинов под действием иода и брома
Имеются данные о проявлении различными производными 1,2,4-триазин-3-тиона широкого ряда биологической активности: пестицидной [1], противораковой [2], психотропной [3] и противовирусной ингибирующей [4]. В связи с чем триазины, а также их конденсированные производные являются перспективными соединениями для разработки на их основе лекарственных средств [5-9], например для лечения нейродегенеративных заболеваний [10]. Однако этим не ограничиваются области применения триазиниевых систем. В частности, полученный на основе 3-метилсульфанил-1,2,4-триазина олигомер обладает оптическими свойствами [11], а многие производные 1,2,4-триазина используются в качестве синтонов в реакции Дильса-Альдера для получения различных пиридинов [12-15]. Известны также внутримолекулярные реакции Дильса-Альдера для 3-(1-фенил-3-бутинилсульфанил)-5-фенил-1,2,4-триазина [16].
Ранее [17-20] был изучен синтез 3-аллил(пропаргил)сульфанил- и 3-циннамил-5-фенил-1,2,4-триазинов и их взаимодействие с галогенами, которое приводит к образованию [1,3]тиазоло[3,2-b] и [1,3]тиазино[3,2-b][1,2,4]триазиниевых систем соответственно. Последние достаточно мало описаны в литературе, хотя представляют большой интерес как потенциально биологически активные соединения, в частности как психотропные вещества [3]. С целью расширения ряда новых конденсированных гетероциклических систем ионного типа с мостиковым атомом азота нами исследованы реакции гетероциклизации продуктов S-алкенилирования 5-фенил-1,2,4-триазин-3-тиона (1) под действием иода и брома.
Экспериментальная часть
Спектры ЯМР 1Н и 13С записаны на спектрометре Bruker AVANCE-500 (500 и 126 МГц), химические сдвиги измерены от внутреннего стандарта ТМС для 1Н и сигнала растворителя для 13С.
Рентгеноструктурный анализ кристаллов 5b и 5c проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор).
Рентгеноструктурный анализ кристаллов 6b проводили на автоматическом четырехкружном дифрактометре Xcalibur 3 (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор, Т=295(2) К). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [21]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [22] и OLEX2 [23]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полные таблицы координат атомов, длин связей и валентных углов соединений 5b, 5c, и 6b депонированы в Кембриджском банке структурных данных (CCDC 1884193, 1884197, 2221265; ; .
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108.
Общая методика синтеза 3-алкенилсульфанил-5-фенил-1,2,4-триазинов (2a-d)
К раствору 0,202 г (1,07 ммоль) соединения 1 в 10 мл ацетона добавляют 1 мл Et3N и 1,07 ммоль алкилирующего агента. Реакционную смесь перемешивают в течение 12 ч и отфильтровывают. Из фильтрата отгоняют растворитель, остаток обрабатывают водой, продукт экстрагируют хлороформом. После испарения хлороформа получают продукт в виде масла.
3-(2-Метилпропен-2-ил)сульфанил-5-фенил-1,2,4-триазин ( 2a ) получают действием 3-хлор-2-метил-пропена на соединение 1 . Выход металлилсульфида 2а 0,226 г (87 %). ЯМР 1 Н: 1,85 (3H, c., CH 3 ); 4,02 (2H, c., SCH 2 ); 4,91(1H, д., 2J = 1,41 Гц, =CH 2 (H b )); 5,12 (1H, д., 2J = 1,41 Гц, =CH 2 (H a )); 7,61–7,70 (3H, м., H 2 , H 2 , H 3 ); 8,31–8,34 (2H, м., H 1 , H 1 ); 9,84 (1H, c., H 6 ). ЯМР 13С: 36,46 (С-1´), 114,31 (С-2´), 127,93 (( о -Ph)-5), 129,43 (( п -Ph)-5), 132,99 (( м -Ph)5), 140,38 (С-6), 143,03 (С-2´), 154,19 (С-5), 171,86 (С-3). Найдено, %: C 64,10; H 5,45; N 17,10. C 13 H 13 N 3 S. Вычислено, %: C 64,17; H 5,38; N 17,27.
3-(2-Бромпропен-2-ил)сульфанил-5-фенил-1,2,4-триазин ( 2b ) получают действием 2,3-дибромпропена-1 на соединение 1 . Выход бромаллилсульфида 2b 0,332 г (98 %). ЯМР 1Н: 4,38 (2H, c., SCH 2 ); 5,58 (1H, д., 2J = 1.81 Гц, =CH 2 (H b )); 6,12 (1H, д., 2J = 1,81 Гц, =CH 2 (H a )); 7,53–7,65 (3H, м., H 2` , H 2`` , H 3` ); 8,29–8,31 (2H, м., H 1` , H 1`` ); 9,75 (1H, c., H 6 ). Найдено, %: C 46,62; H 3,13; N 13,49. C 12 H 10 BrN 3 S. Вычислено, %: C 46,77; H 3,27; N 13,63.
3-Пренилсульфанил-5-фенил-1,2,4-триазин ( 2c ) получают действием 1-бром-3-метилбут-2-ена на соединение 1 . Выход пренилсульфида 2с 0,260 г (92 %). ЯМР 1 Н: 1,76 (3H, c., CH3); 1,78 (3H, c., CH 3 ); 3,97 (2H, д., SCH 2 ); 5,46 (1H, м., -СН=); 7,54 (2H, м., НPh); 7,59 (1H, м., НPh); 8,14–8,15 (2H, м., НPh); 9,36 (1H, c., H6). ЯМР 13С: 17,96 (CH 3 ); 25,70 (CH 3 ); 29,06 (SCH 2 ); 117,93 (-СН=); 127,59 (( о -Ph)-5); 129,28 (( п -Ph)-5); 132,56 (( м -Ph)5); 133,12 (=C); 141,84 (( и -Ph)-5); 143,36 (С-6); 154,51 (С-5); 173,68 (С-3). Найдено, %: C 65,20; H 5,71; N 16,18. C 14 H 15 N 3 S. Вычислено, %: C 65,34; H 5,87; N 16,33.
3-Бутенилсульфанил-5-фенил-1,2,4-триазина ( 2d ) получают действием 4-бром-1-бутена на соединение 1 . Выход пренилсульфида 2d 0,259 г (97 %). ЯМР 1Н: 2,52-2,57 (2Н, м., -СН 2 -); 3,33 (2Н, т., 3 J = 7,3 Гц, SCH 2 ); 5,07-5,09 (1Н, м., =СН); 5,13-5,17 (1Н, м., =СЩ; 5,91 (1Н, д.д.т., 3 J = 6,7 Гц, 3 J = 10,2 Гц, 3 J = 16,9 Гц, -СН=); 7,56 (3H, м., НPh); 8,27 (2H, м., НPh); 9,71 (1H, c., H6). ЯМР 13С: 29,94 (-CH 2 -); 33,18 (SCH 2 ); 116,63 (=CH 2 ); 127,56 (( о -Ph)-5); 129,31 (( п -Ph)-5); 132,62 (( м -Ph)-5); 133,05 (-СН=); 136,04 (( и -Ph)-5); 141,90 (С-6); 154,52 (С-5); 173,38 (С-3). Найдено, %: C 64,02; H 5,24; N 17,11. C 13 H 13 N 3 S. Вычислено, %: C 64,17; H 5,38; N 17,27.
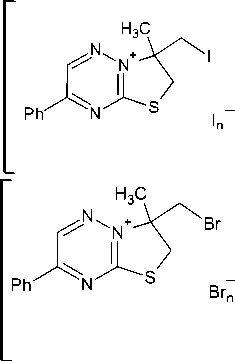
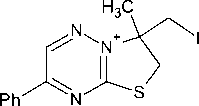
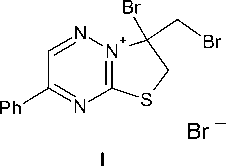
Моноиодид 3-иодметил-3-метил-7-фенил-2,3-дигидро[1,3]тиазоло[3,2- b ][1,2,4]триазиния ( 3а ). К раствору 0,508 г (2 ммоль) иода в 10 мл хлороформа добавляют раствор 0,308 (1 ммоль) соединения 2а в 10 мл хлороформа. Через 24 ч образуется темное масло, которое отделяют от раствора декантацией, сушат. Затем масло растворяют в 10 мл ацетона и добавляют 0,3 г (2 ммоль) NaI. Образующийся оранжевый осадок отфильтровывают, промывают ацетоном и сушат. Выход 0,467 г (94 %). Т пл с разложением 175–176 °С. ЯМР 1Н: 1,91 (3H, c., CH 3 ); 3,90 (1H, д., 2 J = 11,08 Гц, SCH 2 ); 3,95 (1H, д., 2 J = 11,08 Гц, SCH 2 ); 4,00 (2H, с., CH 2 I); 7,76-7,92 (3H, м., Hr, H 2`` , H 3` ); 8,52–8,54 (2H, м., H 1` , H 1`` ); 10,10 (1H, c., H 6 ). ЯМР 13С: 24,91(CH 3 ), 39,30 (CH 2 I), 39,51 (SCH 2 ), 74,68 (C–3), 130,10 (( o -Ph)-8); 130,76 (( п -Ph)-8), 136,90 (( и -Ph)-8); 143,23 (С–6); 162,40 (С– 7); 171,94 (С–8а). Найдено, %: C 31,23; H 2,48; N 8,28. C 13 H 13 I 2 N 3 S. Вычислено, %: C 31,41; H 2,64; N 8,45.
Общая методика синтеза полииодидов (5a,b, 6a,b)
К раствору 0,508 г (2 ммоль) иода в 10 мл хлороформа добавляют раствор 1 ммоль 3-алкенилсульфанил-5-фенил-1,2,4-триазина в 10 мл хлороформа. Через 24 ч образуется смесь кристаллов и масла, которую отделяют от раствора декантацией.
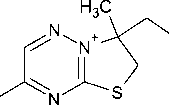
Пентаиодид 7-иод-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5b ) получают взаимодействием иода с соединением 2с . Отделяют механически в виде чёрных кристаллов (выход 0,457 г) от чёрного масла трииодида 7-иод-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5a ). Тш с разложением 81-82 °С. ЯМР 1 Н: 1,80 (3Н, с., -СН3); 1,86 (3Н, с., -СН 3 ); 4,10 (1Н, д.д., 2J =14,1 Гц., 3J =4,1 Гц., SCH 2 ); 4,53 (1Н, д.д., 2J =14,1 Гц., 3J =3,3 Гц., SCH 2 ), 5,53 (1Н, т., 3J =3,7 Гц, >СHI); 7,77–7,80 (2H, м., HPh); 7,93– 7,95 (1H, м., HPh); 8,57–8,59 (2H, м., HPh); 10,03 (1H, c., H–2). ЯМР 13С: 26,50 (-CH 3 ), 27,22 (-CH 3 ); 28,99 (SCH 2 ); 36,62 (>СHI); 73,85 (C–8); 131,03 (( о -Ph)-3); 131,53 (( п -Ph)-3); 131,53 (( м -Ph)3); 137,68 (( и -Ph)-3); 143,36 (C–2); 160,01 (C–3); 169,59 (C-4a). Найдено, %: C 16,35; H 1,33; N 3,96. C 14 H 15 I 6 N 3 S. Вычислено, %: C 16,51; H 1,48; N 4,12.
Полииодид 8-иодметил-7,8-дигидро-6 Н -[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 6b ) получают в виде комплекса с иодом взаимодействием иода с соединением 2d . Отделяют комплекс 6b механически в виде бордово-красных кристаллов (выход 0,463 г) от чёрного масла трииодида 8-иодметил-7,8-дигидро-6 Н -[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 6a ). Для комплекса 6b Тпл с разложением 53–54 °С. ЯМР 1Н: 2,84–2,91 (1H, м., -СH 2 -); 3,14–3,19 (1H, м., -СH 2 -); 3,77–3,88 (2H, м., SCH 2 ); 3,98–3,99 (2Н, м., СH 2 I); 5,31–5,34 (1Н, м., Н–8); 7,77– 7,80 (2H, м., HPh); 7,93–7,95 (1H, м., HPh); 8,56–8,58 (2H, м., HPh); 9,99 (1H, c., H-2). ЯМР 13С: 2,59 (СH 2 I); 25,23 (SCH 2 ); 26,07 (-СH 2 -); 68,28 (С-8); 131,07 (( o -Ph)-3); 131,19 (( п -Ph)-3); 131,46 (( м -Ph)-3); 137,71 (( и -Ph)-3); 143,00 (C-2); 160,41 (C–3); 171,10 (C–4a). Найдено, %: C 18,16; H 1,58; N 4,41. C 28 H 32 I 10 N 6 OS 3 . Вычислено, %: C 18,34; H 1,76; N 4,58.
Общая методика синтеза моноиодидов (5d, 6d)
0,200 г Смеси три- и пентаиодидов растворяют в 10 мл ацетона и добавляют 0,3 г (2 ммоль) NaI. Образующийся оранжевый осадок отфильтровывают, промывают ацетоном и сушат.
Моноиодид 7-иод-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5d) получают из смеси три- и пентаиодидов 5a,b . Выход 0,089 г. Т пл с разложением 104-105 °С. ЯМР 1 Н: 1,82 (3Н, с., -СН 3 ); 1.87 (3Н, с., -СН 3 ); 3,93 (1Н, д.д., 2J =14,1 Гц., 3J =4,1 Гц., SCH 2 ); 4,33 (1Н, д.д., 2J =14,1 Гц., 3J =3,3 Гц., SCH 2 ); 5,36–5,38 (1Н, м., >СHI); 7,74–7,76 (2H, м., HPh); 7,88– 7,90 (1H, м., HPh); 8,47–8,50 (2H, м., HPh); 10,03 (1H, c., H–2). Найдено, %: C 32,73; H 2,79; N 8,05. C 14 H 15 I 2 N 3 S. Вычислено, %: C 32,90; H 2,96; N 8,22.
Моноиодид 8-иодметил-7,8-дигидро-6 Н -[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 6d) получают из смеси три- и пентаиодидов 6a,b . Выход 0,139 г. Тпл с разложением 172-173 °С. ЯМР 1 Н: 2,562,58 (1H, м., -СH 2 -); 2,81–2,84 (1H, м., -СH 2 -); 3,59–3,61 (2H, м., SCH 2 ); 3,72–3,76 (2Н, м., СH 2 I); 5,08–5,10 (1Н, м., Н–8); 7,75– 7,77 (2H, м., HPh); 7,88–7,90 (1H, м., HPh); 8,49–8,51 (2H, м., HPh); 10,04 (1H, c., H-2). Найдено, %: C 31,24; H 2,46; N 8,27. C 13 H 13 I 2 N 3 S. Вычислено, %: C 31,41; H 2,64; N 8,45.
Общая методика синтеза монобромидов (3b, 4, 5e, 6e)
К раствору 1 ммоль 3-алкенилсульфанил-5-фенил-1,2,4-триазина в 10 мл хлороформа добавляют раствор 0,10 мл (2 ммоль) брома в 6 мл хлороформа при охлаждении льдом. Через 24 ч образуется трибромид в виде масла, которое отделяют от раствора декантацией и обрабатывают 10 мл ацетона. Образующийся осадок отфильтровывают, промывают ацетоном и сушат.
Монобромид 3-бромметил-3-метил-7-фенил-2,3-дигидро[1,3]тиазоло[3,2- b ][1,2,4]триазиния ( 3b ) получают взаимодействием соединения 2а с бромом. Жёлтый осадок, выход 0,339 г (84 %). Т пл с разложением 260-261 °С. ЯМР 1 Н: 1,89 (3H, c., CH 3 ); 3,99 (1H, д., 2 J = 12,4 Гц, SCH 2 ); 4,09 (1H, д., 2 J = 12,4 Гц, SCH 2 ); 4,18-4,23 (2H, м., C^Br); 7,74-7,93 (3H, м., H 2 , H 2 , H 3- ); 8,548,55 (2H, м., Hr, Hr); 10,12 (1H, c., H 6 ). ЯМР 13С: 24,00 (CH 3 ); 37,26 (CH 2 Br); 38,02 (SCH 2 ); 75,11 (C-3); 130,10 (( o -Ph)-8); 130,51 (( п -Ph)-8); 130,85 (( м -Ph)-8); 136,9 (( и -Ph)-8); 143,36 (С-6); 162,56 (С-7); 172,42 (С-8а). Найдено, %: C 38,56; H 3,07; N 10,26. C^R^B^S. Вычислено, %: C 38,73; H 3,25; N 10,42.
Монобромид 3-бромметил-7-фенил[1,3]-тиазоло[3,2- b ][1,2,4]триазиния ( 4 ) получают взаимодействием соединения 2b с бромом. Светло-коричневый осадок. Выход 0,107 г (55 %). Т пл с разложением 117-118 °С. ЯМР ' Н: 5,22 (2H, с., C^Br); 7,75-7,80 (2H, м., HPh); 7,85-7,90 (1H, м., HPh); 8,59-8,62 (2H, м., HPh); 9,06 (1H, с., SCH); 10,50 (1H, c., H-6). ЯМР 13С: 19,74 (C^Br); 125,70 (С-2); 128,66 (( o -Ph)-8); 129,91 (( п -Ph)-8); 135,56 (( м -Ph)-8); 137,36 (( и -Ph-8); 143,51 (С-6); 155,39 (С-7); 162,56 (С-8а). Найдено, %: 37,07; H 2,16; N 10,69. C^B^S. Вычислено, %: C 37,23; H 2,34; N 10,86.
Монобромид 7-бром-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5е) получают взаимодействием соединения 2с с бромом. Жёлтый осадок, выход 0,300 г (72 %). Т пл с разложением 230-232 °С. ЯМР 1 Н: 1,78 (3Н, с., -СН 3 ); 1,88 (3Н, с., -СН 3 ); 3,93 (1Н, д.д., 2 J = 14,8 Гц., 3 J = 4,6 Гц., SCH 2 ); 4,37 (1Н, д.д., 2 J = 14,8 Гц., 3 J = 3,0 Гц., SCH 2 ); 5,52 (1Н, т., 3 J = 3,6 Гц., >СHBr); 7,72-7,77 (2H, м., HPh); 7,87-7,91 (1H, м., HPh); 8,48-8,51 (2H, м., HPh); 10,07 (1H, c., H-2). Найдено, %: C 40,12; H 3,43; N 9,89. CmH^B^S. Вычислено, %: C 40,31; H 3,62; N 10,07.
Монобромид 8-бромметил-7,8-дигидро-6 Н -[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 6е ) получают взаимодействием соединения 2d с бромом. Жёлтый осадок, выход 0,350 г (87 %). Тпл с разложением 193-194 °С. ЯМР 1 Н: 2,55-2,62 (м., 1Н, -СH 2 -); 2,77-2,84 (м., 1Н, -С^-); 3,64-3,68 (2H, м., SCH 2 ); 3,99-4,02 (1Н, м., СH 2 Bг); 4,10-4,14 (1Н, м., ^Br); 5,22-5,24 (2H, м., CH 2 Br); 7,737,77 (2H, м., HPh); 7,89-7,91 (1H, м., HPh); 8,49- 8,51 (2H, м., HPh); 10,05 (1H, c., H-2). ЯМР 13С: 23,69 (SCH 2 ); 24,53 (-СH 2 -); 31,40 (С^Вг); 66,30 (С-8); 130,09 (( o -Ph)-3); 130,15 (( п -Ph)-3); 130,42 (( м -Ph)-3); 136,53 (( и -Ph)-3); 142,13 (C-2); 158,68 (C-3); 169,53 (C-4a). Найдено, %: C 38,56; H 3,09; N 10,25. C^R^B^S. Вычислено, %: C 3 8,73; H 3,25; N 10,42.
Трибромид 7-бром-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5с ). К раствору 0,257 г (1 ммоль) соединения 2с в 10 мл хлороформа добавляют раствор 0,10 мл (2 ммоль) брома в 6 мл хлороформа при охлаждении льдом. Через 24 ч образуются оранжевые кристаллы, их отфильровывают и сушат. Выход 0,501 г (87 %). Т пл с разложением 133-135 °С. ЯМР 1 Н: 1,77 (3Н, с., -СН 3 ); 1,88 (3Н, с., -СН 3 ); 3,90 (1Н, д.д., 2 J = 14,8 Гц., 3 J = 4,6 Гц., SCH 2 ); 4,37 (1Н, д.д., 2 J = 14,8 Гц., 3 J = 3,0 Гц., SCH 2 ); 5,48 (1Н, т., 3 J = 3,6 Гц., >СHBr); 7,75-7,77 (2H, м., HPh); 7,88-7,90 (1H, м., HPh); 8,48-8,50 (2H, м., HPh); 10,04 (1H, c., H-2). ЯМР 13С: 25,87 (-CH 3 ); 26,37 (-CH 3 ); 33,53 (SCH 2 ); 50,03 (>СHBr); 72,12 (C-8); 129,98 (( о -Ph)-3); 130,18 (( п -Ph)-3); 130,52 (( м -Ph)-3); 136,43 (( и -Ph)-3); 143,11 (C-2); 158,52 (C-3); 167,68 (C-4a). Найдено, %: C 28,97; H 2,44; N 7,10. C14H15Br4N3S. Вычислено, %: C 29,14; H 2,62; N 7,28.
Результаты и обсуждение
В настоящей работе с целью синтеза новых конденсированных гетероциклических систем ионного типа с мостиковым атомом азота нами алкилированием 5-фенил-1,2,4-триазин-3-тиона ( 1 ) были получены 3-(2-метилпроп-1-енил)-, 3-(2-бромпроп-1-енил)-, 3-пренил- и 3-бутенилсульфанил-5-фенил-1,2,4-триазины ( 2а-d ) и исследованы их реакции с иодом и бромом. Соединения 2а-d получены взаимодействием тиона 1 с 2-метил(бром)-3-галогенпропеном в ацетоне в присутствии избытка триэтиламина при комнатной температуре:
TEA, Me 2 CO, 22-230C
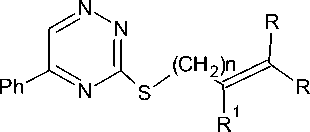
2a-d
2a : n=1, R=R=H, R1=CH3, 87 %; 2b : n=1, R=R=H, R1=Br, 98 %;
2c : n=1, R=R=CH , R1=H, 92%; 2d : n=2, R=R1=H, 97 %.
Триэтиламин выполнял не только роль основания, но и способствовал полному растворению тиона 1 . При проведении реакции в спирте в присутствии щелочи и алкоголятов натрия выход сульфидов 2a-d понижается. Структуры сульфидов 2a-d подтверждаются данными ЯМР 1Н и 13С. В спектре ЯМР 1Н соединения 2b , содержащего в аллильном фрагменте атом брома, происходит, как и следовало ожидать, смещение сигнала протонов SCH2-группы и протонов винильной группы в слабое поле на 0,48 м.д. и 0,60 м.д по сравнению с аналогичными сигналами в спектре 3-аллилсульфанил-5-фенил- 1,2,4-триазина [17].
В спектрах ЯМР 13С соединений 2a-d самый слабопольный сигнал наблюдается в области 171,86-173,68 м.д. и может быть отнесен к ароматическому углеродному атому триазинового цикла в третьем положении, связанному с атомом серы и двумя атомами азота.
Взаимодействие металлилсульфида 2а с двукратным избытком иода в хлороформе с последующим действием иодида натрия в ацетоне приводит к аннелированию тиазольного цикла и образованию моноиодида 3-иодметил-3-метил-7-фенил-2,3-дигидро[1,3]тиазоло[3,2- Ь ][1,2,4]триазиния ( 3а ):
I , CHCl
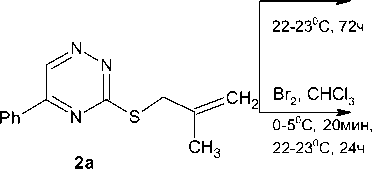
-NaI3
NaI, Me2CO
3a , 94 %
Me2CO
-2BrCH2C(O)CH 3
Ph
Br
Br
3b , 84 %
Аналогично взаимодействию соединения 2а с иодом протекает его реакция с бромом в хлороформе, приводящая при последовательном действии ацетона к образованию монобромида 3-иодметил-3-метил-7-фенил-2,3-дигидро[1,3]тиазоло[3,2- b ][1,2,4]триазиния ( 3а ).
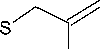
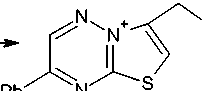
При взаимодействии бромаллилсульфида 2b с бромом c последующей обработкой ацетоном реакция не останавливается на стадии образования бромида 3-бром-3-бромметил7-фенил-2,3-дигидро[1,3]тиазоло[3,2- b ][1,2,4] триазиния I , а происходит дальнейшее дегидробромирование с образованием бромида 3-бромметил-7-фенил[1,3]-тиазоло[3,2- b ][1,2,4]триазиния ( 4 ):
1) Br2, CHCl3 0-50С, 20мин,
2b
Br
22-230C, 24ч
2) Me CO
CH2
-2BrCH C(O)Me
_ HBr
Br
Br
4 , 55 %
В спектре ЯМР 1 Н бромида 4 появляется сигнал ароматического протона SCH при 7,61 м.д. и отсутствует сигнал в области 4 м.д., который мог бы быть отнесён к протонам SCH 2 -группы. Бромаллилсульфид 2b в отличие от металлилсульфида 2а не подвергается гетероциклизации под действием иода, что может быть обусловлено электроноакцепторными свойствами атома брома, присутствующего в аллильном фрагменте соединения 2b и снижающего реакционную способность кратной связи при взаимодействии с электрофилом.
В отличие от сульфидов 2а,Ь , взаимодействие пренилсульфида 2с с галогенами протекает с аннелированием шестичленного тиазинового цикла. На наш взгляд, это обусловлено тем, что га-логенциклизация протекает не через галогеониевый ион А , а через карбкатион B :
Ph
N
2c
S
CH 3

CHCl3
CH 3
CH 3
X2
N
Ph
A
CH
3 Ph
-
X=I
22-230С, 72ч
Ph
N+
CH 3
I
N
H3C
S
-NaI
H3C
N
B
+
CH 3
X
S
X n -
-
- In
Ph
H3C
X n
CH
NaI, Me2CO
N+
I-
5d , 85 %
I
X=Br
0-50С, 20мин ; 22-230С, 72ч
Ph
H3C
N+
5a: n=3, 5b: n=5
5c , 87 %
CH 3
Br
Me2CO
S
Br 3 -
-
Ph
H3C
N+
-BrCH2C(O)Me
5e , 72 %
CH 3
Br
S
Br-
Если бы реакция протекала через галогенониевый ион, то из-за стерических факторов вероятнее всего происходило бы аннелирование пятичленного тиазольного цикла, чего мы не наблюдаем.
При взаимодействии пренилсульфида 2с с двукратным избытком иода образуется смесь три-и пентаиодидов 7-иод-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5a,b ) с преимущественным образованием трииодида 5a . Кристаллы пентаиодида удалось отделить и исследовать методом РСА (рис. 1). Пентаиодид 7-иод-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5b ) кристаллизуется в центросимметричной пространственной группе Р2 1 /п.
Смесь три- и пентаиодидов 5a,b реагирует с иодидом натрия в ацетоне с образованием иодида 7-иод-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5d ). Трибромид 5c при обработке ацетоном переходит в монобромид 7 -бром-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2- b ][1,2,4]триазиния ( 5е ).
Реакция пренилсульфида 2с с двукратным избытком брома в хлороформе протекает с образованием трибромида 7-галоген-8,8-диметил-6,7-дигидро[1,3]тиазино[3,2-b][1,2,4]триазиния (5с), кристаллы которого, по данным РСА, моноклинной кристаллографической сингонии относятся к пространственной группе Р-1 (рис. 2). Тиазиновый гетероцикл в структуре полигалогенидов имеет конформацию «полутвист», выход атома С(8) из плоскости гетероцикла для пентаиодида 5b и трибромида 5c составляет 0,594 и 0,419 А соответственно. В структуре бромида 5c также наблюдается выход атома С(7) из плоскости на 0,367 А. В анионе I5- атомы 1(2-5) лежат в одной плоскости, выход атома 1(6) из плоскости составляет 0,333 А. Угол между фрагментом I(4)-I(2)-I(3) и I(3)-I(5)-I(6) в анионе составляет 84,21°. Длины связей I-I в анионе составляют 2,7452,972 А. Связь I(3)-I(5) является самой длинной и составляет 3,242 А, что встречается в литературе для пентаиодид-анионов [24-27].
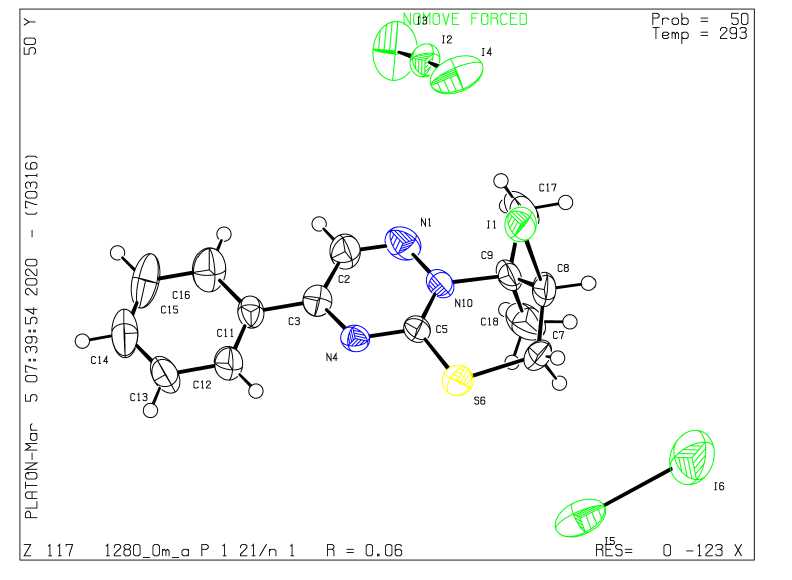
Рис. 1. Молекулярное строение пентаиодида 5b в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью
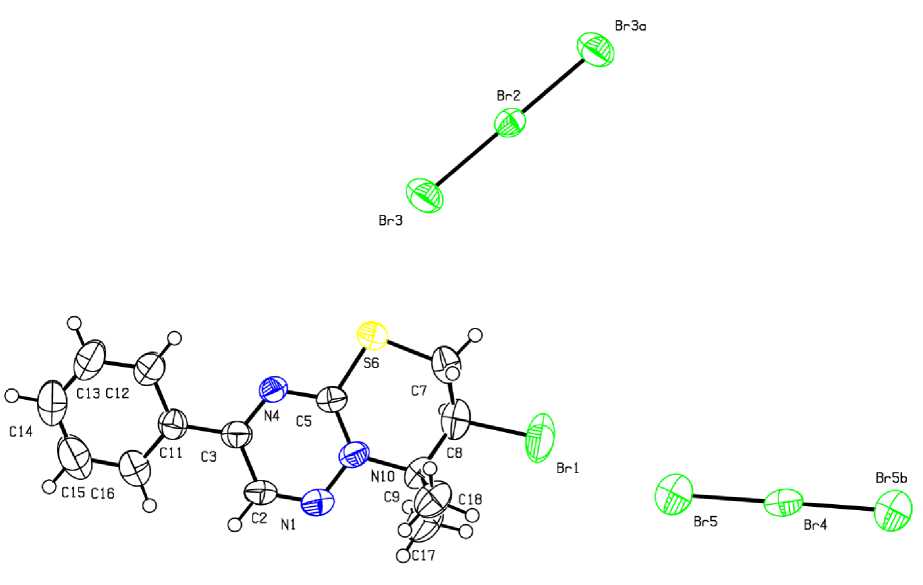
Рис. 2. Молекулярное строение трибромида 5c в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью
В структуре соединения 5с наблюдается два кристаллографически независимых типа анионов Br3-. Связи Br-Br в анионах выровнены и составляют 2,536 А для одного типа аниона и 2,533 А для другого. Упаковка молекул трибромида в слое осуществляется за счет коротких контактов Br -Br (3,383 А), наблюдающихся между атомами брома тиазиновых циклов и концевыми атомами брома Br(5) одного из анионов Br3 . Концевые атомы брома Br(3) аниона другого типа образуют в слое короткие контакты с атомами серы (3,423 А). В свою очередь, внутренние атомы брома Br(4) и Br(2) в разных анионах образуют короткие контакты с водородами Н(2) и Н(8) тиа-зиниевого катиона с параметрами контакта 2,869 и 2,859 А соответственно. За счет взаимодействий Br-Н происходит упаковка молекул в слои. В анионах Br3-атомы Br(3)- Br(2)- Br(3) и Br(5)-Br(4)- Br(5) образуют угол 180 °.
Бутенилсульфид 2d реагирует с иодом и бромом с образованием галогенидов 8-галогенметил-7,8-дигидро-6Н-[1,3]тиазино[3,2-b][1,2,4]триазиния (6а-с). Моногалогениды 8-галогенметил-7,8-дигидро-6Н-[1,3]тиазино[3,2-b][1,2,4]триазиния (6d,e) были получены анало гично галогенидам 5d,e.
X2
CHCl3
S CH2
Ph
-
X n
6a : X=I, n=3; 6b : X=I, n=5; 6c : X=Br, n=3, 73 %
X=I
22-23 0 С, NaI, Me ^ CO
-NaI3
X=Br
22-23 0 С, Me 2 CO
-BrCH2C(O)Me
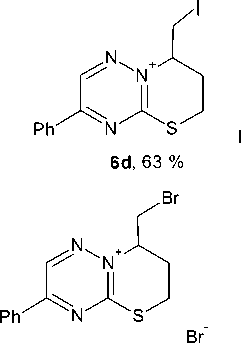
6e , 87 %
Структура полииодида ( 6b ) подтверждена методом РСА (рис. 3). По данным РСА, гетероциклический катион Het+ кристаллизуется в виде солевого комплекса 2(Het+I3-)*I2 или с учётом взаимодействий между галогенами - в виде Het+2I82-. Помимо этого, кристалл сольватирован, сольватную часть составляют молекулы диметилсульфоксида (DMSO). Молекулы растворителя разупорядочены в две позиции по оси вращения. Таким образом, полный состав кристаллической структуры можно описать как 2(Het+I3-)*I2*DMSO. Замыкание тетрагидротиазинового цикла органического катиона происходит по положению N(2) (а не N(4)) триазинового цикла. Тетрагидротиазиновый цикл неплоский, демонстрирует разупорядоченность атомных позиций гибкоцепного фрагмента, вследствие чего однозначно оценить его конформацию затруднительно. Анионная часть (полииодидная цепь) демонстрирует четкое различие длин связи между трииодидным анионом I3- (2,9658(15) и 2,8605(17)А), молекулой иода (связь между атомами 1(4) и I(4) [-x,+x,1/2-z] 2,737(4) А) и укороченным контактом между ними (ок. 3,5 А).
Характерной особенностью спектров ЯМР 1 Н триазиниевых солей 3-6 является смещение сигнала ароматического протона Н-6 в область слабого поля по сравнению с аналогичным сигналом в спектрах исходных сульфидов 2a-d . Такое смещение, например для иодида 3а, составляет 0,26 м.д., для бромида 3b - 0,28 м.д. Сигнал ароматического атома углерода, связанного с атомом серы и двумя атомами азота, в спектрах ЯМР 13С солей 3-6 наблюдается в области 162,56172,42 м.д., тогда как в спектрах ЯМР 13С исходных соединений 2a-d самый слабопольный сигнал наблюдается в области 171,86-173,68 м.д. Можно предположить, что смещение сигнала ароматического протона Н-6 в спектрах ЯМР 1Н и самого слабопольного атома углерода в спектрах
ЯМР 13С соединений 3–6 в сторону слабого поля происходит за счёт появления в их структуре положительно заряженного атома азота.
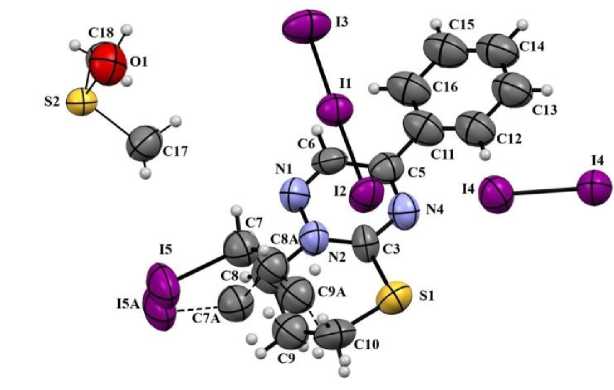
Рис. 3. Молекулярное строение полииодида 6b в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью
Выводы
Таким образом, нами осуществлено алкилирование 5-фенил-2,3-дигидро-1,2,4-триазин-3-тиона ( 1 ) 3-хлор-2-метил-пропеном, 2,3-дибромпропеном-1, 1-бром-3-метилбут-2-еном и 4-бромбут-1-еном. Выделенные при этом неизвестные ранее 3-(2-метилпроп-1-енил)-, 3-(2-бромпроп-1-енил)-, 3-пренилсульфанил- и 3-бутенилсульфанил-5-фенил-1,2,4-триазины ( 2a-d ) были исследованы нами в реакциях электрофильной гетероциклизации под действием иода и брома. Следует отметить, что взаимодействие соединений 2a,b с галогенами протекает с образованием новых производных [1,3]тиазоло[3,2- b ][1,2,4]триазиния, а соединений 2c,d – с образованием новых производных [1,3]тиазино[3,2- b ][1,2,4]триазиния. В ряде случаев структуры образующихся полигалогенидов [1,3]тиазоло(тиазино)[3,2- b ][1,2,4]триазиния были исследованы нами методом РСА.
Список литературы Синтез и электрофильная гетероциклизация 3-алкенилсульфанил-5-фенил-1,2,4-триазинов под действием иода и брома
- A new synthesis of a nitroimino-containing 1,2,4-triazin-5-one from 3-bromo-3-nitropropenoates / V.M. Berestovitskaya, O.Y. Ozerova, T.P. Efimova et al. // Mendeleev Communications. 2016. Vol. 26, no. 4. P. 323-325. DOI: 10.1016/j.mencom.2016.07.019.
- Nassar I.F. Synthesis and antitumor activity of new substituted mercapto-1,2,4-triazine derivatives, their thioglycosides, and acyclic thioglycoside analogs // J. Heterocyclic Chem. 2013. Vol. 50. P.129-134.
- Синтезы и нейрофармакологическая активность производных 1,2,4-триазин-3-тиона / С.С. Смагин, В.Е. Богачев, А.К. Якубовский, С.Е. Меткалова, Т.П. Привольнева, В.В. Чугунов, Е.Ф. Лавретская // Хим.-фарм. журн. 1975. Т. 9, № 4. С. 11-15.
- Rezaei B., Fazlollahi M. Synthesis, solvatochromism and crystal structure of 5-methoxy-5,6-diphenyl-4,5-dihydro-2#-1,2,4-triazine-3-thione // Chemistry Central Journal. 2013. Vol. 7. P. 130-134. DOI: 10.1186/1752-153X-7-130.
- Русинов В.Л., Чарушин В.Н., Чупахин О.Н. Биологически активные азоло-1,2,4-триазины и азолопиримидины // Известия Академии наук. Серия химическая. 2018. № 4. С. 573-599.
- Кравченко А.Н., Баранов В.В., Газиева Г.А. Синтез гликольурилов и их аналогов // Успехи химии. 2018. Т. 87, № 1. С. 89-108. DOI: 10.1070/RCR4763.
- The first stable examples of compounds containing both diazonium and acyl azide, and synthesis of a new pyrazino[2',3':3,4]pyrazolo[5,1-c][1,2,4]triazin-4(6#)-one heterocyclic system / S.M. Ivanov, L.A. Rodinovskaya, A.M. Shestopalov, L.M. Mironovich // Tetrahedron Letters. 2017. Vol. 58, no. 19. P. 1851-1853. DOI: 10.1016/j.tetlet.2017.03.083.
- Синтез и биологическая активность оксиндолилиденпроизводных имидазо[4,5-е]тиазоло [3,2-b]-1,2,4- триазин-7-онов и имидазо[4,5-е]тиазоло[2,3-с]-1,2,4-триазин-8-онов / А.Н. Изместьев, Г.А. Газиева, Л.В. Аникина и др. // Журнал органической химии. 2017. Т. 53, № 5. С. 741-750.
- Синтез имидазо[4,5-е][1,3]тиазоло[3,2-Ь][1,2,4]триазинов. Г.А. Газиева, П.А. Полубояров, Ю.В. Нелюбинаа, М.И. Стручкова, А.Н. Кравченко // Химия гетероциклических соединений. 2012.№ 9. С. 1483-1490.
- Азолоазины - антагонисты А2а-рецептора. Структура и свойства / К.В. Саватеев, Е.Н. Уломский, И.И. Буторин и др. // Успехи химии. 2018. Т. 87, № 7. С. 636-669. DOI 10.1070/RCR4792.
- Synthesis and optical properties of some 3,4-(ethylenedioxythiophen-2-yl)-1,2,4-triazine derivatives / D. Branowska, E. Olender, M. Swietochowska, Z. Karczmarzyk , W. Wysocki, I. Cichosz, A. Wozna, Z. Urbanczyk-Lipkowska, P. Kalicki, M. Gil // Tetrahedron. 2017. Vol. 73, no. 4. P. 411417. DOI: 10.1016/j.tet.2016.12.030.
- 3-Cyano-2-azaanthracene-based "push-pull" fluoro-phores: A one-step preparation from 5-cyano-1,2,4-triazines and 2,3-dehydronaphthalene, generated in situ / D.S. Kopchuk, N.V. Chepchugov, O.S. Taniya, A.F. Khasanov, K. Giri, I.S. Kovalev, S. Santra, G.V. Zyryanov, A. Majee, V.L. Rusinov, O.N. Chupakhin // Tetrahed. Lett. 2016. Vol. 57, no. 50. P. 5639-5643. DOI: 10.1016/j tetlet.2016.11.008.
- Convenient synthesis of a-dichloromethylpyridines from 3-trichloromethyl-1,2,4-triazines / N.V. Chepchugov, D.S. Kopchuk, I.S. Kovalev, G.V. Zyryanov, V.L. Rusinova and O.N. Chupakhin // Mendeleev Commun. 2016. Vol. 26, no. 3. P. 220-222. DOI: 10.1016/j.mencom.2016.04.014.
- п-Extended fluorophores based on 5-aryl-2,2'-bipyridines: synthesis and photophysical studies / O.V. Shabunina, D.Yu. Kapustina, A.P. Krinochkin, G.A. Kim, D.S. Kopchuk, G.V. Zyryanov, F. Lic and O.N. Chupakhin // Mendeleev Commun. 2017. Vol. 27, no. 6. P. 602-604. DOI: 10.1016/j.mencom.2017.11.021.
- Europium complex of 5-(4- dodecyloxyphenyl)-2,2'-bipyridine-6'-carboxylic acid / D.S. Kopchuk, A.P. Krinochkin, G.A. Kim and D.N. Kozhevnikov // Mendeleev Commun. 2017. Vol. 27, no. 4. P. 394-396. DOI: 10.1016/j.mencom.2017.07.026.
- Papadopoulou M.V., & Taylor E.C. Intramolecular Diels-Alder reactions of 1,2,4-triazines. Synthesis of 3-alkylpyridines via Raney nickel desulfurization of thieno[2,3-b]pyridines // Tetrahedron. 2021. 132158. DOI: 10.1016/j .tet.2021.132158.
- Галогенциклизация 3-аллилтио-5-фенил-1,2,4-триазина / Б.В. Рудаков, Д.Г. Ким // Журнал органической химии. 1997. Т. 33, вып. 7. С. 1103-1106.
- Halo-heterocyclization of trans-5-phenyl-3-cinnamylsulfanyl[1,2,4]triazine into [1,3]thiazino[3,2-b][1,2,4]triazin-9-ium systems / D.G. Kim, A.V. Rybakova, V.V. Sharutin, E.I. Danilina, O.V. Sazhaeva // Mendeleev Commun. 2019. Vol. 29. P. 59-60. DOI: 10.1016/j.mencom.2019.01.019.
- Рудаков Б.В., Ким Д.Г., Алексеев С.Г. Синтез 3-метил-7-фенилимидазо[1,2-Ь]-1,2,4-триазина // Химия гетероциклических соединений. 1998. Т. 34, № 1. С. 110-111.
- Гетероциклизация 3-пропаргилсульфанил-5-фенил-1,2,4-триазина: тандемные реакции с бромом, приводящие к синтезу новых производных 7-фенил[1,3]тиазоло[3,2-Ь][1,2,4]триазиния / А.В. Рыбакова, Д.Г. Ким, Е.И. Данилина, О.В. Сажаева, М.А. Ежикова, М.И. Кодесс // Известия высших учебных заведений. Серия «Химия и химическая технология». 2020. Т. 63, № 6. С. 19-24. DOI: 10.6060/ivkkt.20206306.6102.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea, J.A.K. Howard, H. Puschmann // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- A study of the interactions between I-/I3- redox mediators and organometallic sensitizing dyes in solar cells / T. Privalov, G. Boschloo, A. Hagfeldt, P.H. Svensson, L. Kloo // J. Phys. Chem. C. 2009. Vol. 113, iss. 2. P. 783-790. DOI: 10.1021/jp810201c.
- Studies on polyhalides, XXXVI on the octaiodide ion I82-: preparation and crystal structure of [(Crypt-2.2.2)H2]I8, of [Ni(phen)3]I82CHCl3 and of the (N-alkylurotropinium)octaiodides (UrR)2I8 with R = methyl and ethyl / A. Grafe-Kavoosian, S. Nafepour, K. Nagel, K.-F. Tebbe // Z Naturforsch B Chem. Sci. 1998. Vol 53. P. 641-652. DOI: 10.1515/znb-1998-0701.
- Фролова Т.В., Ким Д.Г., Слепухин П.А. Иодциклизация 2-аллил(металлил)сульфанил-6-(трифторметил)пиримидин-4(3#)-онов // Журнал органической химии. 2016. Т. 52, № 9. С. 13561358.
- Synthesis of iodine-substituted quinolines, quinolinium salts, and isoquinolinium salts via a three-component tandem reaction of aryl azides, propargylic alcohols, and iodine / Wu Yunjun, Shao Min, Feng Zhijun, Gu Xiaoxia, Hong Yi, Cui Qiaoyu, Ren Lianbing, Wang Shaoyin // Asian J.Org.Chem. 2017. Vol. 6. P. 76-82. DOI: 10.1002/ajoc.201600503.


