Синтез и электрофильная гетероциклизация 3-аллилсульфанил-1,2,4-триазино[6,5-b]индола
Автор: Рыбакова А.В., Дмитриев М.В., Ким Д.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.16, 2024 года.
Бесплатный доступ
Ряд научных исследований показал, что α-тиосемикарбазоны изатина, а также и их соответствующие продукты циклизации - [1,2,4]триазино[6,5-b]индол-3-тионы - проявляют более высокую способность к ионизации, липофильность и противовоспалительную активность, чем их изомерные β-тиосемикарбазоны изатина и их продукты циклизации. Кроме того, известный индометацин характеризуется меньшей противовоспалительной активностью и большей токсичностью, чем изученные производные изатина. В то же время тот факт, что α-тиосемикарбазоны изатина и их продукты циклизации являются менее описанными в литературе, по сравнению с β-тиосемикарбазонами изатина и [1,2,4]триазино[5,6-b]индол-3-тионами, в связи со сложностью и многостадийностью их синтеза, объясняет важность получения и исследования свойств новых производных данных соединений. В настоящей работе реакцией [1,2,4]триазино[6,5-b]индол-3-тиона с бромистым аллилом в среде ДМФА-КОН-Н2О впервые синтезирован 3-аллилсульфанил-1,2,4-триазино[6,5-b]индол, изомерный по структуре описанному в литературе 3-аллилсульфанил-1,2,4-триазино[5,6-b]индолу. Учитывая, что некоторые известные производные [1,3]тиазоло и [1,3]тиазино[3',2':2,3][1,2,4]триазино[5,6-b]индольных систем показали антимикотическую активность, осуществленная нами дальнейшая гетероциклизация 3-аллилсульфанил-1,2,4-триазино[6,5-b]индола под действием иода и брома в хлороформе интересна с точки зрения получения неизвестных ранее внутримолекулярных солей [1,3]тиазоло[2ʹ,3ʹ:3,4][1,2,4]триазино[6,5-b]индолия. Строение впервые синтезированных соединений подтверждено данными ЯМР 1Н, 13С, а также РСА.
Α-тиосемикарбазон изатина, 2, 9-дигидро[1, 4]триазино[6, 5-b]индол-3-тион, алкилирование, гетероциклизация, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147244645
IDR: 147244645 | УДК: 547.873, | DOI: 10.14529/chem240308
Текст научной статьи Синтез и электрофильная гетероциклизация 3-аллилсульфанил-1,2,4-триазино[6,5-b]индола
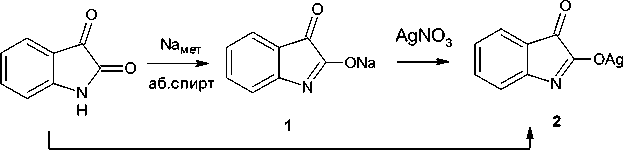
Синтез и свойства α-тиосемикарбазона изатина в литературе изучены значительно меньше, чем его β-изомера. В первую очередь, это может быть связано со значительно большей реакционной способностью карбонильной группы изатина в 3-м положении по сравнению с карбонильной группой во 2-м положении и, как следствие, со сложностью и многостадийностью процесса синтеза α-тиосемикарбазона изатина. Так, в работе [1] описан метод синтеза последнего через О-метиловый эфир изатина. На первом этапе получают серебряную соль изатина из изатина или его натриевой соли при действии на них соответственно ацетата серебра или нитрата серебра [2]. Натриевая соль изатина ( 1 ), в свою очередь, может быть достаточно легко получена при смешивании раствора изатина в абсолютном спирте и раствора натрия в абсолютном спирте [ 2]:
CH COOAg
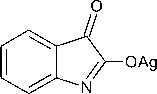
Необходимость перевода натриевой соли изатина в серебряную объясняется двойственностью свойств изатина, способного к образованию как N-, так и О-алкильных производных. Так, метилирование натриевой или калиевой соли изатина метилиодидом приводит к N-метилизатину, а метилирование серебряной соли – к О-метилпроизводному изатина [3].
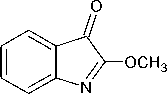
Таким образом, воздействуя на серебряную соль изатина ( 2 ) метилиодидом на следующем этапе получают О-метиловый эфир изатина ( 3 ). Дальнейшая реакция соединения 3 с тиосемикарбазидом при осторожном охлаждении горячего водного раствора до 30 °С приводит к синтезу α-тиосемикарбазона изатина ( 4 ) в виде ярко-красных кристаллов с выходом 67 %:
CH 3 I
-AgI
NH2NHCSNH2
Следует отметить, что при дальнейшем стоянии реакционной смеси образуется желтый осадок в-тиосемикарбазона 1-метилизатина.
Аналогично получают производные а-тиосемикарбазона изатина, содержащие в боковой цепи алкильные радикалы. Кроме того, описан подобный синтез а-тиосемикарбазона 5-бромизатина [4]. Синтез S-, N- моно- и диметил-производных а-тиосемикарбазона изатина осуществлен метилированием соответствующих тиосемикарбазонов [5].
В работе [6] представлен более быстрый способ синтеза преимущественно а-тиосемикарбазонов по реакции 2-анилиноизатина и 1-метил-2-анилиноизатина с семи- и тиосемикарбазидом.
Авторами [7] установлено, что в кислой среде а-тиосемикарбазоны изатина и другие (тиоа-цил)гидразоны рециклизуются в тиадиазолы, и описаны спектральные данные и некоторые реакции тиадиазольных продуктов. Так, а-(4',4'-диметил)тиосемикарбазон изатина в концентрированной HCl превращается в 2-диметиламино-5-(2-аминобензоил)-1,3,4-тиадиазол с выходом 94 %. Позднее на основе этих данных ими был предложен принципиально новый подход к синтезу а-тиосемикарбазонов изатина, который заключается в рециклизации 2-амино-5-(2-амино-5-Я-бензоил)-1,3,4-тиадиазолов при их нагревании в уксусной кислоте [8]:
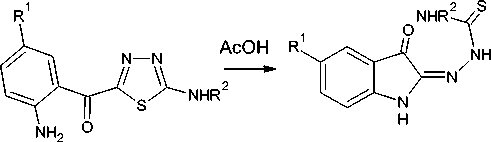
Известен также а,в-дитиосемикарбазон изатина, который, как утверждается, получают только из а-тиосемикарбазона изатина по реакции с тиосемикарбазидом [9]. Н агревание бис (тиосемикарбазона) изатина позволяет перейти к соответствующим 1,2,4-триазоло[4,3- а ]индолинам [10].
Исследована таутомерия некоторых а-тиосемикарбазонов изатина [11, 12]. Данные ИК показали, что в кристаллическом состоянии таутомерия названных соединений зависит от метода кристаллизации. Цвет соединений отражает его таутомерное состояние. Данные электронных спектров показали, что в растворе обычно преобладает таутомерная форма II, а увеличение полярности растворителя обычно увеличивает содержание таутомерной формы I:
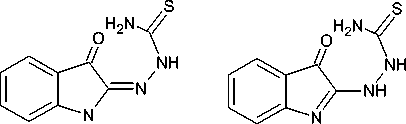
I II
Учитывая упомянутую выше большую реакционную способность карбонильной группы изатина в 3-м положении, следует ожидать, что циклизация а-тиосемикарбазона изатина должна протекать значительно легче, чем циклизация соответствующего в-тиосемикарбазона. Экспериментально было показано, что а-тиосемикарбазон изатина в щелочной среде циклизуется до 2,9-дигидро[1,2,4]триазино[6,5- b ]индол-3-тиона ( 5 ) [13], а в кислой среде происходит замыкание тиадиазинового цикла [1, 14]:
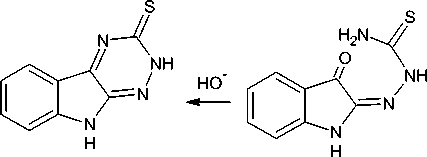
+
H+
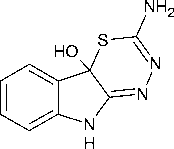
Электронно-спектральные данные показали, что скорости циклизации а-тиосемикарбазонов 1-К-изатина (R = H, Me; R = NH, NMe, SMe, Ph, 4-MeOC H, 3-ClCH H, NHMe, NHPh, NHC5H4CO2Et-4) до соответствующих тиадиазинов увеличиваются по мере повышения кислот- ности среды и в присутствии электронодонорной R-группы. Без катализа эффект заместителя был более сложным [15]. Однако в литературе также отмечается, что эта циклизация не свойственна а-тиосемикарбазонам других 1,2-дикарбонильных соединений [1].
Свойства 2,9-дигидро[1,2,4]триазино[6,5- b ]индол-3-тиона 5 и его производных мало изучены и в основном представлены в литературе реакциями ацилирования [16] и алкилирования. Например, описано алкилирование соединения 5 и его производных иодистым метилом с образованием соответствующих 3-метилсульфанил-1,2,4-триазино[6,5- b ]индолов [17-19]. Взаимодействие с гидрохлоридами 2-диалкиламиноэтилхлоридов, 2-морфолиноэтилбромида, 2-пиперидиноэтилбромида в воде даёт гидрохлориды 3-(2-диалкиламиноэтилсульфанил)-, 3-(2-морфолиноэтилсульфанил)- и 3-(2-пиперидиноэтилсульфанил)-1,2,4-триазино[6,5- b ]индолов [20, 21].
Кроме того, известно, что а-тиосемикарбазоны изатина, как и их соответствующие продукты циклизации, проявляют более высокую способность к ионизации, липофильность и противовоспалительную активность, чем в- тиосемикарбазоны изатина, их продукты циклизации [22] и чем известный индометацин [22, 23], токсичность которого при этом больше, чем для изученных производных изатина. Показано, что антигипоксическая и актопротекторная активности усиливаются у производных 1,2,4-триазина при сочленении триазинового ядра с индольным [24].
Получены и описаны в-, а-, а-(4',4'-диметил)-, а,в- бис - тиосемикарбазоны изатина и в-тиосемикарбазон 1-бутилизатина и их комплексы с SnMe2O [25] и CuCl [26]. Последние были исследованы на противогрибковую активность в отношении дрожжеподобных грибов Candida, плесневых грибов (Penicillium chrysogenum) и антибактериальную активность в отношении Escherichia coli и Staphylococcus aureus. При этом обнаружено, что активность комплексов с медью была значительно выше, чем у самих лигандов, и зависит от строения комплексов и степени их окисления медью [ 26 ].
Противовоспалительная активность в-, а-, а,в- бис -тиосемикарбазонов изатина и 2,9-дигидро[1,2,4]триазино[6,5- b ]индол-3-тиона была изучена на трех моделях асептического патологического воспаления: термических ожогах, адреналиновом отеке легких и ватной гранулемии [23].
Таким образом, химия а-тиосемикарбазонов изатина и их производных представлена в литературе рядом исследований, при этом большая часть исследований посвящена в первую очередь, изучению фармацевтических свойств данных соединений. В связи с чем вовлечение а-тиосемикарбазона изатина в синтез принципиально новых соединений на его основе является актуальным направлением.
Целью настоящей работы является синтез неизвестного ранее S-аллильного производного 2,9-дигидро[1,2,4]триазино[6,5- b ]индол-3-тиона и изучение реакции его гетероциклизации под действием брома и иода.
Экспериментальная часть
Синтез натриевой соли изатина (1) . К раствору 5 г (0,034 моль) изатина в 33 мл абсолютного этилового спирта добавляли охлажденный до 0 °С раствор 0,670 г (0,029 моль) металлического натрия в 33 мл абсолютного этилового спирта. Реакционную смесь перемешивали, а затем отфильтровывали и сушили образовавшийся осадок фиолетового цвета, выход 81 %.
Синтез серебряной соли изатина (2) . Высушенные и измельченные 4,624 г (0,027 моль) натриевой соли изатина добавляли к раствору 4,586 г (0,027 моль) нитрата серебра в 46 мл воды, перемешивали и оставляли стоять 2 часа. Затем отфильтровывали образовавшийся осадок серебряной соли изатина красно-коричневого цвета с выходом 95 %, Тпл (с разложением) 219 °С.
Синтез О-метилового эфира изатина (3). К раствору 6,510 г (0,026 моль) высушенной серебряной соли изатина в 15 мл безводного диэтилового эфира добавляли 2,12 мл (0,034 моль) ме-тилиодида. Реакционную смесь выдерживали без доступа света и влаги при эпизодическом перемешивании в течение 7 суток. Затем добавляли 22 мл безводного бензола, энергично встряхивали 3 минуты и оставляли стоять на 1 час. Отфильтровывали осадок и промывали его безводным бензолом, промывную жидкость присоединяли к фильтрату и получали раствор О-метилового эфира изатина [1, 2 ].
Синтез а-тиосемикарбазона изатина (4). Смешивали полученный в описанной выше методике раствор (0,026 моль) О-метилового эфира изатина в бензоле с раствором 2,333 г (0,026 моль) тиосемикарбазида. Реакционную смесь перемешивали в течение 12 минут. Затем образовавшийся осадок α-тиосемикарбазона изатина отфильтровывали, промывали кипящей водой (30 мл) и этиловым спиртом (5 мл), сушили. Осадок красного цвета с выходом 27 %, Тпл 218–219 °С, лит. 67 %, Тпл. 217 °С [1].
Синтез 2,9-дигидро[1,2,4]триазино[6,5- b ]индол-3-тиона (5) . Раствор 1,536 г (6,94 ммоль) α-тиосемикарбазона изатина в 23 мл 1н раствора гидроксида натрия кипятили с обратным холодильником в течение 3 ч. Затем оставляли стоять на сутки и после кипятили ещё 15 минут. Отфильтровывали раствор от механических примесей, фильтрат подкисляли уксусной кислотой до нейтральной среды. Образовавшийся осадок 2,9-дигидро-3 H -[1,2,4]триазино[6,5- b ]индол-3-тиона красного цвета отфильтровывали и сушили, выход 34 %, Тпл = 190–197 °С.
Синтез 3-аллилсульфанил-9 H -[1,2,4]триазино[6,5- b ]индола (6) . К раствору 0,183 г (0,91 ммоль) соединения 5 в 10 мл ДМФА добавляли раствор 0,051 г (0,91 ммоль) гидроксида калия в 0,01 мл воды и 0,08 мл (0,91 ммоль) бромистого аллила. Реакционную смесь перемешивали в течение 12 ч. Затем добавляли 30 мл воды, оставляли стоять на 24 часа. Образовавшийся осадок 3-аллилсульфанил-1,2,4-триазино[6,5- b ]индола коричневого цвета отфильтровывали и сушили. Выход 51 %. Тпл= 137–138 °С.
Синтез иодида 3-иодметил-2,3-дигидро-6 H -[1,3]тиазоло[2',3':3,4] [1,2,4]триазино[5,6- b ]индолия (7). К раствору 0,071 г (0,28 ммоль) иода в 5 мл хлороформа добавляли раствор 0,034 г (0,14 ммоль) соединения 6 в 5 мл хлороформа. Реакционную смесь оставляли стоять при комнатной температуре на 48 ч. Затем надосадочную жидкость декантировали, остаток – черное масло и осадок – растворяли в небольшом количестве ацетона и добавляли NaI. Образовавшийся красный осадок отфильтровывали, промывали ацетоном и сушили. Выход 23 %, Тпл (с разложением) = 220–222 °С.
Синтез бромида 3-бромметил-2,3-дигидро-6 H -[1,3]тиазоло[2',3':3,4][1,2,4]триазино[5,6- b ]индолия (8) . К раствору (0,23 ммоль) соединения 6 в 5 мл хлороформа при перемешивании и охлаждении льдом добавляли по каплям раствор 0,02 мл (0,46 ммоль) брома в 2 мл хлороформа. Реакционную смесь оставляли стоять на 48 ч при комнатной температуре. Затем надосадочную жидкость декантировали, остаток – красное масло и осадок – растворяли в небольшом количестве ацетона. Образовавшийся осадок красно-оранжевого цвета отфильтровывали, промывали ацетоном и сушили. Выход 24 %, Тпл (с разложением) = 230–232 °С.
Рентгеноструктурный анализ выполнен на монокристальном дифрактометре Xcalibur Ruby (Agilent Technologies) с ССD-детектором (MoKα-излучение, 295(2) K, ω-сканирование c шагом 1°). Поглощение учтено эмпирически с использованием алгоритма SCALE3 ABSPACK [27]. Структура расшифрована с помощью программы SHELXT [28] и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов с помощью программы SHELXL [29] с графическим интерфейсом OLEX2 [30]. Атомы водорода включены в уточнение в модели наездника .
Результаты РСА зарегистрированы в Кембриджском центре кристаллографических данных под номером CCDC 2345635 и могут быть запрошены по адресу
В табл. 1 приведены основные кристаллографические данные и результаты уточнения структуры 7 .
Таблица 1
Основные кристаллографические данные, параметры эксперимента и уточнения структуры 7
|
Параметр |
Значение |
|
Формула |
C 12 H 10 Br 2 N 4 S |
|
Молекулярная масса |
402,12 |
|
Сингония |
моноклинная |
|
Пространственная группа |
I 2/a |
|
a, Å |
24,742(15) |
|
b, Å |
6,3788(16) |
|
c, Å |
20,232(11) |
|
α, град. |
90 |
|
β, град. |
116,51(7) |
|
γ, град. |
90 |
Окончание табл. 1
|
Параметр |
Значение |
|
V, Å3 |
2857(3) |
|
Z |
8 |
|
ρ выч, г/см3 |
1,870 |
|
μ, мм-1 |
5,811 |
|
F (000) |
1568,0 |
|
Размеры кристаллаm, мм3 |
0,35 × 0,22 × 0,08 |
|
Излучение |
MoKα (λ = 0,71073) |
|
Диапазон 2Θ, ° град. |
4,36–59,574 |
|
Всего отражений |
11094 |
|
Независимых отражений |
3578 [ R int = 0,1663, R sigma = 0,2571] |
|
Данные/ограничения/параметры |
3578/7/173 |
|
GOOF |
1,025 |
|
Окончательные факторы расходимости [ I >= 2σ( I )] |
R 1 = 0,1492, wR 2 = 0,3743 |
|
Окончательные факторы расходимости (для всех данных) |
R 1 = 0,3374, wR 2 = 0,4603 |
|
Максимальный и минимальный пики остаточной электронной плотности, e∙Å–3 |
1,10/–0,73 |
Обсуждение результатов
Ранее на примере гетероциклизации 3-аллилсульфанил-5 Н -[1,2,4]триазино[5,6- b ]индола [31, 32] и других S-производных 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тионов [33–36] под действием иода и брома нами был получен ряд новых [1,3]тиазоло и [1,3]тиазино[3',2':2,3][1,2,4]триазино[5,6- b ]индольных систем. Некоторые из последних были исследованы на антимикотическую активность против 8 видов грибов и показали слабую, умеренно-выраженную и высокую антимикотическую активность против культуры гриба Trichophyton rubrum, являющегося возбудителем руброфитии [37]. В связи с чем в настоящей работе нами осуществлен аналогичный синтез [1,3]тиазолотриазиноиндольных систем при действии галогенов на изомерный 3-аллилсульфанил-9 Н -[1,2,4]триазино[6,5- b ]индол ( 6 ).
На первом этапе нашего исследования нами был осуществлен вышеописанный многостадийный синтез 2,9-дигидро[1,2,4]триазино[6,5- b ]индол-3-тиона 5 из натриевой соли изатина 1 через его О-метиловый эфир 3 и α-тиосемикарбазон изатина 4 . Далее мы изучили применимость описанной методики алкилирования в суперосновной среде 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тионов [33–37] для реакции его изомера – 2,9-дигидро-3 H -[1,2,4]триазино[6,5- b ]индол-3-тиона 5 – с бромистым аллилом. При этом нами был получен неизвестный ранее 3-аллилсульфанил-1,2,4-триазино[6,5- b ]индол 6 с выходом 51 %:
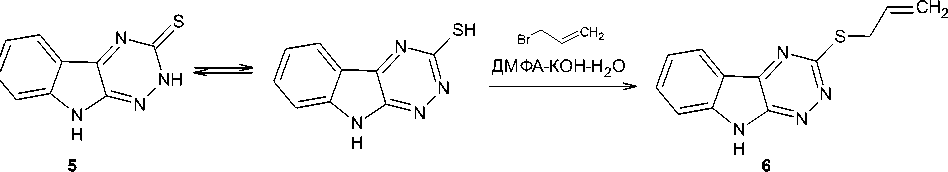
В спектре ЯМР 1Н соединения 6 наблюдаются сигналы протонов аллильной группы: дублет дублетов протонов SCH 2 – в области 4,02 м. д., протоны СН 2 – в виде двух расщепленных сигналов при 5,14–5,16 и 5,39–5,43 м. д., а также мультиплет протона –СН= – при 6,01–6,09 м. д. В спектре ЯМР 13С соединения 6 сигнал в сильном поле при 33,15 м. д. можно отнести к углероду группы SCH 2 , а самый слабопольный сигнал (при 162,28 м. д.) – к углероду триазинового цикла, связанному с двумя атомами азота и одним атомом серы (С-3). Полные данные спектров ЯМР 1Н и 13С соединения 6 представлены в табл. 2.
Данные спектров ЯМР 1Н и 13С соединений 6–8
Таблица 2
|
Структура соединения |
Данные спектров ЯМР 1Н и 13С (5, м. д.) и КССВ ( J , Гц) |
|
Ha 2' 3'
4b 4a
1 H 9 6 |
Спектр ЯМР 1Н (500,13 МГц, DMSO-d6): 4,02 (2Н, д. д., 3 J =20,6; 4 J =6,9; SCH 2 ); 5,14-5,16 (1Н, м., =СННЬ); 5,39-5,43 (1Н, м., =СНаН); 6,01-6,09 (1Н, м., -СН=); 7,37-7,40 (1H, м., H-7); 7,61-7,63 (1H, м., H-6); 7,79-7,82 (1H, м., H-8); 8,30 (1H, д., 3 J = 7,9, H-5); 12,55 (1Н, уш. с., NH) |
|
Спектр ЯМР 13C (125,76 МГц, DMSO-d6): 33,15 (С-1'); 112,85 (С-8); 118,10 (С-3'); 118,29 (С-4Ь); 121,36 (С-5); 123,63 (С-6); 130,83 (С-7); 133,72 (С-2'); 139,89 (С-8а); 143,81 (С-4а); 148,35 (С-9а); 162,28 (С-3) |
|
|
10 11 1S 9 N 11a 2 10a 10b 8 N + 3 7 6a N 5a N I 6 H 5 I_ 1' 7 |
Спектр ЯМР 1Н (500,13 МГц, DMSO-d6): 3,80 (1Н, д. д., 2 J = 11,9, 3 J = 7,7, SCH 2 ); 3,88-3,96 (2Н, м., СН 2 1); 4.17 (1Н, д. д., 2 J = 11,9, 3 J = 9,1, SCH 2 ); 5,59-5,64 (1Н, м, Н-3); 7,55-7,58 (1H, м., 3 J = 7,6, H-9); 7,76 (1H, д., 3 J = 8,4, H-7); 8,07-8,10 (1H, м., H-8); 8,46 (1H, д., 3 J = 8,1, H-10); 13,67 (1Н, уш. с., NH) |
|
Спектр ЯМР 13C (125,76 МГц, DMSO-d6): 5,50 (СН 2 1); 32,97 (С-2); 69,23 (С-3); 114,13 (С-7); 115,61 (С-10а); 123,93 (С-10); 125,90 (С-9); 139,29 (С-8); 145,40 (С-6а); 147,41 (С-10Ь); 150,51 (С-5а); 162,93 (С-11а) |
|
|
1 10 11 S N 11a 2 10a10b 8 N + 3 7 6a N 5a N 5 4 1' Br H Br_ 8 |
Спектр ЯМР 1Н (500,13 МГц, DMSO-d6): 3,90 (1Н, д. д., 2 J = 12,0, 3 J =7,5, SCH2); 4,23-4,31 (3Н, м., СН2Вг, SCH2); 5,875,92 (1Н, м, Н-3); 7,54-7,58 (1H, м., 3 J = 7,6, H-9); 7,78 (1H, д., 3 J = 8,4, H-7); 8,07-8,10 (1H, м., H-8); 8,46 (1H, д., 3 J = 8,02, H-10); 13,70 (1Н, уш. с., NH) |
|
Спектр ЯМР 13C (125,76 МГц, DMSO-d6): 30,71 (СН2Вг); 33,15 (С-2); 69,10 (С-3); 114,12 (С-7); 115,61 (С-10а); 123,90 (С-10); 125,92 (С-9); 139,30 (С-8); 145,39 (С-6а); 147,59 (С-10Ь); 150,58 (С-5а); 163,29 (С-11а) |
Дальнейшую гетероциклизацию соединения 6 под действием иода и брома проводили в хлороформе. Методом РСА нам удалось установить, что она протекает аналогично изученным нами ранее реакциям гетероциклизации S-производных 5 Н -[1,2,4]триазино[5,6- b ]индол-3-тионов [3337] с участием атома азота N-2 триазинового цикла и аннелированием пятичленного тиазольного цикла:
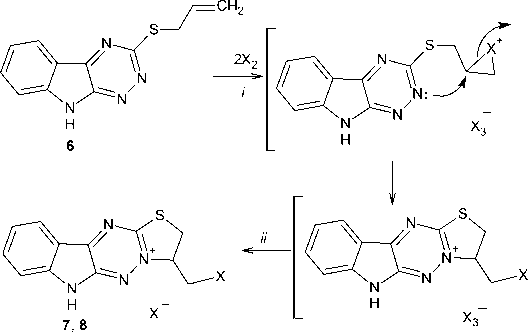
Образующиеся при этом трииодид 3-иодметил-2,3-дигидро-6 H -[1,3]тиазоло[2ʹ,3ʹ:3,4][1,2,4]триазино[5,6- b ]индолия и трибромид 3-бромметил-2,3-дигидро-6 H -[1,3]тиазоло[2ʹ,3ʹ:3,4] [1,2,4]триазино[5,6- b ]индолия, по-видимому, находятся в смеси с соответствующими моногалогенидами, так как представляют собой смесь масла и кристаллического осадка. Поэтому данную смесь мы подвергали обработке ацетоном – в случае трибромида – и обработке ацетоном и иодидом натрия – в случае трииодида. При этом нами были получены моногалогениды 3-галогенметил-2,3-дигидро-6 H -[1,3]тиазоло[2ʹ,3ʹ:3,4][1,2,4]триазино[5,6- b ]индолия ( 7 , 8 ). Данные спектров ЯМР 1Н и 13С моноиодида 7 и монобромида 8 представлены в табл. 2.
Однако в случае реакции гетероциклизации под действием брома нам удалось механически отделить ряд кристаллов из смеси с маслом. Далее мы промывали их гексаном и исследовали методом РСА. Структура бромида 8 и нумерация атомов, принятая в структурном эксперименте, приведена на рисунке.
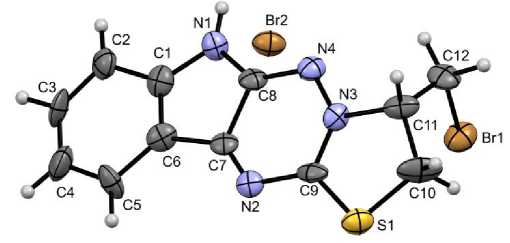
Структура соединения 8 по данным РСА в тепловых эллипсоидах 20 % вероятности
Несмотря на плохое качество кристаллов, структура соединения 8 однозначно подтверждается методом РСА и согласуется с другими спектральными данными. По данным РСА бромид 8 кристаллизуется в центросимметричной пространственной группе моноклинной сингонии в виде рацемата. Тетрациклическая система катиона приблизительно плоская (RMSD 0,059 Å) с наибольшим отклонением от среднеквадратичной плоскости атома C10 на 0,13 Å. Катион и анион связаны водородной связью N1–H1∙∙∙Br2 [N1–H1 0,86 Å, H1∙∙∙Br2 2,339 Å, N1∙∙∙Br2 3,19(2), угол N1H1Br2 169°]. Помимо классической водородной связи в кристалле присутствуют укороченные контакты атомов водорода метиленовых групп и аниона брома.
Заключение
По известной методике через ряд стадий из изатина нами был получен 2,9-дигидро-[1,2,4]триазино[6,5- b ]индол-3-тион 5 для дальнейшего исследования его реакции с бромистым аллилом в среде ДМФА-КОН-Н 2 О, в результате которой впервые получен 3-аллилсульфанил-1,2,4-триазино[6,5- b ]индол 6 . Далее под действием иода и брома в хлороформе была осуществлена гетероциклизация аллилсульфида 6 , которая привела к синтезу неизвестных ранее внутримолекулярных солей [1,3]тиазоло[2ʹ,3ʹ:3,4][1,2,4]триазино[5,6- b ]индолия 7 , 8 . Строение впервые синтезированных соединений 6–8 подтверждено данными ЯМР 1Н, 13С, а также для соединения 8 – методом РСА.
Список литературы Синтез и электрофильная гетероциклизация 3-аллилсульфанил-1,2,4-триазино[6,5-b]индола
- Жунгиету Г.И. Изатин и его производные. Кишинев: изд-во Штиинца. 1977. 229 с.
- Moriconi E.J., Murra J.J. J. Org. Chem. 1964. V. 29, No. 12. P. 3577. DOI: 10.1021/jo01035a033.
- Гетероциклические соединения. В 3-х томах. Т. 3 // под ред. Р. Эльдерфильда. М.: Изд-во Иностранной литературы. 1954. 357 с.
- Томчин А.Б. Журнал органической химии. 1990. Т. 26, вып. 4. С. 59.
- Томчин А.Б., Широкий Г.А., Дмитруха В.С. и др. Химия гетероциклических соединений. 1976. № 1. С. 83.
- Bell M.R., Zalay A.W. Journal of Heterocyclic Chemistry. 1975. V. 12, No. 5. P. 1001.
- Томчин А.Б. Журнал органической химии. 1988. Т. 24, вып. 4. С. 863.
- Tomchin A.B. Journal of Organic Chemistry. 1997. V. 33, No. 4. P. 567.
- Joaquim F.M. da S., Simon J. G. and Angelo da C.P. The chemistry of isatins: a review from 1975 to 1999 https://rushim.ru/books/mechanizms/izatin.pdf
- Tomchin A.B., Dmitrukha V.S., Pel'kis P.S. Journal of Organic Chemistry. 1977. V. 13, No. 4. P. 878.
- Tomchin A.B., Zelenin K.N., Shirokii G.A. Chemistry of Heterocyclic Compounds. 1979. V. 3. P. 355.
- Tomchin A.B., Shirokii G.A. Journal of Organic Chemistry. 1974. V. 10, No. 11. P. 2465.
- Ioffe I.S., Tomchin A.B., Shirokii G.A. Journal of Organic Chemistry. 1971. V. 7, No. 1. P. 179.
- Tomchin A.B., Shirokii G.A. Journal of Organic Chemistry. 1977. V. 13, No. 2. P. 404.
- Tomchin A.B., Shirokii G.A. Journal of Organic Chemistry. 1979. V. 15, No. 4. P. 855.
- Dmitrukha V.S., Pel'kis P.S. Chemistry of Heterocyclic Compounds. 1972. V. 6. P. 852.
- Dmitrukha V.S., Pel'kis P.S. Chemistry of Heterocyclic Compounds. 1972. No. 6. P. 773.
- Tomchin A.B., Ioffe I.S., Lepp Yu.V. et al. Journal of Organic Chemistry. 1974. V. 10, No. 2. P. 371.
- Tomchin A.B., Ioffe I.S., Shirokii G.A. Journal of Organic Chemistry. 1974. V. 10, No. 1. P. 103.
- Tomchin A.B., Okovityi S.V., Velezheva V.S. et al. Pharmaceutical Chemistry Journal. 1998. V. 32, No. 7. P. 362.
- Томчин А.Б., Урюпов О.Ю., Смирнов А.В. Химико-фармацевтический журнал. 1997. Т. 31, № 12. С. 6.
- Ayalp A., Neibioglu D. Pakistan Journal of Pharmacology. 1989. V. 6(1-2). P. 1.
- Томчин А.Б., Жмыхова И.Л., Пономарева М.М. и др. Химико-фармацевтический журнал. 1986. № 9. С. 1051.
- Томчин А.Б., Вележева В.С., Шустов Е.Б. Химико-фармацевтический журнал. 1998. № 2. С. 7.
- Casas J.S., Castiñeiras A., Rodríguez-Argüelles M.C. et al. J. Chem. Soc., Dalton Trans., 2000, 4056. DOI: 10.1039/B005103I.
- Ivanov V.E., Tikhomirova N.G., Tomchin A.B. et al. Pharmaceutical Chemistry Journal. 1989. V. 23, No. 5. P. 588.
- CrysAlisPro, Agilent Technologies, Version 1.171.37.33 (release 27-03-2014 CrysA-lis171.NET)
- Sheldrick G.M. Acta Crystallogr., Sect. A: Found. Adv. 2015. V. 71. P. 3. DOI: 10.1107/S2053273314026370.
- Sheldrick G.M. Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. P. 3. DOI: 10.1107/S2053229614024218.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Ким Д.Г., Журавлёва А.В. Химия гетероцикл. соединений. 2010. № 7. С. 1107.
- Рыбакова А.В., Слепухин П.А., Ким Д.Г. Химия гетероцикл. соединений. 2013. № 8. С. 1320.
- Рыбакова А.В., Ким Д.Г., Ежикова М.А. и др. Изв. АН. Сер. хим. 2015. № 4. С. 901.
- Рыбакова А.В., Ким Д.Г. Вестник ЮУрГУ. Сер. «Химия». 2012. Т. 10, № 36. С. 64.
- Рыбакова А.В., Ким Д.Г., Ежикова М.А. и др. Журн. орг. химии. 2015. Т. 51, вып. 7. С. 1034.
- Рыбакова А.В., Ким Д.Г., Шарутин В.В. Журн. орг. химии. 2016. Т. 52, вып. 1. С. 106.
- Рыбакова А.В. Синтез, структура и свойства [1,3]тиазоло([1,3]тиазино) [1,2,4]триазино[5,6-b]индольных систем: автореф. дис. … канд. хим. наук. Иркутск: 2016. 22 с.

![Синтез и электрофильная гетероциклизация 3-аллилсульфанил-1,2,4-триазино[6,5-b]индола Синтез и электрофильная гетероциклизация 3-аллилсульфанил-1,2,4-триазино[6,5-b]индола](/file/cover/147244645/sintez-i-jelektrofilnaja-geterociklizacija-3-allilsulfanil-124-triazino-65-b.png)
