Синтез и кристаллическая структура аренсульфонатов алкилтрифенилфосфония [Ph3PR][OSO2Ar]
Автор: Механошина Евгения Сергеевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.15, 2023 года.
Бесплатный доступ
Реакцией эквимолярных количеств бромидов алкилтрифенилфосфония с мезитиленсульфоновой, 1-окси-2,4-динитро-7-нафталинсульфоновой, 2-карбоксибензолсульфоновой и сульфосалициловой кислотами в воде получены ионные аренсульфонаты алкилтрифенилфосфония [Ph3PR][OSO2Ar], R = CH2Ph, Ar = С6H2Me3-2,4,6 (1), R = CH2ОMe, Ar = C10H4(OH-1)(NO2)2-2,4 (2), R = (CH2)4Br, Ar = C6H4(COOH-2) (3), R = CH2ОН, Ar = C6H3(COOH-3)(OH-4) (4). Особенности строения комплексов 1-4 установлены методом РСА. Кристаллы 1 [C34H35O4PS, M 570,65; сингония моноклинная, группа симметрии P21/c ; параметры ячейки: a = 11,083(12), b = 21,520(16), c = 12,768(10) Å; a = 90,00, β = 92,62(4), g = 90,00 град., V = 3042(5) Å3, Z = 4; rвыч = 1,246 г/см3], 2 [C30H25N2O9PS, M 620,55; сингония триклинная, группа симметрии P- 1; параметры ячейки: a = 8,998(5), b = 12,347(5), c = 13,204(6) Å; a = 82,92(2), β = 81,90(3), g = 83,92(2) град., V = 1435,2(12) Å3, Z = 2; rвыч = 1,436 г/см3], 3 [C29H28O5PSBr, M 599,45; сингония моноклинная, группа симметрии P21/n ; параметры ячейки: a = 12,685(11), b = 16,178(13), c = 13,743(13) Å; a = 90,00, β = 90,39(3), g = 90,00 град., V = 2820(4) Å3, Z = 4; rвыч = 1,412 г/см3], 4 [C26H27O9PS, M 546,50; сингония моноклинная, группа симметрии P21/n ; параметры ячейки: a = 9,201(4), b = 10,113(15), c = 28,77(4) Å; a = 90,00, β = 90,51(6), g = 90,00 град., V = 2677(7) Å3, Z = 4; rвыч = 1,356 г/см3] состоят из тетраэдрических алкилтрифенилфосфониевых катионов и аренсульфонатных анионов с тетраэдрическим атомом серы. Длины связей P-C варьируют в интервале 1,717(3)-1,931(3) Å. Валентные углы СРС принимают значения 101,87(14)°-122,99(13)°. Расстояния S-C близки между собой и изменяются в пределах 1,752(5)-1,798(6) Å; длины связей S-O: 1,303(2)-1,53(2) Å. Соединения 1 и 4 кристаллизуются в виде гидратов. Катионы и анионы в комплексах 1-4 связаны слабыми водородными связями типа S=O∙∙∙Н(Рh) [2,25-2,67 Å] и S=O∙∙∙Н(C) [2,23-2,63 Å]. В кристаллических структурах 1, 2, 4 присутствуют CH∙∙∙π взаимодействия. В формировании пространственной структуры кристаллов соединений 1, 2 также принимают участие π-π взаимодействия. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2164931 (1), № 2168826 (2), № 2163921 (3), № 2168621 (4), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Мезитиленсульфоновая, 1-окси-2, 4-динитро-7-нафталинсульфоновая, 2-карбоксибензолсульфоновая, сульфосалициловая, кислота, аренсульфонат алкилтрифенилфосфония, синтез, строение, рентгеноструктурные исследования
Короткий адрес: https://sciup.org/147240929
IDR: 147240929 | УДК: 546.87+547.29+548.312.5 | DOI: 10.14529/chem230204
Текст научной статьи Синтез и кристаллическая структура аренсульфонатов алкилтрифенилфосфония [Ph3PR][OSO2Ar]
Органические соединения фосфора (ОФС) активно исследуются во всех научных центрах мира, что связано с их химическими достоинствами и широкими возможностями практического применения. Так, фосфорорганические соединения используются в качестве пластификаторов, инсектицидов, фунгицидов, дефолиантов и гербицидов [1]. ОФС ‒ важнейшие промежуточные продукты в синтетической химии, в частности в реакции Виттига [2]. Фосфониевые соли также являются органокатализаторами в асимметрическом межфазном катализе [3], реагентами для транс -металлирования [4] и метатезиса σ -связей [5]. В нефтехимической промышленности ОФС используют как присадки к маслам и бензинам с целью улучшения их качества [6]. Следует отметить огромное значение солей фосфония в создании новых материалов, каталитических систем, ионных жидкостей, проявляющих уникальные свойства [7‒9]. Кроме того, ОФС применяются в качестве антимикробных, антигрибковых соединений, которые обладают высокой биологической активностью и низкой токсичностью [10‒12].
Наиболее распространенным способом синтеза фосфониевых солей является кватернизация соответствующего фосфина в результате реакции с электрофилом или кислотой Бренстеда [13‒16]. Иной способ получения основан на реакции пентафенилфосфора с кислотами [17‒20]. Однако данные методики имеют определенные недостатки: длительность, достаточно жесткие условия и сравнительно невысокие выходы целевого продукта. Таким образом, разработка новых простых методик получения солей фосфония, содержащих разнообразные функциональные группы, является актуальным направлением современной органической химии.
В работах [21 - 23] нами был синтезирован и структурно охарактеризован ряд органосульфонатов тетраорганилфосфония. Кристаллы соединений были получены в результате реакции водных растворов галогенидов тетраорганилфосфония и аренсульфоновых кислот. Достоинствами данного одностадийного способа являются мягкие условия, быстрота и высокие выходы комплексов.
В настоящей работе представлен синтез новых ионных аренсульфонатов алкилтрифенилфосфония [Ph3PR][OSO2Ar], R = CH2Ph, Ar = С6H2Me3-2,4,6 ( 1 ), R = CH2OMe, Ar = C10H4(OH-1)(NO2)2-2,4 ( 2 ), R = (CH2)4Br, Ar = C 6 H4(COOH-2) ( 3 ), R = CH 2 OH, Ar = C 6 H3(COOH-3)(OH-4) ( 4 ), особенности строения которых установлены методом РСА.
Экспериментальная часть
В работе использовали бромиды алкилтрифенилфосфония производства фирмы Alfa Aesar.
Гидрат 2,4,6-триметилбензолсульфоната бензилтрифенилфосфония (1). К раствору бромида бензилтрифенилфосфония (0,108 г, 0,250 ммоль) в 10 мл воды добавляли 10 мл водного раствора мезитиленсульфоновой кислоты (0,050 г, 0,250 ммоль). По мере испарения растворителя выделялись бесцветные кристаллы, которые сушили на воздухе. Выход 0,131 г (95 %), Т пл = 104 ° С. ИК-спектр ( у , см - 1): 3375, 3051, 2999, 2984, 2849, 2772, 1601, 1585, 1483, 1456, 1437, 1408, 1333, 1315, 1250, 1188, 1165, 1111, 1072, 1032, 995, 922, 874, 849, 824, 791, 748, 719, 691, 615, 582, 530, 496, 449. Найдено, %: C 71,49; Н 6,13. C 34 H 35 O 4 PS. Вычислено, %: С 71,56; Н 6,18.
Соединения 2 - 4 синтезировали аналогично.
1-Окси-2,4-динитро-7-нафталинсульфонат (метоксиметил)трифенилфосфония (2). Оранжевые кристаллы. Выход 0,146 г (94 %), Т = 173 ° С. ИК-спектр ( у , см - 1): 3206, 3096, 3044, 3024, 2905, 2837, 1601, 1576, 1541, 1520, 1481, 1437, 1406, 1343, 1323, 1292, 1271, 1234, 1202, 1161, 1126, 1115, 1092, 1076, 1036, 995, 935, 901, 860, 847, 814, 795, 781, 746, 721, 704, 691, 638, 621, 588, 530, 500, 449, 417. Найдено, %: С 58,00; Н 4,12. C 30 H 25 N 2 O 9 PS. Вычислено, %: С 58,07; Н 4,06.
2-Карбоксибензолсульфонат (4-бромбутил)трифенилфосфония (3). Бесцветные кристаллы. Выход 0,139 г (93 %), Т пл = 99 ° С. ИК-спектр ( у , см - 1): 3193, 3059, 3003, 2980, 2934, 2886, 2793, 1705, 1587, 1560, 1485, 1437, 1296, 1279, 1248, 1173, 1159, 1136, 1111, 1076, 1022, 1007, 995, 984, 918, 877, 854, 799, 754, 733, 723, 691, 621, 569, 528, 503, 457, 419. Найдено, %: С 58,06; Н 4,80. C 29 H 28 O 5 PSBr. Вычислено, %: С 58,11; Н 4,71.
Гидрат 3-карбокси-4-гидроксибензолсульфоната (гидроксиметил)трифенилфосфония (4). Бесцветные кристаллы. Выход 0,121 г (96 %), Тпл = 106 ° С. ИК-спектр ( у , см - 1): 3424, 3169, 3073, 2940, 2905, 2866, 1670, 1609, 1587, 1476, 1439, 1319, 1290, 1242, 1171, 1157, 1148, 1115, 1076, 1057, 1030, 997, 959, 934, 916, 885, 870, 833, 799, 743, 721, 689, 665, 598, 581, 532, 501, 478, 440. Найдено, %: C 57,07; Н 5,02. C 26 H 27 O 9 PS. Вычислено, %: С 57,14; Н 4,98.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектры соединений 1-4 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ (РСА) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo Ka-излучение, X = 0,71073 А, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [24‒26]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Кристаллографические данные, параметры эксперимента и уточнения структур 1 ‒ 4
Длины связей и валентные углы в структурах 1 ‒ 4
Таблица 1
|
Параметр |
1 |
2 |
3 |
4 |
|
Формула |
C 34 H 35 O 4 PS |
C 30 H 25 N 2 O 9 PS |
C 29 H 28 O 5 PSBr |
C 26 H 27 O 9 PS |
|
М |
570,65 |
620,55 |
599,45 |
546,50 |
|
Сингония |
Моноклинная |
Триклинная |
Моноклинная |
Моноклинная |
|
Пр. группа |
P2 1 / c |
P -1 |
P2 1 / n |
P2 1 / n |
|
a , Å |
11,083(12) |
8,998(5) |
12,685(11) |
9,201(4) |
|
b, Å |
21,520(16) |
12,347(5) |
16,178(13) |
10,113(15) |
|
c, Å |
12,768(10) |
13,204(6) |
13,743(13) |
28,77(4) |
|
α , град. |
90,00 |
82,92(2) |
90,00 |
90,00 |
|
β , град. |
92,62(4) |
81,90(3) |
90,39(3) |
90,51(6) |
|
γ , град. |
90,00 |
83,92(2) |
90,00 |
90,00 |
|
V , Å3 |
3042(5) |
1435,2(12) |
2820(4) |
2677(7) |
|
Z |
4 |
2 |
4 |
4 |
|
Двыч.), г/см 3 |
1,246 |
1,436 |
1,412 |
1,356 |
|
ц , мм-1 |
0,195 |
0,228 |
1,625 |
0,232 |
|
F (000) |
1208,0 |
644,0 |
1232,0 |
1144,0 |
|
Размер кристалла, мм |
0,37 × 0,23 × 0,15 |
0,5 × 0,27 × 0,05 |
0,3 × 0,25 × 0,2 |
0,35 × 0,17 × 0,02 |
|
Область сбора данных по 9 , град. |
6,08–64,9 |
5,76‒71,58 |
5,84–56,56 |
5,986–56,948 |
|
Интервалы индексов отражений |
–16 ≤ h ≤ 16, –28 ≤ k ≤ 28, –14 ≤ l ≤ 14 |
–14 ≤ h ≤ 14, –20 ≤ k ≤ 20, –21 ≤ l ≤ 21 |
–16 ≤ h ≤ 16, –21 ≤ k ≤ 21, –18 ≤ l ≤ 18 |
–12 ≤ h ≤ 12, –13 ≤ k ≤ 13, –38 ≤ l ≤ 38 |
|
Измерено отражений |
64557 |
74248 |
90194 |
76873 |
|
Независимых отражений |
7518 |
12433 |
6963 |
6640 |
|
R int |
0,1069 |
0,0598 |
0,0622 |
0,2321 |
|
Переменных уточнения |
367 |
392 |
335 |
372 |
|
GOOF |
1,020 |
1,088 |
1,847 |
1,085 |
|
R -факторы по F 2 > 2 с ( F 2 ) |
R 1 = 0,0687, wR 2 = 0,1745 |
R 1 = 0,1039, wR 2 = 0,1559 |
R 1 = 0,1338, wR 2 = 0,4344 |
R 1 = 0,0973, wR 2 = 0,1767 |
|
R -факторы по всем отражениям |
R 1 = 0,1294, wR 2 = 0,2069 |
R 1 = 0,1686, wR 2 = 0,1782 |
R 1 = 0,1715, wR 2 = 0,4654 |
R 1 = 0,2243, wR 2 = 0,2150 |
|
Остаточная электронная плотность (min/max), e/A3 |
0,38/–0,59 |
0,48/–0,54 |
2,17/–2,79 |
0,42/–0,30 |
Таблица 2
|
Связь d , Å |
Угол ю, ° |
||
|
1 |
|||
|
S(1)–O(1) |
1,303(2) |
O(1)S(1)O(2) |
110,46(18) |
|
S(1)–O(2) |
1,494(3) |
O(1)S(1)O(3) |
107,10(19) |
|
S(1)–O(3) |
1,611(3) |
O(2)S(1)O(3) |
120,81(19) |
|
S(1)–C(41) |
1,788(3) |
O(1)S(1)C(41) |
97,84(16) |
|
P(1)–C(1) |
1,744(3) |
C(1)P(1)C(11) |
102,91(13) |
|
P(1)–C(11) |
1,897(3) |
C(11)P(1)C(21) |
122,99(13) |
|
P(1)–C(21) |
1,931(3) |
C(21)P(1)C(37) |
106,44(14) |
|
P(1)–C(37) |
1,717(3) |
C(1)P(1)C(21) |
105,22(13) |
|
C(47)‒C(42) |
1,605(5) |
C(41)C(42)C(47) |
126,3(3) |
Окончание табл. 2
|
Связь d , Å |
Угол ю, ° |
||
|
2 |
|||
|
S(1)–O(2) |
1,437(2) |
O(2)S(1)O(3) |
113,26(16) |
|
S(1)–O(3) |
1,440(2) |
O(2)S(1)O(4) |
113,45(17) |
|
S(1)–O(4) |
1,444(2) |
O(3)S(1)O(4) |
113,22(15) |
|
S(1)–C(31) |
1,791(2) |
O(2)S(1)C(31) |
105,67(13) |
|
P(1)–C(1) |
1,791(2) |
C(1)P(1)C(7) |
107,15(10) |
|
P(1)–C(7) |
1,818(2) |
C(7)P(1)C(11) |
111,19(11) |
|
P(1)–C(11) |
1,792(2) |
C(11)P(1)C(21) |
110,49(11) |
|
P(1)–C(21) |
1,791(2) |
C(1)P(1)C(21) |
108,54(10) |
|
O(1)–C(7) |
1,408(3) |
C(7)O(1)C(8) |
110,71(19) |
|
O(1)–C(8) |
1,426(3) |
O(1)C(7)P(1) |
107,60(14) |
|
O(5)–C(38) |
1,333(3) |
O(5)C(38)C(39) |
116,4(2) |
|
N(1)–O(6) |
1,240(3) |
O(6)N(1)O(7) |
122,4(2) |
|
N(2)–O(8) |
1,222(4) |
O(8)N(2)O(9) |
121,62(17) |
|
3 |
|||
|
S(1)–O(1) |
1,447(6) |
O(1)S(1)O(2) |
116,4(4) |
|
S(1)–O(2) |
1,439(6) |
O(1)S(1)O(3) |
111,0(4) |
|
S(1)–O(3) |
1,456(5) |
O(2)S(1)O(3) |
111,6(4) |
|
S(1)–C(31) |
1,798(6) |
O(1)S(1)C(31) |
105,6(3) |
|
P(1)–C(1) |
1,785(6) |
C(1)P(1)C(7) |
110,1(3) |
|
P(1)–C(7) |
1,814(7) |
C(7)P(1)C(11) |
108,8(4) |
|
P(1)–C(11) |
1,798(6) |
C(11)P(1)C(21) |
106,2(3) |
|
P(1)–C(21) |
1,814(6) |
C(1)P(1)C(21) |
108,9(3) |
|
O(4)–C(37) |
1,185(8) |
C(7)P(1)C(21) |
112,3(3) |
|
O(5)–C(37) |
1,315(9) |
O(4)C(37)O(5) |
118,4(6) |
|
Br(1)–C(10) |
1,923(15) |
Br(1)C(10)C(9) |
114,0(10) |
|
4 |
|||
|
S(1)–O(1A) |
1,453(5) |
O(1A)S(1)O(2A) |
111,4(4) |
|
S(1)–O(1B) |
1,53(2) |
O(1A)S(1)O(3A) |
111,6(4) |
|
S(1)–O(2A) |
1,451(5) |
O(2A)S(1)O(3A) |
112,4(4) |
|
S(1)–O(2B) |
1,35(2) |
O(1B)S(1)O(2B) |
111,5(14) |
|
S(1)–O(3A) |
1,442(5) |
O(1B)S(1)O(3B) |
108,5(13) |
|
S(1)–O(3B) |
1,43(2) |
O(2B)S(1)O(3B) |
123,1(15) |
|
S(1)–C(31) |
1,752(5) |
O(1A)S(1)C(31) |
106,9(3) |
|
P(1)–C(1) |
1,801(5) |
C(1)P(1)C(7) |
111,0(3) |
|
P(1)–C(7) |
1,822(6) |
C(7)P(1)C(11) |
107,2(3) |
|
P(1)–C(11) |
1,783(5) |
C(11)P(1)C(21) |
111,4(2) |
|
P(1)–C(21) |
1,781(5) |
C(1)P(1)C(11) |
110,3(2) |
|
O(4)–C(37) |
1,297(6) |
C(1)P(1)C(21) |
109,0(2) |
|
O(5)–C(37) |
1,214(6) |
O(4)C(37)O(5) |
122,5(5) |
|
O(6)–C(34) |
1,337(6) |
O(6)C(34)C(35) |
117,8(5) |
|
O(8)–C(7) |
1,398(6) |
O(8)C(7)P(1) |
112,1(4) |
Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2164931 (1), № 2168826 (2), № 2163921 (3), № 2168621 (4), ; .
Обсуждение результатов
Взаимодействие водных растворов бромидов алкилтрифенилфосфония и соответствующей аренсульфоновой кислоты приводит к образованию целевых комплексов 1 ‒ 4 . Устойчивые на воздухе прозрачные кристаллы аренсульфонатов алкилтрифенилфосфония хорошо растворимы в хлороформе, диэтиловом эфире, этаноле, аренах, ацетонитриле, тетрагидрофуране, четыреххлористом углероде и плохо - в воде при комнатной температуре.
[Ph3PR]Br + HOSO2Ar ⎯⎯⎯-> [Ph3PR][OSO2Ar] R = CH2Ph, Ar = С-6H2rMe3-2,4,6 (1), он
R = CH2ОMe, Ar = и Л Л (2), no2
R = (CH 2 ) 4 Br, Ar = C 6 H 4 (COOH-2) ( 3 ), R = CH 2 ОН, Ar = C 6 H 3 (COOH-3)(OH-4) ( 4 )
В ИК-спектрах комплексов 1 - 4 наблюдаются полосы поглощения средней интенсивности при 3096‒3003 см–1, отвечающие валентным колебаниям связей C Ar –H. Полосы при 1126‒984 и 885‒781 см–1 относятся соответственно к плоскостным и внеплоскостным деформационным колебаниям этих же связей. Также присутствуют характерные полосы валентных колебаний углеродного скелета ароматических фрагментов в области 1609‒1456 см–1. Валентным колебаниям метиленовых групп соответствуют полосы при 2999‒2837 см–1, деформационным колебаниям ‒ при 1485‒1456 см–1.
Полосы поглощения сильной интенсивности при 1439-1437 и 1115-1111 см-1 отвечают асимметричным и симметричным валентным колебаниям сульфонатной группы SO 3 . Интенсивные полосы в области 719‒689 см–1 соответствуют валентным колебаниям связи S‒O. Валентным колебаниям связей CAr–S и CAr–P отвечают полосы сильной интенсивности при 532‒528 и 754‒721 см–1 соответственно [27].
В структурах комплексов 2–4 присутствуют связанные гидроксильные группы, валентным колебаниям которых соответствуют широкие полосы при 3206, 3193 и 3169 см–1. Интенсивные полосы поглощения валентных колебаний карбонильной группы в комплексах 3 , 4 расположены при 1705 и 1670 см–1. Валентным колебаниям связей C‒O в спектрах 3 , 4 отвечают полосы в области 1319‒1279 см–1. Присутствие метоксигруппы в соединении 2 подтверждается наличием полосы при 2837 см–1. В ИК-спектре комплекса 2 также наблюдается широкая полоса при 1202 см–1, соответствующая валентным колебаниям связи C‒O‒C. Широкие полосы в спектрах 2 , 3 , 4 при 691, 934, 916 см–1 отвечают деформационным колебаниям гидроксильных групп.
В спектре соединения 2 асимметричным колебаниям NO2-групп соответствует интенсивная полоса поглощения при 1520 см–1, симметричным колебаниям – при 1343 см–1. Полоса валентных колебаний связи C - Br в спектре комплекса 3 расположена при 569 см–1. Наличие молекул воды в кристаллах гидратов 1 , 4 подтверждается полосами при 3375 и 3424 см–1 [28].
По данным РСА, кристаллы комплексов 1 ‒ 4 образованы катионами алкилтрифенилфосфония и аренсульфонатными анионами (рис. 1 - 3).
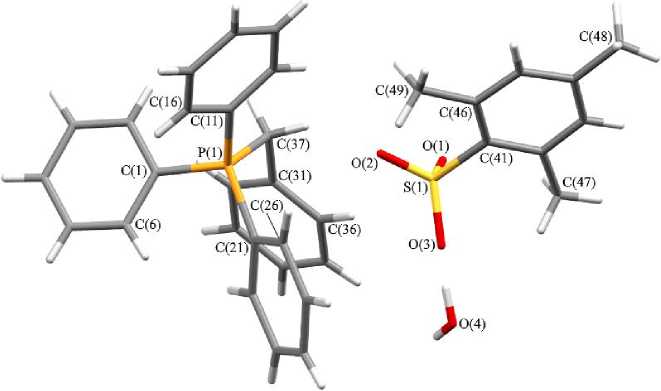
Рис. 1. Общий вид гидрата 2,4,6-триметилбензолсульфоната бензилтрифенилфосфония
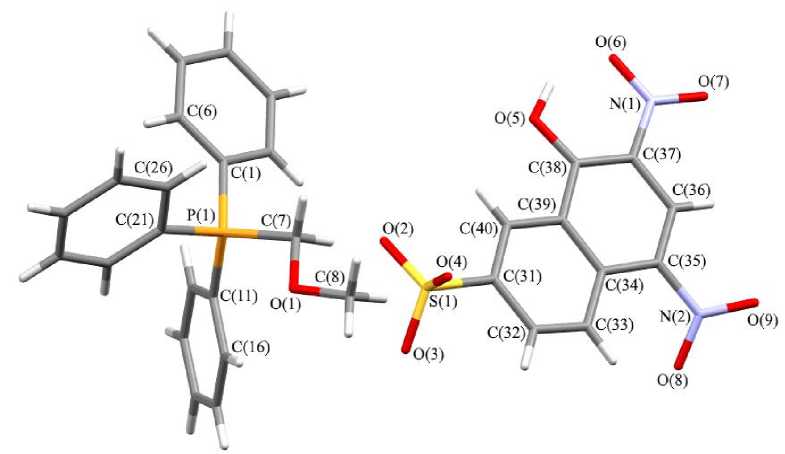
Рис. 2. Общий вид 1-окси-2,4-динитро-7-нафталинсульфоната (метоксиметил)трифенилфосфония
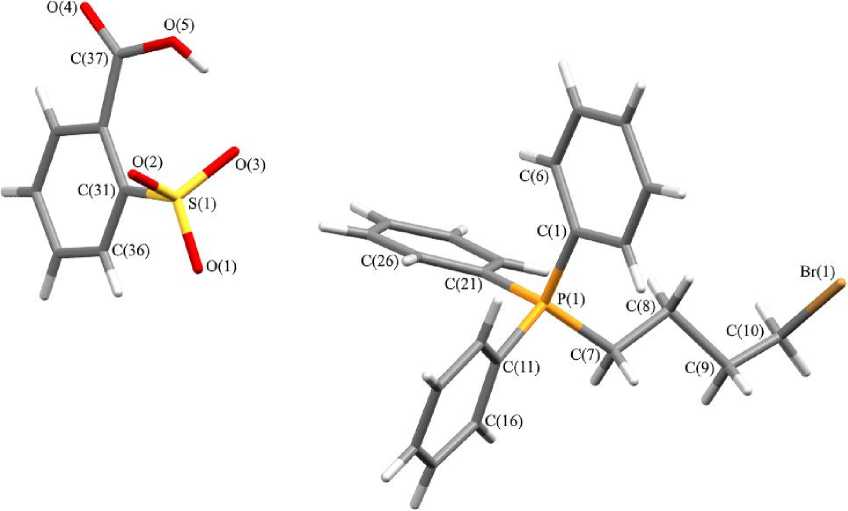
Рис. 3. Общий вид 2-карбоксибензолсульфоната (4-бромбутил)трифенилфосфония
Комплексы 1 и 4 кристаллизуются в виде гидратов состава [Ph 3 PCH 2 Ph][OSO 2 С 6 H 2 Me 3 -2,4,6] ∙ H 2 O и [Ph 3 PCH 2 ОН][OSO 2 C 6 H 3 (COOH-3)(OH-4)] ∙ 2H 2 O.
В соединении 4 атомы кислорода в аренсульфонат-анионе [O(1)‒O(3)] разупорядочены по двум положениям (рис. 4). Уточненное соотношение вкладов положений в разупорядоченный фрагмент составляет 0,82/0,18.
Атомы фосфора в катионах алкилтрифенилфосфония 1 ‒ 4 имеют незначительно искаженную тетраэдрическую координацию. Длины связей P-С варьируют в интервалах 1,717(3)-1,931(3) Å [1,717(3)-1,931(3) Å ( 1 ); 1,791(2)–1,818(2) Å ( 2 ); 1,785(6)–1,814(7) Å ( 3 ); 1,781(5)–1,822(6) Å ( 4 )], что в основном меньше суммы ковалентных радиусов атомов-партнеров (1,83 Å) [29]. Валентные углы СРС принимают значения 101,87(14)-122,99(13)°: 101,87(14)-122,99(13)°; 107,15(10)-111,19(11)°; 106,2(3)-112,3(3)°; 107,2(3)-111,4(2)° в 1 , 2 , 3 , 4 соответственно.
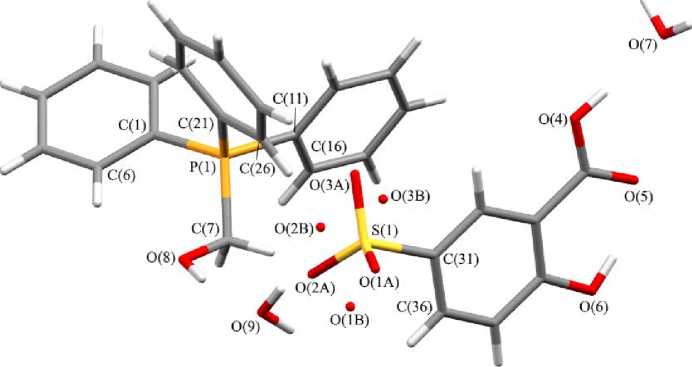
Рис. 4. Общий вид гидрата 3-карбокси-4-гидроксибензолсульфоната (гидроксиметил)трифенилфосфония
[для разупорядоченных атомов показаны два положения: O(A) и O(B)]
Расстояния S-C в аренсульфонатных анионах соединений 1 - 4 близки между собой и изменяются в интервале 1,752(5)-1,798(6) А. Длины связей S-О варьируют в пределах 1,303(2)-1,53(2) А: 1,303(2)-1,611(3) А ( 1 ), 1,437(2)-1,444(2) А ( 2 ), 1,439(6)-1,456(5) А ( 3 ), 1,35(2)-1,53(2) А ( 4 ). Валентные углы oSC в сульфонатных группах (97,84(16)-114,90(15)°) в среднем меньше, чем углы OSO (107,10(19)-123,1(15)°), что полностью согласуется с теорией отталкивания электронных пар валентных оболочек [30].
В сульфонат-анионе комплекса 2 плоскость ^О2-2)-группы незначительно отклоняется от средней плоскости нафталинового цикла (соответствующий двугранный угол 8,46°), нитрогруппа NO 2 -4 развернута относительно плоскости кольца на угол 35,88°. Связи N-O практически выровнены и принимают значения 1,218(3)-1,240(3) А.
В структуре 4 молекулы воды формируют пространственную сетку сульфосалицилат-анионов посредством прочных водородных связей (Н∙∙∙O 1,82‒1,97 Å), кроме того, имеют место водородные связи между карбоксильной и гидроксильной группами в орто -положении (1,89 А) (рис. 5).
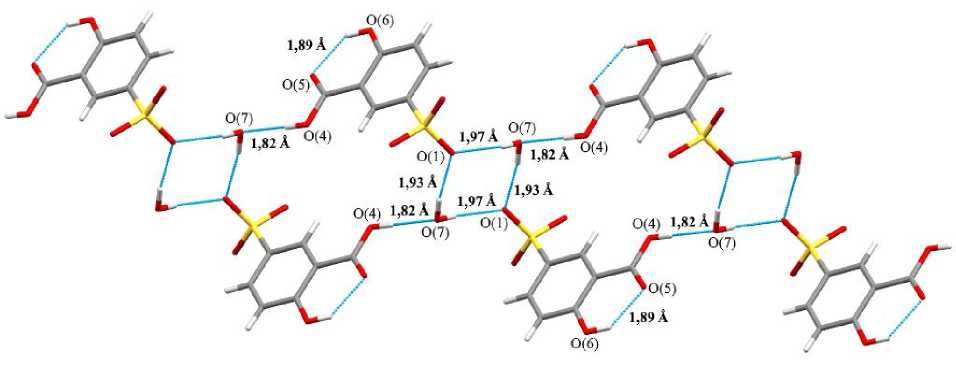
Рис. 5. Пространственная организация аренсульфонатных анионов в кристалле соединения 4
Катионы и анионы в комплексах 1 - 4 связаны слабыми водородными связями типа S=O—H(Ph) [2,56-2,67 А ( 1 ), 2,25-2,56 А ( 2 ), 2,43-2,63А ( 3 ), 2,47-2,67 А ( 4 )]. Также имеют место водородные связи между атомами водорода алкильных групп в катионах и атомами кислорода в аренсульфонатных анионах S=O-R(C) [2,23-2,61 А ( 1 ), 2,31-2,63 А ( 2 ), 2,36-2,39 А ( 3 ), 2,31 А ( 4 )].
В структуре 2 присутствуют короткие контакты типа N - O∙∙∙H(Ph) [2,678–2,710 Å] (сумма ван-дер-ваальсовых атомов-партнеров O···Н 2,62 Å [31]). В кристалле соединения 3 наблюдаются короткие контакты типа Br∙∙∙H(Ph) (2,875 Å), а в кристаллических структурах 1 , 2, 4 ‒ короткие контакты типа С Ar ∙∙∙H(C) (CH∙∙∙π взаимодействия) [2,617; 2,857 Å ( 1 ), 2,827; 2,882 Å ( 2 ), 2,873‒2,893 Å ( 4 )]. Более того, в формировании пространственной структуры кристаллов комплексов 1 , 2 принимают участие π‒π взаимодействия [3,360 Å ( 1 ), 3,374; 3,385 Å ( 2 )]. Так, множественные межмолекулярные контакты типа O···Н, CH∙∙∙π и π‒π взаимодействия структурируют молекулы кристалла 2 в катионный и анионный слои, чередующиеся вдоль кристаллографической оси c (рис. 6).
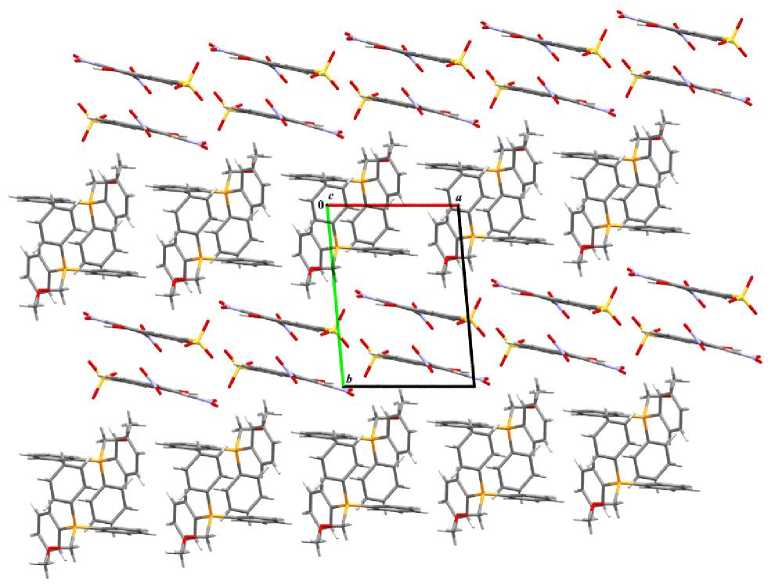
Рис. 6. Упаковка ионов комплекса 2 в кристалле
Выводы
Реакцией замещения доступных бромидов алкилтрифенилфосфония с аренсульфоновыми кислотами в воде синтезированы новые ионные комплексы аренсульфонатов алкилтрифенилфосфония, особенности строения которых установлены методом РСА.
Выражаю признательность профессору В.В. Шарутину за рентгеноструктурный анализ кристаллов соединений 1‒4 и помощь при работе над статьей.
Список литературы Синтез и кристаллическая структура аренсульфонатов алкилтрифенилфосфония [Ph3PR][OSO2Ar]
- Hartley F.R. The Chemistry of Organophosphorus Compounds. Vol. 3. Phosphonium Salts, Ylides and Phosphoranes / F.R. Hartley. John Wiley & Sons, Ltd., 1983. 458 p.
- Hydrophobic encapsulated phosphonium salts-synthesis of weakly coordinating cations and their application in Wittig reactions / R. Moritz, M. Wagner, D. Schollmeyer et al. // Chem. Eur. J. 2015. Vol. 21. P. 9119–9125. DOI: 10.1002/chem.201406370.
- Werner T. Phosphonium salt organocatalysis / T. Werner // Adv. Synth. Catal. 2009. Vol. 351. P. 1469‒1481. DOI: 10.1002/adsc.200900211.
- The Stille reaction, 38 years later / C. Cordovilla, C. Bartolome, J.M. Martinez-Ilarduya et al. // ACS Catal. 2015. Vol. 5. P. 3040‒3053. DOI: 10.1021/acscatal.5b00448.
- Chong C.C. Metal-free 𝜎-bond metathesis in 1,3,2-diazaphospholene-catalyzed hydroboration of carbonyl compounds / C.C. Chong, H. Hirao, R. Kinjo // Angew. Chem. Int. Ed. 2015. Vol. 127. P. 192‒196. DOI: 10.1002/ange.201408760.
- Luiz J.F. Tribofilm formation, friction and wear-reducing properties of some phosphorus-containing antiwear additives / J.F. Luiz, H. Spikes // Tribology Letters. 2020. Vol. 68. P. 75‒99. DOI: 10.1007/s11249-020-01315-8.
- Enantioselective base-free electrophilic amination of benzofuran-2(3H)-ones: catalysis by binol-derived P-spiro quaternary phosphonium salts / Ch.-L. Zhu, F.-G. Zhang, W. Meng et al. // Angew. Chem. Int. Ed. 2011. Vol. 50. P. 5869‒5872. DOI: 10.1002/anie.201100283.
- Ionic liquids of superior thermal stability / C.G. Cassity, A. Mirjafari, N. Mobarrez et al. // Chem. Commun. 2013. Vol. 49, no. 69. P. 7590‒7592. DOI: 10.1039/c3cc44118k.
- Canac Y. A diaminocarbene-phosphonium ylide: direct access to C,C chelating ligands / Y. Canac, C. Duhayon, R. Chauvin // Angew. Chem. Int. Ed. 2007. Vol. 46. P. 6313‒6315. DOI: 10.1002/anie.200701490.
- Synthesis, spectral and solid state characterization of a new bioactive hydrazine bridged cyclic diphosphonium compound / M. Milenkovic, B. Warzajtis, U. Rychlewska et al. // Molecules. 2012. Vol. 17, no. 3. P. 2567‒2578. DOI: 10.3390/molecules17032567.
- Triphenilphosphonium analogs of chloramphenicol as dual-acting antimicrobial and antiprolife-rating agents / J.A. Pavlova, Z.Z. Khairullina, A.G. Tereshchenkov et al. // Antibiotics. 2021. Vol. 10. P. 489‒511. DOI: 10.3390/antibiotics10050489.
- Synthesis and in vitro evaluation of triphenylphosphonium derivatives of acetylsalicylic and salicylic acids: structure-dependent interactions with cancer cells, bacteria, and mitochondria / O.V. Tsepaeva, T.I. Salikhova, L.R. Grigor’eva et al. // Med. Chem. Res. 2021. Vol. 30. P. 925‒939. DOI: 10.1007/s00044-020-02674-6.
- Tuning the hydrophobicity of a mitochondria-targeted NO photodonor / F. Sodano, B. Rolando, F. Spyrakis et al. // ChemMedChem. 2018. Vol. 13. P. 1238‒1245. DOI: 10.1002/cmdc.201800088.
- Rational design 2-hydroxypropylphosphonium salts as cancer cell mitochondria-targeted vec-tors: synthesis, structure, and biological properties / V.F. Mironov, A.V. Nemtarev, O.V. Tsepaeva et al. // Molecules. 2021. Vol. 26. P. 6350‒6384. DOI: 10.3390/molecules26216350.
- New bisphosphonium salt containing a 1,4-dihydroxynaphthalene moiety: molecular and supramolecular structure / N.R. Khasiyatullina, A.T. Gubaidullin, A.M. Shinkareva et al. // Russ. Chem. Bull., Int. Ed. 2020. Vol. 69. P. 2140‒2146. DOI: 10.1007/s11172-020-3012-3.
- Tertiary phosphines in reactions with substituted cinnamic acids / S. Romanov, A. Aksunova, Y. Bakhtiyarova et al. // J. Organomet. Chem. 2020. Vol. 910. P. 121130. DOI: 10.1016/j.jorganchem.2020.121130.
- Карбоксилаты и сульфонаты тетрафенилфосфора. Синтез и строение / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общей химии. 2009. Т. 79. С. 80‒89. DOI: 10.1134/S1070363209010125.
- Синтез и строение карбоксилатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, А.В. Рыбакова и др. // Журн. общей химии. 2018. Т. 88, № 8. С. 1308‒1313. DOI: 10.1134/S0044460X18080139.
- Шарутин В.В., Мукушева Н., Уржумова А.В. Синтез и строение 2,4-динитробензолсульфоната тетрафенилфосфония // Вестник ЮУрГУ. Серия «Химия». 2018. Т. 10, № 2. С. 48‒54. DOI: 10.14529/chem180206.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. Синтез и строение аренсульфонатов тет-рафенилфосфония // Изв. вузов. Химия и хим. технология. 2019. Т. 62, № 2. С. 4‒10. DOI: 10.6060/ivkkt.20196202.5823.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R’], R = Ph, R’ = C6H3Cl2-2,5; R = C6H11-cyclo, R’ = C6H3Cl2-2,5; R = CH2OMe, R’ = C6H3(NO2)2-2,4; R = CH2OMe, R’ = C6H4(COOH-2) // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41–51. DOI: 10.14529/chem220205.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. Новый способ синтеза аренсульфонатов тетраорганилфосфония [Ph3PR1][OSO2R2] // Журн. общей химии. 2022. Т. 92, № 6. С. 885–893. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. Исследование кристаллических струк-тур 2,4-динитробензолсульфонатов органилтрифенилфосфония [Ph3PR][OSO2C6H3(NO2)2-2,4], R = CH2OMe, CH2CN, CH2CH=CHCH2PPh3 // Журн. структурной химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Display-ing Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a complete structure solution, refinement and analysis program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339–341. DOI: 10.1107/S0021889808042726.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. М.: МГУ, 2012. 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. СПб.: СПбГЛТА, 2007. 54 с.
- Covalent radii revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. 2008. Vol. 21. P. 2832–2838. DOI: 10.1039/B801115J.
- Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул. М.: Мир, 1992. 75 c.
- Consistent Van der Waals radii for the whole main group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. 2009. Vol. 113, no. 19. P. 5806–5812. DOI: 10.1021/jp8111556.

![Синтез и кристаллическая структура аренсульфонатов алкилтрифенилфосфония [Ph3PR][OSO2Ar] Синтез и кристаллическая структура аренсульфонатов алкилтрифенилфосфония [Ph3PR][OSO2Ar]](/file/cover/147240929/sintez-i-kristallicheskaja-struktura-arensulfonatov-alkiltrifenilfosfonija-ph3pr.png)
