Синтез и кристаллическая структура бис(2-метилкарборанилкарбоксилата) трис(3-фторфенил)сурьмы
Автор: Брегадзе Владимир Иосифович, Ефремов Андрей Николаевич, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.15, 2023 года.
Бесплатный доступ
Окисление трис (3-фторфенил)сурьмы гидропероксидом третичного бутила в присутствии 2-метилкарборанилкарбоновой кислоты приводит к образованию бис (2-метилкарборанилкарбоксилата) трис (3-фторфенил)сурьмы (1), особенности строения которого установлены методом рентгеноструктурного анализа. По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD-детектор, Мо K α -излучение, λ = 0,71073 Å, графитовый монохроматор), кристаллы характеризуются: C26H38B20F3O4Sb, M 809,52; сингония моноклинная, группа симметрии С 2/ c ; параметры ячейки: a = 19,050(13), b = 14,441(9), c = 14,568(9) Å; a = 90°, β = 98,51(2)°, g = 90°; V = 3964(4) Å3; Z = 4; размер кристалла 0,8 × 0,55 × 0,29 мм; интервалы индексов отражений -25 ≤ h ≤ 25, -18 ≤ k ≤ 18, -18 ≤ l ≤ 19; всего отражений 37401; независимых отражений 4709; R int 0,0545; GOOF 1,108; R 1 = 0,0578, wR 2 = 0,1482; остаточная электронная плотность -0,59/1,09 e/Å3. По данным РСА, в молекулах соединения 1 атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Связи Sb-C (2,104(4)-2,114(8) Å) короче расстояний Sb-O (2,113(3) Å), аксиальный угол OSbО составляет 178,48(15)°, углы CSbC равны 109,7(2)°, 118,4(2)°, 131,8(3)°, при этом значительное увеличение одного из углов связано с цис -конформацией карбоксилатных лигандов относительно экваториальной плоскости. Конформация арильных лигандов по отношению к экваториальной плоскости [С3] пропеллерная. В структуре 1 присутствуют внутримолекулярные контакты Sb···O=С между атомами сурьмы и кислорода карбонильных групп карбоксилатных лигандов, которые составляют 3,089(3) Å. Формирование пространственной сетки в кристалле соединения 1 обусловлено наличием слабых водородных связей с участием атомов бора карбоксилатных лигандов и фтора арильных лигандов: B···Н (3,19 Å) и F···B (3,45 Å). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2178731; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Трис(3-фторфенил)сурьма, 2-метилкарборанилкарбоновая кислота, трет-бутилгидропероксид, окислительное присоединение, бис(2-метилкарборанил-карбоксилат) трис(3-фторфенил)сурьмы, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147239544
IDR: 147239544 | УДК: 547.1’13+546.273+546.865+547.29+548.312.5 | DOI: 10.14529/chem230104
Текст научной статьи Синтез и кристаллическая структура бис(2-метилкарборанилкарбоксилата) трис(3-фторфенил)сурьмы
Дикарбоксилаты триарилсурьмы представлены наиболее широким рядом соединений с различными карбоксилатными и арильными лигандами [1, 2]. Методы синтеза соединений этого класса также разнообразны. Так, например, в работах [3–12] приведены методы синтеза в две и более стадии, основанные на реакциях замещения. Однако наиболее перспективными являются методы, в основе которых лежит реакция окислительного присоединения [13–23]. Преимуществами данных методов являются одностадийность, мягкие условия протекания реакции, высокий выход и чистота целевого продукта. Вне зависимости от метода синтеза возникают трудности, связанные с выделением индивидуального вещества из реакционной смеси в кристаллическом виде, что необходимо для рентгеноструктурных исследований. Именно по этой причине дикарборанилкарбоксилаты триарил-сурьмы представлены единичными случаями структурно охарактеризованных соединений [19 - 22]. В настоящей работе впервые синтезирован бис (2-метилкарборанилкарбоксилат) трис (3-фторфенил)сурьмы ( 1 ) по реакции окислительного присоединения из трис (3-фторфенил)сурьмы, 2-метилкарборанилкарбоновой кислоты и трет -бутилгидропероксида в диэтиловом эфире и определены его структурные особенности методом рентгеноструктурного анализа.
(3-FC 6 H 4 ) 3 Sb[OC(O)C 2 (B 10 H 10 )Me-2] 2 ( 1 ). Смесь 0,100 г (0,246 ммоль) трис (3-фторфенил)сурьмы, 0,100 г (0,492 ммоль) 2-метилкарборанилкарбоновой кислоты и 0,031 г (0,246 ммоль) 70%-ного водного раствора гидропероксида третичного бутила в 30 мл диэтилового эфира выдерживали при 20 °С в течение 24 ч. После перекристаллизации твердого остатка из смеси растворителей бензол-октан (2:1 объемн.) получили 0,151 г (76 %) бесцветных кристаллов соединения 1 с т. разл. 182 °С. ИК-спектр, ν , см - 1: 3071, 2945, 2617, 2558, 1692, 1676, 1585, 1518, 1472, 1425, 1317, 1298, 1259, 1231, 1219, 1163, 1144, 1113, 997, 943, 907, 858, 787, 777, 725, 675, 621, 582, 521, 478, 457, 434. Найдено, %: С 38,09; Н 4,81; B 27,08. C 26 H 38 B 20 F 3 O 4 Sb. Вычислено, %: С 38,54; Н 4,69; B 27,17.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температура плавления измерена на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus . Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [24‒26]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
1 |
|
Формула |
C 26 H 38 B 20 F 3 O 4 Sb |
|
М |
809,51 |
|
Сингония |
Моноклинная |
|
Пр. группа |
C 2 /c |
|
a , Å |
19,050(13) |
|
b, Å |
14,441(9) |
|
c, Å |
14,568(9) |
|
α, град. |
90,00 |
|
β, град. |
98,51(2) |
|
γ, град. |
90,00 |
|
V , Å3 |
3964(4) |
|
Z |
4 |
|
ρ (выч.), г/см3 |
1,357 |
|
µ , мм–1 |
0,743 |
|
F (000) |
1616,0 |
|
Размер кристалла, мм |
0,8×0,55×0,29 |
|
Область сбора данных по θ , град. |
6,312–55,884 |
|
Интервалы индексов отражений |
–25 ≤ h ≤ 25, –18 ≤ k ≤ 18, –18 ≤ l ≤ 19 |
|
Измерено отражений |
37401 |
|
Независимых отражений |
4709 |
|
R int |
0,0545 |
|
Переменных уточнения |
336 |
|
GOOF |
1,108 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0578, wR 2 = 0,1482 |
|
R -факторы по всем отражениям |
R 1 = 0,0741, wR 2 = 0,1647 |
|
Остаточная электронная плотность (max/min), e/A3 |
1,09/–0,59 |
Таблица 2
Длины связей и валентные углы в структуре 1
|
Связь d , Å |
Угол ю, ° |
||
|
Sb(1)–O(1) |
2,113(3) |
O(11)Sb(1)O(1) |
178,48(15) |
|
Sb(1)–C(11) |
2,104(4) |
O(1)Sb(1)C(1) |
87,8(5) |
|
Sb(1)–C(1) |
2,114(8) |
O(11)Sb(1)C(1) |
90,7(5) |
|
O(1)–C(7A) |
1,275(6) |
C(11)Sb(1)O(11) |
92,07(15) |
|
O(1)–C(7B) |
1,09(2) |
C(11)Sb(1)O(1) |
88,81(14) |
|
F(2A)–C(13) |
1,343(9) |
C(111)Sb(1)O(1) |
92,06(15) |
|
C(15)–F(2B) |
1,290(15) |
C(111)Sb(1)C(11) |
109,7(2) |
|
C(3)–F(1) |
1,333(17) |
C(111)Sb(1)C(1) |
118,4(2) |
|
B(4)‒B(3) |
1,716(17) |
C(11)Sb(1)C(1) |
131,8(3) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2178731, ; .
Обсуждение результатов
Наиболее эффективным методом синтеза дикарбоксилатов триарилсурьмы является метод, в основе которого лежит реакция окислительного присоединения между триарилсурьмой и органическим пероксидом (или пероксидом водорода) в присутствии карбоновой кислоты [13–23]. Эффективность метода заключается в ряде преимуществ: одностадийности, мягких условиях протекания реакции (комнатная температура, доступные растворители, воздушная атмосфера), высоком выходе и чистоте синтезируемого продукта. В данной работе синтез бис (2-метилкарборанилкарбоксилата) трис (3-фторфенил)сурьмы ( 1 ) осуществлен по реакции окислительного присоединения трис (3-фторфенил)сурьмы с 2-метилкарборанилкарбоновой кислотой и гидропероксидом третичного бутила в диэтиловом эфире с последующей перекристаллизацией из смеси растворителей бензол–октан:
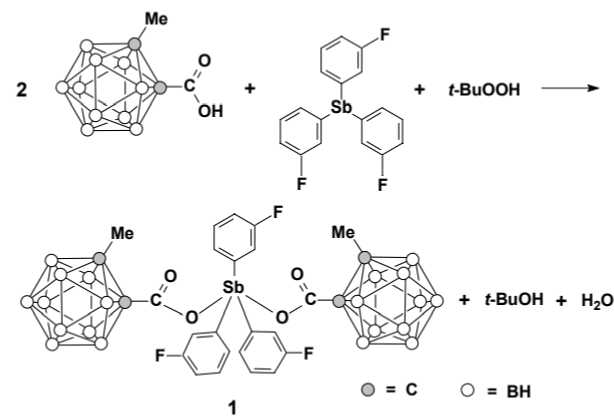
Строение соединения 1 подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектре соединения 1 наблюдаются полосы поглощения, характерные для арильных и метильных групп (3071 и 2945 см–1 соответственно). На наличие карбонильной группы в 1 указывают полосы поглощения сильной интенсивности при 1692 и 1676 см–1 (валентные колебания связи С=О). Полоса поглощения, характеризующая колебания ν(С–О), наблюдается в области 1298 см-1. Также в ИК-спектре 1 присутствуют полосы поглощения валентных колебаний B - H и B - С при 2617 и 1259 см-1 соответственно.
Химия элементоорганических соединений
По данным РСА, центросимметричные молекулы соединения 1 (центр инверсии - атом сурьмы) имеют искаженную тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях (см. рисунок). Один из арильных лигандов и карборанил-карбоксилатные лиганды разупорядочены по двум положениям.
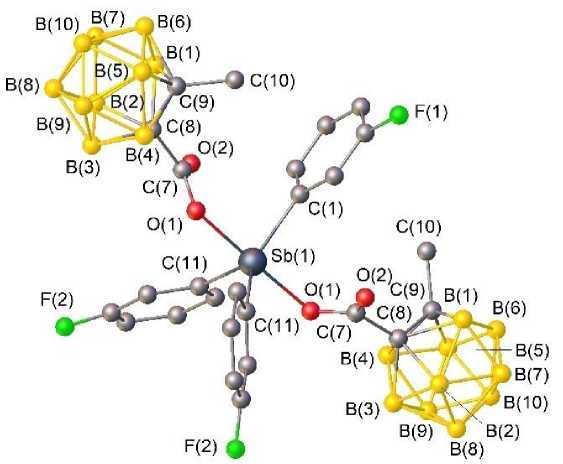
Общий вид бис (2-метилкарборанилкарбоксилата) трис (3-фторфенил)сурьмы (атомы водорода и разупорядоченные атомы не приведены)
Интервалы изменения длин связей Sb-C составляют 2,104(4)-2,104(4) А, что сопоставимо с аналогичными изменениями расстояний в изомере бис (2-метилкарборанилкарбоксилата) трис (4-фторфенил)сурьмы ( 2 ) 2,086(4)-2,110(3) А [22]. Связи Sb-O (2,113(3) А) сравнимы с аналогичными длинами связей Sb-O (2,116(3), 2,130(3) А) в 2 и значительно длиннее расстояний Sb–C, что характерно для ранее структурно охарактеризованных дикарбоксилатов триарилсурьмы [2]. Сумма углов CSbC в экваториальной плоскости в структурах 1 и 2 составляет 360° (в пределах погрешности эксперимента). При этом значения индивидуальных углов в 1 и 2 несколько отличаются и составляют 109,7(2)°, 118,4(2)°, 131,8(3)° ( 1 ) и 115,97(15)°, 116,70(14)°, 127,32(15)° ( 2 ). Значительное увеличение одного из углов связано с цис -конформацией карбоксилатных лигандов относительно экваториальной плоскости. Наибольший угол располагается со стороны внутримолекулярных контактов Sb···O=С. Аксиальные углы OSbО составляют 178,48(15)° ( 1 ) и 172,66(10)° ( 2 ). Фрагменты SbC3 плоские, значения валентных углов между экваториальными и аксиальными заместителями незначительно отличаются от теоретического значения 90° и варьируются в пределах 87,8(5)-92,07(15)° ( 1 ), 86,33(12)-93,52(13)° ( 2 ). Конформация арильных лигандов по отношению к экваториальной плоскости [С3] пропеллерная.
В структуре дикарборанилкарбоксилата трис (3-фторфенил)сурьмы присутствуют внутримолекулярные контакты между атомами сурьмы и кислорода карбоксилатных лигандов, которые составляют 3,089(3) А, что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 А) [27] и аналогичных контактов в 2 (3,349(3), 3,237(3) А). Формирование пространственной сетки в кристаллах соединения 1 обусловлено наличием слабых водородных связей с участием атомов бора карбоксилатных лигандов и фтора арильных лигандов: В^Н (3,186 А), F^B (3,461 А).
Выводы
Таким образом, взаимодействие трис(3-фторфенил)сурьмы с 2-метилкарборанилкарбоновой кислотой в присутствии трет-бутилгидропероксида приводит к образованию бис (2-метилкарборанилкарбоксилата) трис(3-фторфенил)сурьмы. Рентгеноструктурный анализ пока- зал, что атомы сурьмы в молекулах бис(2-метилкарборанилкарбоксилата) трис(3-фторфенил)сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. В кристалле соединения наблюдаются внутримолекулярные контакты Sb···O=С и слабые водородные связи B···Н и F···B.
Список литературы Синтез и кристаллическая структура бис(2-метилкарборанилкарбоксилата) трис(3-фторфенил)сурьмы
- Cambridge Crystallographic Database. Release 2022. Cambridge. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
- Шарутина О.К., Шарутин В.В. Молекулярные структуры органических соединений сурьмы (V): монография. Челябинск: Издательский центр ЮУрГУ, 2012. 395 с.
- Saxena A.K., Ranjan A., Venkaramani P.S. Perfluorophenylantimony acetates (I): synthetic and spectroscopic studies (UV, JR Proton and 19F NMR) of some new tris(pentafluorophenyl)antimony (V) diacetates // J. Fluor. Chem. 1993. Vol. 64, no. 1-2. Р. 107-115. DOI: 10.1016/S0022-1139(00)80067-6.
- Four triarylantimony(V) carboxylates: syntheses, structural characterization and in vitro cytotoxicities / H. Geng, M. Hong, Y. Yang, D. Li, X. Li, F. Liu, M. Niu // J. Coord. Chem. 2015. Vol. 68, no. 16. P. 2938-2952. DOI: 10.1080/00958972.2015.1060322.
- Structural elucidation and bioassays of newly synthesized pentavalent antimony complexes / T. Iftik-har, M.K. Rauf, S. Sarwar, A. Badshah, D. Waseem, M.N. Tahir, A. Khan, K M. Khan, G.M. Khan // J. Or-ganomet. Chem. 2017. Vol. 851. P. 89-96. DOI: 10.1016/j.jorganchem.2017.09.002.
- Synthesis and in vitro antitumor activity of some triarylantimony di(N-phenylglycinates) / L. Yu, Y.-Q. Ma, G.-C. Wang, J.-S. Li // Heteroat. Chem. 2004. Vol. 15, no. 1. P. 32-36. DOI: 10.1002/hc.10208.
- Quan L., Yin H., Wang D. 5is(5-bromopyridine-2-carboxylato-KO)triphenylantimony(V) // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2008. Vol. 64, no. 12. P. m1503-m1503. DOI: 10.1107/s1600536808033783.
- Highly symmetrical 24-membered macrocyclic organoantimony(V) complexes constructed from schiff base ligands possessing two terminal carboxyl groups / M. Hong, H.-D. Yin, W.-K. Li, X.-Y. You // Inorg. Chem. Commun. 2011. Vol. 14, no. 10. P. 1616-1621. DOI: 10.1016/j.inoche.2011.06.023.
- Characterising secondary bonding interactions within triaryl organoantimony(V) and organobis-muth(V) complexes / H. Barucki, S.J. Coles, J.F. Costello, T. Gelbrich, M.B. Hursthouse // J. Chem. Soc., Dalton Trans. 2000. Vol. 200, no. 14. P. 2319-2325. DOI: 10.1039/b002337j.
- Wen L., Yin H., Wang C. 5is(2-amino-4-chlorobenzoato)triphenylantimony(V) // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2009. Vol. 65, no. 11. P. m1442-m1442. DOI: 10.1107/s160053680904358x.
- Triphenylbis(2,4,5-trifluoro-3-methoxybenzoato)antimony(V) / L. Wen, H. Yin, L. Quan, D. Wang // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2008. Vol. 64, no. 10. P. m1303-m1303. DOI: 10.1107/s1600536808029656.
- Novel triphenylantimony(V) and triphenylbismuth(V) complexes with benzoic acid derivatives: structural characterization, in vitro antileishmanial and antibacterial activities and cytotoxicity against macrophages / A. Islam, J.G. Da Silva, F.M. Berbet, S.M. Da Silva, B.L. Rodrigues, H. Beraldo, M.N. Melo, F. Frézard, C. Demicheli // Molecules. 2014. Vol. 19, no. 5. P. 6009-6030. DOI: 10.3390/molecules19056009.
- Calorimetric study of organic compounds of antimony and bismuth Ph3Sb(O2CCH=CHCH3)2 and Ph3Bi(O2CCH=CHCH3)2 / I.A. Letyanina, A.V. Markin, N.N. Smirnova, M.N. Klimova, O.V. Kali-stratova, A.V. Gushchin // J. Therm. Anal. Calorim. 2016. Vol. 125, no. 1. P. 339-349. DOI: 10.1007/s10973-016-5401-2.
- Особенности строения дикарбоксилатов триорганилсурьмы R3Sb[OC(O)R')]2 / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина, Т.П. Платонова, С.В. Смирнова, М.А. Пушилин, А.В. Герасименко // Журн. коорд. химии. 2003. Т. 29, № 11. P. 843-851.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. Дикарбоксилаты трис(4-фторфенил)сурьмы (4-FC6H4)3Sb[OC(O)R]2 (R = Q0H15, C^-цикло): синтез и строение // Журн. неорг. химии. 2016. Т. 61, № 1. С. 46-50. DOI: 10.7868/S0044457X16010232.
- Synthesis and structure of 6is[(2E)-3-(2-furyl)prop-2-enoato]triphenylantimony Ph3Sb[O2CCH=CH(C4H3O)]2 / O.S. Kalistratova, P.V. Andreev, A.V. Gushchin, N.V. Somov, E.V. Chuprunov // Crystallogr. Rep. 2016. Vol. 61, no. 3. P. 391-394. DOI: 10.1134/s1063774516030135.
- Comparative stability, toxicity and anti-leishmanial activity of triphenyl antimony(V) and bis-muth(V) a-hydroxy carboxylato complexes / R.N. Duffin, V.L. Blai, L. Kedzierski, P.C. Andrews // Dalton Trans. 2018. Vol. 47, no. 3. P. 971-980. DOI: 10.1039/c7dt04171c.
- Синтез и строение дикарбоксилатов трис(3-фторфенил)сурьмы (3-FC6H4)3Sb[OC(O)R]2 (R = CH2Cl, Ph, CH2C6H4(NO2)-4, C10H15) / ВВ. Шарутин, ОК. Шарутина, Р.В. Решетникова, Е В. Лобанова, А.Н. Ефремов // Журн. неорг. химии. 2017. Т. 62, № 11. С. 1457-1463. DOI: 10.7868/S0044457X17110058.
- Синтез и строение бис(фенилкарборанилкарбоксилата) трифенилвисмута / В.В. Шарутин, B.С. Сенчурин, О.К. Шарутина, В.И. Брегадзе, Г.Г. Жигарева // Журн. общ. химии. 2010. Т. 80, № 10. С.1630-1633.
- Синтез и строение бис(фенилкарборанилкарбоксилата) три(и-толил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина, С.А. Глазун, В.И. Брегадзе // Бутлеровские сообщения. 2011. Т. 28, № 19. С. 54-58.
- Синтез и молекулярные структуры бис(2-метилкарборанилкарбоксилатов) трифенил-сурьмы и трифенилвисмута / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин, З.А. Старикова, C.А. Глазун, В.И. Брегадзе // Бутлеровские сообщения. 2012. Т. 29, № 3. С. 51-56.
- Брегадзе В.И., Глазун С.А., Ефремов А.Н. Дикарборанилкарбоксилаты трис(4-фторфенил)сурьмы // Вестник ЮУрГУ. Серия «Химия». 2019. Т. 11, № 4. С. 17-25. DOI: 10.14529/chem 190402.
- Investigations into a change of aryl group on the cytotoxicity and anti-leishmanial activity of a series of tris-aryl Sb(V) pentafluoropropionates / E.V. Artem'eva, R.N. Duffin, S. Munuganti, A.N. Efremov, P.C. Andrews, O.K. Sharutina, V.V. Sharutin // Polyhedron. 2022. Vol. 213. P. 115627. DOI: 10.1016/j.poly.2021.115627.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a complete structure solution, refinement and analysis program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea, J.A.K. Howard, H. Puschmann // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726
- Consistent van der waals radii for the whole main group / M. Mantina, A.C. Chamberlin, R. Valero, C.J. Cramer, D.G. Truhlar // J. Phys. Chem. A. 2009. Vol. 113, iss. 19. P. 5806-5812. DOI: 10.1021/jp8111556.


