Синтез и особенности строения 2,3-дифтори 2,3,4,5,6-пентафторбензоата тетрафенилсурьмы
Автор: Ефремов Андрей Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.12, 2020 года.
Бесплатный доступ
Взаимодействием пентафенилсурьмы с 2,3-дифторбензойной и 2,3,4,5,6-пентафторбензойной кислотами в бензоле получены с выходом до 98 % 2,3-дифторбензоат тетрафенилсурьмы (1) и 2,3,4,5,6-пентафторбензоат тетрафенилсурьмы (2), которые также были синтезированы по реакции перераспределения лигандов из пентафенилсурьмы и дикарбоксилатов трифенилсурьмы. Соединения идентифицированы методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, атомы сурьмы в соединениях 1, 2 имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода в аксиальных позициях. Согласно данным РСА, проведенного на дифрактометре D8 QUEST фирмы Bruker, криталлографические параметры элементарной ячейки соединений: 1 пространственная группа Р 1 , а = 9,857(5), b = 10,154(7), c = 14,362(11) Å, α = 83,74(4)°, β = 82,59(3), γ = 68,34(2)°, V = 1321,9(16) Å3, ρвыч = 1,475 г/см3, Z = 2; 2 пространственная группа Р 21/ с , а = 16,186(9), b = 8,771(6), c = 20,413(13) Å, α = 90,00°, β = 113,073(17), γ = 90,00°, V = 2666(3) Å3, ρвыч = 1,597 г/см3, Z = 4. Аксиальные углы OSbO несколько различаются и составляют 177,90(5)º в 1 и 179,00(5)º в 2. Суммы экваториальных углов CSbC имеют значения 356,89(9)º (1), 355,85(7)º (2). Расстояния Sb-Сэкв в соединениях 1 и 2 составляют 2,116(2), 2,119(2), 2,118(2) и 2,1073(17), 2,1158(18), 2,1152(19) Å соответственно, что значительно короче длин связей Sb-Сакс (2,169(2) и 2,1617(19) Å). Организация молекул в кристаллах соединений обусловлена водородными связями и СН×××π-взаимодействиями колец арильных и карбоксильных лигандов. Основным отличием структур 1 и 2 являются различные длины связей Sb-O (2,2864(18) и 2,3168(18) Å), что обусловлено увеличением электроотрицательности карбоксильного лиганда в 2, вызванного присутствием пяти электроотрицательных атомов фтора в бензоатном заместителе. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1980908 (1); 1977189 (2); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
2, 3-дифторбензоат тетрафенилсурьмы, пентафторбензоат тетрафенилсурьмы, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147234239
IDR: 147234239 | УДК: 547.29+547.53.024+549.242+548.312.5 | DOI: 10.14529/chem200402
Текст научной статьи Синтез и особенности строения 2,3-дифтори 2,3,4,5,6-пентафторбензоата тетрафенилсурьмы
Взаимодействием пентафенилсурьмы с 2,3-дифторбензойной и 2,3,4,5,6-пентафтор-бензойной кислотами в бензоле получены с выходом до 98 % 2,3-дифторбензоат тетрафе-нилсурьмы (1) и 2,3,4,5,6-пентафторбензоат тетрафенилсурьмы (2), которые также были синтезированы по реакции перераспределения лигандов из пентафенилсурьмы и дикарбоксилатов трифенилсурьмы. Соединения идентифицированы методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, атомы сурьмы в соединениях 1, 2 имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода в аксиальных позициях. Согласно данным РСА, проведенного на дифрактометре D8 QUEST фирмы Bruker, криталлографические параметры элементарной ячейки соединений: 1 пространственная группа Р1 , а = 9,857(5), b = 10,154(7), c = 14,362(11) Å, α = 83,74(4)°, β = 82,59(3), γ = 68,34(2)°, V = 1321,9(16) Å3, ρвыч = 1,475 г/см3, Z = 2; 2 пространственная группа Р21/с, а = 16,186(9), b = 8,771(6), c = 20,413(13) Å, α = 90,00°, β = 113,073(17), γ = 90,00°, V = 2666(3) Å3, ρвыч = 1,597 г/см3, Z = 4. Аксиальные углы OSbO несколько различаются и составляют 177,90(5)º в 1 и 179,00(5)º в 2. Суммы экваториальных углов CSbC имеют значения 356,89(9)º (1), 355,85(7)º (2). Расстояния Sb–Сэкв в соединениях 1 и 2 составляют 2,116(2), 2,119(2), 2,118(2) и 2,1073(17), 2,1158(18), 2,1152(19) Å соответственно, что значительно короче длин связей Sb–Сакс (2,169(2) и 2,1617(19) Å). Организация молекул в кристаллах соединений обусловлена водородными связями и СН⋅⋅⋅π-взаимодействиями колец арильных и карбоксильных лигандов. Основным отличием структур 1 и 2 являются различные длины связей Sb-O (2,2864(18) и 2,3168(18) Å), что обусловлено увеличением электроотрицательности карбоксильного лиганда в 2, вызванного присутствием пяти электроотрицательных атомов фтора в бензоатном заместителе. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1980908 (1); 1977189 (2); или .
Особенности молекулярного и кристаллического строения карбоксилатов тетраарилсурьмы обсуждались в монографии [1], однако влияние электроотрицательности карбоксилатного лиганда на длину связи Sb - O ранее не рассматривалось, поскольку для этого требовалось сравнить особенности строения как минимум двух схожих между собой сурьмаорганических молекул, отличающихся только числом электроотрицательных атомов в карбоксилатном заместителе. Для этой цели были выбраны 2,3-дифторбензоат тетрафенилсурьмы ( 1 ) и 2,3,4,5,6-пентафторбензоат тетрафенилсурь-мы ( 2 ).
Реакции дефенилирования пентафенилсурьмы карбоновыми кислотами лежат в основе эффективного метода синтеза карбоксилатов тетрафенилсурьмы Ph 4 SbOC(O)R [2–28]. Эффективный способ синтеза карбоксилатов тетраарилсурьмы основан на реакции замещения атома галогена в галогениде тетраарилсурьмы на карбоксилатную группу [29, 30]. Еще одним способом синтеза производных тетраарилсурьмы Ar 4 SbХ также является метод, основанный на реакции галогенида тетраарилсурьмы с соединениями, содержащими активный атом водорода, в присутствии амина [31, 32].
По другому способу карбоксилаты тетрафенилсурьмы получают из пентафенилсурьмы и дикарбоксилатов трифенилсурьмы, при этом выход целевого соединения приближается к количественному [33, 34]. Отметим работы [35, 36], в которых описан метод идентификации кар- боновых кислот, заключающийся в осаждении ацилатов тетраарилсурьмы при обработке водного раствора сульфата тетраарилсурьмы органической кислотой. Реакция эффективна лишь при определенном значении рН реакционной смеси; выход получаемых при этом сурьмаорганических соединений достигал 70–80 %. Из анализа литературных данных нами выбран первый метод синтеза карбоксилатов тетрафенилсурьмы.
В настоящей работе синтезированы и структурно охарактеризованы 2,3-дифторбензоат тетрафе-нилсурьмы ( 1 ) и 2,3,4,5,6-пентафторбензоат тетрафенилсурьмы ( 2 ).
Экспериментальная часть
Синтез 1 и 2 осуществляли по методикам, описанным в работе [16].
Соединение 1 , выход 89 %, т. пл. 189 °С. ИК-спектр, ν , см - 1: 3097, 3064, 3043, 2987, 1633, 1625, 1587, 1570, 1521, 1479, 1435, 1352, 1321, 1269, 1220, 1188, 1159, 1149, 1101, 1064, 1020, 997, 950, 833, 815, 779, 758, 736, 692, 669, 653, 623, 516, 468, 451, 426. Найдено, %: С 63,24; Н 3,95. C 31 H 23 O 2 F 2 Sb. Вычислено, %: С 63,37; Н 3,92.
Соединение 2 , выход 91 %, т. пл. 161 °С (с разл.). ИК-спектр, ν , см - 1: 3068, 2987, 2926, 1656, 1645, 1573, 1516, 1485, 1436, 1332, 1274, 1192, 1182, 1163, 1103, 1068, 1018, 989, 925, 914, 823, 750, 738, 692, 653, 615, 580, 503, 462, 451, 418. Найдено, %: С 57,96; Н 3,19. C 31 H 20 O 2 F 5 Sb. Вычислено, %: С 58,03; Н 3,12.
ИК-спектры соединений 1 , 2 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристаллов соединений 1 , 2 проведен на дифрактометре D8 QUEST фирмы Bruker (Mo K α - излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [37]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [38], OLEX2 [39]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в табл. 1, основные длины связей и валентные углы - в табл. 2.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1980908 (1); 1977189 (2); или .
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1, 2
|
Параметр |
1 |
2 |
|
М |
587,24 |
641,22 |
|
Сингония |
Триклинная |
Моноклинная |
|
Пр. группа |
Р 1 |
P 2 1 / c |
|
a , Å |
9,857(5) |
16,186(9) |
|
b , Å |
10,154(7) |
8,771(6) |
|
c , Å |
14,362(11) |
20,413(13) |
|
α, град |
83,74(4) |
90,00 |
|
β, град |
82,59(3) |
113,073(17) |
|
γ, град |
68,34(2) |
90,00 |
|
V , Å3 |
1321,9(16) |
2666(3) |
|
Z |
2 |
4 |
|
ρ (выч.), г/см3 |
1,475 |
1,597 |
|
–1 µ, мм– |
1,083 |
1,097 |
|
F (000) |
588,0 |
1272,0 |
|
Размер кристалла, мм |
0,32 × 0,28 × 0,11 |
0,27 × 0,21 × 0,13 |
|
Область сбора данных по 2θ, град |
6,92 - 74,46 |
5,96 - 68,84 |
|
Интервалы индексов отражений |
- 16 ≤ h ≤ 16, - 17 ≤ k ≤ 17, - 24 ≤ l ≤ 24 |
- 25 ≤ h ≤ 25, - 13 ≤ k ≤ 13, - 32 ≤ l ≤ 32 |
Окончание табл. 1
|
Параметр |
1 |
2 |
|
Измерено отражений |
94563 |
111355 |
|
Независимых отражений |
13547 ( R int = 0,0542) |
11210 ( R int = 0,0337) |
|
Переменных уточнения |
325 |
352 |
|
GOOF |
1,014 |
1,032 |
|
R -факторы по F2>2σ(F2) |
R 1 = 0,0431, wR 2 = 0,0734 |
R 1 = 0,0289, wR 2 = 0,0619 |
|
R -факторы по все отражениям |
R 1 = 0,0941, wR 2 = 0,0841 |
R 1 = 0,0491, wR 2 = 0,0692 |
|
Остаточная электронная плотность (max/min), e/Å3 |
0,47/ - 0,55 |
0,41/ - 0,77 |
Таблица 2
Основные длины связей и валентные углы в структурах 1, 2
|
Связь |
d , Å |
Угол |
ω , град. |
|
1 |
|||
|
Sb(1) - O(1) |
2,2864(18) |
C(21)Sb(1)O(1) |
86,15(8) |
|
Sb(1) - C(21) |
2,116(2) |
C(21)Sb(1)C(11) |
129,38(9) |
|
Sb(1) - C(11) |
2,119(2) |
C(21)Sb(1)C(1) |
113,15(8) |
|
Sb(1) - C(1) |
2,118(2) |
C(21)Sb(1)C(31) |
94,19(8) |
|
Sb(1) - C(31) |
2,169(2) |
C(11)Sb(1)O(1) |
82,98(8) |
|
O(1) - C(47) |
1,280(2) |
C(11)Sb(1)C(31) |
95,22(8) |
|
F(2) - C(43) |
1,344(3) |
C(1)Sb(1)O(1) |
83,27(7) |
|
F(1) - C(42) |
1,345(3) |
C(1)Sb(1)C(11) |
114,36(9) |
|
O(2) - C(47) |
1,223(2) |
C(1)Sb(1)C(31) |
98,49(7) |
|
C(21) - C(22) |
1,376(3) |
C(31)Sb(1)O(1) |
177,90(5) |
|
2 |
|||
|
Sb(1) - O(1) |
2,3168(18) |
C(31)Sb(1)O1 |
179,00(5) |
|
Sb(1) - C(31) |
2,1617(19) |
C(1)Sb(1)O1 |
84,24(6) |
|
Sb(1) - C(1) |
2,1073(17) |
C(1)Sb(1)C31 |
95,34(7) |
|
Sb(1) - C(11) |
2,1152(19) |
C(1)Sb(1)C11 |
130,17(6) |
|
Sb(1) - C(21) |
2,1158(18) |
C(1)Sb(1)C21 |
110,59(7) |
|
O(1) - C(47) |
1,278(2) |
C(11)Sb(1)O1 |
84,69(6) |
|
F(5) - C(46) |
1,346(3) |
C(11)Sb(1)C31 |
94,90(7) |
|
F(2) - C(43) |
1,345(5) |
C(11)Sb(1)C21 |
115,09(6) |
|
F(1) - C(42) |
1,319(3) |
C(21)Sb(1)O1 |
80,35(6) |
|
F(3) - C(44) |
1,338(3) |
C(21)Sb(1)C31 |
100,65(6) |
|
F(4) - C(45) |
1,344(5) |
C(47)O(1)Sb1 |
125,50(11) |
|
O(2) - C(47) |
1,219(2) |
C(36)C(31)Sb1 |
120,72(12) |
Обсуждение результатов
В данной работе синтез карбоксилатов тетрафенилсурьмы осуществлен по реакции пентафе-нилсурьмы с карбоновой кислотой в бензоле при комнатной температуре:
Ph 5 Sb + HOC(O)Ar → Ph 4 SbOC(O)Ar (1)
Ar = C 6 H 3 F 2 -2,3 ( 1 ), C 6 F 5 ( 2 )
Установлено, что независимо от соотношения исходных реагентов, продуктами реакции являются карбоксилаты тетрафенилсурьмы.
Карбоксилаты тетрафенилсурьмы также синтезировали по реакции перераспределения радикалов из пентафенилсурьмы и дикарбоксилатов трифенилсурьмы по методике, описанной в [32, 34].
Ph 5 Sb + Ph 3 Sb[OC(O)Ar] 2 → 2 Ph 4 SbOC(O)Ar (2)
Отметим, что выход полученных по указанной реакции целевых продуктов был несколько ниже, чем в реакции (1). Исходные дикарбоксилаты трифенилсурьмы получали по реакции окислительного присоединения из трифенилсурьмы и карбоновой кислоты в присутствии гидропероксида третичного бутила в эфире при комнатной температуре по методике, описанной в [40–43].
Строение соединений подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа. Кристаллы, пригодные для РСА, были выделены после перекристаллизации продуктов реакции из смеси бензол – октан (2:1 объемн.). Соединения представляют собой твердые, устойчивые на воздухе бесцветные вещества с четкой температурой плавления.
В ИК-спектрах соединений 1 , 2 наблюдаются интенсивные полосы поглощения валентных колебаний фрагмента SbC3 при 451, 468 и 451, 462 см–1 соответственно. Полосы поглощения при 1625, 1633 см–1 ( 1 ) и 1645, 1656 см–1 ( 2 ) характеризуют колебания ν(С=О) [44]. ИК-спектры соединений содержат полосы валентных колебаний углеродного скелета арильных групп: 1479, 1435 см–1 ( 1 ); 1485, 1436 см–1 ( 2 ). Валентным колебаниям связей CAr–H отвечает полоса поглощения средней интенсивности при 3064 ( 1 ), 3068 ( 2 ) см–1, а внеплоскостным деформационным колебаниям этих же связей – интенсивные полосы при 736 и 692 ( 1 ), 738 и 692 ( 2 ) см–1.
По данным РСА, атомы сурьмы в соединениях 1 , 2 имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода в аксиальных позициях (рис. 1, 2).
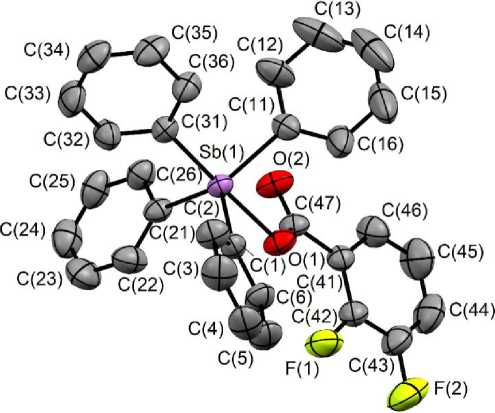
Рис. 1. Строение соединения 1
Аксиальные углы OSbС несколько различаются и составляют 177,90(5)º в 1 и 179,00(5)º в 2 . Суммы экваториальных углов CSbC имеют значения 356,89(9)º ( 1 ), 355,85(7)º ( 2 ), что характерно для подобных соединений сурьмы [45]. Атом сурьмы выходит из экваториальной плоскости [C 3 ] в сторону аксиального атома углерода на 0,215 ( 1 ) и 0,248 ( 2 ) Å. Чтобы минимизировать внутри-и межмолекулярные взаимодействия, фенильные кольца повернуты вокруг связей Sb–Cэкв таким образом, что двугранные углы между экваториальной плоскостью и плоскостями колец составляют 8,59º [С(21)–С(26)], 38,32º [С(11)–С(16)], 81,48º [С(1)–С(6)] в 1 ; 10,77º [С(1)–С(6)], 49,63º [С(21)–С(26)], 56,65º [С(11)–С(16)] в 2 . Отметим, что плоскость фенильного кольца С(21)–С(26) в соединении 1 практически компланарна экваториальной плоскости, при этом угол между плоскостями [C 3 ] и кольца С(1)–С(6) приближается к 90º.
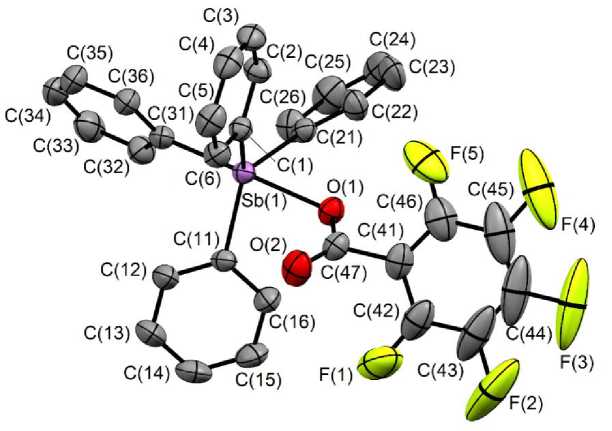
Рис. 2. Строение соединения 2
Расстояния Sb–С экв в соединениях 1 и 2 составляют 2,116(2), 2,119(2), 2,118(2) и 2,1073(17), 2,1158(18), 2,1152(19) Å соответственно, что значительно короче длин связей Sb–С акс (2,169(2) и 2,1617(19) Å). Основным отличием структур 1 и 2 являются различные длины связей Sb - O (2,2864(18) и 2,3168(18) Å), что обусловлено увеличением электроотрицательности карбоксильного лиганда в 2 , вызванного присутствием пяти электроотрицательных атомов фтора в бензоат-ном заместителе.
Наличие внутримолекулярных взаимодействий между атомом сурьмы и карбонильным атомом кислорода является неотъемлемой характеристикой карбоксилатов тетраарилсурьмы [1–28]. Величина контактов Sb ⋅⋅⋅ O=C в структурах соединений 1 и 2 составляет 3,189(2) и 3,509(2) Å соответственно, что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å) [46]. Такое взаимодействие вызывает увеличение одного экваториального угла (129,38(9)° ( 1 ), 130,17(6)° ( 2 )), расположенного со стороны внутримолекулярного контакта.
Формирование кристаллической структуры соединения 1 обусловлено наличием водородных связей с участием карбонильного атома кислорода (2,37, 2,56 Å) и СН ⋅⋅⋅ π-взаимодействий колец арильных и карбоксильных лигандов. Данные взаимодействия структурируют молекулы кристалла в слои, расположенные ортогонально кристаллографической оси с (рис. 3).
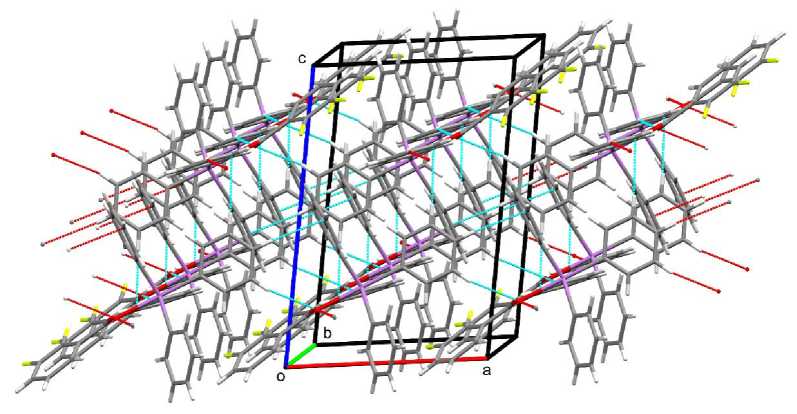
Рис. 3. Упаковка молекул в кристалле соединения 1
Пространственная сетка кристалла соединения 2 образуется не только благодаря взаимодействиям типа Н∙∙∙O=C (2,68 Å) и СН ⋅⋅⋅ π, но и водородным связям с участием карбоксильного кислорода (2,71 Å) и атома фтора карбоксилатного лиганда (2,62 Å) (рис. 4).
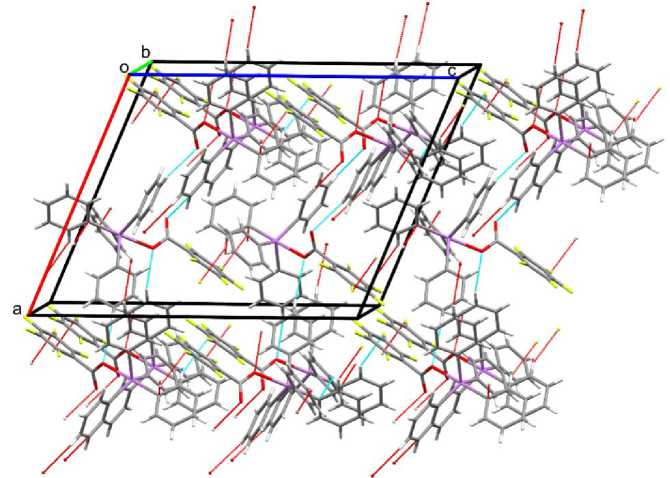
Рис. 4. Упаковка молекул в кристалле соединения 2
Выводы
Таким образом, взаимодействием пентафенилсурьмы с 2,3-дифторбензойной и 2,3,4,5,6-пентафторбензойной кислотами в бензоле получены 2,3-дифторбензоат тетрафенилсурьмы ( 1 ) и 2,3,4,5,6-пентафторбензоат тетрафенилсурьмы ( 2 ), которые также были синтезированы по реакции перераспределения лигандов из пентафенилсурьмы и дикарбоксилатов трифенилсурьмы. Соединения идентифицированы методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, атомы сурьмы в соединениях 1 , 2 имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода в аксиальных позициях.
Выражаю благодарность проф. В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и особенности строения 2,3-дифтори 2,3,4,5,6-пентафторбензоата тетрафенилсурьмы
- Шарутина, О.К. Молекулярные структуры органических соединений сурьмы(У) / О.К. Шарутина, В.В. Шарутин. - Челябинск: Издат. центр ЮУрГУ, 2012. - 395 с.
- Синтез и строение 3,3,3-трифторпропанатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорган. химии. - 2019. - Т. 64, № 10. -С. 1051-1056. DOI: 10.1134/S0044457X19100131.
- Шарутин, В.В. Синтез и строение производных тетра-пара-толилсурьмы (4-MeC6H4)4SbX, X = OC(O)C6H4(NO2-2), OC(O)C=CPh, ON=CHC6H4(NMe2-4) / В.В. Шарутин, О.К. Шарутина // Журн. неорган. химии. - 2017. - Т. 62, № 7. - С. 925-929. DOI: 10.7868/S0044457X17070224.
- Шарутин, В.В. Синтез и строение 2-гидрокси-4-тетрафенилстибоксибензоата тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова // Вестник ЮУрГУ. Серия «Химия». -2017. - Т. 9, № 4. - С. 56-60. DOI: 10.14529/chem170409.
- Синтез и строение 1-адамантанкарбоксилата тетрафенилсурьмы и бис(1-адамантан-карбоксилата трифенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 2009. - Т. 79, № 10. - С. 1636-1641.
- Шарутин, В.В. Синтез и строение N-бензоилглицината тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, К.А. Хныкина // Журн. неорган. химии. - 2016. - Т. 61, № 2. - С. 192-194. DOI: 10.7868/S0044457X16020197.
- Шарутин, В.В. Синтез и строение фенилпропионатов тетра- и трифенилсурьмы / В.В. Ша-рутин, О.К. Шарутина, А.Р. Котляров // Журн. неорган. химии. - 2015. - Т. 60, № 4. - С. 525-528. DOI: 10.7868/S0044457X15040236.
- Шарутин, В.В. Синтез и строение 4-оксибензоатов тетра- и трифенилсурьмы / B.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорган. химии. - 2014. - Т. 59, № 9. - C. 1182-1186. DOI: 10.7868/S0044457X14090189.
- Синтез и термическое разложение производных ацилокситетрафенилсурьмы / O.K. Шарутина, В.В. Шарутин, В.С. Сенчурин и др. // Изв. РАН. Сер. хим. - 1996. - № 1. - С. 194-198.
- Reactions of Pentaphenylantimony with Dicarboxylic acids / V.V. Sharutin, O.K. Sharutina,
- A.P. Pakusina et al. // J. Organomet. Chem. - 1997. - V. 536, № 1. - P. 87-92. DOI: 10.1016/S0022-328X(96)06463-7.
- Синтез и строение кислого фталата тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, И.Г. Мельникова и др. // Изв. РАН. Сер. хим. - 1996. - № 8. - С. 2082-2085.
- Синтез и строение 2-фуроината и бензоататетрафенилсурьмы / В.А. Шарутин, А.П. Паку-сина, Т.П. Платонова и др. // Коорд. химия. - 2002. - Т. 28, № 11. - С. 803-808.
- Синтез и строение ниацината тетрафенилсурьмы / В.А. Шарутин, А.П. Пакусина, Т.П. Платонова и др. // Журн. общ. химии. - 2003. - Т. 73, № 2. - С. 234-237.
- Синтез и строение пентафторбензоата тетрафенилсурьмы и нитрата тетра-и-толилсурьмы / B.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Коорд. химия. - 2001. - Т. 27, № 6. - С. 423-427.
- Синтез фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. общ. химии. - 2002. - Т. 72, № 3. - С. 419-420.
- Синтез и строение фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Коорд. химия. - 2002. - Т. 28, № 5. - С. 356-363.
- Синтез и строение тетрафторфталата бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. неорг. химии. - 2002. - Т. 72, №. 12. - С. 2029-2032.
- Фенилглиоксилат тетрафенилсурьмы. Синтез и строение / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. неорг. химии. - 2002. - Т. 72, № 2. - С. 245-248.
- Шарутин, В.В. Синтез и строение кислого малоната татрафенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина // Журн. неорг. химии. - 2014. - Т. 59, № 2. - С. 247. DOI: 10.7868/S0044457X14020184.
- Шарутин, В.В. Синтез и строение сукцината, малата и тартрата бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина // Коорд. химия. - 2014. - Т. 40, № 9. - С. 559. DOI: 10.7868/S0132344X14090072.
- Sharutin, V.V. Interaction of Pentaphenylantimony with Acetylenedicarboxylic Acid. Molecular Structure of ^«(tetraphenylantimony) Acetylenedicarboxilate / V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova // Вестник ЮУрГУ. Серия «Химия». - 2015. - V. 7, № 4. - P. 17-22. DOI: 10.14529/chem150403.
- Шарутин, В.В. Синтез и строение тетрахлорфталата бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина // Журн. неорг. химии. - 2015. - Т. 60, № 3. - С. 340. DOI: 10.7868/S0044457X15030174.
- Interaction of Pentaphenylantimony with Carboranedicarboxylic Acid / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // J. Organomet. Chem. - 2015. - V. 798. - P. 41-45. DOI: 10.1016/j.jorganchem.2015.09.002.
- Шарутин, В.В. Синтез и строение пропиолатов три- и тетрафнилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. - 2014. - Т. 40, № 2. - С. 108-112. DOI: 10.7868/S0132344X14020108.
- Synthesis and Structure of 57s(tetraphenyl-A5-stibanyl)-1,7-carborane-1,7-dicarboxylate / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // Mendeleev Commun. - 2018. - V. 28, № 6. -P. 621-622. DOI: 10.1016/j.mencom.2018.11.019.
- Dihydroxybenzoic Acids as Polydentate Ligands in Phenylantimony (V) Complexes / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // Inorg. Chim. Acta. - 2019. - V. 494. - P. 211215. DOI: 10.1016/j.ica.2019.05.029
- Шарутин, В.В. Синтез и строение салицилальдоксиматов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова // Журн. неорг. химии. - 2012. - Т. 57, № 6. - С. 902.
- Шарутин, В.В. Синтез и строение оксиматов тетрафенилсурьмы: Ph4SbON=CHR (R = C6H4Br-2, QH4NO2-2, C4H3S) / В.В. Шарутин, О.К. Шарутина // Коорд. химия. - 2017. -Т. 43, № 4. - С. 244-249. DOI: 10.7868/S0132344X17040065.
- Synthesis, Characterization and Crystal Structures of Tri- and Tetraphenylantimony(V) Compounds Containing Arylcarbonyloxy Moiety / L. Quan, H. Yin, J. Cui et al. // J. Organomet. Chem. -2009. - V. 694, № 23. - P. 3708-3717. DOI: 10.1016/j.jorganchem.2009.07.040.
- Synthesis, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Various Isomers of Fluoromethylbenzoate Ligands / H.-D. Yin, L.-Y. Wen, J.-C. Cui et al. // Polyhedron. - 2009. - V. 28, № 14. - P. 2919-2926. DOI: 10.1016/j.poly.2009.06.065.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Organoantimony Aryl-hydroxamates / G.-C. Wang, Y.-N. Lu, J. Xiao et al. // J. Organomet. Chem. - 2005. - V. 690, № 1. -P. 151-156. DOI: 10.1016/j.jorganchem.2004.09.002.
- Synthesis, Characterization and Structure of Some Arylantimony Ferrocenylacrylates / J.-S. Li, R.-C. Liu, X.-B. Chi et al. // Inorg. Chim. Acta - 2004. - V. 357. - P. 2176-2180. DOI: 10.1016/j.ica.2003.12.012.
- Способ получения солей тетрафенилстибония общей формулы Ph4SbX [X = Cl, Br, OC(O)Ph, SCN] / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. -1996. - Т. 66, № 10. - С. 1755-1756.
- Реакции пентаарилсурьмы с диацилатами триарилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Журн. общ. хим. - 1997. - Т. 67, № 9. - С. 1536-1541.
- Affsprung, H.E. Tetraphenylstibonium Sulfate as a Reagent for the Qualitative Analysis of Organic Acids / H.E. Affsprung, H.E. May // Analyt. Chem. - 1960. - V. 32. - P. 1164-1166. DOI: 10.1021/ac60165a034.
- Affsprung, H.E. Tetratolylstibonium Sulfate a New Reagent for the Qualitative Analysis of Organic Asids / H.E. Affsprung, A.B. Gainer // Analyt. Chem. Acta. - 1962. - V. 27. - P. 578-584. DOI: 10.1016/S0003-2670(00)88556-6.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- Синтез и строение бис(1-адамантанкарбоксилото)трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Журн. неорг. химии. - 2008. - Т. 53, № 8. - С. 1335-1341.
- Синтез, строение и фотохимические свойства комплексов Ar3Sb[OC(O)C6HF4-2,3,4,5]2, Ar3Sb[OC(O)CF2Br]2, Ar3Sb[OC(O)CF2CF2CF3]2 (Ar = C6^OMe-2-Br-5) / ЕВ. Артемьева, О.К. Шарутина, В.В. Шарутин и др. // Журн. неорг. химии. - 2020. - Т. 65, № 1. - С. 25-33. DOI: 10.31857/S0044457X20010031
- Синтез и особенности строения бис(циклопропанкарбоксилата) трис(5-бром-2-метоксифенил)сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Журн. общ. химии. - 2012. - Т. 82, № 10. - С. 1646-1649.
- Шарутин, В.В. Синтез и особенности строения дикарбоксилатов трис(5-бром, 2-метоксифенил)сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорг. химии. -2014. - Т. 59, № 4. - С. 481. DOI: 10.7868/S0044457X14040217
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Cambridge Crystallografic Datebase. Release 2020. Cambridge.
- Бацанов, С.С. Атомные радиусы элементов / С.С. Бацанов // Журн. неорган. химии. -1991. - Т. 36, № 12. - С. 3015-3037.


