Синтез и особенности строения метилового эфира 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты и его натриевого производного
Автор: Мозгунова Екатерина Михайловна, Муковоз Петр Петрович, Козьминых Владислав Олегович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 33 (250), 2011 года.
Бесплатный доступ
Конденсацией ацетона с диметилоксалатом получены метиловый эфир 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты и его натриевый енолят. Обсуждаются особенности строения полученных соединений на основании данных ИК и ЯМР 1H спектроскопии.
Конденсация клайзена, ацетон, диметилоксалат, полиоксосистемы, оксопираны, хелаты, пентаоксокарбонильные кислоты, спектральный анализ
Короткий адрес: https://sciup.org/147160202
IDR: 147160202 | УДК: 547.341+547.725
Текст научной статьи Синтез и особенности строения метилового эфира 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты и его натриевого производного
Перспективным направлением современной органической химии являются исследования, связанные с изучением структуры, реакционной способности и возможности функционализации поликарбонильных систем с сопряжёнными 1,2- и 1,3-диоксогруппами. Поликетиды и их производные обладают высокой химической активностью, принимают участие в процессах биосинтеза природных объектов, а также являются удобными объектами для синтеза различных биологически активных соединений [1]. Такие свойства обусловлены возможностью поликетидов участвовать в кольчато-цепных и кольчато-кольчатых интерконверсиях, способностью образовывать различные таутомерные формы, а также наличием нескольких альтернативных реакционных центров в молекуле, не характерных для более простых оксосоединений. Среди сопряжённых полиоксосистем наиболее хорошо изученными являются 1,2,4-трикарбонильные и некоторые 1,3,4,6-тетракарбонильные соединения. Металл-еноляты таких соединений до последнего времени оставались мало исследованными. Металлопроизводные поликетидов с пятью и более оксогруппами известны по единичным примерам [2, 3, 4], что связано со сложностью выделения целевых веществ. Недавние сведения о использовании енолятов щелочных металлов три- и тетра-карбонильных соединений в качестве биологически активных соединений [5] стимулируют исследования по дальнейшему изучению строения и свойств поликетидов и их металлопроизводных.
Основным способом получения поликарбонильных соединений является сложноэфирная конденсация Клайзена метилкетонов со сложными эфирами карбоновых кислот в присутствии сильных оснований. Щелочные металл-еноляты поликетидов образуются непосредственно в процессе конденсации, а сами поликетиды получают действием кислот на металл-еноляты. Нами изучена оксалильная конденсация ацетона с диметилоксалатом и натрием в соотношении 2:2:3 при кипячении реакционной смеси в толуоле. В результате реакции выделен тринатрий-1-метокси-1,4,9-триоксодека-2,5,7-триен-2,6,7-триолят 1 , при подкислении которого соляной кислотой получен метиловый эфир 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты 2 . Енолят 1 представляет собой кристаллическое вещество ярко-оранжевого цвета, растворимое в воде, уксусной кислоте и практически не растворимое в обычных органических растворителях, которое при хранении подвергается разложению. Эфир 2 является кристаллическим веществом лимонно-жёлтого цвета, растворимым в большинстве стандартных органических растворителей.
Надёжное установление строения соединения 1 методами рентгеноструктурного анализа в настоящее время невыполнимо, так как его монокристаллы получить не удаётся. Однако нам удалось установить некоторые особенности строения енолята 1 , не противоречащие данным ИК и ЯМР 1Н спектроскопии. Строение соединения 2 в твёрдом состоянии и растворах в неполярных растворителях (хлороформ) установлено методами ИК и ЯМР 1Н спектроскопии. В растворе ДМСО соединение 2 образует множество форм, однозначная идентификация которых требует дополнительных исследований.
Синтез и особенности строения метилового эфира 2,6,7-тригидрокси-1,4,9-триоксо-2,5,7-декатриеновой кислоты и его натриевого енолята:
Me Me MeO г+
O
O
Na
OO
O Na (NaH)
л OMe (2 : 2 : 3) Me
PhH
- MeOH
Na
O
Me
OMe
O
O O 1 E, (5 %)
Na
Me ONa _ Na Na
Me O O O
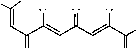
OMe
O 1 D
O
Na Na O Oa " O
OMe
O „ O 1 А, (85 %) O
Na
Na Na O Oa-O
Me OMe
O O 1 B, (7 %) O Na
Na Na
Me O O " NaO Na O
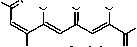
ONa 1 C, (3 %) O
OMe
Na Na OO " O
Me
O Na O
OMe
O
HCl
- NaCl
HH OOO
Me OMe
O
OH
Me
O
2 C, (27 %)
O
O H
OMe
ДМСО
OH
OH O 2 A, (7 %) O
ДМСО O
O
2 B, (66 %)
O
O O
H
OMe
Me
O O 2 D O
Me
O
O O 2 E O H O
ДМСО EtO OEt
HH OOO
EtO OEt
OO
3 A, (38 %)
OMe
OO
3 B, (62 %)
Согласно спектральным данным, в твёрдом
1 представлено, как ми-
состоянии соединение
нимум, тремя изомерными формами: преобладающими региоизомерами С(7)-ОNa 1А и С(9)-ОNa 1В , а также незначительным количеством (7 E )-изомера 1С .
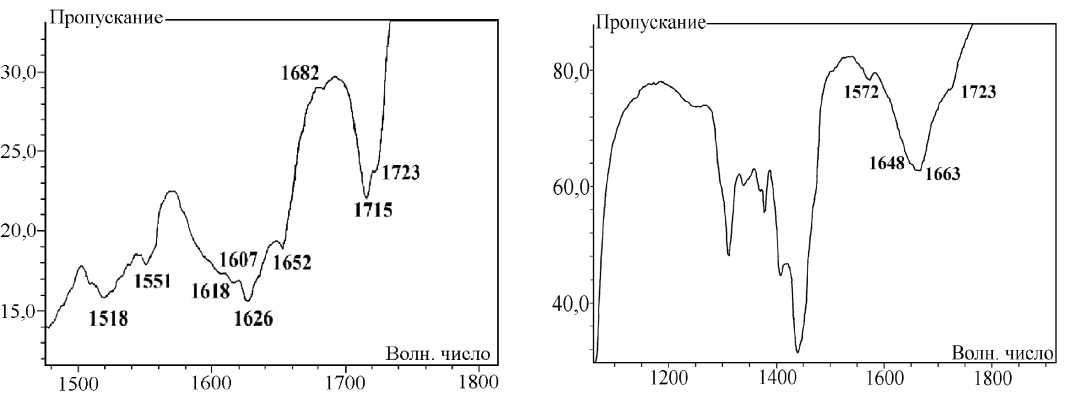
Так, в ИК спектре натриевого енолята 1 в твердом состоянии присутствуют два малоинтенсивных, но отчётливых сигнала валентных колебаний протонов метиновых групп СН С=О...NaО-С-хелатных фрагментов преобладающего изомера 1А. Более высокочастотный сигнал при 3199 см–1 соответствует колебаниям двух С(3,5)Н-групп бис-хелатного ансамбля, более низкочастотный при 3134 см–1 колебаниям С(8)Н-группы монохелатного звена изомера 1А. В области кратных связей (рис. 1, а) наблюдаются два близко расположенных сигнала сложноэфирных карбонилов: более высокочастотный менее интенсивный сигнал при 1723 см–1 соответствует (8Z)-минорному изомеру 1В, низкочастотный и более интенсивный при 1715 см–1 принадлежит (7Z)-изомеру 1А. Интенсивный сигнал при 1652 см–1 принадлежит О=С(9)-карбонильной группе монохелатного (7Z)-фрагмента изомера 1А, а более низкочастотный высоко интенсивный уширенный сигнал при 1626 см–1 соответствует О=С(4)-карбонильному поглощению его бис-хелатного (2Z,5Z)-ансамбля. Для изомера 1В аналогичные сигналы О=С(4)- и О=С(7)-карбонильных групп хелатных фрагментов смещены в более низкочастотную область и наблюдаются при 1607 см–1 и 1618 см–1, соответственно. Понижение частоты этих сигналов обусловлено увеличением степени сопряжения бис-хелатного (2Z,5Z)-ансамбля с О=С(7)-карбонильной группой и делокализации π-электронов по всей хелатной системе. Такие сигналы перекрываются высокоинтенсивной полосой 1626 см–1 изомера 1А, однако хорошо различимы. О присутствии изомера 1С может свидетельствовать малоинтенсивный, но отчётливый сигнал карбонильного поглощения О=С(9)-группы при 1682 см–1. Достаточно высокая частота поглощения О=С(9)-кетогруппы, вероятно, связанна с её не копла-нарным расположением к бис-хелатному (2Z,5Z)-ансамблю в виде (7E)-изомера 1С. Однако, выделить индивидуальный сигнал О=С(4)-карбонильной группы изомера 1С на фоне уширенного сигнала при 1626 см–1 нам не удалось из–за его малой интенсивности. Низкочастотные уширенные, но интенсивные сигналы при 1551 см–1 и 1518 см–1 соответствуют поглощению С=С связей сопряжённых звеньев различных изомеров 1. В растворе ДМСО соединение 1 обнаруживает тенденцию к образованию p-π-делокализованных «усредненных» форм, структурно близких предельному изомеру 1Е. Так, в спектре енолята 1, записанного в диметилсульфоксиде (рис. 1, б), присутствует интенсивный уширенный (от 1580 см–1 до 1770 см–1) сигнал карбонильного поглощения, с максимумом при 1663 см–1, что свидетельствует о перераспределении электронной плотности металлохелатных колец и их сопряжении со сложноэфирной карбонильной группой. Такое перераспределение, обусловленное специфически поляризующим действием молекул ДМСО, хорошо объясняет уширение сигналов в спектре. В то же время, ожидаемого снижения частоты поглощения бис-хелатных фрагментов в сравнении со спектром твердого образца не происходит. Как видно из ИК спектров, частота карбонильного поглощения даже несколько воз- растает (на 10–30 см–1), что нехарактерно для сопряжённых систем. Данный факт, вероятно, можно объяснить специфической сольватацией молекулами диметилсульфоксида, соединения 1. Известно, что полярный ДМСО хорошо координирует с катионами металлов, образуя устойчивые комплексы Me+…O=S(CH3)2, стабилизированные кислородными связями. Если связь с металлом в соединении достаточно полярна, а металл является сильным акцептором электронов (щелочные металлы), то это может привести к его диссоциации в виде сольватированнго катиона. В тоже время апротонный ДМСО не может протонировать анион, образующийся в результате гетеролитического разрыва. В случае соединения 1 бис-хелатный фрагмент является наиболее полярным звеном молекулы, а натрий очень сильным электронным акцептором. Это, вероятно, приводит к сольватации натрия молекулами ДМСО с его последующей диссоциацией и образованием сольватирванного катиона натрия и мало сольватированного хелат-аниона, имеющего избыточный электрон. Избыточная электронная плотность бис-хелатного фрагмента в сочетании с отсутствием в среде ДМСО свободных протонов обуславливают повышение в нем порядка связи и соответственно увеличивают частоту поглощения в ИК спектре, по сравнению с твердым образцом [6]. Присутствие изомеров 1А и 1В с локализованным сложноэфирным карбонилом подтверждает достаточно интенсивное поглощение при 1723 см–1, наблюдаемое на фоне уширенного сигнала хелатных фрагментов, а также интесивный сигнал при 1648 см–1, соответствующий карбонильной группе монохелатного фрагмента изомера 1А. Малоинтенсивный сигнал при 1572 см–1 соответствует поглощению кратных С=С связей соединения 1. Сигналы ниже 1000 см–1 принадлежат собственному поглощению кюветы из CaF2.
а)
б)
Рис. 1. ИК спектры соединения 1 в пасте твердого вещества в масле (а) и в растворе ДМСО (б)
ИК спектр соединения 1 в растворе ДМСО позволяет исследовать отдельные детали структуры присутствующих изомеров, однако в целом, является недостаточно информативным. Более полную картину присутствующих изомеров дает анализ ЯМР 1Н спектра, записанного в ДМСО-d6 при небольшом нагревании по причине малой растворимости вещества. В спектре ЯМР 1H соединения 1 кроме стандартных сигналов метильных групп и метоксигрупп сложноэфирных звеньев присутствуют маркерные сигналы одного Е-ориентированного С(8)Н протона и двух Z-ориентированных С(3,5)Н протонов формы 1С (3 %), при 4,52 м.д. и 5,30 м.д. соответственно. Необычно сильнопольный химический сдвиг Е-ориентированного С(8)Н протона формы 1С вероятно связан с экранирующим действием неподелённых электронных пар кислорода NaО–С(7)-звена и малой долей сопряжения (7Е)-ориентированного концевого фрагмента с бис-хелатным (2Z,5Z)-ансамблем. Маркерный моносигнал трех Z-ориентированных С(3,5,8)Н протонов, при 5,39 м.д., соответствует преобладающей форме 1А (85 %). Сигналы одного Z-ориентированного С(8)Н протона и двух Z-ориентированных С(3,5)Н протонов при 5,60 м.д. и 5,78 м.д. принадлежат форме 1В (7 %). Отмеченные сигналы характеризуются сопоставимой интегральной интенсивностью и хорошо согласуются с данными ИК-спектра. Кроме отмеченных изомеров в растворе ДМСО-d6 соединения 1 присутствует также некоторое количество «усредненной» формы 1Е (5 %), о чем свидетельствуют сигналы одного Z-ориентированного С(8)Н протона при 5,97 м.д. и двух Z-ориентированных С(3,5)Н протонов при 6,86 м.д. Сильное смещение сигналов метиновых протонов формы 1Е в слабые поля подтверждает образование p-π-делокализованной структуры с перераспределённой электронной плотностью внутри металлохелатных колец. От альтернативного изомера 1D в (8E)-форме можно отказаться на основании данных ЯМР 1H спектра: в случае изомера 1D в спектре наблюдались бы дополнительные сигналы Е-ориентированного С(8)Н протона и С(10)Н3 метильной группы. Причём сигнал метинового протона должен был бы наблюдаться в более слабых полях по сравнению с сигналом Е-ориентированного протона изомера 1С вследствие дезэкранирующего влияния хелатного фрагмента, образованного О=С(7)-карбонильной группой и сопряженным с ней бис-хелатным ансамблем. В тоже время сигнал С(10)Н3 метильной группы изомера 1D должен был бы наблюдаться в достаточно сильных полях, за счет экранирующего действия неподеленных электронных пар кислорода NaО–С(9)-фрагмента (вероятно, даже более сильных, чем сигнал С(10)Н3 группы изомера 1В, в котором имеет место сопряжение монохелатного фрагмента с бис-хелатным ансамблем, частично ослабляющее экранирующее действие кислорода NaО–С(9)-звена). Сигналов, соответствующих изомеру 1D в ЯМР 1H спектре соединения 1 нами не обнаружено.
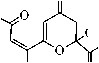
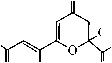
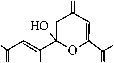
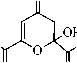
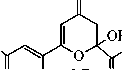
Соединение 2 как в твёрдом состоянии, так и в растворе хлороформа существует в форме полностью енолизованного изомера 2А. Так, в ИК спектре соединения 2, записанном в пасте вазелинового масла, присутствуют два малоинтенсивных, уширенных сигнала поглощения гидроксильных групп монохелатного фрагмента при 3585 см–1 и бис-хелатного ансамбля при 3442 см–1. Частота и интенсивность аналогичных сигналов ИК спектра в растворе хлороформа практически совпадают с сигналами твёрдого образца (3588 см–1 и 3442 см–1) и не меняются при изменении концентрации. Небольшая интенсивность и уширение данных сигналов свидетельствует о возникновении в растворе CНCl3 устойчивых С=О...Н–О-водородных связей, а постоянное значение частоты при изменении концентрации – об их внутримолекулярном характере. Очень интенсивное поглощение при 1733 см–1 принадлежит сложноэфирной карбонильной группе изомера 2А, частота которой практически не меняется при переходе от спектра твёрдого образца к спектру в растворе хлороформа (1736 см–1). Это свидетельствует о незначительном сопряжении сложно-эфирного карбонила с бис-хелатным ансамблем, как в твердом состоянии, так и в растворе хлороформа. В то же время, частота поглощения сложноэфирного карбонила изомера 1А в твёрдом состоянии на 18 см–1 ниже аналогичного поглощения его структурного аналога 2А, что свидетельствует о большей доле сопряжения сложноэфирной карбонильной группы енолята 1 с бис-хелатным ансамблем. Причина этого, вероятно, связана с большей долей полярности связи Na–O в еноляте 1, приводящей к смещению электронной плотности в бис-хелатном фрагменте, и ее перераспределению на сложноэфирную карбонильную группу. Эти сведения хорошо согласуются с ранее полученными данными о структурных особенностях более простых металл-енолятов α-, β-сопряженных диоксосоединений и их производных [5, 6]. Интенсивные уширенные сигналы в спектре твёрдого образца соединения 2 при 1638 см–1 и 1581 см–1 соответствуют карбонильному поглощению С(9)=О группы монохелатного фрагмента и С(4)=О группы бис-хелатного ансамбля формы 2А. В растворе хлороформа аналогичные сигналы несколько смещены в низковолновую область (при 1622 см–1 и 1571 см–1, соответственно), что объясняется тенденцией к образованию в растворах более устойчивых структур, с большей долей делокализации π-электронов в хелатных фрагментах. На сигнал бис-хелатного ансамбля в спектре твёрдого образца накладывается сильно уширенный, но достаточно интенсивный сигнал поглощения С=С связей, при 1558 см–1 (в хлороформе не различим на фоне уширенного сигнала бис-хелатного ансамбля), хорошо согласующийся с приведенной структурой 2А. Сигналов, подтверждающих присутствие других изомеров соединения 2, в ИК спектрах нами не обнаружено. В отличие от неполярных растворителей (СНСl3), в растворе ДМСО соединение 2 образует, по крайней мере, три изомера, один из которых является линейным таутомером 2А, а два других – функционализованными производными пирана. Анализ ИК спектра соединения 2 в растворе ДМСО показывает, что в области кратных связей присутствуют два интенсивных, накладывающихся сигнала поглощения сложноэфирных карбонильных групп при 1731 и 1728 см–1, принадлежащие двум оксопирановым формам 2С и 2В, соответственно. Высокая частота поглощения сложноэфирной карбонильной группы свидетельствует о малой степени сопряжения с оксопирановым фрагментом. Уширенный сигнал при 1703 см–1 предположительно соответствует поглощению C(4)=O карбонильной группе оксопиранового фрагмента. Поглощение при 1654 см–1 соответствует карбонильным группам монохелат- ных фрагментов присутствующих изомеров, сигналы которых накладываются и практически не отличается от поглощения в спектре твердого образца. Малоинтенсивный сигнал при 1600 см–1 соответствует C(4)=O карбонильной группе бис-хелатного фрагмента, подтверждая присутствие минорной формы 2А. Более высокая частота этого сигнала по сравнению с поглощением в растворе хлороформа и в твердом образце, вероятно, связана со специфической сольватацией формы 2А молекулами ДМСО. Аналогичный факт наблюдается при рассмотрении спектра енолята 1 в растворе диметилсульфоксида. Интенсивное поглощение при 1569 см–1 соответствует С=С связям различных изомеров 2. В спектре ЯМР 1H соединения 2, записанном в растворе дейтерохлороформа, кроме стандартных сигналов метильной группы и метоксигруппы сложноэфирного звена, присутствуют маркерные синглеты Z-ориентированных С(8)Н, С(5)Н и С(3)Н протонов, соответствующие полностью енолизованной линейной форме 2А. Уширенные сигналы трёх С(2)–ОН, С(6)–ОН, С(7)–ОН протонов енольных гидроксильных групп расположены в очень слабых полях – при 13,38 м.д., 13,49 м.д. и 14,62 м.д., соответственно, что вызвано сильным дезэкранирующим влиянием всех сопряженных хелатов, стабилизированных прочными внутримолекулярными OH-хелатными связями. Эти данные хорошо согласуются с данными ИК спектра соединения 2, записанного в хлороформе. В спектре ЯМР 1H соединения 2, записанном в ДМСО-d6, присутствуют стандартные сигналы метильных групп и метоксигрупп сложноэфирных звеньев двух кольчатых оксопирановых форм 2В, 2С и одной линейной минорной формы 2А. Кроме стандартных сигналов сложноэфирных звеньев в области 2,82–3,14 м.д. присутствуют сигналы четырех магнитнонеэквивалентных протонов двух C(3)H2 групп оксопиранового фрагмента с неразрешенной мультиплетностью, которые, вероятно, соответствуют двум изомерам 2В и 2С. Рассчитать константы спин–спинового взаимодействия протонов этих метиленовых групп не представляется возможным из-за наложения сигнала гидроксильных групп воды, присутствующей в ДМСО-d6. Однако о принадлежности сигналов может косвенно свидетельствовать расчетный спектр соединения 2, в программе ACDLABS, в котором аналогичные сигналы расщепляются в виде двухдублетной спиновой АВ-системы с центрами при 2,77 и 3,10 м.д. Кроме того, сходные сигналы в виде двух дублетов с центрами при 2,78 и 3,10 м.д., наблюдаются в спектре эфира 3, имеющего структурно сходный с изомерами 2В и 2С оксопирановый фрагмент [5]. Присутствие преобладающей формы 2В (66 %) подтверждают маркерные сигналы одного Z-ориентированного протона хелатного фрагмента при 5,86 м.д. и одного протона С(5)Н группы оксопиранового цикла при 5,90 м.д., а также сигнал протона ацетального гидроксила при 6,39 м.д., со сходными интегральными интенсивностями. Сигналы протонов С(5)Н группы и ацетального гидроксила хорошо согласуется с положением аналогичных сигналов в спектре структурно сходного эфира 3. В области 7,80 м.д. присутствует уширенный сигнал протона енольного гидроксила, подтверждая присутствие хелатного фрагмента в структуре 2В. О присутствии формы 2С (27 %) свидетельствуют два маркерных сигнала равной интегральной интенсивности одного Е-ориентированного протона в линейном фрагменте боковой цепи, при 5,50 м.д. и одного метинового протона С(5)Н группы оксопиранового цикла при 6,04 м.д. Смещение последнего сигнала в слабые поля, по сравнению с формой 2В может быть обусловлено пространственной близостью карбонильной группы Е-ориентированного кетонного звена боковой цепи к С(5)Н группе, приводящей к её дезэкранированию. Подобное явление, вероятно, не должно наблюдаться у формы 2В, в которой карбонильная группа кетонного звена пространственно удалена от С(5)Н протона и не может значительно влиять на его химический сдвиг. Кроме того, данная карбонильная группа сама деполяризована в составе хелатного фрагмента и не может оказывать такое же дезэкранирующее влияние, как в форме 2С. Сигнал протона ацетального гидроксила формы 2С смещен на 0,11 м.д. в сильные поля относительно аналогичного сигнала формы 2В и хорошо согласуется с отсутствием в α-положении хелатного фрагмента, дезэкранирующего протон ацетального гидроксила. Сигнал протона енольного гидроксила формы 2С несколько смещен в слабые поля (на 0,20 м.д.) относительно сигнала формы 2В, что объясняется отсутствием внутримолекулярных водородных связей хелатного типа, дезэкранирующих аналогичный протон в изомере 2В. Основные сигналы формы 2А в спектре в ДМСО-d6, в целом сходятся с сигналами в спектре дейтерохлороформа. Слабопольный сдвиг сигналов метиновых протонов, по сравнению со спектром в CDCl3 может быть объяснен поляризующим влиянием молекул ДМСО-d6, а сильнопольный сдвиг сигналов протонов енольных гидроксилов – сольватацией молекулами диметилсульфоксида кислорода гидроксильных групп. При сольватации неподеленных пар кислорода молекулами ДМСО-d6 эф- фективный заряд на нем ослабляется, что соответственно приводит к ослаблению его дезэкранирующего влияния на протон, сигнал которого смещается в сильные поля. Следует отметить, что в спектре эфира 3, записанного в ДМСО-d6, сигналы Z-ориентированных метиновых протонов и протонов енольных гидроксогрупп линейной формы 3А наблюдаются при 7,04 м.д. и 8,74 м.д. соответственно. Сигнал протона енольной НОС(7)-гидроксигруппы формы 2А нами не идентифицирован, что вероятно связано с его малой интенсивностью. Сигнал протона метоксигруппы формы 2А маскируется сигналом воды, присутствующей в ДМСО-d6 и не различим в спектре. От альтернативного изомера 2D в растворе ДМСО-d6 можно отказаться на основании полного отсутствия в спектре сигналов протонов метиленовых C(3,5,8)H2 групп. Косвенным признаком, позволяющим отвергать изомер 2Е, является химический сдвиг протонов ацетального гидроксила и метиновой С(5)Н группы в спектре эфира 3. Так, при анализе спектров соединений 3 и 2, химический сдвиг протона метиновой С(5)Н группы изомера 2Е, (так же как и изомера 3В) должен наблюдаться в более слабом поле, чем аналогичный сигнал изомера 2В. Это обусловлено дезэкранирующим влиянием карбонильной группы сложноэфирного фрагмента, расположенного в изомерах 2Е, 3В в α-положении к С(5)Н группе. В действительности, сигнал протона С(5)Н группы в спектре соединения 2, наблюдается на 0,21 м.д. в более сильном поле, чем сигнал изомера 3В, что свидетельствует об отсутствии дезэкранируэщего влияния такого сильного акцептора, как сложноэфирная карбонильная группа. В тоже время, сигнал ацетального гидроксила изомера 2Е должен наблюдаться в значительно более сильном поле, чем аналогичный сигнал изомеров 3В, 2В, что связано с экранирующим влиянием хелатного фрагмента, расположенного к ацетальному гидроксилу изомера 2Е в α-положении. Сигнал ацетального гидроксила в спектре соединения 2 наблюдается при 6,39 м.д., и имеет достаточно близкий химический сдвиг с сигналом изомера 3В (6,45 м.д.), что хорошо согласуется с наиболее вероятной структурой изомера 2В. Данные спектров ИК (в ДМСО) и ЯМР 1Н (в ДМСО-d6) не противоречат приведённым нами структурам, однако, присутствие в спектрах сигналов нескольких форм, а также возможных сигналов продуктов деструкции, затрудняет их интерпретацию. Для окончательной идентификации всех присутствующих форм соединения 2, вероятно, требуются дополнительные исследования, с привлечением различных методов: ЯМР 13С, двумерной спектроскопии ЯМР 1Н–1Н и 13С–1Н.
Не растворимость соединения 1 в толуоле исключает возможность таутомерных превращений в процессе конденсации. Формообразование присутствующих изомеров определяется относительными скоростями их образования и зависит от кинетических параметров реакции. В пользу этого свидетельствует постепенное осаждение продукта 1 в виде нерастворимого осадка в ходе конденсации. Аналогичная зависимость наблюдаются в процессе образования эфира 2 , выпадающего в виде нерастворимого осадка хелатной структуры 2А , при взаимодействии енолята 1 с раствором HCl. Однако в ДМСО водородные связи хелатов изомера 2А разрушаются, вероятно, в результате сольватирующего влияния молекул диметилсульфоксида, что приводит к более устойчивому в полярной, но апротонной среде состоянию, при котором энергетически более выгодными становятся гетероциклические структуры. Между подвижными формами устанавливается равновесие, скорость образования которых регулируется уже не кинетическими, а термодинамическими параметрами.
Заключение
В результате оксалильной конденсации ацетона с диметилоксалатом и натрием получены соединения 1 и 2 , изучены особенности их строения и таутомерные равновесия в различных средах. Установлено, что енолят 1 , как в твёрдом состоянии, так и в растворе ДМСО представлен линейными изомерами. Эфир 2 в твёрдом состоянии и в растворе хлороформа представлен одним изомером линейного строения, в растворе ДМСО появляются два преобладающих кольчатых изомера, имеющих функционализованный оксопирановый фрагмент.
Экспериментальная химическая часть.
ИК спектры соединения 1 записаны на спектрофотометре «Инфралюм ФТ–02» в пасте твёрдого вещества в вазелиновом масле и растворе диметилсульфоксида; соединения 2 в пасте твёрдого вещества в вазелиновом масле, растворе хлороформа и растворе диметилсульфоксида. Спектры ЯМР 1H соединения 1 получены на приборе «MERCURYplus–300» (300,05 МГц) в ДМСО– d 6 ; соединения 2 в СDCl 3 и ДМСО- d 6 , внутренний стандарт – ТМС. Расчётные спектры
ЯМР 1 H построены по программе ACDLABS, версия 10. Протекание реакций контролируют, а индивидуальность полученных веществ подтверждают методом ТСХ на пластинках Silufol UV– 254 в системе гексан–ацетон, 2:3, хроматограммы проявляют парами иода. Исходные реактивы
перед использованием очищают перегонкой.
Синтез тринатрий-1-метокси-1,4,9-триоксодека-2,5,7-триен-2,6,7-триолята (1). К смеси 1,4 мл (20 ммоль) ацетона, и 2,36 г (20 ммоль) диметилоксалата и 30 мл толуола добавляли при перемешивании 1,11 г (30 ммоль) гидрида натрия или 0,69 г натрия, затем кипятили 2,5–3 ч., оставляли на ночь. Отфильтровывали, остаток промывали диэтиловым эфиром, высушивали, получали соединение 1 :
Na Na OOO
Me
OMe
ONaO
O
Выход 3,06 г (95 %), Т разл. > 300 C. ИК спектр, ν , см –1 (тв.): 3199 ν (C(3,5)H, бис -хелат), 3134 v (C(8)H, хелат), 1723 v (C(1)=O, сложноэфирный, форма 1В ), 1715 v (C(1)=O, сложноэфирный, форма 1А ), 1682 v (C(9)=O, форма 1С ), 1652 v (C(9)=O, хелат, форма 1А ), 1626 ушир. v (C(4)=O, бис -хелат, форма 1А ), 1618 v (C(7)=O, хелат, форма 1В ), 1607 ушир. v (C(4)=O, бис -хелат, форма 1В ), 1551 v (C(7)=C(8), C(8)=C(9), формы 1А , 1В , 1С ), 1518 v (C(2)=C(3), C(5)=C(6), бис -хелат, формы 1А , 1В , 1С ), 1451 8 аs (OCH 3 ), 1381 8 s (OCH 3 ), 1371 8 s (CH 3 ), 1329 8 плоские (CH, бис -хелат), 1304 δ плоские (CH, хелат), 1255 ν as (C–OCH 3 , эфирная полоса), 996 ν s (C–OCH 3 ), 973, 939, 900, 867, 841, ν скелетные (C–C), 793 δ не плоские (CH, хелат ), 771 δ не плоские (CH, хелат ), 679, 626, 561, 521, 469 δ скелетные (C–С). ИК спектр, ν , см–1 (ДМСО): 3443 ушир. ν (ОH, Н 2 О в ДМСО), 2986 ν as (ОCH 3 ), 2976 ν as (CH 3 ), 2913 ν as (CH 3 , ДМСО), 2847 ν s (ОCH 3 ), 2833 ν s (CH 3 ), 1723 ν (C(1)=O, сложноэфирный, форма 1В ), 1663 ушир. v (C(4)=O, бис -хелат, формы 1А , 1В , 1С , 1Е ), 1648 ушир. v (C(9)=O, хелат, форма 1А , C(7)=O, хелат, форма 1В , C=O, хелат, форма 1Е ), 1572 v (C=C, формы 1А , 1В , 1С , 1Е ), 1470 8 as (OCH 3 ), 1439 8 аs (CH 3 ), 1377 8 s (OCH 3 ), 1368 8 s (CH 3 ), 1311 8 (CH, хелат), 1248 ν as (C–OCH 3 , эфирная полоса). Спектр ЯМР 1H, ДМСО- d 6 , δ , м.д.: 1,62 с (3H, CH 3 , форма 1В , 7 %), 1,91 с (3H, CH 3 , форма 1А , 85 %), 2,08 с (3H, CH 3 , форма 1С , 3 %), 2,30 с (3H, CH 3 , форма 1Е , 5 %), 3,16 с (3H, в OCH 3 , форма 1С ), 3,49 с (3H, в OCH 3 , форма 1В ), 3,59 с (3H, в OCH 3 , форма 1А ), 4,52 с (1Н, С(8)Н, форма 1С ), 5,30 с (2H, С(3,5)Н, форма 1С ), 5,39 с (3H, С(3,5,8)Н, форма 1А ), 5,60 с (1H, С(8)Н, форма 1В ), 5,78 с (2H, С(3,5)Н, форма 1В ), 5,97 с (1H, С(8)Н, форма 1Е ), 6,86 с (2H, С(3,5)Н, форма 1Е ).
Синтез метилового эфира 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты (2). 1,68 г соединения (1) обрабатывали 10-15 мл 15 % ледяной соляной кислотой. Oбразовавшийся осадок отфильтровывали, промывали холодным раствором соляной кислоты, сушили. Кристаллизовали из смеси этилацетата и этанола 1:1.
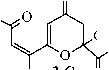
Метиловый эфир 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты (2А), ме-
тил-2-гидро-6-[(1 Z)-1-гидрокси-3-оксобут-1-ен-1-ил]-4-оксо-3,4-дигидро-2 H-пиран-2-кар-
боксилат (2В), метил-2-гидро-6-[(1 Д)-1-гидрокси-3-оксобут-1-ен-1-ил]-4-оксо-3,4-дигидро-
2H-пиран-2-карбоксилат (2С)
HH OOO
Me OMe Me
ДМСО
O „O 2 A O - O
H
O
O H
O ДМСОHO
O
OH
O
OMe
Выход 0,82 г (32 %), т. пл. 156–158 °C, разл. ИК спектр, ν , см –1 (тв.): 3585 ушир. ν (C(7)–ОH,
хелат), 3442 ушир. ν (C(3,5)–ОH, бис -хелат), 3100 ν (C(3,5,8)H, хелат), 2957 ν as (ОCH 3 ), 2929 ν as (CH 3 ), 2848 ν s (ОCH 3 ), 2818 ν s (CH 3 ), 1733 ν (C(1)=O, сложноэфирный), 1638 ушир. ν (C(9)=O),
1581 ушир. ν (C(4)=O, бис -хелат), 1558 ν (C=C, хелат), 1329 δ плоские (CH, хелат), 1302 δ плоские (CH, бис -хелат), 1255 ν as (C–OCH 3 , эфирная полоса), 1191 ν as (C(3)–ОH), 1167 ν s (C(3)–ОH), 1117 ν as (C(5)–ОH), 1098 ν s (C(5)–ОH), 1043 ν s (C–OCH 3 ), 996 ν as (C(7)–ОH), 973 ν s (C(7)–ОH), 939, 898,
841, ν скелетные (C–C), 805 δ
не плоские (CH, бис -хелат ), 771 δ
не плоские
(CH, хелат), 726, 549 δ скелетные
(C–С). ИК спектр, ν , см –1 (CНCl 3 ): 3588 ушир. ν (C(7)–ОH, хелат), 3442 ушир. ν (C(3,5)–ОH, бис -
хелат), 3100 ν (C(3,5,8)H, хелат), 1736 ν (C(1)=O, сложноэфирный), 1622 ушир. ν (C(9)=O), 1571
ушир. ν (C(4)=O, бис -хелат), 1570 ν (C=C, хелат), 1437 δ аs (ОCH 3 ), 1418 δ аs (CH 3 ), 1382 δ s (ОCH 3 ), 1360 δ s (CH 3 ), 1276 ν as (C–OCH 3 , эфирная полоса), 1183 ν as (C(3)–ОH), 1155 ν s (C(3)–ОH), 1117 ν as (C(5)–ОH), 1094 ν s (C(5)–ОH), 1020 ν s (C–OCH 3 ), 982 ν (C(7)–ОH), 920, 878, 847 ν скелетные (C–C), 802 δ не плоские (CH, хелат ), 689, 655, 624, 569, 551 δ скелетные (C–С). ИК спектр, ν , см–1 (ДМСО): 3444 ушир. ν (ОH, Н 2 О в ДМСО), 3064 ν (CH, хелат), 2989 ν as (ОCH 3 ), 2912 ν as (CH 3 , ДМСО), 2848 ν s (ОСН 3 ), 2809 v s (CH 3 ), 1731 v (C=O, сложноэфирный, форма 2С ), 1728 v (C=O, сложноэфирный, форма 2В ), 1703 ушир. v (C(3)=O, пиранон, формы 2А , 2В ), 1654 ушир. v (C=O, монохелат, формы 2А , 2В ), 1600 v (C(4)=O, бис -хелат, форма 2А ), 1569 v (С=С, формы 2А , 2В , 2С ), 1440 8 as (СН з , ДМСО), 1365 δ s (ОCH 3 ), 1312 δ (CH, хелат), 1251 ν as (C–OCH 3 , эфирная полоса). Спектр ЯМР 1H, CDCl 3 , δ , м.д.: 2,26 с (3H, CH 3 ), 3,90 с (3H, в OCH 3 ), 6,31 с (1H, С(8)Н), 6,33 с (1H, C(5)H), 6,35 с (1H, C(3)H), 13,38 уш. с (1H, C(2)ОH), 13,49 уш. с (1H, C(6)ОH), 14,62 уш. с (1H, C(7)ОH). Спектр ЯМР 1 Н, ДМСО- d 6 , 5 , м.д.: 2,12 с (3H, СН 3 , форма 2В , 66 %), 2,16 с (3H, СН 3 , форма 2С , 27 %), 2,27 с (3H, CH 3 , форма 2А , 7 %), 2,82-3,14 м (4H, 2С(3)Н 2 , формы 2В , 2С ), 3,77 с (3H, ОСН 3 , форма 2С ), 3,81 с (3H, OCH 3 , форма 2В ), 5,50 с (1H, СНСОСН з , форма 2С ), 5,86 с (1H, СНСОСН з , форма 2В ), 5,90 с (1H, С(5)Н, форма 2В ), 6,04 с (1H, С(5)Н, форма 2С ), 6,28 с (1H, С(2)ОН, форма 2С ), 6,39 с (1H, С(2)ОН, форма 2В ), 6,75 с (1H, С(8)Н, форма 2А ), 7,00 с (2H, 2С(3,5)Н, форма 2А ), 7,80 с (1H, НОССНСОСН з , форма 2В ), 8,00 с (1H, НОССНСОСН з , форма 2С ), 8,71 с (2H, 2С(2,6)ОН, форма 2А ).
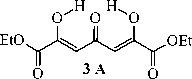
Диметил (2Z,5Z)-2,6-gurugpoKcu-4-oKcorenTa-2,5-gueHguoaT (3А), диметил 2-гидрокси-4-оксо-3,4-дигидро-2 H -пиран-2,6-дикарбоксилат (3В):
ДМСО
O
EtO
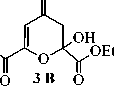
Спектр ЯМР 1 Н, ДМСО- d 6 , 5 , м.д.: 1,23 т (3H, С(2)СООСН 2 СН з , форма 3В , 62 %), 1,29 т (6H, 2ОСН 2 СН 3 , форма 3А , 38 %), 1,34 т (3H, С(6)СООСН 2 СН з , форма 3В ), 2,78 и 3,10 два д (2H, C(2)H 2 , форма 3В ), 4,22 кв (2H, С(2)СООСН 2 СН з , форма 3В ), 4,28 кв (4H, 2ОСН 2 СН 3 , форма 3А ), 4,37 кв (2H, С(6)СООСН 2 СН з , форма 3В ), 6,11 с (1H, С(2)Н, форма 3В ), 6,45 с (1H, С(2)ОН, форма 3В ), 7,04 с (2H, 2С(3,5)Н, форма 3А ), 8,74 с (2H, 2С(2,6)ОН, форма 3А ).
Список литературы Синтез и особенности строения метилового эфира 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой кислоты и его натриевого производного
- Hong, F. Antibiotic activity of polyketide products derived from combinatorial biosynthesis: Implications for directed evolution/F. Hong, K. Chaitan//Molecular Diversity. -1996. -Vol. 1. -№ 2. -P. 121-124.
- Schmitt, V.J. Oxalester-Kondensationen I. Die forgesetzte Kondensation des Oxalesters mit Aceton. Die forgesetzte, gemischte Kondensation des Oxalesters mit zwei verschiedenen Ketonen/V.J. Schmitt//Lieb. Ann. -1950. -Bd. 569. -S. 17.
- Lehmann, E. Synthese hoherer Polyoxo-carbonsauren der Fettsaure-Reihe (I. Mitteil.)/E. Lehmann, W. Grabow//Berichte der deutschen chemischen Gesellschaft (A und B Series). -1935. -Bd. 68. -№ 4. -S. 703-707.
- Эфиры 2,6,7-тригидрокси-4,9-диоксо-2,5,7-декатриеновой и 2-гидрокси-2-(3-гидрокси4-метил-2,5-диоксо-3-циклопентенилиден)уксусной кислот: синтез и особенности строения/В.О. Козьминых, В.И. Гончаров, Е.Н. Козьминых, С.И. Фирганг//ЖОрХ. -2006. -№ 42. -Вып. 10. -С. 1460-1463.
- Металлопроизводные p-π-электроноизбыточных поликарбонильных систем с сочленёнными α-и β-диоксофрагментами. Сообщение 2. Синтез и строение натриевых енолятов оксопроизводных 1,3-дикарбонильных соединений/В.О. Козьминых, П.П. Муковоз, Е.А. Кириллова и др.//Вестник Оренбургского гос. ун-та. -2009. -№ 1 (95). -С. 128-140.
- Кукушкин, Ю.Н. Диметилсульфоксид -важнейший апротонный растворитель/Ю.Н. Кукушкин//Соросовский образовательный журнал. -1997. -№ 9. -С. 54-59.


