Синтез и психофармакологические свойства гидразона 3-(2-оксопропил) хиназолин-4(3 Н)-она
Автор: Глухова Е.Г., Иванова О.В., Солодунова Г.Н.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 4 (44), 2014 года.
Бесплатный доступ
Алкилированием ханазолин-4(3Н)-она хлорацетоном и последующей конденсацией с гидразином синтезирован гидразон 3-(2-оксопропил)хиназолин-4(3Н)-она. Соединение усиливало снотворное действие тиопентала натрия и уменьшало судорожный эффект пикротоксина.
Хиназолин, хлорацетон, алкилирование, гидразон, тиопентал, пикротоксин
Короткий адрес: https://sciup.org/142149128
IDR: 142149128 | УДК: 615.3:547.856.1
Текст научной статьи Синтез и психофармакологические свойства гидразона 3-(2-оксопропил) хиназолин-4(3 Н)-она
N-замещенные производные хиназолина демонстрируют разнообразную фармакологическую активность. Среди них найдены соединения, обладающие выраженным антибактериальным, фунгицидным и противоопухолевым действием [7]. Заслуживают интереса и психофармакологические свойства соединений данного ряда [3, 4, 6]. Ранее нами были получены 3-(2-феноксиэтил)производные хиназолин-4(3 Н )-она как аналоги известных высокоактивных противовирусных агентов ненуклеозидной природы [2]. N3-замещенные производные хиназолин-4(3 Н )-она, содержащие различные функциональные группы в боковой цепи, например карбонильную [1, 5], также представляют значительный интерес как потенциальные фармакологически активные соединения.
ЦЕЛЬ РАБОТЫ
Осуществить синтез и оценить психофармакологические свойства гидразона 3-(2-оксо-пропил)хиназолин-4(3 Н )-она – важного интермедиата для получения разнообразных конденсированных гетероциклических соединений.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ПМР регистрировали на спектрометре Bruker DRX-300 (300 МГц) в ДМСО-D 6 , внутренний стандарт – ГМДС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пластинах Sorbfil в этилацетате, проявление в парах иода. Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
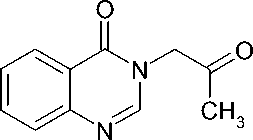
3-(2-Оксопропил)хиназолин-4(3Н)-он (II). 10,0 г (68,4 ммоль) хиназолин-4(3Н)-она (I) и 12,5 г (90,4 ммоль) безводного карбоната калия перемешивают 15 мин при комнатной температуре в 100 мл безводного ДМФА, добавляют 6,0 мл (75,3 ммоль) свежеперегнанного хлорацетона, перемешивают 15 мин сначала без нагревания, а затем 1 ч при 70-80 °С. Фильтруют, фильтрат упаривают в вакууме на кипящей водяной бане, охлаждают, закристаллизовавшийся остаток промывают 25 мл холодной воды, отфильтровывают, сушат на воздухе, кристаллизуют из 100 мл изопропилового спирта и получают 8,65 г светло-коричневого кристаллического вещества, выход 62 %, Тпл. 166-168 °С, Rf 0,38.
Спектр ПМР, δ, м.д.: 2,02 с (3 Н, СН 3 ); 4,91 с (2 Н, СН 2 ); 7,51 т (7 Гц, 1 Н, Н-7); 7,59 д (7 Гц, 1 Н, Н-8); 7,80 т (7 Гц, 1 Н, Н-6); 8,08 д (7 Гц, 1 Н, Н-5); 8,18 с (1 Н, Н-2).
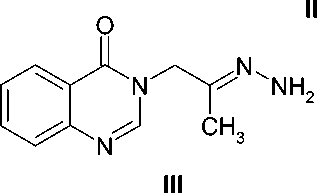
Гидразон 3-(2-оксопропил)хиназолин-4(3 Н )-она ( III ). 5,0 г (24,7 ммоль) 3-(2-оксопро-пил)хиназолин-4(3 Н )-она ( II ), 3,0 г (28,6 ммоль) гидразина дигидрохлорида и 3,5 г (56,3 ммоль) 90 % гранулированного едкого кали кипятят в 50 мл безводного метанола в течение 1 ч, охлаждают, фильтруют, выдерживают при температуре -15 ° С в течение суток, выделившийся осадок отфильтровывают, промывают на фильтре 10 мл холодного метанола и 25 мл воды, сушат на воздухе, кристаллизуют из 150 мл изопропилового спирта и получают 4,50 г желтого игольчатого кристаллического вещества, выход 84 %, Т пл. 172-175 ° С, R f 0,19.
Спектр ПМР, δ, м.д.: 1,64 с (3 Н, СН 3 ); 4,56 с (2 Н, СН 2 ); 5,79 с (2 Н, NH 2 ); 7,44 т (7 Гц, 1 Н, Н-7); 7,58 д (7 Гц, 1 Н, Н-8); 7,73 т (7 Гц, 1 Н, Н-6); 8,05 д (7 Гц, 1 Н, Н-5); 8,12 с (1 Н, Н-2).
Гидрохлорид гидразона 3-(2-оксопро-пил)хиназолин-4(3 Н )-она ( IV ). 2,0 г (9,3 ммоль) гидразона 3-(2-оксопропил)хиназолин-4(3 Н )-она ( III ) растворяют при нагревании в 50 мл 95 % этанола, охлаждают до комнатной температуры, добавляют 1,0 мл (11,0 ммоль) концентрированной соляной кислоты, выдерживают при температуре 0-5 ° С в течение суток, выделившийся осадок отфильтровывают, промывают 10 мл холодного этанола, диэтиловым эфиром, сушат на воздухе и получают 1,75 г светло-желтого мелкокристаллического вещества, выход 75 %, Т пл. 233-236 ° С (разл.).
Эксперименты были выполнены на белых беспородных крысах обоего пола массой 180–250 г и белых мышах массой 25–30 г.
Исследование психотропной активности проводили согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ».
Использовались следующие тесты психофармакологического скрининга: открытого поля, приподнятого крестообразного лабиринта, принудительного плавания, подвешивания за хвост, экстраполяционного избавления, условной реакции пассивного избегания, влияние на судорожный эффект пикротоксина и продолжительность тиопенталового сна. Влияние исследуемого вещества на судорожный эффект антагониста ГАМК А -рецепторов пикротоксина оценивали по латентному периоду возникновения судорог и их продолжительности. Пикротоксин в дозе 3 мг/кг вводили мышам внутрибрюшинно за 15 мин до начала опыта. Исследуемое вещество вводилось однократно внутрибрюшинно в виде водного раствора в дозе 23 мг/кг, что соответствует 1/10 от величины молекулярной массы соединения, за 1 ч до экспериментов. Животным контрольной группы вводился изотонический раствор хлорида натрия.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Исходный хиназолин-4(3 Н )-он ( I ) в среде безводного диметилформамида в присутствии карбоната калия легко вступает в реакцию с хлорацетоном, давая с достаточно высоким выходом продукт селективного N3-алкилирования – 3-(2-оксопропил)хиназолин-4(3 Н )-он ( II ). Последующее кипячение полученного карбонильного производного с эквимолярным количеством гидразина дигидрохлорида в безводном метаноле в присутствии едкого кали приводит к целевому гидразону ( III ), легко образующему водорастворимый гидрохлорид ( IV ) при действии концентрированной хлористоводородной кислоты в спирте.
O
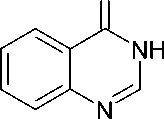
CH3C(O)CH2Cl
K2CO3
NH2NH2 * 2 HCl
KOH
I
HCl
IV
В результате проведенных фармакологических исследований было установлено, что гидрохлорид гидразона 3-(2-оксопропил)хина-золин-4(3 Н )-она ( IV ) не оказывает влияния на поведение крыс в тесте открытого поля. Ни на одной из использованных моделей первичного отбора антидепрессантов (тесты принудительного плавания, подвешивания за хвост, экстраполяционного избавления) не было выявлено статистически достоверных отличий поведения животных в экспериментальных группах по сравнению с контролем. Тесты приподнятого крестообразного лабиринта и условной реакции пассивного избегания показали отсутствие транквилизирующей и ноотропной активности, соответственно, у исследуемого вещества в использованной дозе.
При изучении влияния соединения на судорожный эффект пикротоксина обнаружено выраженное увеличение латентного периода начала судорог [(924 ± 123) с против (678 ± 51) с в контроле] при значительном сокращении общей продолжительности судорожного припадка [(53 ± 25) с против (120 ± 32) с в контроле]. При этом сокращалась как тоническая (на 22 %), так и клоническая (на 57 %) фазы судорог. Результаты теста свидетельствуют о возможном наличии у соединения IV центрального ГАМК-ергического действия.
На модели тиопенталового сна (65 мг/кг) соединение IV более, чем в 2 раза [(178 ± 39) с против (76 ± 19) с в контроле] увеличивало продолжительность сна, что также может быть связано с усилением ГАМК-ергической передачи.
При введении тиопентала натрия в меньшей дозе (50 мг/кг) количество уснувших животных в экспериментальной и контрольной группах было практически одинаковым.
ЗАКЛЮЧЕНИЕ
Установлено, что алкилирование хиназо-лин-4(3Н)-она хлорацетоном в среде безводного диметилформамида в присутствии карбоната калия с хорошим выходом приводит к 3-(2-оксопропил)хиназолин-4(3 Н )-ону, гидрохлорид гидразона которого обладает заметной противосудорожной активностью и снотворным действием.
Список литературы Синтез и психофармакологические свойства гидразона 3-(2-оксопропил) хиназолин-4(3 Н)-она
- Гпухова Е. Г., Озерова Т. П., Солодунова Г. Н. и др.//ВНМЖ. -2014. -Вып. 1. -С. 23-25.
- Озеров А. А, Новиков М. С., Солодунова Е. А. и др.//Бюлл. ВНЦ РАМН. -2009. -Вып. 2. -С. 25-27.
- Тюренков И. Н., Озеров А. А, Солодунова Е. А. и др.//Вестник ВолгГМУ. -2012. -Вып. 2. -С. 66-68.
- Тюренков И. Н., Озеров А. А, Солодунова Е. А. и др.//Хим.-фарм. журн. -2013. -Т. 47. -Вып. 5. -С. 7-10.
- Цибизова А. А., Тюренков И. Н., Самотруева М. А. и др.//Междунар. журн. прикл. и фундамент. исслед. -2013. -№ 11. -С. 71-72.
- Wolfe J. F., Rathman T. L., Sleevi M. C., et al.//J. Med. Chem. -1990. -Vol. 33, № 1. -P. 161-166.
- Xie C., Li H. X., Liu M. G., et al.//Chinese Chem. Lett. -2008. -Vol. 19. -P. 505-508.


