Синтез и строение 2,4,6-тринитрофеноксида тетрафенилсурьмы и μ-оксо бис[(2,4,6- тринитрофеноксо)трифенилсурьмы]
Автор: Шарутин Владимир Викторович, Шарутина Ольга Константиновна, Сенчурин Владислав Станиславович, Неудачина Анастасия Николаевна, Щелоков Артем Олегович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.6, 2014 года.
Бесплатный доступ
μ-Оксобис[(2,4,6-тринитрофеноксо)трифенилсурьма] (1) синтезирована из трифенилсурьмы и 2,4,6-тринитрофенола в эфире в присутствии пероксида водорода. Взаимодействием пентафенилсурьмы с 1 или 2,4,6-тринитрофенолом в толуоле получен 2,4,6-тринитрофеноксид тетрафенилсурьмы (2). В молекулярном комплексе 1 координация атомов сурьмы тригонально-бипирамидальная с мостиковым атомом кислорода (Sb-O 1,956(3), 1,965(3) Å) и атомами кислорода пикратных групп в аксиальных положениях (Sb-O 2,287(4), 2,268(3) Å). В кристалле комплекса 2 присутствуют по два типа кристаллографически независимых катионов [Ph4Sb]+ и пикрат-анионов, связанных между собой слабыми водородными связями С-H···О(Ar) (2,34, 2,44 Å).
Пентафенилсурьма, трифенилсурьма, пероксид водорода, 6-тринитрофенол, 6-тринитрофеноксид тетрафенилсурьмы, μ-оксобис[(2, 6-тринитрофеноксо)трифенилсурьма], молекулярные структуры
Короткий адрес: https://sciup.org/147160296
IDR: 147160296 | УДК: 547.243;
Текст научной статьи Синтез и строение 2,4,6-тринитрофеноксида тетрафенилсурьмы и μ-оксо бис[(2,4,6- тринитрофеноксо)трифенилсурьмы]
Известно, что взаимодействие пентафенилсурьмы с фенолами приводит к образованию ароксидов тетрафенилсурьмы [1 - 4], которые могут быть получены также по реакции перераспределения лигандов из пентафенилсурьмы и диароксидов трифенилсурьмы, где пентафенил-сурьма выступает в качестве эффективного фенилирующего агента [3, 5]. Фенилирующая способность пентафенилсурьмы в реакциях с µ- оксо бис [(ароксо)трифенилсурьмой] ранее не исследовалась.
Анализ структур ароксидов тетраарилсурьмы показывает, что введение электроноакцепторных заместителей в ароксильный лиганд приводит к искажению тригонально-бипирамидальной координации атома сурьмы и удлинению связи Sb–O [6].
Целью настоящей работы является изучение реакции пентафенилсурьмы с µ - оксо бис [(2,4,6-тринитрофеноксо)трифенилсурьмой] и установление влияния электроноакцепторных нитрогрупп на структуру полученных соединений.
Обсуждение результатов
Найдено, что пентафенилсурьма реагирует при комнатной температуре в толуоле с µ -оксо бис [(2,4,6-тринитрофеноксо)трифенилсурьмой] ( 1 ) с образованием 2,4,6-тринитрофеноксида тетрафенилсурьмы ( 2 ) с выходом 97 %. Вторым продуктом реакции являлся карбонат тетрафенил-сурьмы, образование которого легко протекает при контакте промежуточно образующегося оксида тетрафенилсурьмы с углекислым газом воздуха в растворе ароматического углеводорода [7].
2 Ph 5 Sb + [Ph 3 SbOC 6 H 2 (NO 2 ) 3 -2,4,6] 2 O → 2 [Ph 4 Sb]+ [OC 6 H 2 (NO 2 ) 3 -2,4,6]– + (Ph 4 Sb) 2 O
(Ph 4 Sb) 2 O + CO 2 → (Ph 4 Sb) 2 CO 3
ИК-спектр и температура плавления соединения 2 совпадали с аналогичными характеристиками продукта, полученного из пентафенилсурьмы и 2,4,6-тринитрофенола.
Ph 5 Sb + HOC 6 H 2 (NO 2 ) 3 -2,4,6 → [Ph 4 Sb]+ [OC 6 H 2 (NO 2 ) 3 -2,4,6]– + PhH
По данным рентгеноструктурного анализа (РСА), в кристаллах 2 присутствуют два типа кристаллографически независимых катионов [Ph4Sb]+ и пикрат-анионов с близкими геометрическими параметрами (рис. 1). Валентные углы CSbC в катионах (106,7(5)°-114,8(1)°) мало отли- чаются от значения 2,088(3)-2,103(3) Å.
изменяются в интервале
тетраэдрического угла, длины связей Sb – C
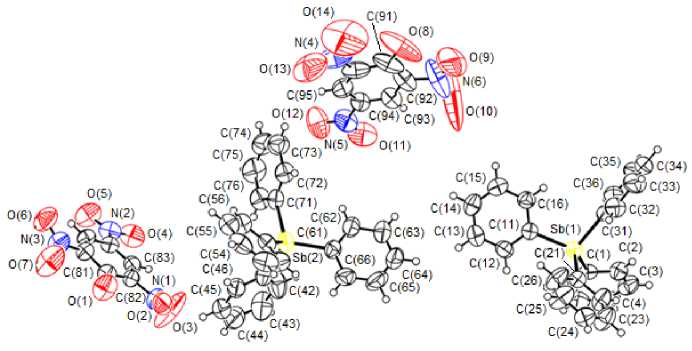
Рис. 1. Строение соединения 2
Отметим, что соединение 2 среди структурно охарактеризованных ароксидов тетрафенилсурьмы является единственным производным, имеющим ионное строение [8]. Молекулы других арокси-дов тетрафенилсурьмы имеют конфигурацию тригональной бипирамиды, длина связи Sb–O в которых изменяется в широком диапазоне и возрастает с введением в ароксильную группу электроноакцепторных заместителей, достигая максимального значения в 2,4,6-трибромфеноксиде тетрафенилсурьмы [9]. Три нитрогруппы в ароматическом кольце фенола стабилизируют арокси-анион и уменьшают его основность, при этом фрагмент Ph4Sb переходит в тетраэдрическую конфигурацию. В кристалле 2 катионы и анионы взаимодействуют посредством водородных связей, наиболее прочные из которых показаны на рис. 2.
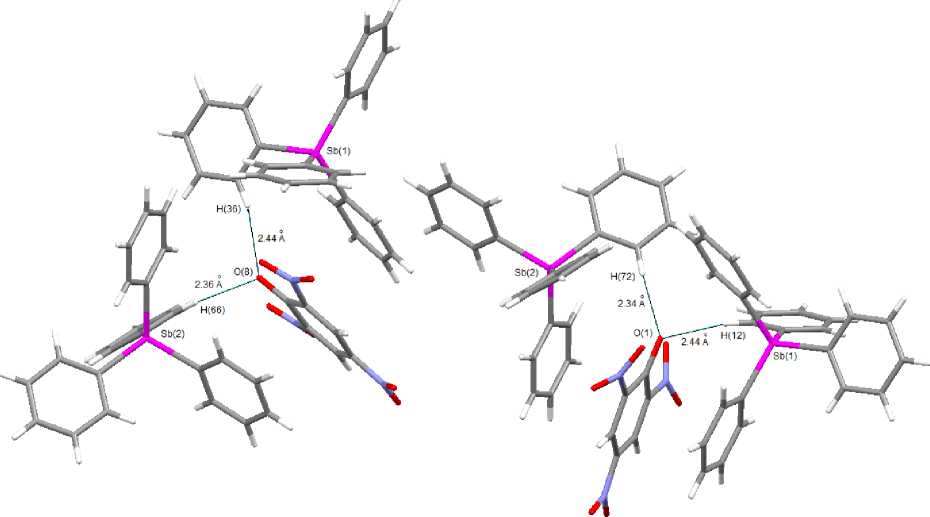
Рис. 2. Водородные связи в кристалле 2
µ -Оксо бис [(2,4,6-тринитрофеноксо)трифенилсурьма] ( 1 ) была синтезирована по реакции окислительного присоединения из трифенилсурьмы, 2,4,6-тринитрофенола и пероксида водорода в эфире по методике, описанной в [10].
Органическая химия
Установлено, что независимо от мольного соотношения (1:2:1 или 1:1:1) трифенилсурьма реагирует с пикриновой кислотой в присутствии пероксида водорода с образованием 1 .
2 Ph 3 Sb + 2 HOC 6 H 2 (NO 2 ) 3 -2,4,6 + 2 Н 2 О 2 ^ 1 + 3 H 2 O
По данным РСА, в кристалле 1 атомы сурьмы имеют малоискаженную тригонально-бипирамидальную координацию с атомами кислорода в аксиальных положениях (рис. 3).
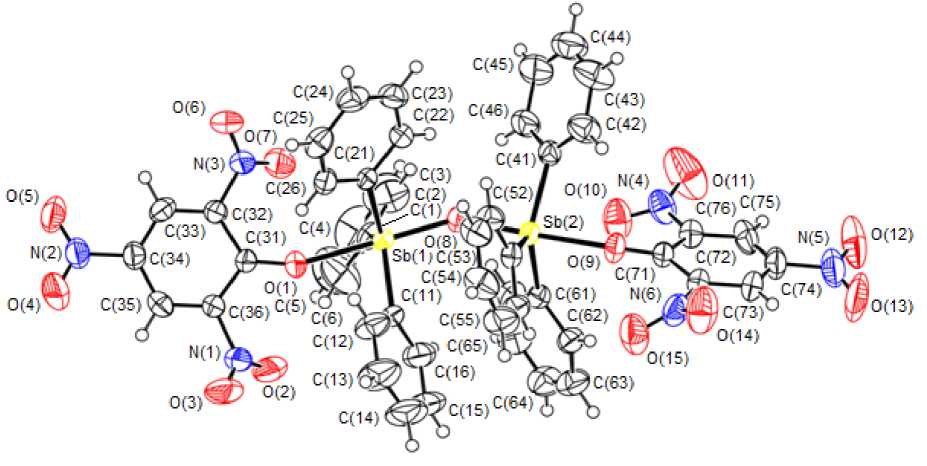
Рис. 3. Строение молекулы соединения 1
Значения аксиальных углов O(1)Sb(1)O(8) 176,65(14) ° и O(8)Sb(2)O(9) 176,30(12) ° практически совпадают между собой. Суммы углов CSbC в экваториальных плоскостях составляют 357,7 ° и 358,76 ° . Угол при мостиковом атоме кислорода Sb(1)O(8)Sb(2) равен 142,5(8) ° , что близко к величинам аналогичных углов в ц -оксобис[(4-бром,2-формилфенолято)трифенилсурьме], ц -оксобис[(4-ацетил,3-гидроксифенолято)трифенилсурьме] и ц -оксобис[(2,4,6-трибромофенолято)-трифенилсурьме] (142,4(1) ° , 143,1(9) ° и 143,9(9) ° соответственно) [10]. Расстояния Sb(1) - O(8) и Sb(2) - O(8) составляют 1,956(3) и 1,965(3) А соответственно. В структуре 1 расстояния Sb(1) - O(1) (2,287(4) А) и Sb(2) - O(9) (2,268(3) А) значительно длиннее, чем в других оксоарокси-дах трифенилсурьмы (2,129 - 2,185 А). Длины связей С - O в пикратных группах составляют 1,258(6) и 1,260(6) Å и больше таковых для изолированных пикрат-анионов комплекса 2 (1,231(5) и 1,234(4) Å). Структурная организация кристалла 1 обусловлена межмолекулярными водородными связями типа N - O—H - C.
Экспериментальная часть
µ -Оксобис[(2,4,6-тринитрофеноксо)трифенилсурьма] ( 1 ). Смесь 0,300 г (0,85 ммоль) три-фенилсурьмы, 0,195 г (0,85 ммоль) 2,4,6-тринитрофенола, 0,09 мл 30%-ного водного раствора пероксида водорода и 20 мл диэтилового эфира выдерживали 24 ч при комнатной температуре. Получили 0,46 г (92 %) желтых кристаллов I с т. разл. 225 ° С. Найдено, %: С 48,83, Н 2,96. Для C 48 H 34 O 15 N 6 Sb 2 вычислено, %: С 48,92, Н 2,89. ИК-спектр (ν, см‾1): 3055, 1608, 1575, 1539, 1475, 1437, 1348, 1283, 1169, 1084, 1021, 996, 942, 915, 845, 757, 722, 712, 689, 458.
2,4,6-Тринитрофеноксид тетрафенилсурьмы ( 2 ). а ) Смесь 0,215 г (0,42 ммоль) пентафенил-сурьмы, 0,250 г (0,21 ммоль) ц -оксо бис [(2,4,6-тринитрофеноксо)трифенилсурьмы] и 2 мл толуола нагревали 1 час на кипящей водяной бане в запаянной стеклянной ампуле. После вскрытия ампулы и испарения растворителя наблюдали образование кристаллов двух типов: желтых – 2,4,6-тринитрофеноксида тетрафенилсурьмы массой 0,271 г (97 %) с т.пл. 194 ° С и неокрашенных -карбоната тетрафенилсурьмы массой 0,185 г (95 %) с т.пл. 221 - 222 ° С. Найдено, %: С 54,55, Н 3,48. Для C 30 H 22 O 7 N 3 Sb вычислено, %: С 54,73, Н 3,34. ИК-спектр (ν, см‾1): 3053, 1628, 1605, 1559,
1479, 1436, 1385, 1364, 1333, 1305, 1288, 1262, 1160, 1070, 995, 924, 904, 788, 744, 731, 705, 688, 454, 441.
-
б ) Смесь 0,250 г (0,49 ммоль) пентафенилсурьмы, 0,113 г (0,49 ммоль) 2,4,6-тринитрофенола и 2 мл толуола выдерживавали при комнатной температуре в запаянной стеклянной ампуле 24 часа. Удаляли растворитель. Получили 0,305 г (94 %) желтых кристаллов, ИК-спектр и температура плавления которых совпадали с аналогичными для 2,4,6-тринитрофеноксида тетрафенил-сурьмы, полученного способом а ).
ИК-спектры снимали на ИК-спектрометре Bruker Tensor 27 в таблетке KBr.
Рентгеноструктурный анализ (РСА) кристаллов 1 и 2 проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [11]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [12]. Структуры 1 и 2 определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов.
Основные кристаллографические данные и результаты уточнения структур приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1, 2
|
Параметр |
Значение |
|
|
1 |
2 |
|
|
Формула |
C 48 H 34 N 6 O 15 Sb 2 |
C 60 H 44 N 6 O 14 Sb 2 |
|
М |
1178,31 |
1316,51 |
|
Т , К |
296(2) |
296(2) |
|
Сингония |
Моноклинная |
Триклинная |
|
Пр. группа |
P2 1 /c |
P г |
|
a, Å |
11,9168(3) |
12,6194(5) |
|
b, Å |
19,2970(5) |
13,5558(5) |
|
c , Å |
20,7034(6) |
17,3616(7) |
|
α , град |
90,00 |
100,3400(10) |
|
β, град |
90,00 |
98,443(2) |
|
γ , град |
90,00 |
102,7180(10) |
|
V , Å3 |
4760,9(2) |
2795,81(19) |
|
Z |
4 |
2 |
|
ρ (выч.), г/см3 |
1,644 |
1,564 |
|
-1 µ , мм |
1,211 |
1,039 |
|
F (000) |
2344,0 |
1320,0 |
|
Форма кристалла (размер, мм) |
обломок (0,32 × 0,17 × 0,14) |
обломок (0,75 × 0,38 × 0,15) |
|
Область сбора данных по θ , град |
5,78–52,16 |
6,1–57,44 |
|
Интервалы индексов отражений |
–14 ≤ h ≤ 14 –23 ≤ k ≤ 23 –25 ≤ l ≤ 25 |
–17 ≤ h ≤ 17 –18 ≤ k ≤ 17 –23 ≤ l ≤ 23 |
|
Измерено отражений |
43833 |
109543 |
|
Независимых отражений |
6644 |
14427 |
|
Переменных уточнения |
640 |
747 |
|
GOOF |
1,004 |
1,021 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0379, wR 2 = 0,0874 |
R 1 = 0,0375, wR 2 = 0,0894 |
|
R -факторы по всем отражениям |
R 1 = 0,0631, wR 2 = 0,0948 |
R 1 = 0,0587, wR 2 = 0,1033 |
|
Остаточная электронная плотность (min/max), e/A3 |
–0,33/0,69 |
–0,77/0,93 |
Органическая химия
Таблица 2
Длины связей и валентные углы в структурах 1, 2
|
Связь d, Å |
Угол ω , град |
||
|
1 |
|||
|
Sb(1)–O(1) |
2,287(4) |
Sb(1)O(8)Sb(2) |
142,59(16) |
|
Sb(1)–O(8) |
1,956(3) |
O(1)Sb(1)O(8) |
176,65(14) |
|
Sb(2)–O(9) |
2,268(3) |
O(8)Sb(2)O(9) |
176,30(12) |
|
Sb(2)–O(8) |
1,965(3) |
C(1)Sb(1)C(11) |
117,0(2) |
|
Sb(1)–C(1) |
2,092(5) |
C(11)Sb(1)C(21) |
115,33(18) |
|
Sb(1)–C(11) |
2,100(4) |
C(1)Sb(1)C(11) |
125,36(18) |
|
Sb(1)–C(21) |
2,102(5) |
C(41)Sb(2)C(51) |
114,05(19) |
|
Sb(2)–C(41) |
2,107(5) |
C(51)Sb(2)C(61) |
116,09(18) |
|
Sb(2)–C(51) |
2,100(4) |
C(41)Sb(2)C(61) |
128,62(19) |
|
Sb(2)–C(61) |
2,095(5) |
||
|
2 |
|||
|
Sb(1)–С(1) |
2,096(3) |
C(1)Sb(1)C(11) |
113,82(11) |
|
Sb(1)–С(11) |
2,103(3) |
C(1)Sb(1)C(21) |
110,56(10) |
|
Sb(1)–С(21) |
2,099(3) |
C(1)Sb(1)C(31) |
106,74(11) |
|
Sb(1)–С(31) |
2,095(3) |
C(11)Sb(1)C(21) |
110,31(11) |
|
Sb(2)–C(41) |
2,101(3) |
C(11)Sb(1)C(31) |
107,51(11) |
|
Sb(2)–С(51) |
2,088(3) |
C(21)Sb(1)C(31) |
107,61(11) |
|
Sb(2)–С(61) |
2,091(3) |
C(41)Sb(2)C(51) |
108,98(12) |
|
Sb(2)–С(71) |
2,100(3) |
C(41)Sb(2)C(61) |
108,10(13) |
|
O(1)–С(81) |
1,234(4) |
C(41)Sb(2)C(71) |
107,20(13) |
|
O(1)–C(91) |
1,231(5) |
C(51)Sb(2)C(61) |
114,80(13) |
|
C(51)Sb(2)C(71) |
108,62(12) |
||
|
C(61)Sb(2)C(71) |
108,88(12) |
||
Заключение
Таким образом, установлено, что пентафенилсурьма фенилирует ц- оксо бис [(ароксо)трифенилсурьму] до 2,4,6-тринитрофеноксида тетрафенилсурьмы, кристалл которого образован катионами тетрафенилстибония и фенолят-анионами. Ионное строение 2,4,6-тринитрофеноксида тетрафенилсурьмы можно объяснить устойчивостью пикрат-аниона, обусловленной электронными эффектами нитрогрупп. Акцепторные свойства арокси-группы способствуют удлинению связей Sb–O в молекуле µ - оксо бис [(2,4,6-тринитрофеноксо)-трифенилсурьмы], которые существенно превышают сумму ковалентных радиусов атомов.
Список литературы Синтез и строение 2,4,6-тринитрофеноксида тетрафенилсурьмы и μ-оксо бис[(2,4,6- тринитрофеноксо)трифенилсурьмы]
- Синтез, строение и термическое разложение арикситетрафенилстиборанов/В.В. Шарутин, В.В. Жидков, Д.В. Муслин и др.//Известия Академии наук. Серия химическая. -1995. -Т. 44. -№ 5. -С. 958-964.
- Реакции пентаарилсурьмы с орто-замещенными фенолами/В.В. Шарутин, O.K. Шарутина, П.E. Oсипов и др.//Журнал общей химии. -1997. -Т. 67. -№ 9. -С. 1528-1530.
- Арокситетраарильные соединения сурьмы. Синтез строение и термическое разложение/В.В. Шарутин, O.K. Шарутина, П.E. Oсипов и др.//Журнал общей химии. -2000. -Т. 70. -№ 6. -С. 931-936.
- Сурьмаорганические производные 2,4,6-трибромфенола/В.В. Шарутин, А.П. Пакусина, М.А. Пушилин и др.//Журнал общей химии. -2003. -Т. 73. -№ 4. -С. 573-577.
- Шарутин, В.В. Пентафенилсурьма и пентафенилвисмут как фенилирующие реагенты в реакциях с органическими соединениями элементов (обзор)/В.В. Шарутин, О.К. Шарутина//Вестник ЮУрГУ. Серия «Химия». -2012. -№ 24. -С. 18-31.
- Шарутина, O.K. Молекулярные структуры органических соединений сурьмы (V)/O.K. Шарутина, В.В. Шарутин. -Челябинск: Издат. центр ЮУрГУ, 2012. 395 с.
- Синтез, строение и реакции мю-оксобис(тетрафенилсурьмы)/В.В. Шарутин, O.K. Шарутина, В.С. Сенчурин и др.//Коорд. химия. -2001. -Т. 27. -№ 9. -C. 710-716.
- Cambridge Crystallografic Database. Release 2014, Cambridge.
- Оcобенности строения арильных соединений сурьмы Ar4SbX (X ≠ Alk, Ar)/А.П. Пакусина, О.К. Шарутина, Т.П. Платонова и др.//Химия и компьютерное моделирование. Бутлеровские сообщения. -2003. -Т. 4. -№ 1. -С. 22-30.
- Синтез, строение и реакции соединений сурьмы (Ar3SbX)2O, X=Hal, NO2, NO3, OSO2R, OC(O)R’, OAr’/В.В. Шарутин, А.П. Пакусина, О.К. Шарутина и др.//Химия и компьютерное моделирование. Бутлеровские сообщения. -2002. -Т. 3. -№ 11. -С. 1322.
- SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. -Bruker AXS Inc. -1998. -Madison, Wisconsin, USA.
- SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. -Bruker AXS Inc. -1998. -Madison, Wisconsin, USA.

![Синтез и строение 2,4,6-тринитрофеноксида тетрафенилсурьмы и μ-оксо бис[(2,4,6- тринитрофеноксо)трифенилсурьмы] Синтез и строение 2,4,6-тринитрофеноксида тетрафенилсурьмы и μ-оксо бис[(2,4,6- тринитрофеноксо)трифенилсурьмы]](/file/cover/147160296/sintez-i-stroenie-246-trinitrofenoksida-tetrafenilsurmy-i-okso-bis-246.png)
