Синтез и строение аренсульфонатов алкилтрифенилфосфония
Автор: Шарутин Владимир Викторович, Шарутина Ольга Константиновна, Механошина Евгения Сергеевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.14, 2022 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств галогенида алкилтрифенилфосфония с мезитиленсульфоновой, 2,5-дихлорбензолсульфоновой и сульфосалициловой кислотами в воде синтезированы аренсульфонаты алкилтрифенилфосфония [Ph3PR][OSO2Ar], R = CH2OMe, Ar = C6H2Me3-2,4,6 (1); R = CH2C(O)Me, Ar = C6H2Me3-2,4,6 (2); R = (CH2)2Br, Ar = C6H3Cl2-2,5 (3); R = (CH2)4COOH, Ar = C6H3(COOH-3)(OH-4) (4), особенности строения которых установлены методом РСА. Кристаллы 1 [С29H31O4PS, M 506,57; сингония моноклинная, группа симметрии P21/c; параметры ячейки: a = 13,228(9), b = 14,530(12), c = 14,192(10) Å; a = 90,00, β = 101,46(3), g = 90,00 град., V = 2673(3) Å3, Z = 4; rвыч = 1,259 г/см3], 2 [С30H31O4PS, M 518,58; сингония моноклинная, группа симметрии P21/c; параметры ячейки: a = 12,569(8), b = 15,888(12), c = 13,819(10) Å; a = 90,00, β = 100,16(2), g = 90,00 град., V = 2716(3) Å3, Z = 4; rвыч = 1,268 г/см3], 3 [С26H22BrCl2O3PS, M 596,28; сингония моноклинная, группа симметрии Cc; параметры ячейки: a = 21,731(15), b = 8,974(6), c = 14,794(9) Å; a = 90,00, β = 117,928(19), g = 90,00 град., V = 2549(3) Å3, Z = 4; rвыч = 1,554 г/см3], 4 [С60H59O16.5P2S2, M 1170,12; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 10,678(7), b = 11,025(5), c = 13,250(7) Å; a = 104,117(19), β = 104,13(2), g = 91,23(3) град., V = 1461,5(14) Å3, Z = 2; rвыч = 1,330 г/см3] состоят из катионов алкилтрифенилфосфония и аренсульфонатных анионов. Атомы фосфора в катионах 1-4 имеют тетраэдрическую координацию [углы CРС варьируют в интервале 104,50(8)°-115,41(9)°]. Длины связей P-C составляют 1,7890(16)-1,823(3) Å, что несколько меньше суммы их ковалентных радиусов (1,88 Å). Расстояния S-O в аренсульфонатных анионах незначительно отличаются и равны 1,441(3)-1,454(2) Å; длины связей S-C составляют 1,7706(15)-1,807(3) Å. Структурная организация кристаллов 1-4 формируется за счет множества слабых водородных связей между катионами и анионами. Аренсульфонатные анионы в комплексе 4 посредством прочных водородных связей структурированы в димеры. Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2161982 (1), 2162500 (2), 2162502 (3), 2167983 (4), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Аренсульфонат алкилтрифенилфосфония, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147239552
IDR: 147239552 | УДК: 546.865+547.53.024+548.312.5 | DOI: 10.14529/chem220404
Текст научной статьи Синтез и строение аренсульфонатов алкилтрифенилфосфония
Известно, что органические соединения фосфора (ОСФ) применяются в самых разнообразных областях практической деятельности: в качестве инсектицидов, фунгицидов, дефолиантов, гербицидов, пластификаторов, ионитов, присадок к бензинам и смазочным маслам [1]. ОСФ нашли применение и в синтетической органической химии, например, при получении олефинов по Виттигу [2] или синтезе элементоорганических соединений [3]. Сообщалось также о перспективах практического применения некоторых фосфорорганических соединений в качестве катализаторов гидрофункционализации непредельных субстратов [4], реагентов для транс металлирования [5] и метатезиса σ-связей [6]. Из всех производных пятивалентного фосфора наиболее изучены соли тетрафенилфосфония, которые обычно получают по реакции пентафе-нилфосфора с кислотами [7 - 10]. Синтез структурно охарактеризованных органосульфонатов тетрафенилфосфония описан в работах [11 - 17], однако в литературе неизвестны примеры получения аренсульфонатов органилтрифенилфосфония.
Экспериментальная часть
В работе использовали галогениды алкилтрифенилфосфония производства фирмы Alfa Aesar.
2,4,6-Триметилбензолсульфонат (метоксиметил)трифенилфосфония (1). Раствор хлорида (метоксиметил)трифенилфосфония (0,103 г, 0,300 ммоль) в 8 мл воды смешивали с 8 мл водного раствора 2,4,6-триметилбензолсульфоновой кислоты (0,060 г, 0,300 ммоль). При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе. Выход 0,147 г (97 %), т. пл. 101 ° С. ИК-спектр ( v , см - 1): 3078, 3053, 2972, 2934, 2914, 1585, 1481, 1435, 1246, 1217, 1206, 1179, 1159, 1109, 1084, 1043, 1016, 995, 853, 758, 725, 691, 675, 579, 535, 427. Найдено, %: С 68,68; H 6,19. С 29 H 31 O 4 PS. Вычислено, %: С 68,70; H 6,12.
2,4,6-Триметилбензолсульфонат (ацетонил)трифенилфосфония (2). Раствор бромида (ацетонил)трифенилфосфония (0,120 г, 0,300 ммоль) в 8 мл воды смешивали с 8 мл водного раствора 2,4,6-триметилбензолсульфоновой кислоты (0,060 г, 0,300 ммоль). При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе. Выход 0,148 г (95 %), т. пл. 127 ° С. ИК-спектр ( v , см - 1): 3088, 3073, 3051, 2988, 2968, 2895, 1983, 1929, 1603, 1587, 1564, 1485, 1470, 1437, 1377, 1362, 1319, 1308, 1243, 1217, 1198, 1169, 1109, 1082, 1039, 1011, 995, 982, 856, 800, 748, 721, 692, 675, 581, 548, 509, 496, 451, 411. Найдено, %: С 69,39; H 6,01. С 30 H 31 O 4 PS. Вычислено, %: С 69,42; H 5,98.
2,5-Дихлорбензолсульфонат (2-бромэтил)трифенилфосфония (3). Раствор бромида (2-бромэтил)трифенилфосфония (0,135 г, 0,300 ммоль) в 8 мл воды смешивали с 8 мл водного раствора 2,5-дихлорбензолсульфоновой кислоты (0,068 г, 0,300 ммоль). При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе. Выход 0,170 г (95 %), т. пл. 92 ° С. ИК-спектр ( v , см - 1): 3080, 3049, 2994, 2934, 2897, 1612, 1585, 1557, 1485, 1437, 1406, 1373, 1339, 1319, 1231, 1217, 1169, 1148, 1107, 1096, 1051, 1015, 995, 899, 835, 810, 741, 733, 714, 692, 619, 567, 535, 523, 482, 469, 457, 428. Найдено, %: С 52,28; H 3,71. С 26 H 22 BrCl 2 O 3 PS. Вычислено, %: С 52,33; H 3,69.
Гидрат 3-карбокси-4-гидроксибензолсульфоната (4-карбоксибутил)трифенилфосфония (4). Раствор бромида (4-карбоксибутил)трифенилфосфония (0,133 г, 0,300 ммоль) в 8 мл воды смешивали с 8 мл водного раствора 3-карбокси-4-гидроксибензолсульфоновой кислоты (0,066 г, 0,300 ммоль). При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе. Выход 0,157 г (90 %), т. пл. 165 ° С. ИК-спектр ( v , см - 1): 3084, 3063, 2995, 2887, 1989, 1938, 1670, 1612, 1587, 1474, 1439, 1400, 1344, 1317, 1281, 1238, 1217, 1171, 1150, 1108, 1086, 1040, 1013, 835, 800, 779, 745, 714, 691, 660, 565, 550, 496, 467, 444. Найдено, %: С 61,50; H 5,11. С 60 H 59 O 16.5 P 2 S 2 . Вычислено, %: С 61,53; H 5,04.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектры соединений 1-4 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ ( РСА ) проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K „ -излучение, X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [18]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [19] и OLEX-2 [20]. Структуры соединений определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 ‒ 4
|
Параметр |
1 |
2 |
3 |
4 |
|
Формула |
С 29 H 31 O 4 PS |
С 30 H 31 O 4 PS |
С 26 H 22 BrCl 2 O 3 PS |
С 60 H 59 O 16.5 P 2 S 2 |
|
М |
506,57 |
518,58 |
596,28 |
1170,12 |
|
Сингония |
Моноклинная |
Моноклинная |
Моноклинная |
Триклинная |
|
Пр. группа |
P 2 1 /c |
P 2 1 /c |
Cc |
P– 1 |
|
a , Å |
13,228(9) |
12,569(8) |
21,731(15) |
10,678(7) |
|
b, Å |
14,530(12) |
15,888(12) |
8,974(6) |
11,025(5) |
|
c, Å |
14,192(10) |
13,819(10) |
14,794(9) |
13,250(7) |
|
α, град. |
90,00 |
90,00 |
90,00 |
104,117(19) |
Окончание табл. 1
|
Параметр |
1 |
2 |
3 |
4 |
|
β, град. |
101,46(3) |
100,16(2) |
117,928(19) |
104,13(2) |
|
γ, град. |
90,00 |
90,00 |
90,00 |
91,23(3) |
|
V , Å3 |
2673(3) |
2716(3) |
2549(3) |
1461,5(14) |
|
Z |
4 |
4 |
4 |
2 |
|
ρ (выч.), г/см3 |
1,259 |
1,268 |
1,554 |
1,330 |
|
µ , мм–1 |
0,213 |
0,212 |
1,994 |
0,215 |
|
F (000) |
1072,0 |
1096,0 |
1208,0 |
613,0 |
|
Размер кристалла, мм |
0,34×0,32×0,08 |
0,5×0,26×0,19 |
0,45×0,32×0,1 |
0,5×0,5×0,3 |
|
Область сбора данных по θ , град. |
5,48–56,64 |
5,94‒65,3 |
6,4–60,24 |
5,746–57 |
|
Интервалы индексов отражений |
–17 ≤ h ≤ 17, –19 ≤ k ≤ 19, –18 ≤ l ≤ 18 |
–19 ≤ h ≤ 19, –24 ≤ k ≤ 24, –20 ≤ l ≤ 20 |
–30 ≤ h ≤ 28, –12 ≤ k ≤ 11, –20 ≤ l ≤ 20 |
–14 ≤ h ≤ 14, –14 ≤ k ≤ 14, –17 ≤ l ≤ 17 |
|
Измерено отражений |
109903 |
82287 |
17067 |
64488 |
|
Независимых отражений |
6632 |
9896 |
6290 |
7406 |
|
R int |
0,0585 |
0,0634 |
0,0330 |
0,0285 |
|
Переменных уточнения |
320 |
329 |
307 |
406 |
|
GOOF |
1,054 |
1,008 |
1,026 |
1,044 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0432, wR 2 = 0,1115 |
R 1 = 0,0571, wR 2 = 0,1268 |
R 1 = 0,0340, wR 2 = 0,0715 |
R 1 = 0,0373, wR 2 = 0,0992 |
|
R -факторы по всем отражениям |
R 1 = 0,0632, wR 2 = 0,1240 |
R 1 = 0,1193, wR 2 = 0,1532 |
R 1 = 0,0531, wR 2 = 0,0779 |
R 1 = 0,0461, wR 2 = 0,1067 |
|
Остаточная электронная плотность (min/max), e/A3 |
0,22/–0,38 |
0,27/–0,49 |
0,23/–0,65 |
0,29/–0,22 |
Таблица 2
|
Связь d , Å |
Угол ω, град. |
||
|
1 |
|||
|
S(1)–O(2) |
1,4512(17) |
O(2)S(1)O(3) |
111,67(11) |
|
S(1)–O(3) |
1,4417(17) |
O(2)S(1)O(4) |
112,01(10) |
|
S(1)–O(4) |
1,4502(18) |
O(3)S(1)O(4) |
113,71(11) |
|
S(1)–C(31) |
1,800(2) |
O(2)S(1)C(31) |
105,83(9) |
|
P(1)–C(1) |
1,7932(19) |
C(1)P(1)C(7) |
111,04(9) |
|
P(1)–C(7) |
1,8048(17) |
C(7)P(1)C(11) |
109,21(8) |
|
P(1)–C(11) |
1,793(2) |
C(11)P(1)C(21) |
110,59(8) |
|
P(1)–C(21) |
1,7910(18) |
C(1)P(1)C(21) |
110,57(8) |
|
C(7)‒O(1) |
1,415(2) |
C(7)O(1)C(8) |
111,27(16) |
|
2 |
|||
|
S(1)–O(2) |
1,442(2) |
O(2)S(1)O(3) |
111,97(11) |
|
S(1)–O(3) |
1,4423(17) |
O(2)S(1)O(4) |
114,68(12) |
|
S(1)–O(4) |
1,4459(16) |
O(3)S(1)O(4) |
110,44(11) |
|
S(1)–C(31) |
1,798(2) |
O(2)S(1)C(31) |
104,34(9) |
|
P(1)–C(1) |
1,797(2) |
C(1)P(1)C(7) |
110,36(9) |
|
P(1)–C(7) |
1,7999(18) |
C(7)P(1)C(11) |
115,41(9) |
|
P(1)–C(11) |
1,796(2) |
C(11)P(1)C(21) |
109,34(9) |
|
P(1)–C(21) |
1,7983(18) |
C(1)P(1)C(21) |
109,26(8) |
|
O(1)‒C(8) |
1,206(2) |
O(1)C(8)C(7) |
121,57(16) |
|
3 |
|||
|
S(1)–O(1) |
1,441(3) 1 |
O(1)S(1)O(2) |
115,01(17) |
Окончание табл. 1
|
Связь d , Å |
Угол ω, град. |
||
|
S(1)–O(2) |
1,454(2) |
O(1)S(1)O(3) |
113,51(18) |
|
S(1)–O(3) |
1,452(3) |
O(2)S(1)O(3) |
112,38(15) |
|
S(1)–C(31) |
1,807(3) |
O(1)S(1)C(31) |
105,72(15) |
|
P(1)–C(1) |
1,797(3) |
C(1)P(1)C(7) |
109,29(14) |
|
P(1)–C(7) |
1,823(3) |
C(7)P(1)C(11) |
113,48(13) |
|
P(1)–C(11) |
1,808(3) |
C(11)P(1)C(21) |
105,22(12) |
|
P(1)–C(21) |
1,797(3) |
C(1)P(1)C(11) |
111,33(13) |
|
Br(1)–C(8) |
1,939(3) |
C(1)P(1)C(21) |
110,56(13) |
|
Cl(1)–C(32) |
1,748(3) |
C(7)P(1)C(21) |
106,79(13) |
|
Cl(2)–C(35) |
1,740(3) |
Br(1)C(8)C(7) |
112,9(2) |
|
4 |
|||
|
S(1)–O(3) |
1,4505(15) |
O(3)S(1)O(4) |
113,56(9) |
|
S(1)–O(4) |
1,4438(13) |
O(3)S(1)O(5) |
111,04(9) |
|
S(1)–O(5) |
1,4497(13) |
O(4)S(1)O(5) |
112,23(9) |
|
S(1)–C(31) |
1,7706(15) |
O(3)S(1)C(31) |
106,13(8) |
|
P(1)–C(1) |
1,8004(16) |
C(1)P(1)C(7) |
111,52(7) |
|
P(1)–C(7) |
1,8004(17) |
C(7)P(1)C(11) |
110,67(7) |
|
P(1)–C(11) |
1,7890(16) |
C(11)P(1)C(21) |
107,79(7) |
|
P(1)–C(21) |
1,7924(15) |
O(1A)C(17B)O(1B) |
123,1(5) |
|
O(1A)–C(17B) |
1,195(6) |
O(1A)C(17B)C(10) |
125,2(4) |
|
O(1B)–C(17B) |
1,326(6) |
O(1B)C(17B)C(10) |
111,7(4) |
|
O(2A)–C(17A) |
1,194(4) |
O(2A)C(17A)O(2B) |
122,8(3) |
|
O(2B)–C(17A) |
1,318(4) |
O(2A)C(17A)C(10) |
126,8(4) |
|
C(10)–C(17A) |
1,383(4) |
O(2B)C(17A)C(10) |
110,3(3) |
|
C(10)–C(17B) |
1,688(5) |
C(17A)C(10)C(9) |
120,82(18) |
|
O(6)–C(37) |
1,2209(19) |
C(17B)C(10)C(9) |
103,7(2) |
|
O(7)–C(37) |
1,310(2) |
O(6)C(37)O(7) |
122,79(15) |
|
O(8)–C(34) |
1,355(2) |
O(8)C(34)C(35) |
118,50(15) |
Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2161982 (1), № 2162500 (2), № 2162502 (3), № 2167983 (4), ; .
Обсуждение результатов
Нами найдено, что реакции галогенидов алкилтрифенилфосфония с аренсульфоновыми кислотами в воде приводят к образованию аренсульфонатов алкилтрифенилфосфония, выделенных из реакционной смеси с выходом до 97 %.
[Ph3PR]Hal + HOSO2Ar н20124^' 14 [Ph3PR][OSO2Ar]
—HHal
Hal = Cl, Br;
R = CH 2 OMe, Ar = C 6 H 2 Me 3 -2,4,6 ( 1 ); R = CH 2 C(O)Me, Ar = C 6 H 2 Me 3 -2,4,6 ( 2 );
R = (CH 2 ) 2 Br, Ar = C 6 H 3 Cl 2 -2,5 ( 3 ); R = (CH 2 ) 4 COOH, Ar = C 6 H 3 (COOH-3)(OH-4) ( 4 )
При испарении воды имело место образование устойчивых на воздухе бесцветных прозрачных кристаллов, хорошо растворимых в хлороформе, аренах и дихлорметане, плохо - в воде и ацетонитриле при комнатной температуре.
В ИК-спектрах соединений 1-4 наблюдаются полосы поглощения средней интенсивности валентных и деформационных колебаний связей CAr–H при 3088‒3049 см–1 и 1171‒1107 см–1; внеплоскостные деформационные колебания характеризуются полосами при 872‒810 см–1. Колебания связей C-Н в алкильных заместителях проявляются в области 2995-2934 см–1 (СН3), 2914-2887 см–1 (СН2). Полосы поглощения при 1246-1217 см-1 и 1109-1082 см-1 относятся к асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Интенсивные полосы поглощения при 692‒691 см–1 и 581‒535 см‒1 можно отнести к валентным колебаниям связей S‒O и C–S. Валентные и деформационные колебания связей CAr–P характеризуются полосами поглощения в областях 1439‒1435 см–1 и 1051‒1011 см–1 соответственно. Колебаниям связей CAr–Cl в спектре структуры 3 отвечают полосы высокой интенсивности при 741 и 733 см–1, полоса при 523 см–1 подтверждает присутствие в комплексе связи C-Br. Также в ИК-спектре комплекса 4 присутствуют три интенсивные полосы валентных колебаний карбонильной группы в области 1670-1587 см–1, свидетельствующие о наличии в нем двух типов карбоксильных групп [21, 22].
По данным РСА, кристаллы 1 - 4 состоят из катионов алкилтрифенилфосфония и аренсульфонатных анионов (рис. 1 - 4).
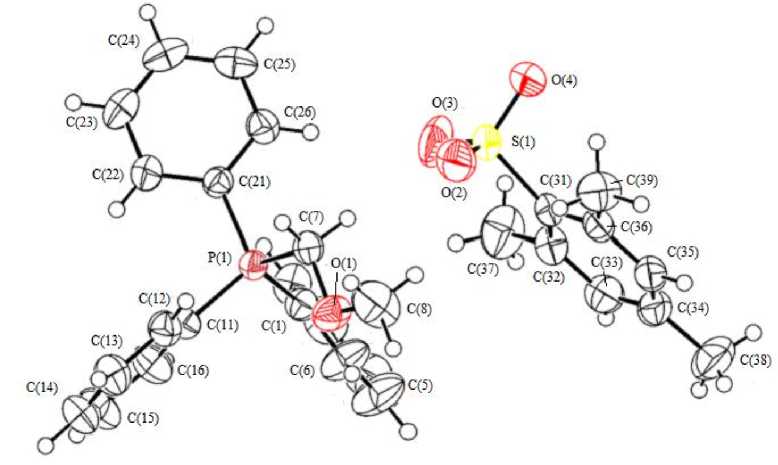
Рис. 1. Строение комплекса 1 в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью
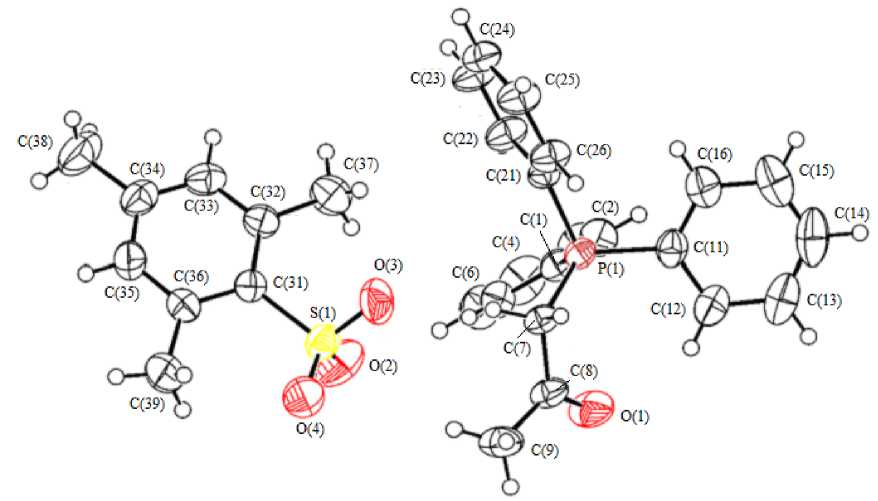
Рис. 2. Строение комплекса 2 в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью
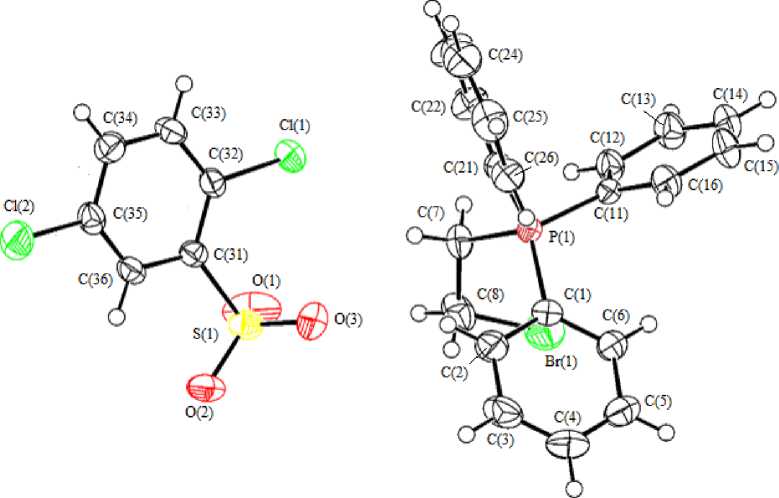
Рис. 3. Строение комплекса 3 в представлении атомов эллипсоидамитепловых колебаний с 50%-ной вероятностью
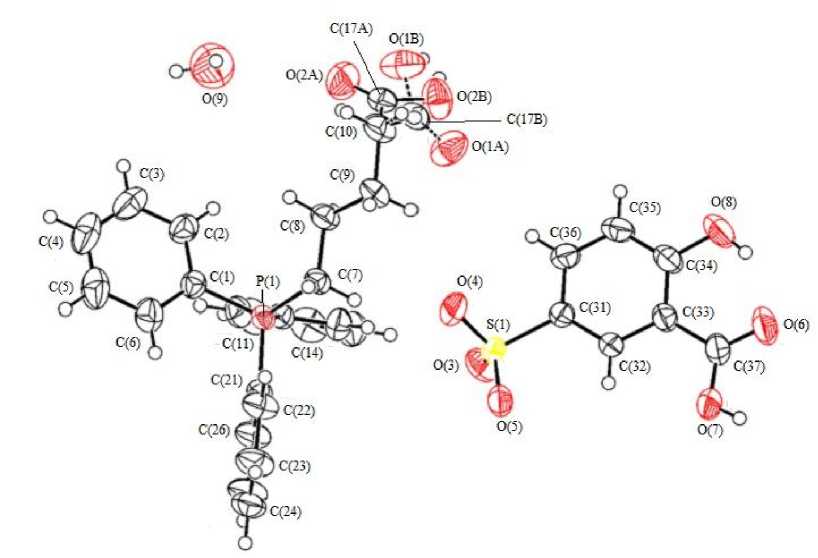
Рис. 4. Строение гидрата комплекса 4 в представлении атомов эллипсоидами тепловых колебаний с 50%-ной вероятностью
Атомы фосфора в катионах 1-4 имеют тетраэдрическую координацию (углы СРС варьируют в интервале 107,18(8)°-111,04(9)° для 1, 104,50(8)°-115,41(9)° для 2, 105,22(12)°-113,48(13)° для 3, 107,79(7)°-111,52(7)° для 4). Длины связей P-C составляют 1,7910(18)-1,8048(17), 1,796(2)-1,7999(18), 1,797(3)-1,823(3), 1,7890(16)-1,8004(17) А соответственно, что несколько меньше суммы их ковалентных радиусов (1,88 А [23]). Расстояния S-O в аренсульфонатных анионах незначительно отличаются [1,4417(17)-1,4512(17), 1,442(2)-1,4459(16), 1,441(3)-1,454(2), 1,4438(13)-1,4505(15) А], однако в первом приближении можно говорить о равномерном распределении электронной плотности в группах SO3. Длины связей S-C состав- ляют 1,800(2), 1,798(2), 1,807(3), 1,7706(15) Å, что сопоставимо с суммой ковалентных радиусов атомов-партнеров [1,81 Å].
Структурная организация кристаллов 1 - 4 формируется за счет множества слабых водородных связей между катионами и анионами, например, S=O···H - CAr (2,33 - 2,58, 2,34 - 2,62, 2,47 - 2,65, 2,56 - 2,62 Å). В кристалле 4 наблюдаются наиболее прочные водородные связи (S=O···H - OC(O) (1,83 Å)), посредством которых аренсульфонатные анионы структурируются в димеры (рис. 5).
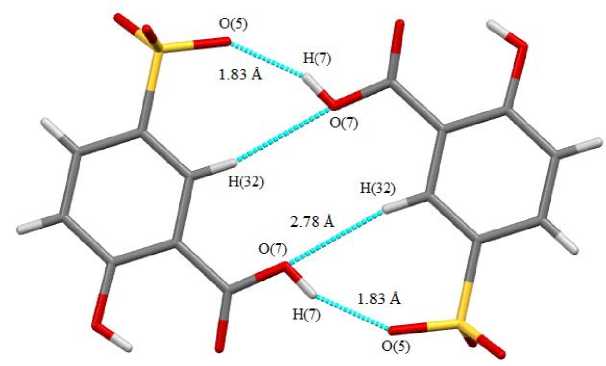
Рис. 5. Димерная организация аренсульфонатных анионов в кристалле соединения 4
Выводы
Таким образом, взаимодействием эквимолярных количеств галогенида алкилтрифенилфосфония с мезитиленсульфоновой, 2,5-дихлорбензолсульфоновой и сульфосалициловой кислотами в воде получены аренсульфонаты алкилтрифенилфосфония [Ph 3 PR][OSO 2 Ar], R = CH 2 OMe, Ar = C 6 H 2 Me 3 -2,4,6 ( 1 ); R = CH 2 C(O)Me, Ar = C 6 H 2 Me 3 -2,4,6 ( 2 ); R = (CH 2 ) 2 Br, Ar = C 6 H 3 Cl 2 -2,5 ( 3 ); R = (CH 2 ) 4 COOH, Ar = C 6 H 3 (COOH-3)(OH-4) ( 4 ), особенности строения которых установлены методом РСА. Кристаллы 1 - 4 состоят из тетраэдрических алкилтрифенилфосфониевых катионов и аренсульфонатных анионов с тетраэдрическим атомом серы. Аренсульфонатные анионы в комплексе 4 посредством водородных связей структурированы в димеры.
Список литературы Синтез и строение аренсульфонатов алкилтрифенилфосфония
- Пурдела Д., Вылчану Р. Химия органических соединений фосфора. М.: Химия, 1972. 752 с.
- Бартон Д. Общая органическая химия. Т. 5. Соединения фосфора и серы / Д. Бартон, У.Д. Оллис. М.: Химия, 1983. 720 с.
- Alkyloxy- and silyloxy-derivatives of P(V) and Sb(V) / G.A. Razuvaev, N.A. Osanova, T.G. Brilkina et al. // J. Organomet. Chem. 1975. Vol. 99, no. 1. P. 93-106. DOI: 10.1016/S0022-328X(00)86365-2.
- Wang D., Astruc D. The golden age of transfer hydrogenation // Chem. Rev. 2015. Vol. 115. P. 6621-6686. DOI: 10.1021/acs.chemrev.5b00203.
- The Stille reaction, 38 years later / C. Cordovilla, C. Bartolome, J.M. Martinez-Ilarduya et al. // ACS Catal. 2015. Vol. 5. P. 3040-3053. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Kinjo R. Metal-free ст-bond metathesis in 1,3,2-diazaphospholene-catalyzed hydro-boration of carbonyl compounds // Angew. Chem. Int. Ed. 2015. Vol. 127. P. 192-196. DOI: 10.1002/ange.201408760.
- Карбоксилаты и сульфонаты тетрафенилфосфора. Синтез и строение / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общей химии. 2009. Т. 79. С. 80-89. DOI: 10.1134/S1070363209010125.
- Синтез и строение карбоксилатов тетрафенилфосфония / В.В. Шарутин, О.К. Шарутина, А.В. Рыбакова и др. // Журн. общей химии. 2018. Т. 88, № 8. С. 1308-1313. DOI: 10.1134/S0044460X18080139.
- Шарутин В.В., Мукушева Н., Уржумова А.В. Синтез и строение 2,4-динитробензолсульфоната тетрафенилфосфония // Вестник ЮУрГУ. Серия «Химия». 2018. Т. 10, № 2. С. 48-54. DOI: 10.14529/chem180206.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. Синтез и строение аренсульфонатов тетрафенилфосфония // Изв. вузов. Химия и хим. технология. 2019. Т. 62, № 2. С. 4-10. DOI: 10.6060/ivkkt.20196202.5823.
- New organic free radical anions TEMPO-A-CO-(o-; m-; ^СбН^Оз- (A = NH; NCH3; O) and their TTF and/or BEDT-TTF salts / H. Akutsu, K. Masaki, K. Mori et al. // Polyhedron. 2005. Vol. 24. P. 2126-2132. DOI: 10.1016/j.poly.2005.03.023.
- Tunable GUMBOS-based sensor array for label-free detection and discrimination of proteins / W.I.S. Galpothdeniya, F.R. Fronczek, M. Cong et al. // J. Mater. Chem. B. 2016. Vol. 4, no. 8. P. 1414-1422. DOI: 10.1039/C5TB02038G.
- A new anionic acceptor, 2-sulfo-3,5,6-trichloro-1,4-benzoquinone and its charge-transfer salts / H. Akutsu, J. Yamada, S. Nakatsuji et al. // CrystEngComm. 2009. Vol. 11, no. 12. P. 2588-2592. DOI: 10.1039/b909519e.
- Dinuclear calcium complex with weakly NH-0 hydrogen-bonded sulfonate ligands / A. Onoda, Y. Yamada, M. Doi et al. // Inorg. Chem. 2001. Vol. 40, no. 3. P. 516-521. DOI: 10.1021/ic0003067.
- Anion polarity-induced self-doping in a purely organic paramagnetic conductor, a-a'-(BEDT-TTF)2(PO-CONH-m-C6H4SO3-H2O where BEDT-TTF is te(ethylenedithio)tetrathiafulvalene and PO is the radical 2,2,5,5-tetramethyl-3-pyrrolin-1-oxyl / H. Akutsu, K. Ishihara, S. Ito et al. // Polyhedron. 2017. Vol. 136. P. 23-29. DOI: 10.1016/j.poly.2017.02.001.
- Correlation between metal-insulator transition and hydrogen-bonding network in the organic metal á-(BEDT-TTF)4[2,6-anthracene-67s(sulfonate)](H2O)4 / F. Camerel, G. Le Helloco, T. Guizouarn et al. // Cryst. Growth Des. 2013. Vol. 13, no. 11. P. 5135-5145. DOI: 10.1021/cg401416h.
- Ferrer E.G., Williams P.A.M., Castellano E.E. On a novel synthesis of 2-sulfonatobenzoic acid by oxidation of thiosalicylic acid catalyzed by copper(II): a structural study // Z. Anorg. Allg. Chem. 2002. Vol. 628. P. 1979-1984. DOI: 10.1002/1521-3749(200209)628:9/10<1979::AID-ZAAC1979-3.0.CO;2-V.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a complete structure solution, refinement and analysis program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. СПб.: СПбГЛТА, 2007. 54 с.
- Covalent radii revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. 2008. Vol. 21. P. 2832-2838. DOI: 10.1039/B801115J.


