Синтез и строение бис(2,5-дифторбензоата) трис(2-метоксифенил)сурьмы
Автор: Ефремов Андрей Николаевич, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.13, 2021 года.
Бесплатный доступ
По реакции окислительного присоединения между трис(2-метоксифенил)сурьмой, 2,5-дифторкарбоновой кислотой и гидропероксидом третичного бутила в диэтиловом эфире получен с выходом 72 % бис(2,5-дифторбензоат) трис(2-метоксифенил)сурьмы (1). Соединение идентифицировано методом ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, в кристалле соединения 1 присутствуют два типа кристаллографически независимых молекул а и б, геометрические параметры которых незначительно отличаются друг от друга. В молекулах а и б атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Также в кристалле присутствует сольватная молекула диэтилового эфира, разупорядоченная по двум положениям. Уточненные соотношения вкладов положений составляют 0,50/0,50. Суммы углов CSbC в экваториальной плоскости молекул 1а и 1б составляют 359,9(3)° и 359,8(3)° соответственно. Аксиальные углы OSbO составляют 174,60(16)° (1а) и 175,51(17)° (1б). Выход атома сурьмы из экваториальной плоскости [C3] составляет 0,040 Å для обеих молекул. Конформация арильных лигандов по отношению к экваториальной плоскости [С3] пропеллерная. Длины связей Sb-C имеют близкие значения: 2,097(7)-2,127(6) Å в 1а, 2,107(7)-2,115(6) Å в 1б. Расстояния Sb-O (2,112(5), 2,131(5) Å в 1а, 2,107(5), 2,128(5) Å в 1б) соизмеримы с ковалентными длинами связей Sb-O. Бидентатные карбоксилатные лиганды координируют на атом металла менее симметрично в молекуле 1а, при этом внутримолекулярные расстояния Sb×××O(=С) равны 3,116(7), 3,063(7) Å в 1а, а в 1б - 3,120(6), 3,126(7) Å, что меньше суммы ван-дер-ваальсовых радиусов атомов Sb и O. В молекулах в 1а и 1б наблюдаются короткие расстояния между атомами кислорода метокси-групп и атомами сурьмы (3,080(6), 3,138(7), 3,164(4) Å для 1а, 3,023(6), 3,085(5), 3,194(7) Å для 1б), что повышает координационное число атома сурьмы. Структура кристалла представлена таким образом, что сольватные молекулы диэтилового эфира, расположенные в одну цепочку вида (∙∙∙СH3CH2OCH2CH3∙∙∙F∙∙∙)n, окружены молекулами бис(2,5-дифторбензоата) трис(2-метоксифенил)сурьмы, образующими своего рода оболочку для цепочки из эфирных молекул. Данное взаимодейсвие обусловлено водородными связями: -ОСH(СH3)-H∙∙∙F, Et2O∙∙∙HMeO-, -ОСH2CH2-H∙∙∙F. Молекулы типов а и б контактируют между собой посредством водородных связей С=О∙∙∙HMeO-, F∙∙∙HMeO-, F∙∙∙HAr и Sb-O∙∙∙HAr. Также в упаковке молекул наблюдаются СН∙∙∙π-взаимодействия и стэкинг-эффект. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2077192 (1), deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Трис(2-метоксифенил)сурьма, 2, 5-дифторбензойная кислота, реакция окислительного присоединения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147236610
IDR: 147236610 | УДК: 549.242+547.53.024+548.312.2+548.312.5 | DOI: 10.14529/chem210410
Текст научной статьи Синтез и строение бис(2,5-дифторбензоата) трис(2-метоксифенил)сурьмы
По реакции окислительного присоединения между трис(2-метоксифенил)сурьмой, 2,5-дифторкарбоновой кислотой и гидропероксидом третичного бутила в диэтиловом эфире получен с выходом 72 % бис(2,5-дифторбензоат) трис(2-метоксифенил)сурьмы (1). Соединение идентифицировано методом ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА, в кристалле соединения 1 присутствуют два типа кристаллографически независимых молекул а и б, геометрические параметры которых незначительно отличаются друг от друга. В молекулах а и б атомы сурьмы имеют искаженную триго-нально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Также в кристалле присутствует сольватная молекула диэтилового эфира, разупорядоченная по двум положениям. Уточненные соотношения вкладов положений составляют 0,50/0,50. Суммы углов CSbC в экваториальной плоскости молекул 1а и 1б составляют 359,9(3)° и 359,8(3)° соответственно. Аксиальные углы OSbO составляют 174,60(16)° (1а) и 175,51(17)° (1б). Выход атома сурьмы из экваториальной плоскости [C3] составляет 0,040 Å для обеих молекул. Конформация арильных лигандов по отношению к экваториальной плоскости [С3] пропеллерная. Длины связей Sb-C имеют близкие значения: 2,097(7)-2,127(6) Å в 1а, 2,107(7)-2,115(6) Å в 1б. Расстояния Sb-O (2,112(5), 2,131(5) Å в 1а, 2,107(5), 2,128(5) Å в 1б) соизмеримы с ковалентными длинами связей Sb-O. Бидентатные карбоксилатные лиганды координируют на атом металла менее симметрично в молекуле 1а, при этом внутримолекулярные расстояния Sb⋅⋅⋅O(=С) равны 3,116(7), 3,063(7) Å в 1а, а в 1б – 3,120(6), 3,126(7) Å, что меньше суммы ван-дер-ваальсовых радиусов атомов Sb и O. В молекулах в 1а и 1б наблюдаются короткие расстояния между атомами кислорода метокси-групп и атомами сурьмы (3,080(6), 3,138(7), 3,164(4) Å для 1а, 3,023(6), 3,085(5), 3,194(7) Å для 1б), что повышает координационное число атома сурьмы. Структура кристалла представлена таким образом, что сольватные молекулы диэтилового эфира, расположенные в одну цепочку вида (∙∙∙СH3CH2OCH2CH3∙∙∙F∙∙∙)n, окружены молекулами бис(2,5-дифторбензоата) трис(2-метоксифенил)сурьмы, образующими своего рода оболочку для цепочки из эфирных молекул. Данное взаимодейсвие обусловлено водородными связями: –ОСH(СH3)–H∙∙∙F, Et2O∙∙∙HMeO–, –ОСH2CH2–H∙∙∙F. Молекулы типов а и б контактируют между собой посредством водородных связей С=О∙∙∙HMeO–, F∙∙∙HMeO–, F∙∙∙HAr и Sb–O∙∙∙HAr. Также в упаковке молекул наблюдаются СН∙∙∙π-взаимодействия и стэкинг-эффект. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2077192 (1), или .
Наиболее изученными арильными производными сурьмы являются соединения с фенильными лигандами [1, 2]. Наличие вакантных d -орбиталей у атомов сурьмы позволяет образовывать дополнительные координационные связи с лигандами, содержащими пространственно доступные атомы с неподеленными электронными парами, что приводит к увеличению координационного числа металла и часто влияет на реакционную способность соединений. Однако арильные соединения сурьмы, содержащие в фенильных заместителях такие потенциальные координирующие центры, как атомы азота [3–10] или кислорода [11–25], изучены в меньшей степени.
В настоящей работе впервые синтезирован бис (2,5-дифторбензоат) трис (2-метоксифенил)сурьмы ( 1 ) по реакции окислительного присоединения между трис (2-метоксифенил)сурьмой, 2,5-дифторбензойной кислотой и трет -бутилгидропероксидом в диэтиловом эфире и определены его структурные особенности методом рентгеноструктурного анализа.
Экспериментальная часть
Исходный реагент - трис (2-метоксифенил)сурьму получали по методике, описанной в монографии [26], из 2-метоксифениллития и трихлорида сурьмы. В работе использовали 2,5-дифторбензойную кислоту производства фирмы «Alfa Aesar».
Синтез (2-MeOC 6 H 4 ) 3 Sb[OC(O)C 6 H 3 F 2 -2,5] 2 ( 1 ).
Смесь 0,150 г (0,338 ммоль) трис (2-метоксифенил)сурьмы, 0,107 г (0,676 ммоль) 2,5-дифторбензойной кислоты и 0,044 г (0,338 ммоль) 70%-ного водного раствора гидропероксида третичного бутила в 30 мл диэтилового эфира выдерживали при 20 °С в течение 24 ч. После удаления растворителя получили 0,184 г (72 %) бесцветных кристаллов соединения 1 с т. пл. 191 °С. ИК-спектр, ν , см - 1: 3076, 3001, 2974, 2947, 2910, 2841, 1664, 1625, 1581, 1483, 1450, 1436, 1423, 1411, 1338, 1313, 1273, 1251, 1244, 1186, 1165, 1126, 1072, 1058, 1018, 979, 939, 904, 893, 858, 823, 806, 794, 758, 692, 669, 605, 574, 543, 505, 476, 441, 418. Найдено, %: С 55,37; Н 3,83. C 35 H 27 F 4 O 7 Sb. Вычислено, %: С 55,50; Н 3,60.
ИК-спектр соединения 1 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 проведен на дифрактометре D8 QUEST фирмы Bruker (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [27]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [28], OLEX2 [29]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в таблице. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2077192 для 1; или .
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
Значение |
|
М |
757,37 |
|
Сингония |
Моноклинная |
|
Пр. группа |
P2/n |
|
a , Å |
24,92(4) |
|
b , Å |
9,687(19) |
|
c , Å |
29,59(5) |
|
α, град. |
90 |
|
β, град. |
106,56(7) |
|
γ, град. |
90 |
|
V , Å3 |
6848(22) |
|
Z |
1 |
|
ρ (выч.), г/см3 |
1,505 |
|
µ, мм–1 |
0,875 |
|
F (000) |
3124,0 |
|
Размер кристалла, мм |
0,19 × 0,17 × 0,05 |
|
Область сбора данных по 2θ, град. |
5,656–55,236 |
|
Интервалы индексов отражений |
–32 ≤ h ≤ 32, –12 ≤ k ≤ 12, –38 ≤ l ≤ 38 |
|
Измерено отражений |
173678 |
|
Независимых отражений |
15693 ( R int = 0,1955) |
|
Переменных уточнения |
901 |
|
GOOF |
1,017 |
|
R -факторы по F2>2σ(F2) |
R 1 = 0,0607, wR 2 = 0,1248 |
|
R -факторы по всем отражениям |
R 1 = 0,1357, wR 2 = 0,1560 |
|
Остаточная электронная плотность (max/min), e/Å3 |
0,88/–0,95 |
Обсуждение результатов
В данной работе синтез бис(2,5-дифторбензоата) трис(2-метоксифенил)сурьмы (1) осуществлен по реакции окислительного присоединения между трис(2-метоксифенил)сурьмой (полученной нами из 2-метоксифениллития и трихлорида сурьмы), 2,5-дифторбензойной кислотой и 70%-ным водным раствором гидропероксида третичного бутила (1:2:1 мольн.) в диэтиловом эфире:
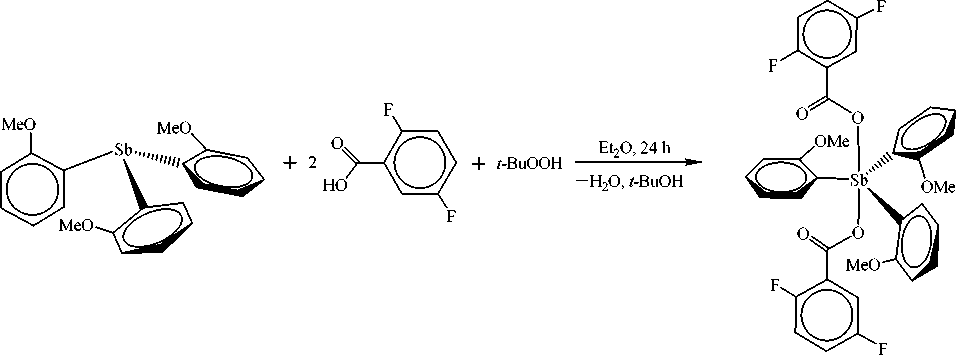
Соединение 1 представляет собой бесцветные кристаллы, хорошо растворимые в ароматических углеводородах и полярных растворителях. Строение соединения подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектре соединения 1 наблюдается полоса поглощения средней интенсивности валентных колебаний связей Sb–C при 476 см–1. Наличие карбонильной группы характеризуется присутствием полосы поглощения валентных колебаний связи С=О сильной интенсивности при 1665 см–1. Полосы поглощения, характеризующие колебания ν(С–О) в арильных и карбоксилатных лигандах, наблюдаются при 1273, 1252 и 1244 см–1. Валентным колебаниям связей C–F соответствуют две интенсивные полосы поглощения при 1186 и 1314 см–1. Полосы поглощения валентных колебаний метильных групп расположены в ИК-спектре при 2974 см–1 (асимметричные колебания) и при 2841 см–1 (симметричные колебания). ИК-спектр соединения 1 также содержит характерные полосы валентных колебаний углеродного скелета ароматических фрагментов: 1582, 1483, 1437 см–1. Валентным колебаниям связей CAr–H отвечает полоса поглощения средней интенсивности при 3076 см–1, внеплоскостным деформационным колебаниям этих же связей – полосы при 823, 794 и 758 см–1, плоскостным деформационным колебаниям – полосы при 1126, 1072 и 1018 см–1. Отсутствие в ИК-спектре соединения полос поглощения колебаний гидроксильной группы определяет образование связей Sb–O [30–32].
По данным РСА, в кристалле соединения 1 присутствуют два типа кристаллографически независимых молекул а и б , геометрические параметры которых незначительно отличаются друг от друга (рис. 1). В молекулах а и б атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Также в кристалле присутствует сольватная молекула диэтилового эфира, разупорядо-ченная по двум положениям. Уточненные соотношения вкладов положений составляют 0,50/0,50.
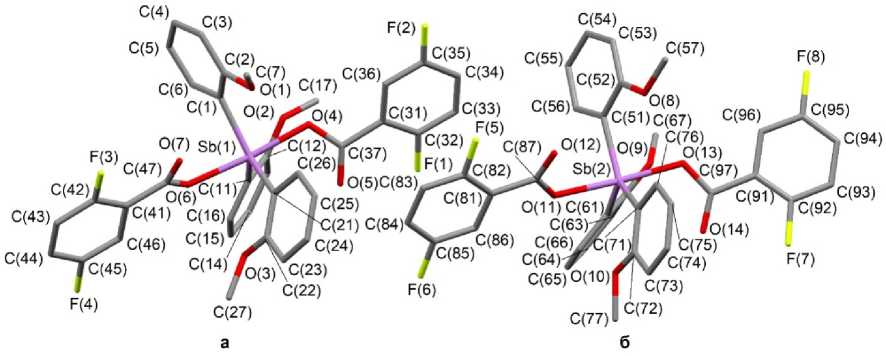
Рис. 1. Строение соединения 1 (атомы водорода и сольватная молекула эфира не указаны)
Суммы углов CSbC в экваториальной плоскости молекул 1а и 1б составляют 359,9(3)° и 359,8(3)° соответственно. Аксиальные углы OSbO составляют 174,60(16)° ( 1а ) и 175,51(17)° ( 1б ). Выход атома сурьмы из экваториальной плоскости [C3] составляет 0,040 Å для обеих молекул. Конформация арильных лигандов по отношению к экваториальной плоскости [С 3 ] пропеллерная. Двугранные углы между плоскостями бензольных колец и экваториальной плоскостью составляют 19,04° [C(1)–C(6)], 55,68° [C(11)–C(16)], 41,96° [С(21)–С(26)] ( 1а ); 25,31° [C(51)–C(56)], 51,33° [C(61)-C(66)], 19,17° [С(71)-С(76)]. Длины связей Sb - C имеют близкие значения: 2,097(7) - 2,127(6) А в 1а , 2,107(7) - 2,115(6) А в 1б . Расстояния Sb - O (2,112(5), 2,131(5) А в 1а , 2,107(5), 2,128(5) А в 1б ) соизмеримы с ковалентными длинами связей Sb - O (2,05 А [33]).
Известно, что карбоксилатные лиганды в молекулах структурно охарактеризованных дикарбоксилатов триарилсурьмы, как правило, расположены таким образом, что внутримолекулярные контакты Sb--O(=C) формируются внутри одного экваториального угла, значение которого может возрастать до 161,47(6) ° [1]. Однако в молекулах соединения 1 карбонильные атомы кислорода находятся напротив разных экваториальных углов, которые изменяются в интервалах 110,9(2) - 126,4(3) ° в 1а , 106,3(3) - 127,4(3) ° в 1б . Бидентатные карбоксилатные лиганды координируют на атом металла менее симметрично в молекуле 1а , при этом внутримолекулярные расстояния Sb --- O(=C) равны 3,116(7), 3,063(7) А в 1а , а в 1б - 3,120(6), 3,126(7) А, что меньше суммы ван-дер-ваальсовых радиусов атомов Sb и O (3,58 Å [34]).
В молекулах 1а и 1б наблюдаются короткие расстояния между атомами кислорода метоксигрупп и атомами сурьмы (3,080(6), 3,138(7), 3,164(4) Å для 1а , 3,023(6), 3,085(5), 3,194(7) Å для 1б ), что повышает координационное число атома сурьмы. Для сравнения: в молекуле трис (2-метоксифенил)сурьмы аналогичные расстояния составляют 3,040(4), 3,052(3) и 3,079(3) Å [1].
Очевидно, что невалентные взаимодействия Sb⋅⋅⋅OСН 3 в молекулах соединения 1 , в результате чего возрастает координационное число металла до 10 (5+5), являются причиной необычной ориентации карбоксилатных групп относительно экваториальной плоскости.
Интерес представляет упаковка молекул в кристалле соединения 1 . Структура кристалла представлена таким образом, что сольватные молекулы диэтилового эфира, расположенные в одну цепочку вида (∙∙∙СH 3 CH 2 OCH 2 CH 3 ∙∙∙F∙∙∙) n , окружены молекулами бис (2,5-дифторбензоата) трис (2-метоксифенил)сурьмы, образующими своего рода оболочку для цепочки из эфирных молекул. При этом одна молекула эфира взаимодействует с шестью молекулами соединения 1 (2 молекулы типа а и 4 молекулы типа б ) (рис. 2). Данное взаимодействие обусловлено водородными связями: –ОСH(СH 3 )–H∙∙∙F (1,92 Å) в 1а , Et 2 O∙∙∙H MeO– (2,53 Å), –ОСH 2 CH 2 –H∙∙∙F (2,40, 2,46 Å) в 1б . Молекулы типов а и б контактируют между собой посредством водородных связей С=О∙∙∙H MeO– (3,00, 2,42, 2,45 Å), F∙∙∙H MeO– (2,51 Å), F∙∙∙H Ar (2,51, 2,42 Å) и Sb–O∙∙∙H Ar (2,68 Å). Также в упаковке молекул наблюдаются СН∙∙∙π-взаимодействия и стэкинг-эффект.
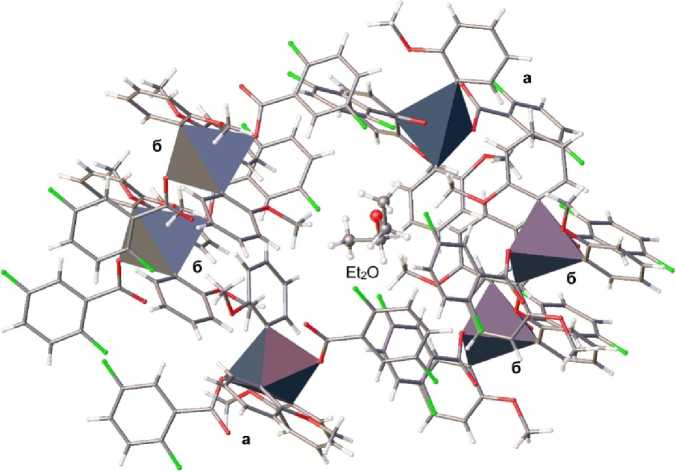
Рис. 2. Упаковка молекул в кристалле соединения 1
Выводы
Таким образом, взаимодействие трис (2-метоксифенил)сурьмы с 2,5-дифторбензойной кислотой в присутствии трет -бутилгидропероксида приводит к образованию бис (2,5-дифторбензоата) трис (2-метоксифенил)сурьмы ( 1 ). Рентгеноструктурный анализ показал, что в кристалле соединения 1 присутствуют по два типа кристаллографически независимых молекул а и б , геометрические параметры которых незначительно отличаются друг от друга. Атомы сурьмы в молекулах а и б имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. В структурах соединений наблюдаются внутримолекулярные контакты Sb···O=С и Sb⋅⋅⋅OСН3. Формирование пространственной структуры кристалла обусловлено образованием водородных связей с участием атомов фтора, кислорода карбонильных, карбоксильных и метокси-групп.
Финансирование работы
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 20-3390099.
Список литературы Синтез и строение бис(2,5-дифторбензоата) трис(2-метоксифенил)сурьмы
- Cambridge Crystallografic Datebase. Release 2020. Cambridge.
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / B.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. химия. - 2020. - Т. 46, № 10. - C. 579-648. DOI: 10.31857/S0132344X20100011.
- A Novel Organobismuth Compound, 1-[(2-di-p-tolylbismuthanophenyl)diazenyl]pyrrolidine, Induces Apoptosis in the Human Acute Promyelocyte Leukemia Cell Line NB4 via Reactive Oxygen Species. / K. Onishi, M. Douke, T. Nakamura et al. // J. Inorg. Biochem. - 2012. - V. 117. - P. 77-84. DOI: 10.1016/j.jinorgbio.2012.09.009.
- Palladium(II) Complexes with Chiral Organoantimony(III) Ligands. Solution Behaviour and Solid State Structures. / D. Copolovici, F. Isaia, H.J. Breunig et al. // RSC Advances. - 2014. - V. 4. -P. 26569-26576. DOI: 10.1039/C4RA03482A.
- Homoleptic Organometallic Compounds of Heavy Pnicogens. Crystal and Molecular Structure of [2-(/ -Pr2NCH2)C6H4]3M (M = Sb, Bi) / I. Chirca, A. Soran, A. Silvestru et al. // Rev. Roum. Chim. -2015. - V.60. - P. 643-650.
- New Chiral Organoantimony(III) Compounds Containing Intramolecular N ^ Sb Interactions -Solution Behaviour and Solid State Structures / D. Copolovici, V.R. Bojan, C.I. Rat et al. // Dalton Trans. - 2010. - V. 39. - P. 6410-6418. DOI: 10.1039/C003318A.
- Synthesis of Sb-Chiral Organoantimony Compounds Having Intramolecular Sb—N Interaction and Their Separation into Optically Pure Compounds via Ortho-Palladated Benzylamine Complexes / S. Okajima, S. Yasuike, N. Kakusawa et al. // J. Organomet. Chem. - 2002. - V. 656. - P. 234-242. DOI: 10.1016/S0022-328X(02)01622-4.
- Structure and Dynamic Behavior of Neutral Hexacoordinate Antimony Compounds with Intramolecular Coordination / H. Yamamichi, S. Matsukawa, S. Kojima et al. // Heteroat. Chem. - 2011. -V. 22. - P. 553-561. DOI: 10.1002/hc.20721.
- Synthesis and Cytostatic Activity of Pt(II) Complexes of Intramolecularly Coordinated Phos-phine and Stibine Ligands / T. Reznicek, L. Dostal, A. Ruzicka et al. // Appl. Organomet. Chem. -2012. - V. 26, № 5. - P. 237-245. DOI: 10.1002/aoc.2845.
- Synthesis, Structural Characterization and Antitumor Activity Of 2-(di-p-Tolylstibano)- and 2-(di-jp-Tolylbismuthano)-JN-p-tolylbenzamide / T. Obata, M. Matsumura, M. Kawahata et al. // J. Organomet. Chem. - 2016. - V. 807. - P. 17-21. DOI: 10.1016/j.jorganchem.2016.02.008.
- Diverse Structures and Remarkable Oxidizing Ability of Triarylbismuthane Oxides. Comparative Study on the Structure and Reactivity of a Series of Triarylpnictogen Oxides / Y. Matano, H. Nomura, T. Hisanaga et al. // Organometallics. - 2004. - V. 23, № 23. - P. 5471-5480. DOI: 10.1021/om0494115.
- Шарутин, В.В. Окисление трис(5-бром-2-метоксифенил)сурьмы трет-бутилгидро-пероксидом. Строение сольвата [(5-Br-2-MeOC6H3)3SbO]2 • C/HgO / В.В. Шарутин, О.К. Шарутина // Журн. неорг. химии. - 2015. - Т. 60, № 12. - С. 1631-1634. DOI: 10.7868/S0044457X15120211.
- Синтез и особенности строения бис(2-нитробензоата) трис(5-бром-2-метоксифенил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Коорд. химия. -2011. - Т. 37, № 10. - С. 782-785.
- 2-Метокси-5-бромфенильные соединения сурьмы. Синтез и строение / В.В. Шарутин, B.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 2011. - Т. 81, № 10. - С. 1649-1652.
- Синтез новых арильных соединений сурьмы(Ш) и висмута(Ш). Кристаллическая и молекулярная структура трис(5-бром-2-метоксифенил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. неорг. химии. - 2011. - Т. 56, № 10. - С. 1640-1643.
- Шарутин, В.В. Трис(2-метокси-5-хлорфенил)сурьма: синтез и реакции окислительного присоединения / В.В. Шарутин, О.К. Шарутина // Журн. общ. химии. - 2020. - Т. 90, № 10. - C. 1577-1582. DOI: 10.31857/S0044460X20100133.
- Hirai, M. Squeezing Fluoride out of Water with a Neutral Bidentate Antimony(V) Lewis Acid / M. Hirai, F.P. Gabbai // Angew. Chem., Int. Ed. - 2015. - V. 54, № 4. - P. 1205-1209. DOI: 10.1002/anie.201410085.
- Matano, Y. Synthesis and First X-ray Structural Analysis of Monomeric Imino-A5-stibanes / Y. Matano, H. Nomura, H. Suzuki // Inorg. Chem. - 2000. - V. 39, № 7. - P. 1340-1341. DOI: 10.1021/ic991120e.
- Matano, Y. Synthesis and Structural Comparison of Triaryl(sulfonylimino)pnictoranes / Y. Matano, H. Nomura, H. Suzuki // Inorg. Chem. - 2002. - V. 41, № 7. - P. 1940-1948. DOI: 10.1021/ic0110575.
- Синтез и особенности строения бис(циклопропанкарбоксилата) трис(5-бром-2-метоксифенил)сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Журн. общ. химии. - 2012. - Т. 82, № 10. - С. 1646-1649.
- Шарутин, В.В. Синтез и особенности строения дикарбоксилатов трис(5-бром,2-метоксифенил)сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорг. химии. -2014. - Т. 59, № 4. - С. 481-486. DOI: 10.7868/S0044457X14040217.
- Синтез и строение моно-, би- и триядерных органилсульфонатных производных триарил-сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Журн. неорг. химии. - 2018. -Т. 63, № 7. - С. 823-830. DOI: 10.1134/S0044457X18070188.
- Новые сурьмаорганические соединения [2,6-(OMe)2C6H3]3SbO и [2,6-(OMe)2C6H3]3Sb(NCO)2 0.5(CH3)2CO. Синтез и строение / И.В. Егорова, В.В. Жидков, И.П. Гринишак и др. // Журн. общ. химии. - 2016. - Т. 86, № 11. - С. 1841-1848.
- Диазид трис(2,6-диметоксифенил)сурьмы. Синтез и строение / И.В. Егорова, В.В. Жидков, И.П. Гринишак и др. // Журн. неорг. химии. - 2018. - Т. 63, № 6. - С. 745-749. DOI: 10.7868/S0044457X18060132.
- Комплексные соединения сурьмы: {[2,6-(OMe)2C6H3]3SbCH2C(O)OEt}2+ [Hg2I6]2- и {[2,6-(OMe)2C6H3]3SbMe}2+ [HgIJ2- • ДМСО. Синтез и строение / И.В. Егорова, В.В. Жидков, И.П. Гринишак и др. // Журн. неорг. химии. - 2019. - Т. 64, № 1. - С. 15-22. DOI: 10.1134/S0044457X19010070.
- Кочешков, К.А. Методы элементоорганической химии. Сурьма, висмут / К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский. - М.: Наука, 1976. - 483 с.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е В. Гриненко, А О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Spectral Database for Organic Compounds, SDBS. Release 2021. National Institute of Advanced Industrial Science and Technology.
- Consistent van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. - 2009. - V. 113, № 19. - P. 5806-5812. DOI: 10.1021/jp8111556.


