Синтез и строение бис(2,5-диметилбензолсульфоната) и бис(дибромфторацетата) трис(3-фторфенил)сурьмы
Автор: Сенчурин Владислав Станиславович, Филимонова Дарья Михайловна, Хроменко Виктория Евгеньевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.13, 2021 года.
Бесплатный доступ
Взаимодействием трис (3-фторфенил)сурьмы с 2,5-диметилбензолсульфоновой и дибромфторуксусной кислотами в присутствии трет -бутилгидропероксида (1:2:1 мольн.) получены бис (2,5-диметилбензолсульфонат) трис (3-фторфенил)сурьмы (1) и бис (дибромфторацетат) трис (3-фторфенил)сурьмы (2). По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо К α-излучение, λ = 0,71073 Å, графитовый монохроматор) кристаллов 1 [C34H30F2O6S2Sb, M 777,45; сингония триклинная, группа симметрии P -1; параметры ячейки: a = 10,634(18), b = 11,38(2), c = 14,31(3) Å; α = 90,51(8) град., β = 90,35(11) град., γ = 112,79(5) град.; V = 1596(5) Å3; размер кристалла 0,5 × 0,48 × 0,17 мм; интервалы индексов отражений -15 ≤ h ≤ 14, -15 ≤ k ≤ 15, -19 ≤ l ≤ 19; всего отражений 30473; независимых отражений 8318; Rint 0,0920; GOOF 1,894; R 1 = 0,1699, wR 2 = 0,4237; остаточная электронная плотность 6,78/-5,48 e/Å3] и 2 [C22H12O4F7SbBr2, M 754,89; сингония триклинная, группа симметрии P -1; параметры ячейки: a = 8,98(3), b = 10,41(2), c = 14,92(3) Å; α = 90,77(7) град., β = 90,73(9) град., γ = 113,95(10) град.; V = 1275(5) Å3; размер кристалла 0,65 × 0,32 × 0,14 мм; интервалы индексов отражений -13 ≤ h ≤ 13, -15 ≤ k ≤ 14, -21 ≤ l ≤ 21; всего отражений 61066; независимых отражений 8511; Rint 0,0863; GOOF 1,983; R1 = 0,1529, wR 2 = 0,4647; остаточная электронная плотность 4,41/-3,48 e/Å3] атомы Sb имеют искаженную тригонально-бипирамидальную координацию. Аксиальные углы OSbO равны 178,2(3)° (1) и 174,0(4)° (2); сумма углов CSbC в экваториальной плоскости 360°. Длины связей Sb-O 2,108(9), 2,111(8) Å (1) и 2,124(12), 2,131(12) Å (2); интервалы изменения длин связей Sb-C составляют 2,090(11)-2,21(3) Å и 2,090(14)-2,096(16) Å. Структурная организация в кристаллах 1 и 2 обусловлена слабыми водородными связями типа O···H 2,53-2,70 Å (1) и 2,57-2,60 Å (2), F···H 2,46-2,59 Å (1) и Br···H 3,02 Å (2). В 2 также наблюдаются короткие контакты C···F между арильными лигандами соседних молекул 3,079 и 3,085 Å. Полные таблицы координат атомов, длин связей и валентных углов для структур 1 и 2 депонированы в Кембриджском банке структурных данных (№ 2055553, 2055764; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Трис(3-фторфенил)сурьма, 2, 5-диметилбензолсульфоновая кислота, дибромфторуксусная кислота, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147235331
IDR: 147235331 | УДК: 546.863+546.865+547.53.024+548.312.5 | DOI: 10.14529/chem210302
Текст научной статьи Синтез и строение бис(2,5-диметилбензолсульфоната) и бис(дибромфторацетата) трис(3-фторфенил)сурьмы
Производные пятивалентной сурьмы общей формулы Ar 3 SbX 2 , где в качестве арильного лиганда чаще выступает фенильный и толильный, а X – остаток разнообразных ОН-кислот, представлены широким рядом соединений [1]. Структурные особенности таких соединений подробно рассмотрены в [2, 3].
Производные сурьмы, содержащие в арильном лиганде атом фтора, изучены в меньшей степени. К настоящему моменту структурно охарактеризован ряд дикарбоксилатов триарилсурьмы, содержащих атомы фтора в арильных лигандах в пара - [4–8] и мета - [9–12] положениях, а также диароксидов трис (4-фторфенил)сурьмы [13, 14] и диоксиматов трис (3-фторфенил)- [15, 16] и трис (4-фторфенил)сурьмы [15]. Также по реакции обмена между бис (пентахлорфеноксидом) трис (3-фторфенил)сурьмы и дихлоридом трис (3-фторфенил)сурьмы получен смешаннолигандный хлоро(пентахлорфеноксид) трис (3-фторфенил)сурьмы [17].
В настоящей работе рассматриваются синтез и особенности строения бис (2,5-диметилбензолсульфоната) и бис (дибромфторацетата) трис (3-фторфенил)сурьмы, полученных по реакции окислительного присоединения из трис (3-фторфенил)сурьмы, соответствующей кислоты и трет -бутилгидропероксида.
Экспериментальная часть
Синтез бис (2,5-диметилбензолсульфоната) трис (З-фторфенил)сурьмы ( 1 ). Смесь 0,217 г (0,53 ммоль) трис (3-фторфенил)сурьмы, 0,198 г (1,06 ммоль) 2,5-диметилбензолсульфоновой кислоты и 0,073 г (0,53 ммоль) 70%-ного водного раствора трет- бутилгидропероксида в 20 мл диэтилового эфира выдерживали в открытом стакане при температуре 20 ° С 24 часа. После испарения растворителя остаток перекристаллизовывали из смеси бензол-гептан (5:1 объемн.). Получили 0,316 г (76 %) неокрашенных кристаллов соединения 1 с т. пл. 178 ° С. ИК-спектр, ( у , см - 1): 3030, 1587, 1577, 1492, 1473, 1390, 1315, 1284, 1157, 1089, 1064, 1031, 898, 866, 829, 518, 432.
По аналогичной методике, из трис (3-фторфенил)сурьмы, дибромфторуксусной кислоты и трет- бутилгидропероксида (1:2:1 мольн.) получен с выходом 81 % бис (дибромфторацетат) трис (З-фторфенил)сурьмы ( 2 ) неокрашенные кристаллы, т. пл. 129,5 °С. ИК-спектр ( v , см - 1): 3062, 1716, 1589, 1577, 1519, 1475, 1350, 1305, 1141, 1089, 1060, 856, 819, 561, 540, 520, 430.
ИК-спектры соединений 1 и 2 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
Рентгеноструктурный анализ ( РСА ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K „ -излучение, X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [18]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [19] и OLEX2 [20]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)). Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
Формула |
C 34 H 30 F 2 O 6 S 2 Sb |
C22H12O4F7SbBr2 |
|
М |
777,45 |
754,89 |
|
Т , К |
293,15 |
293,15 |
|
Сингония |
Триклинная |
Триклинная |
|
Пр. группа |
P –1 |
P –1 |
|
a , Å |
10,634(18) |
8,98(3) |
|
b, Å |
11,38(2) |
10,41(2) |
|
c, Å |
14,31(3) |
14,92(3) |
|
α, град. |
90,51(8) |
90,77(7) |
|
β, град. |
90,35(11) |
90,73(9) |
|
γ, град. |
112,79(5) |
113,95(10) |
|
V , Å3 |
1596(5) |
1275(5) |
|
Z |
2 |
2 |
|
р (выч.), г/см3 |
1,618 |
1,966 |
|
–1 ц , мм |
1,058 |
4,294 |
|
F (000) |
784,0 |
720,0 |
|
Форма кристалла (размер, мм) |
0,5 × 0,48 × 0,17 |
0,65 × 0,32 × 0,14 |
|
Область сбора данных по 0 , град. |
5,7–64,66 |
4,28–65,68 |
|
Интервалы индексов отражений |
–15 ≤ h ≤ 14, –15 ≤ k ≤ 15, –19 ≤ l ≤ 19 |
–13 ≤ h ≤ 13, –15 ≤ k ≤ 14, –21 ≤ l ≤ 22 |
|
Измерено отражений |
30473 |
61066 |
|
Независимых отражений |
8318 |
8511 |
|
R int |
0,0920 |
0,0863 |
|
Переменных уточнения |
419 |
325 |
Химия элементоорганических соединений
Окончание табл. 1
|
Параметр |
1 |
2 |
|
GOOF |
1,894 |
1,983 |
|
R -факторы по F 2 > 2 ^ ( F 2 ) |
R 1 = 0,1699, wR 2 = 0,4237 |
R 1 = 0,1529, wR 2 = 0,4647 |
|
R -факторы по всем отражениям |
R 1 = 0,2325 , wR 2 = 0,4695 |
R 1 = 0,1769, wR 2 = 0,4737 |
|
Остаточная электронная плотность (min/max), e/A3 |
6,78/–5,48 |
4,41/–3,48 |
Таблица 2
Длины связей и валентные углы в 1 и 2
|
Связь d , Å |
Угол to, ° |
||
|
1 |
|||
|
Sb(1)–O(1) |
2,111(8) |
O(1)Sb(1)O(4) |
178,2(3) |
|
Sb(1)–O(4) |
2,108(9) |
C(1)Sb(1)C(11) |
123,0(5) |
|
Sb(1)–C(1) |
2,21(3) |
C(11)Sb(1)C(21) |
114,9(6) |
|
Sb(1)–C(11) |
2,153(13) |
C(1)Sb(1)C(21) |
122,1(5) |
|
Sb(1)–C(21) |
2,090(11) |
O(1)Sb(1)C(1) |
90,7(4) |
|
Sb(1)···O(3) |
3,250(10) |
O(1)Sb(1)C(11) |
93,0(4) |
|
Sb(1)···O(5) |
3,228(11) |
O(1)Sb(1)C(21) |
87,7(4) |
|
S(1)–O(1) |
1,540(8) |
O(4)Sb(1)C(1) |
87,5(4) |
|
S(1)–O(2) |
1,379(14) |
O(4)Sb(1)C(11) |
87,5(4) |
|
S(1)–O(3) |
1,455(9) |
O(4)Sb(1)C(21) |
93,6(4) |
|
S(2)–O(4) |
1,548(10) |
Sb(1)O(1)S(1) |
125,6(4) |
|
S(2)–O(5) |
1,419(11) |
Sb(1)O(4)S(2) |
124,3(5) |
|
S(2)–O(6) |
1,453(13) |
||
|
2 |
|||
|
Sb(1)–O(1) |
2,124(12) |
O(3)Sb(1)O(1) |
174,0(4) |
|
Sb(1)–O(3) |
2,131(12) |
C(1)Sb(1)C(11) |
116,7(5) |
|
Sb(1)–C(1) |
2,090(14) |
C(11)Sb(1)C(21) |
110,9(6) |
|
Sb(1)–C(11) |
2,096(12) |
C(1)Sb(1)C(21) |
132,4(6) |
|
Sb(1)–C(21) |
2,096(16) |
O(1)Sb(1)C(1) |
94,3(6) |
|
Sb(1)···O(2) |
3,186(14) |
O(1)Sb(1)C(11) |
87,6(6) |
|
Sb(1)···O(4) |
3,191(12) |
O(1)Sb(1)C(21) |
90,1(5) |
|
C(7)–O(1) |
1,28(2) |
O(3)Sb(1)C(1) |
88,3(5) |
|
C(7)–O(2) |
1,23(2) |
O(3)Sb(1)C(11) |
86,4(6) |
|
C(9)–O(3) |
1,273(18) |
O(3)Sb(1)C(21) |
92,2(5) |
|
C(9)–O(4) |
1,222(19) |
Sb(1)O(1)C(7) |
118,5(11) |
|
Sb(1)O(3)C(9) |
118,2(8) |
||
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2055553 (1), 2055764 (2); ; .
Обсуждение результатов
Нами изучено взаимодействие трис (3-фторфенил)сурьмы с 2,5-диметилбензолсульфоновой и бромдифторуксусной кислотами в присутствии трет -бутилгидропероксида, а также структурно охарактеризованы продукты реакций. Реакция между указанными веществами протекала по обычной схеме с образованием бис (2,5-диметилбензолсульфоната) трис (3-фторфенил)сурьмы ( 1 ) и бис (дибромфторацетата) трис (3-фторфенил)сурьмы ( 2 ):
( m -FC 6 H 4 ) 3 Sb + 2 HX + t -BuOOH → ( m -FC 6 H 4 ) 3 SbX 2 + t -BuOH + H 2 O
X = OSO 2 C 6 H 3 (CH 3 ) 2 -2,5 ( 1 ), OC(O)CF 2 Br ( 2 ).
По данным РСА, атомы сурьмы в соединениях 1 и 2 имеют малоискаженную тригонально-бипирамидальную координацию с аксиально расположенными сульфонатными и карбоксилатными лигандами (рис. 1 и 2). Аксиальные углы OSbO равны 178,2(3)° ( 1 ), 174,0(4)° ( 2 ). Суммы углов CSbC в экваториальной плоскости составляют 360,02° ( 1 ), 360,2° ( 2 ). Длины аксиальных связей Sb–O равны 2,111(8), 2,108(9) Å ( 1 ) и 2,124(12), 2,131(12) Å ( 2 ) при сумме ковалентных радиусов атомов сурьмы и кислорода 2,05 Å [21]. Диапазон длин связей Sb–C в 1 (2,090(11)– 2,21(3) Å) больше, чем в 2 (2,090(14)–2,096(16) Å) при сумме ковалентных радиусов атомов сурьмы и sp2-гибридного углерода равной 2,12 Å [21].
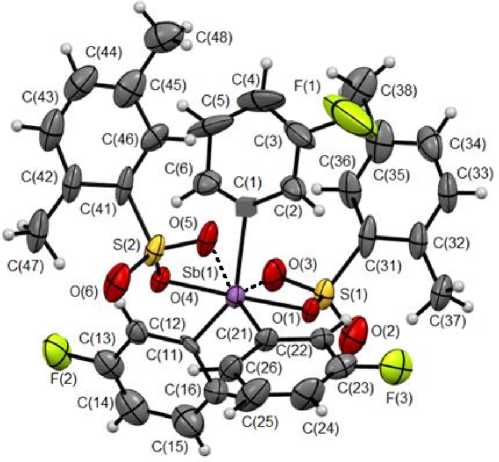
Рис. 1. Общий вид молекулы бис (2,5-диметилбензолсульфоната) трис (3-фторфенил)сурьмы (1)
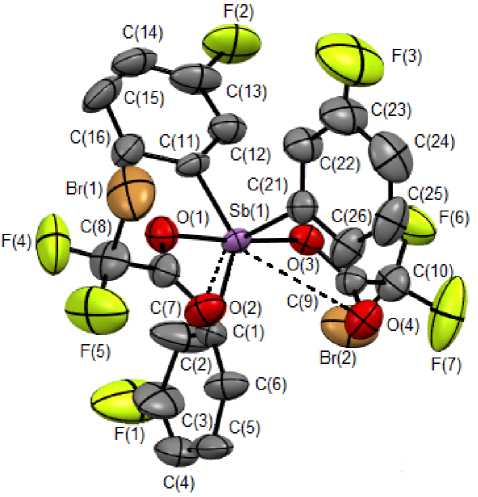
Рис. 2. Общий вид молекулы бис (дибромфторацетата) трис (3-фторфенил)сурьмы (2)
Внутримолекулярные расстояния Sb⋅⋅⋅O(=S) в молекуле соединения 1 (Sb(1)···O(5) 3,228(11) Å и Sb(1)···O(3) 3,250(10) Å) меньше суммы ван-дер-ваальсовых радиусов атомов сурьмы и кислорода (3,58 Å) [22], два других расстояния Sb(1)···O(2) 4,284(14) Å и Sb(1)···O(6) 4,265(16) Å в 1
Химия элементоорганических соединений
существенно превышают эту сумму. В 2 наблюдаются аналогичные внутримолекулярные контакты центрального атома сурьмы с атомами кислорода дибромфторацетатных лигандов Sb⋅⋅⋅O(=C) 3,186(14) Å и 3,191(12) Å, что приводит к увеличению координационного числа атома сурьмы в 1 и 2 до 7 (5+2).
Структурная организация в кристаллах 1 и 2 обусловлена слабыми водородными связями типа O···H 2,53–2,70 Å ( 1 ) и 2,57–2,60 Å ( 2 ), F···H 2,46–2,59 Å ( 1 ) и Br···H 3,02 Å ( 2 ). В 2 также наблюдаются короткие контакты C···F между арильными лигандами соседних молекул 3,079 и 3,085 Å, что меньше суммы ван-дер-ваальсовых радиусов атомов фтора и углерода (3,27 Å [22]) (рис. 3).
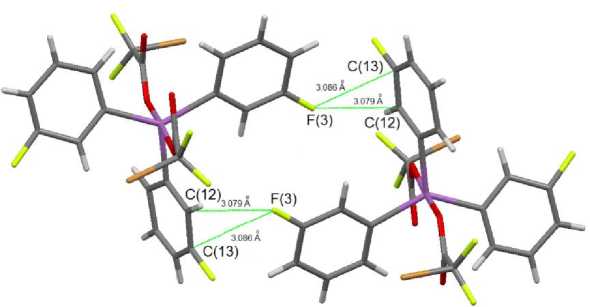
Рис. 3. Межмолекулярные контакты C···F в кристалле соединения 2
Выводы
Установлено, что взаимодействие трис (3-фторфенил)сурьмы с 2,5-диметилбензол-сульфоновой и бромдифторуксусной кислотами в присутствии трет -бутилгидропероксида приводит к образованию бис (2,5-диметилбензолсульфоната) трис (3-фторфенил)сурьмы ( 1 ) и бис (дибромфторацетата) трис (3-фторфенил)сурьмы ( 2 ) соответственно.
Мы благодарим профессора В.В. Шарутина за проведение рентгеноструктурного анализа соединений 1 и 2 .
Список литературы Синтез и строение бис(2,5-диметилбензолсульфоната) и бис(дибромфторацетата) трис(3-фторфенил)сурьмы
- Cambridge Crystallografic Datebase. Release 2020. Cambridge.
- Шарутина, О.К. Молекулярные структуры органических соединений сурьмы (V): моно-графия / О.К. Шарутина, В.В. Шарутин. – Челябинск: Издательский центр ЮУрГУ, 2012. – 395 с.
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / В.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. химия. - 2020. - Т. 46, № 10. – С. 579-648. DOI: 10.31857/S0132344X20100011.
- Шарутин, В.В. Взаимодействие фенилантраниловой кислоты с три(4-фторфенил)сурьмой в присутствии трет-бутилгидропероксида / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Бут-леровские сообщения. – 2014. – Т. 39, № 7. – С. 151–153.
- Шарутин, В.В. Дикарбоксилаты трис(4-фторфенил)сурьмы (4-FC6H4)3Sb[OC(O)R]2, R = С10H15, С3H5-цикло) / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Журн. неорган. химии. - 2016. - Т. 61, № 1. - С. 46-50. DOI: 10.7868/S0044457X16010232.
- Шарутин, В.В. Синтез и строение дикарбоксилатов трис(4-фторфенил)сурьмы / В.В. Шарутин, О.К. Шарутина // Журн. общ. химии. - 2016. - Т. 86, № 8. - С. 1366-1370.
- Шарутин, В.В. Синтез и строение дикарбоксилатов трис(4-фторфенилсурьмы: (4-FC6H4)3Sb[OC(O)R]2, R = CH2I, C6F5 / В.В. Шарутин, О.К. Шарутина // Изв. АН. Серия хим. - 2017. - № 4. - С. 707-710.
- Брегадзе, В.И. Дикарборанилкарбоксилаты трис(4-фторфенил) сурьмы / В.И. Брегадзе, С.А. Глазун, А.Н. Ефремов // Вестник ЮУрГУ. Серия «Химия». – 2019. – Т. 11, № 4. – С. 17–25. DOI: 10.14529/chem190402.
- Four Triarylantimony(V) Carboxylates: Syntheses, Structural Characterization and in Vitro Cyto-toxicities / H. Geng, M. Hong, Yu. Yang et al. // J. Coord. Chem. - 2015. - V. 68. – P. 2938–2952. DOI: 10.1080/00958972.2015.1060322.
- Синтез и строение дикарбоксилатов трис(3-фторфенилсурьмы: (3-FC6H4)3Sb[OC(O)R]2, R = C6H3(NO2)2-3,5, CH2Br, CH2Cl, CH=CHPh) / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Коорд. химия. - 2018. - Т. 44, № 5. – С. 333–339. DOI: 10.1134/S0132344X18050109.
- Синтез и строение дикарбоксилатов трис(3-фторфенилсурьмы: (3-FC6H4)3Sb[OC(O)R]2 (R = СH2Cl, Ph, CH2C6H4NO2-4, С10H15) / В.В. Шарутин, О.К. Шарутина, Р.В. Решетникова и др. // Журн. неорган. химии. - 2017. - Т. 62, № 11. - С. 1457-1463. DOI: 10.7868/S0044457X17110058.
- Синтез и строение производных трис(3-фторфенил)-сурьмы: (3-FC6H4)3Sb(OC6H3Br2-2,4)2, (3-FC6H4)3Sb(OC6Cl5-2,3,4,5,6)2 и (3-FC6H4)3Sb[OC(O)C6H4(NO2-2)]2 / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорган. химии. - 2018. - Т. 63, № 2. - С. 164-169. DOI: 10.7868/S0044457X1802006X.
- Шарутин, В.В. Синтез и строение диароксидов трис(пара-толил)- и трис(4-фторфенил)сурьмы / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Коорд. химия. - 2017. - Т. 43, № 9. – С. 521-528. DOI: 10.7868/S0132344X17090092.
- Шарутин, В.В. Сольваты диароксидов трис(4-фторфенил)сурьмы с бензолом (4-FC6H4)3Sb(OAr)2 · 1/2PhH (Ar = C6H4Cl-4, C6H4Br-4, C6H3Br2-2,4). Синтез и строение / В.В. Ша-рутин, О.К. Шарутина, А.Н. Ефремов // Коорд. химия. - 2016. - Т. 42, № 11. – С. 712-716. DOI: 10.7868/S0132344X16110098.
- Шарутин, В.В. Синтез и строение диоксиматов трис(пара-толил)-, трис(3-фторфенил)- и трис(4-фторфенил)сурьмы / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Коорд. химия. - 2017. - Т. 43, № 8. – С. 496-504. DOI: 10.7868/S0132344X17080072.
- Шарутин, В.В. Синтез и строение диоксиматов триарилсурьмы (3-FC6H4)3Sb[ON=CHC6H4(Br-2)]2 и p-Tol3Sb(ON=CHC4H3O)2·PhH / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Бутлеровские сообщения. – 2013. – Т. 36, № 11. – С. 145–149.
- Ефремов, А.Н. Синтез и строение хлоро-(пентахлорфеноксида) трис(3-фторфенил)сурьмы (3-FC6H4)3SbCl(OC6Cl5) / А.Н. Ефремов // Вестник ЮУрГУ. Серия «Химия». – 2019. – Т. 11, № 1. – С. 34–41. DOI: 10.14529/chem190104.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Display-ing Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. – 2009. – V. 42. – P. 339–341. DOI: 10.1107/S0021889808042726.
- Covalent Radii Revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. – 2008. – Iss. 21. – P. 2832–2838. DOI: 10.1039/B801115J.
- Consistent Van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. – 2009. – V. 113, iss. 19. – P. 5806–5812. DOI: 10.1021/jp8111556.


