Синтез и строение бис[3,4-дифторбензоата] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OC(O)C6H3(F2-3,4)]2 и бис[бензолсульфоната] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OSO2C6H5]2
Автор: Шарутин В.В., Мородецких М.О.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Бис[3,4-дифторбензоат] трис(2-метоксифенил)сурьмы (1) и бис[бензолсульфонат] трис(2-метоксифенил)сурьмы (2) получены по реакции окислительного присоединения из триарилсурьмы и 3,4-дифторбензойной/бензолсульфоновой кислоты в присутствии гидропероксида третичного бутила в эфире. Строение 1 и 2 установлено методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). Кристаллы 1 [C35H27O7F4Sb, M 757,32; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,219(4), b = 9,507(6), c = 20,240(11) Å; a = 99,43(3)°, β = 95,756(16)°, g = 107,90(3)°; V = 1643,6(16) Å3; Z = 2; rвыч = 1,530 г/см3; 2q 6,68-54,98 град.; всего отражений 31858; независимых отражений 7153; число уточняемых параметров 427; Rint = 0,0429; GOOF 1,051; R1 = 0,0265, wR2 = 0,0551; остаточная электронная плотность (max/min); 0,30/-0,44 e/Å3], 2 [C33H31O9S2Sb, M 757,46; сингония моноклинная, группа симметрии С2/с; параметры ячейки: a = 21,157(9), b = 10,363(4), c = 18,285(7) Å; β = 126,590(13) град., V = 3219(2) Å3, Z = 1; rвыч = 1,563 г/см3; 2q 6,012-54,234 град.; всего отражений 32454; независимых отражений 3541; число уточняемых параметров 231; Rint = 0,0283; GOOF 1,161; R1 = 0,0283, wR2 = 0,0659; остаточная электронная плотность (max/min); 0,74/-0,83 e/Å3] состоят из тригонально-бипирамидальных молекул с электроотрицательными лигандами в аксиальных положениях. Длины связей Sb-C варьируют в интервале 2,093(2)-2,125(3) Å, валентные углы OSbO принимают значения 176,63(6) и 174,52(10)° соответственно. Расстояния Sb-О в 1 (2,1106(17) и 2,1149(17) Å) короче, чем в 2 (2,128(2) и 2,128(2) Å). Внутримолекулярные контакты Sb∙∙∙O в 1 (3,162(2) и 3,257(2) Å) значительно меньше, чем в 2 (3,617(2) и 3,617(2) Å), и не превышают сумму их ван-дер-ваальсовых радиусов (3,7 Å). Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2123247 (1), № 2116583 (2), deposit@ccdc.cam.ac.uk; http://www.ccdc. cam.ac.uk).
Синтез, бис(3, 4-дифторбензоат) трис(2-метоксифенил)сурьмы, бис(бензолсульфонат) трис(2-метоксифенил)сурьмы, особенности строения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147244638
IDR: 147244638 | УДК: 546.865+547.53.024+548.312.5 | DOI: 10.14529/chem240208
Текст научной статьи Синтез и строение бис[3,4-дифторбензоата] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OC(O)C6H3(F2-3,4)]2 и бис[бензолсульфоната] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OSO2C6H5]2
Аннотация. Бис[3,4-дифторбензоат] трис(2-метоксифенил)сурьмы (1) и бис[бензолсульфонат] трис(2-метоксифенил)сурьмы (2) получены по реакции окислительного присоединения из триа-рилсурьмы и 3,4-дифторбензойной/бензолсульфоновой кислоты в присутствии гидропероксида третичного бутила в эфире. Строение 1 и 2 установлено методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). Кристаллы 1 [C35H27O7F4Sb, M 757,32; сингония триклинная, группа симметрии P -1; параметры ячейки: a = 9,219(4), b = 9,507(6), c = 20,240(11) А; а = 99,43(3)°, в = 95,756(16)°, Y = 107,90(3)°; V = 1643,6(16) А3; Z = 2; рвыч = 1,530 г/см3; 20 6,68-54,98 град.; всего отражений 31858; независимых отражений 7153; число уточняемых параметров 427; Rint = 0,0429; GOOF 1,051; R1 = 0,0265, wR2 = 0,0551; остаточная электронная плотность (max/min); 0,30/-0,44 e/А3], 2 [C33H31O9S2Sb, M 757,46; сингония моноклинная, группа симметрии С2/с; параметры ячейки: a = 21,157(9), b = 10,363(4), c = 18,285(7) Å; β = 126,590(13) град., V = 3219(2) А3, Z = 1; рвыч = 1,563 г/см3; 20 6,012-54,234 град.; всего отражений 32454; независимых отражений 3541; число уточняемых параметров 231; Rint = 0,0283; GOOF 1,161; R1 = 0,0283, wR2 = 0,0659; остаточная электронная плотность (max/min); 0,74/-0,83 e/А3] состоят из триго-нально-бипирамидальных молекул с электроотрицательными лигандами в аксиальных положениях. Длины связей Sb-C варьируют в интервале 2,093(2)-2,125(3) Å, валентные углы OSbO принимают значения 176,63(6) и 174,52(10)° соответственно. Расстояния Sb-О в 1 (2,1106(17) и 2,1149(17) Å) короче, чем в 2 (2,128(2) и 2,128(2) Å). Внутримолекулярные контакты Sb∙∙∙O в 1 (3,162(2) и 3,257(2) Å) значительно меньше, чем в 2 (3,617(2) и 3,617(2) Å), и не превышают сумму их ван-дер-ваальсовых радиусов (3,7 Å). Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2123247 (1), № 2116583 (2), ; .
Abstract. Tris(2-methoxyphenyl)antimony bis[3,4-difluorobenzoate] (1) and tris(2-methoxyphenyl)antimony bis[benzenesulfonate] (2) were obtained by oxidative addition reaction from triarylantimony and 3,4-difluorobenzoic/benzenesulfonic acid in the presence of tertiary butyl hydroperoxide in ether. The structure of 1 and 2 was established with the use of IR spectroscopy and X-ray diffraction analysis (XRD). Crystals 1 [C35H27O7F4Sb, M 757.32; triclinic syngony, symmetry group P–1; cell parameters: a = 9.219(4), b = 9.507(6), c = 20.240(11) A; a = 99.43(3)°, в = 95.756(16)°, у = 107.90(3)°; V = 1643.6(16) A3; Z = 2; pcalc = 1.530 g/cm3; 20 6.68-54.98 degrees; total reflections 31858; independent reflections 7153; number of specified parameters 427; Rint = 0.0429; GOOF 1.051; R1 = 0.0265, wR2 = 0.0551; residual electron density (max/min); 0.30/-0.44 e/A3], 2 [C33H31O9S2Sb, M 757.46; monoclinic system, symmetry group C2/c; cell parameters: a = 21.157(9), b = 10.363(4), c = 18.285(7) A; в = 126.590(13) deg., V = 3219(2) A3, Z = 1; Pcalk = 1.563 g/cm3; 20 6.012-54.234 degrees; total reflections 32454; independent reflections 3541; number of specified parameters 231; Rint = 0.0283; GOOF 1.161; R1 = 0.0283, wR2 = 0.0659; residual electron density (max/min); 0.74/-0.83 e/A3] consist of trigonal bipyramidal molecules with electronegative ligands in axial positions. The Sb–C bond lengths vary in the range 2.093(2)-2.125(3) Å, The OSbO bond angles take values 176.63(6)° and 174.52(10)°, respectively. The Sb–O distances in 1 (2.1106(17) and 2.1149(17) Å) are shorter than in 2 (2.128(2) and 2.128(2) Å). Intramolecular Sb∙∙∙O contacts in 1 (3.162(2) and 3.257(2) Å) are significantly smaller than in 2 (3.617(2) and 3.617(2) Å) and do not exceed the sum of their van der Waals radii (3.7 Å). Complete tables of atomic coordinates, bond lengths and bond angles for structures have been deposited in the Cambridge Structural Data Bank (No. 2123247 (1), No. 2116583 (2), ; .
Интерес к синтезу новых соединений сурьмы во многом определяется расширяющимся потенциалом различных областей применения в практической деятельности: в фармацевтической промышленности, в качестве биоцидов, фунгицидов, а также реагентов в тонком органическом синтезе и компонентов каталитических систем при полимеризации, антиоксидантов и др. [1].
Известно, что взаимодействие три- пара -толилсурьмы с трифторуксусной, трихлоруксусной, йодуксусной, толуолсульфоновой кислотами (НХ) в растворе толуола в присутствии или в отсутствие кислорода воздуха приводит к образованию дикарбоксилатов триарилсурьмы по двум конкурирующим между собой направлениям с образованием производных пятивалентной сурьмы общей формулы p-Tol 3 SbХ 2 (Х – остаток карбоновой кислоты) [2].
p-Tol3Sb + 2HX ----► p-Tol3SbX2
-H2
p-Tol3Sb + 2HX + 1/2O2----► p-Tol3SbX2
-H2O
В основе другого эффективного способа синтеза соединений пятивалентной сурьмы лежит другая реакция окислительного присоединения, когда из триарильных соединений сурьмы, кислоты НХ и пероксида получают арильные производные пятивалентной сурьмы Ar3SbX2. Указанная реакция впервые была осуществлена на примере синтеза диацетата трифенилсурьмы из трифенилсурьмы, уксусной кислоты и пероксида водорода [3]. Именно по этой схеме были синтезированы бис-(1-адамантанкарбоксилат) трифенилсурьмы [4], бис(бромацетат) трис(2-метокси-5-бромфенил)сурьмы [5], бис(2-нитробензоат) трифенилсурьмы [6], бис(1-адамантанкарбоксилат) три-м-толилсурьмы [7], бис(циклопропанкарбоксилат) трис(5-бром-2-метоксифенил)сурьмы [8], дибензоат трис(4-N,N-диметиламинофенил)сурьмы [9], бис(2-метилбензоат) трис(4-N,N-диметиламинофенил)сурьмы [10], бис(4-метилбензоат) трис(4-N,N-диметиламинофенил)сурьмы [11], бис(2-нитробензоат) трис(5-бром-2-метоксифенил)сурьмы [12], бис(хлорацетат) трис-(5-бром-2-метоксифенил)сурьмы, бис-(бромацетат) трис-(5-бром-2-метоксифенил)сурьмы и бис(иодацетат) трис(5-бром-2-метоксифенил)сурьмы [13], бис(4-нитрофенилацетат) трис(5-бром-2-метоксифенил)сурьмы, бис(2-метоксибензоат) трис(5-бром-2-метоксифенил)сурьмы и бис(фенилпропиолат) трис(5-бром-2-метоксифенил)сурьмы [14], бис(4-оксибензолсульфонат) трифенилсурьмы [15]. Серия α-гидроксикарбоксилатных комплексов трифенилсурьмы была получена по реакции окислительного присоединения из трифенилсурьмы, карбоновой кислоты и гидроперекиси третичного бутила [16].
n RR'C(OH)-COOH
Ph3Sb + 2 t-BuOOH----*- Ph3Sb(OH)2 --------► Ph3Sb(RR'C(OH)-COO)n
-2t-BuOH -nH7O r = r-= h, n = 1
R = Ph, R' = H, П = 1
R = Ph, R' = H, n = 2
R = R' = Ph, n = 2
Отметим, что, несмотря на наличие двух карбоксильных групп в орто- фталевой кислоте, ее взаимодействие с трифенилсурьмой в присутствии пероксида водорода протекает по классической схеме реакции окислительного присоединения [17]. Особенностью молекулярной структуры дифталата трифенилсурьмы является отсутствие внутримолекулярной водородной связи, характерной для орто- фталевой кислоты. Из дихлорида трифенилсурьмы и карбоксилата серебра в тетрагидрофуране синтезирован бис (2-оксибензоат) трифенилсурьмы с выходом 73 % [18].
По реакции окислительного присоединения из триарилсурьмы и карбоновой кислоты с более высокими выходами образуются бис (пропиолат) трифенилсурьмы [19], бис (иодацетат) трис (4-фторфенил)сурьмы и бис (пентафторбензоат) трис (4-фторфенил)сурьмы [20], бис (1-адамантанкарбоксилат) трис (4-фторфенил)сурьмы и бис (циклопропанкарбоксилат) трис (4-фторфенил)сурьмы [21], бис (хлорацетат) трис (4-фторфенил)сурьмы, бис (4-нитрофенил-ацетат) трис (4-фторфенил)сурьмы и дибензоат трис (4-фторфенил)сурьмы [22], дикарбоксилаты трис (3-фторфенил)сурьмы [23, 24], диакрилаты трифенилсурьмы [25, 26], дибензоат три( мета -толил)сурьмы [27], бис (2-нитробензоат)три(3-фторфенил)сурьмы [28], бис (фенилпропиолат) трифенилсурьмы [29], бис (4-оксибензоат) трифенилсурьмы [30], бис (3-фторфенилацетат), бис (пентафторбензоат) и бис (2,3-дифторбензоат) трис (3-фторфенил)сурьмы [31].
При взаимодействии эквимолярных количеств триарилсурьмы, кислоты НХ и пероксида водорода в эфире образуются соединения сурьмы мостикового типа (Ar 3 SbX) 2 O, что, например, наблюдается в реакциях трифенилсурьмы с салициловой кислотой, когда с выходом 40 % образуется мостиковое соединение сурьмы, обладающее противоопухолевой активностью [32]. В аналогичных условиях из трифенилсурьмы и пропиоловой кислоты в присутствии пероксида водорода образуется μ 2 -оксо- бис [(пропиолато)трифенилсурьма] [Ph 3 SbOC(O)C≡СН] 2 O.
Реакционная способность триарилсурьмы в реакциях окислительного присоединения с аренсульфоновыми кислотами во многом сравнима с аналогичными реакциями карбоновых кислот. Так, взаимодействием три(мета-толил)сурьмы с бензолсульфоновой кислотой в присутствии гидропероксида третичного бутила в эфире синтезирован бис(бензолсульфонат) три(мета-толил)сурьмы [33]. В аналогичных условиях реагирует триарилсурьма с аренсульфоновыми ки- слотами [34-37], однако взаимодействие трис(3-метилфенил)сурьмы с трифторметансульфоно-вой кислотой в присутствии трет-бутилгидропероксида в эфире приводит к образованию трех-ядерного комплекса нона(3-метилфенил)тристибоксан-1,5-диил-бис(трифторметансульфоната), выделенного после перекристаллизации из cмеси бензол-октан в виде сольвата с бензолом CF3OSO2Sb(3-MeC6H4)3OSb(3-MeC6H4)3OSb(3-MeC6H4)3OSO2CF3 ⋅ PhH [38].
Соединения сурьмы общей формулы Ar 3 SbX 2 (X – электроотрицательная группа), содержащие в арильных лигандах при атоме сурьмы различные функциональные группы [8, 14, 39 - 46], изучены в гораздо меньшей степени, чем соответствующие фенильные производные, однако именно некоторые их представители проявляют противоопухолевую активность [32] и анти-лейшманиозные свойства [46], поэтому исследование синтеза и свойств подобных соединений представляется важной задачей.
В настоящей работе изучены синтез и особенности строения бис (3,4-дифторбензоата) трис [(2-метоксифенил]сурьмы ( 1 ) и бис [бензолсульфоната] трис (2-метоксифенил)сурьмы ( 2 ).
Экспериментальная часть
Соединения 1 и 2 синтезировали по методике, описанной в [1], из трис [(2-метоксифенил]сурьмы и 3,4-дифторбензолсульфоновой/бензолсульфоновой кислоты в присутствии трет бутилгидропероксида в растворе эфира (мольное соотношение исходных реагентов 1:2:1). После удаления растворителя и перекристаллизации целевого продукта из смеси бензол-октан (1:2 объем.) получали с выходом 86 % бесцветные кристаллы 1 (т. пл. 199 °С), которые анализировали методами элементного анализа, РСА и ИК-спектроскопии. ИК-спектр, ν , см–1: 3065, 3022, 3001, 2841, 1582, 1477, 1433, 1302, 1285, 1254, 1163, 1097, 1055, 1015, 974, 943, 924, 795, 750, 727, 692, 606, 579, 555, 482, 440. Найдено, %: С 55,24; Н 3,64. C 35 H 27 O 7 F 4 Sb. Вычислено, %: С 55,46; Н 3,56.
Аналогично получали 2 (79 %, т. пл. 212 °С). ИК-спектр, ν , см–1: 3067, 2941, 2839, 1582, 1477, 1431, 1283, 1252, 1157, 1096, 1055, 1016, 914, 793, 752, 725, 683, 605, 579, 554, 480, 440. Найдено, %: С 52,49; Н 4,21. C 33 H 31 O 9 S 2 Sb. Вычислено, %: С 52,98; Н 4,15.
ИК-спектры соединений записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S; образец готовили таблетированием с KBr (область поглощения 4000 - 400 см - 1).
Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter. Элементный анализ проводился на анализаторе Euro EA3028-НТ.
Рентгеноструктурный анализ проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [47]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [48] и OLEX2 [49]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в таблице.
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
Формула |
C 35 H 27 O 7 F 4 Sb |
C 32 H 31 O 9 S 2 Sb |
|
М |
757,32 |
757,46 |
|
Сингония |
Триклинная |
Моноклинная |
|
Пр. группа |
P– 1 |
C 2/ c |
|
a , Å |
9,219(4) |
21,157(9) |
|
b, Å |
9,507(6) |
10,363(4) |
|
c, Å |
20,240(11) |
18,285(7) |
|
α, град. |
99,43(3) |
90 |
|
β, град. |
95,756(16) |
126,590(13) |
|
γ, град. |
107,90(3) |
90 |
|
V , Å3 |
1643,6(16) |
3219(2) |
|
Z |
2 |
1 |
|
ρ (выч.), г/см3 |
1,530 |
1,563 |
|
–1 µ , мм |
0,909 |
1,041 |
|
F (000) |
760,0 |
1536,0 |
Окончание таблицы
|
Параметр |
1 |
2 |
|
Размер кристалла (мм) |
0,44 × 0,27 × 0,07 |
0,5 × 0,35 × 0.27 |
|
Область сбора данных по 2 0 , град. |
6,68–54,98 |
6,012–54,234 |
|
Интервалы индексов отражений |
–11 ≤ h ≤ 11, –12 ≤ k ≤ 12, –25 ≤ l ≤ 25 |
–27 ≤ h ≤ 27, –13 ≤ k ≤ 13, –23 ≤ l ≤ 23 |
|
Измерено отражений |
31858 |
32454 |
|
Независимых отражений |
7153 |
3541 |
|
Переменных уточнения |
427 |
231 |
|
GOOF |
1,051 |
1,161 |
|
R -факторы по F 2 > 2 а ( F 2) |
R 1 = 0,0265, wR 2 = 0,0551 |
R 1 = 0,0283, wR 2 = 0,0659 |
|
R -факторы по всем отражениям |
R 1 = 0,0356, wR 2 = 0,0580 |
R 1 = 0,0319, wR 2 = 0,0691 |
|
Остаточная электронная плотность (min/max), e /Å3 |
0,30/–0,44 |
0,74/–0,83 |
Полные таблицы координат атомов, длин связей и валентных углов соединения 1 и 2 депонированы в Кембриджском банке структурных данных (CCDC 2123247 и 2116583; ; .
Обсуждение результатов
Соединение 1 было нами получено по реакции окислительного присоединения из 2,3-дифторбензойной кислоты и трис (2-метоксифенил)сурьмы в присутствии гидропероксида третичного бутила (1:2:1 мольн.) и кристаллизовалось из смеси бензол-октан.
(2-MeOC 6 H 4 ) 3 Sb + 2 HOC(O)C 6 H 3 F 2 -3,4 + t -BuOOH ^ (2-MeOC 6 H 4 ) 3 Sb[OC(O)C 6 H 3 F 2 -3,4] 2 1
По аналогичной схеме синтезировали бис [бензолсульфонат] трис (2-метоксифенил)сурьмы [(2-MeO)C 6 H 4 ] 3 Sb[OSO 2 Ph] 2 ( 2 ).
(2-MeOC 6 H 4 ) 3 Sb + 2 HOSO 2 Ph + t -BuOOH ^ (2-MeOC 6 H 4 ) 3 Sb[OSO 2 Ph] 2
В ИК-спектре комплекса 1 наблюдаются характерные для данного типа соединений полосы [50, 51]. Так, при 440 см–1 наблюдается полоса средней интенсивности, относящаяся к колебаниям связи Sb–C. Валентным колебаниям карбонильных групп соответствует интенсивная полоса при 1582 см–1. Слабой интенсивностью обладают полосы, соответствующие скелетным колебаниям ароматических колец при 727, 1433 см-1 и связей C Ar -Н при 3065 см-1. Колебаниям v (C Ar -О–Ме) в ИК-спектре 1 соответствуют интенсивные полосы при 1015, 1055, 1254 и 1285 см–1. Две интенсивных полосы при 1098 и 1254 см-1 соответствуют валентным колебаниям C - F в производных, содержащих два атома фтора в ароматическом кольце. ИК-спектр соединения 2 содержит практически те же полосы, кроме полос валентных колебаний карбонильных групп и колебаний C - F. Однако в области валентных колебаний 80 2 -групп наблюдаются интенсивные полосы при 1096, 1157 и 1283 см–1.
Молекула бис (3,4-дифторбензоата) трис [(2-метокси)фенил]сурьмы имеет координацию искаженной тригональной бипирамиды (рис. 1).
Аксиальный угол OSbO составляет 176,63 ° . Расстояния O - Sb 2,1106(17) и 2,1149(17) А незначительно превышают сумму соответствующих ковалентных радиусов (2,05 Å) [52]. Арильные лиганды находятся в пропеллерной конформации, разворачиваясь относительно экваториальной плоскости в силу стерических причин. Сумма углов CSbC в экваториальной плоскости молекул составляет 359,86 ° . Длины связей C-Sb (2,100(2) - 2,114(2) А) отличаются незначительно. Карбоксилатные заместители в 1 не имеют обычную для дикарбоксилатов триарилсурьмы относительно фрагмента Ar 3 Sb цис -ориентацию, а со стороны двух наибольших экваториальных углов СSbC (128,14 ° и 117,49 ° ) наблюдаются контакты Sb --- O(=C) (3,162 и 3,257 А), что меньше суммы ван-дер-ваальсовых радиусов атомов-партнеров (3,7 Å [52]). Наличие дополнительных внутримолекулярных взаимодействий Sb --- O(=C) в 1 подтверждается выравниванием длин связей С-О (1,307, 1,311 Å) и С=О (1,218, 1,218 Å) в карбоксильной группе.
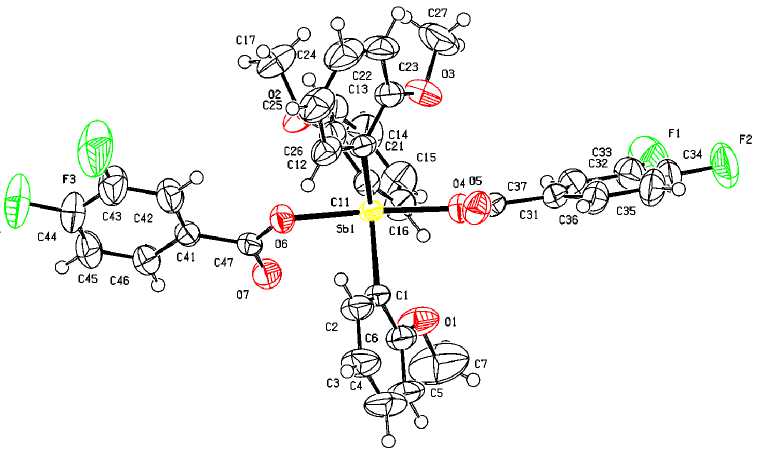
Рис. 1. Строение комплекса [(2-MeO)C 6 H 3 ] 3 Sb[OC(O)C 6 H 3 (F 2 -3,4)] 2 (1)
По данным РСА, атом сурьмы в соединении 2 имеет искаженную тригонально-бипирамидальную координацию с аксиально расположенными бензолсульфонатными лигандами рис. 2). Молекула обладает симметрией C2v и имеет ось симметрии 2-го порядка, проходящую через атом металла и атом углерода С(11) одного из арильных лигандов.
Аксиальный угол OSbO равен 174,52(10) ° . Сумма углов CSbC в экваториальной плоскости составляет 360 ° . Длины экваториальных связей Sb-C изменяются в интервале 2,093(2)-2,125(3) А и имеют близкие значения к суммам ковалентных радиусов атомов сурьмы и sp2-гибридного углерода 2,12 Å [52]. В молекулах 2 присутствуют слабые внутримолекулярные контакты Sb⋅⋅⋅O=S (два по 3,617(3) Å), которые по значению приближаются к сумме ван-дер-ваальсовых радиусов атомов сурьмы и кислорода (3,8 Å) [52].
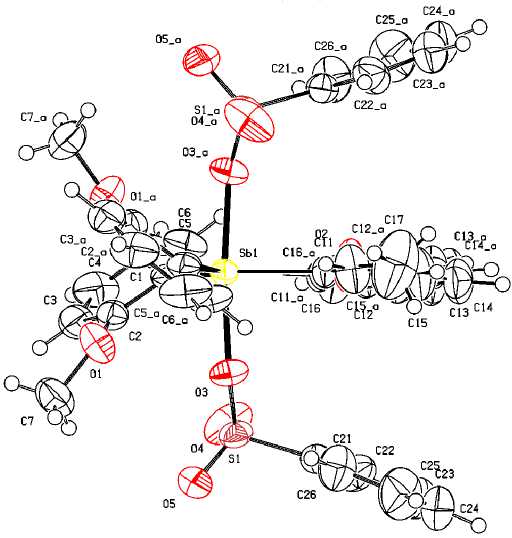
Рис. 2. Строение комплекса [(2-MeO)C 6 H 3 ] 3 Sb[OSO 2 Ph] 2 (2)
Заключение
Таким образом, по реакции окислительного присоединения из трис [(2-метоксифенил]сурьмы, 3,4-дифторбензойной/бензолсульфоновой кислот и трет -бутилгидропероксида при мольном соотношении 1:2:1 в эфире получены бис (3,4-дифторбензоат) трис [(2-метокси)фенил]сурьмы и бис (бензолсульфонат) трис [(2-метокси)фенил]сурьмы, строение которых после перекристаллизации из смеси бензол-октан доказано методами ИК-спектроскопии и рентгеноструктурного анализа. Атомы сурьмы в молекулах 1 , 2 имеют искаженную тригонально-бипирамидальную конфигурацию с атомами кислорода в аксиальных положениях.
Список литературы Синтез и строение бис[3,4-дифторбензоата] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OC(O)C6H3(F2-3,4)]2 и бис[бензолсульфоната] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OSO2C6H5]2
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Kazakov M.V. // Russ. J. Gen. Chem. 2012. V. 82, No 1. P. 95. DOI: 10.1134/S1070363212010161.
- Thepe T.C., Garascia R.J., Selvoski M.A., Patel A.N. // Ohio J. Sci. 1977. V. 77. P. 134. http://hdl.handle.net/1811/22448.
- Sharutin V.V., Sharutina O.K., Pakusina A.P. et al. // Russ. J. Inorg. Chem. 2008. V. 53, No 8. P. 1242. DOI: 10.1134/S0036023608080160.
- Artem'eva E.V., Sharutin V.V., Sharutina O.K., Bulanova A.V. // Russ. J. Inorg. Chem. 2020. V. 65. No 1. P. 22. DOI: 10.1134/S00360236200100.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. // Бутлеровские сообщения. 2010. Т. 22, № 12. C. 7. EDN: NCYMUX
- Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Inorg. Chem. 2011. V. 56, No 7. P. 1060. DOI: 10.1134/S0036023611070242.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. Chagarova O.V. // Russ. J. Gen. Chem. 2012. V. 82, No 10. P. 1665. DOI: 10.1134/S1070363212100064.
- Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2008. V. 78, No 12. P. 2344. DOI: 10.1134/S1070363208120098.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Chagarova O.V. // Russ. J. Inorg. Chem. 2011. V. 56, No 7. P. 1064. DOI: 1064 10.1134/S0036023611070254.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Chagarova O.V. // Russ. J. Gen. Chem. 2011. V. 81, No 11. P. 2242 DOI: 10.1134/S1070363211110053.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., et al. // Russ. J. Coord. Chem. 2011. V. 37, No 10. P. 781. DOI: 10.1134/S1070328411090089.
- Sharutin V.V., Sharutina O.K., Tolstoguzov D.S. // Russ. J. Gen. Chem. 2014. V. 84, No 9. P. 1754. DOI: 10.1134/S1070363214090199.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2014. V. 59, No 4. P. 326. DOI: 10.1134/S0036023614040202.
- Sharutin V.V., Egorova I.V., Pakusina A.P. et al. // Russ. J. Coord. Chem. 2007. V. 33, No 3. P. 168. DOI: 10.1134/S1070328407030037.
- Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // Dalton Trans. 2018. V. 47. P. 971. DOI: 10.1039/C7DT04171C.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2014. V. 59, No 9. P. 947. DOI: 10.1134/S0036023614090162.
- Barucki H., Coles S.J., Costello J.F. et al. // J. Chem. Soc., Dalton Trans., 2000. P. 2319. DOI: 10.1039/B002337J.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Coord. Chem. 2014. V. 40, No 2. P. 109. DOI: 10.1134/S1070328414020109.
- Sharutin V.V., Sharutina O.K. // Russ. Chem. Bull. 2017. V. 66, No 4. P. 707. DOI: 10.1007/s11172-017-1796-6.
- Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2016. V. 61, No. 1. P. 43. DOI: 10.1134/S003602361601023X.
- Sharutin V.V., Sharutina O.K. // Russ. J. Gen. Chem. 2016. V. 86. No 8. P. 1902. DOI: 10.1134/S107036321608020X.
- Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Coord. Chem. 2018. V. 44, No 10. P. 635. DOI: 10.1134/S107032841810010X.
- Sharutin V.V., Sharutina O.K., Reshetnikova R.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62, No 11. P. 1450. DOI: 10.1134/S003602361711016X.
- Гущин А.В., Прыткова Л.К., Шашкин Д.В. и др. // Вестник Нижегородского университета им. Н.И. Лобачевского. 2010. № 1. С. 95.
- Fukin G.K., Samsonov M.A., Arapova A.V. et al. // J. Solid State Chem. 2017. V. 254. P. 32. DOI: 10.1016/j.jssc.2017.06.030.
- Sharutin V.V., Sharutina O.K., Kazakov M.V. // Russ. J. Inorg. Chem. 2014. V. 59. No 10. P. 1115. DOI: 10.1134/S0036023614100167.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. и др. // Журн. неорган. химии. 2018. Т. 63, № 2. С. 164. DOI: 10.7868/S0044457X1802006X.
- Шарутин В.В., Шарутина О.К., Котляров А.Р. // Журн. неорган. химии 2015. Т. 60, № 4. С. 525. DOI: 10.7868/S0044457X15040236.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии 2014. Т. 59, № 9. С. 1182. DOI: 10.7868/S0044457X14090189.
- Шарутин В.В., Шарутина О.К., Жеребцов Д.А. и др. // Коорд. химия. 2022. Т. 48, № 4. С. 223. DOI: 10.31857/S0132344X2204003X.
- Polychronis N.M., Banti C.N., Raptopoulou C.P. et al. // Inorg. Chim. Acta. 2019. V. 489. P. 39. DOI: 10.1016/j.ica.2019.02.004.
- Sharutin V.V., Sharutina O.K., Senchurin V.S. // Bulletin of the South Ural State University. Ser. Chemistry. 2015. V. 7, No. 4. P. 93. DOI: 10.14529/chem150412.
- Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Коорд. химия. 2004. Т. 30, № 1. С. 15. EDN: OVZSPL.
- Шарутин В.В., Шарутина О.К., Платонова Т.П. и др. // Журн. общ. химии. 2003. Т. 73, вып. 3. С. 380. EDN: OYTHWD.
- Шарутин В.В., Шарутина О.К., Панова Л.П., Бельский В.К. // Журн. общ. химии. 1997. Т. 67, вып. 9. С. 1531.
- Шарутин В.В., Шарутина О.К., Платонова Т.П. и др. // Журн. общ. химии. 2000. Т. 70, вып. 10. С. 1668.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. неорган. химии. 2018. Т. 63, № 7. С. 823. DOI: 10.1134/S0044457X18070188.
- Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2021. Т. 66, № 3. С. 358. DOI: 10.31857/S0044457X21030156
- Sharutina O.K., Sharutin V.V., Artem'eva E.V. et al. // J. Fluor. Chem. 2019. V. 228. P. 109393. DOI: 10.1016/j.jfluchem.2019.109393.
- Шарутин В.В., Шарутина О.К., Хайбуллина O.A. // Журн. общ. химии. 2021. Т. 91, № 9. С. 1446. DOI: 10.31857/S0044460X2109016X.
- Артемьева Е.В., Шарутина О.К., Шарутинa В.В. и др. // Журн. неорган. химии 2020. Т. 65, № 1. С. 25. DOI: 10.31857/S0044457X20010031.
- Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2011. V. 37, No 10. С. 781. DOI: 10.1134/S1070328411090089.
- Артемьева Е.В., Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2019. Т. 64, № 11. С. 1184. DOI: 10.1134/S0044457X19110035.
- Шарутин В.В., Шарутина О.К., Толстогузов Д.С. // Журн. общ. химии. 2014. Т. 84, № 9. С. 1516. EDN: SKCTUP.
- Artem'eva E.V., Efremov A.N., Sharutina O.K. et al. // Polyhedron. 2022. V. 213. P. 115627. DOI: 10.1016/j.poly.2021.115627.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.43.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин А.О. и др. Инфракрасная спектроскопия органических и природных соединений: учебное пособие. СПб.: СПбГЛТА, 2007. 54 с.
- Бацанов С.С. Атомные радиусы элементов. // Журн. неорг. химии. 1991. Т. 36, № 12. С. 3015.

![Синтез и строение бис[3,4-дифторбензоата] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OC(O)C6H3(F2-3,4)]2 и бис[бензолсульфоната] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OSO2C6H5]2 Синтез и строение бис[3,4-дифторбензоата] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OC(O)C6H3(F2-3,4)]2 и бис[бензолсульфоната] трис(2-метоксифенил)сурьмы [(2-MeO)C6H4]3Sb[OSO2C6H5]2](/file/cover/147244638/sintez-i-stroenie-bis-34-diftorbenzoata-tris-2-metoksifenil-surmy-2-meo-c6h4-3sb.png)
