Синтез и строение бис(бут-3-еноата) трифенилвисмута
Автор: Дрожилкин Павел Дмитриевич, Малеева Алевтина Игоревна, Андреев Павел Валерьевич, Гущин Алексей Владимирович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.13, 2021 года.
Бесплатный доступ
В результате взаимодействия трифенилвисмута и винилуксусной кислоты с трет-бутилгидропероксидом при комнатной температуре в эфире получено новое соединение бис(бут-3-еноат) трифенилвисмута Ph3Bi(O2CCH2CH=CH2)2 с выходом 60 %, температурой плавления 131 °С. В ИК-спектре вещества, записанном в таблетке KBr на приборе IR Prestige-21, Shimadzu (Япония), в диапазоне 4000-400 см-1 найдены сигналы валентных колебаний (ν, см-1): 3054 (Ph-H), 2978 (CH2), 1600 (C=C), 1599 (СOO-as); 1471, 1439, 1362 (COO-s), 919, 734, 680, 573 (Bi-C), 454 (Bi-O). В 1Н ЯМР спектре, снятом в дейтерохлороформе на спектрометре Agilent DD2 400 обнаружены сигналы (м. д.): 8,15 (dd, J = 8,3, 1,0 Hz, 6H), 7,59 (t, J = 7,6 Hz, 6H), 7,46 (dd, J = 11,0, 3,7 Hz, 3H), 5,76 (td, J = 17,1, 6,9 Hz, 2H), 4,96-4,86 (m, 4H), 2,86 (dt, J = 6,9, 1,3 Hz, 4H). 13C ЯМР: 40,44 (2C, -CH2-), 116,70 (2C, CH2=), 130,71 (3C, Ph), 131,13 (6C, Ph), 132,34 (6C, Ph), 133,90 (2C, =CH-), 160,38 (3C, Bi-С), 177,43 (2C, C=O). Методом РСА была найдена молекулярная структура соединения. РСА проводили на дифрактометре Oxford Diffraction Gemini Sapphire3 c использованием Mo Kα-излучения (λ = 0,71073 Å, графитовый монохроматор) при T = 293 K. P21/с, a = 12,7672(3), b = 22,0170(4), c = 8,9767(17) Å, β = 104,831(2)º, V = 2439,25(9) Å3, Z = 4. Атом висмута в структуре имеет искаженную тригонально-бипирамидальную координацию. Аксиальный угол O-Bi-O равен 171,5(2)º. Длины связей Bi-O и Bi-C равны соответственно 2,280(4)-2,310(3) и 2,197(7)-2,209(6) Å.
Бис(бут-3-еноат) трифенилвисмута, трифенилвисмут, винилуксусная кислота, трет-бутилгидропероксид, синтез, рентгеноструктурный анализ, ик, ямр
Короткий адрес: https://sciup.org/147236613
IDR: 147236613 | УДК: 546.864+547.53.024 | DOI: 10.14529/chem210405
Текст научной статьи Синтез и строение бис(бут-3-еноата) трифенилвисмута
В настоящее время получен и исследован широкий ряд производных трифенилвисмута с непредельными карбоновыми кислотами типа Ph3Bi[OC(O)R]2 и аналогичных производных сурьмы Ph3Sb[OC(O)R]2 [1, 2]. Интерес к такому типу соединений связан с потенциальными возможностями их применения. Некоторые карбоксилатные комплексы указанных типов проявляют противоопухолевую активность [3–5], используются для лечения лейшманиоза [6–8] или в качестве компонентов высокочувствительных молекулярных металлоорганических УФ резистов [9]. Активно развивается химия полимеров, содержащих висмут и сурьму. В литературе имеются данные о введении в полиметилметакрилат, полиакриловую кислоту, в поливинилацетат металлических сурьмы и висмута в коллоидном состоянии [10, 11]. Сурьмаорганические производные могут либо встраиваться в основную цепь макромолекул [12, 13], либо фиксироваться в качестве заместителей в боковой цепи. Акрилаты, метакрилаты, винилбензоаты и другие производные сурьмы, способные к полимеризации, уже использованы для синтеза металлосодержащих полимеров на основе метилметакрилата, стирола, винилацетата, акриловой кислоты, проявляющих фунгицидную и биоцидную активность [14, 15]. Добавки таких соединений в полимерные материалы улучшают их термическую [16] и радиационную стойкость, а также поглощение рентгеновского излучения [17].
Экспериментальная часть
Синтез бис (бут-3-еноата) трифенилвисмута. К 1,1 г (2,5 ммоль) трифенилвисмута в 6 мл эфира добавляли 0,43 мл (5 ммоль) винилуксусной кислоты и 0,28 мл 92,6%-ного раствора (2,5 ммоль) трет -бутилгидропероксида (ГПТБ). Реакцию проводили в колбе при комнатной температуре. Через сутки выпавшие кристаллы отфильтровывали, промывали эфиром. Выход бис (бут-3-еноата) трифенилвисмута составил 60 %, т. пл. 131 °С.
ЯМР 1H (400 МГц, CDCl 3 ): 8,15 (dd, J = 8,3, 1,0 Hz, 6H), 7,59 (t, J = 7,6 Hz, 6H), 7,46 (dd, J = 11,0; 3,7 Hz, 3H), 5,76 (td, J = 17,1; 6,9 Hz, 2H), 4,96–4,86 (m, 4H), 2,86 (dt, J = 6,9; 1,3 Hz, 4H).
ЯМР 13C : 40,44 (2C, -CH 2 -), 116,70 (2C, CH 2 =), 130,71 (3C, Ph), 131,13 (6C, Ph), 132,34 (6C, Ph), 133,90 (2C, =CH-), 160,38 (3C, Bi-С), 177,43 (2C, C=O).
ИК-спектр (ν, см–1): 3054 (Ph-H), 2978 (CH 2 ), 1600 (C=C), 1599 (СOO-as); 1471, 1439, 1362 (COO-s), 919, 734, 680, 573 (Bi-C), 454 (Bi-O).
Физико-химические методы анализа
ИК-спектры записывались в таблетке KBr на приборе IR Prestige-21, Shimadzu (Япония) в диапазоне 4000–400 см–1 с использованием программы IRsolution V 1.30.
ЯМР спектры снимали в дейтерохлороформе на ЯМР-спектрометре Agilent DD2 400. Для расшифровки и моделирования спектров использовали программу MestReNowa 9.0.2 (демонстрационная версия).
Рентгеноструктурный анализ (РСА) исследуемых кристаллов был проведен на четырехкружном рентгеновском дифрактометре Oxford Diffraction Gemini Sapphire3 (c использованием Mo K α – излучения, λ = 0,71073 Å) при температуре 293 К. Сбор, редактирование данных, уточнение параметров элементарной ячейки, а также учет поглощения осуществлялся с помощью ПО дифрактометра CrysAlisPro [18]. Работа по решению структур и их уточнению проводились при помощи программного комплекса SHELX [19], c использованием графических оболочек WinGX [20] и ShelxLe [21]. Определение структуры проводилось прямыми методами, а уточнение – методом наименьших квадратов и разностного синтеза электронной плотности в анизотропном приближении для неводородных атомов. Положение водородных атомов для фенильных и винилацетатных фрагментов определяли геометрически, по модели наездника (длины связей d (C–H) = 0,96 Å. U (H) = 1,5 U (C)). Основные данные рентгеноструктурного эксперимента и уточнения структуры представлены в табл. 1. Информация о длинах связей и валентных углах представлена в табл. 2 и 3 соответственно.
Полные таблицы координат атомов, длин связей и валентных углов для данной структуры можно найти в Кембриджском структурном банке данных (№ 1945774, ; .
Taблица 1 Кристаллографические данные, параметры эксперимента и уточнения структур соединения бис (бут-3-еноат) трифенилвисмута
|
Параметр |
Значение |
|
Химическая формула |
C 26 H 25 BiO 4 |
|
Mолярная масса, г/моль |
610,44 |
|
Сингония |
Моноклинная |
|
Температура, K |
293(2) |
|
Пространственная группа |
P 2 1 /c |
|
a , Å |
12,7672(3) |
|
b , Å |
22,0170(4) |
|
c , Å |
8,9767(17) |
|
α, ° |
90 |
|
β, ° |
104,831 (2) |
|
γ, ° |
90 |
|
Объем, Å3 |
2439,25(9) |
|
Число формульных единиц, Z |
4 |
|
Плотность, г/см3 |
1,662 |
|
μ, mm–1 |
7,255 |
|
F(000) |
1184 |
|
Размеры, мм |
0,201 × 0,113 × 0,1 |
|
Диапазон по θ, ° |
3,302–33,203 |
|
Диапазон индексов h, k, l |
–17 ≤ h ≤ 17,–30 ≤ k ≤ 30, –12 ≤ l ≤ 12 |
|
Полученные рефлексы, все/независимые/с I> 2a(I)/Rint |
43481 / 6839 / 5629 / 0,0618 |
|
Число уточняемых параметров |
280 |
|
GOOF |
1,226 |
|
R -фактор для F> 2 a(F) |
R 1 = 0,0530, wR 2 = 0,1076 |
|
R -фактор для всех рефлексов |
R 1 = 0,0683, wR 2 = 0,1132 |
|
Остаточная электронная плотность, e ⋅ Å–3 |
–0,981 / 2,401 |
Химия элементоорганических соединений
Taблица 2
Длины связей в соединении бис (бут-3-еноат) трифенилвисмута
|
Атомы |
Длина, Å |
|
Bi(1)–O(1) |
2,310(3) |
|
Bi(1)–O(3) |
2,280(4) |
|
Bi(1)–C(9) |
2,209(6) |
|
Bi(1)–C(15) |
2,197(7) |
|
Bi(1)–C(21) |
2,198(7) |
Taблица 3
Величины углов связей в соединении бис (бут-3-еноат) трифенилвисмута
|
Угол |
Величина, град. |
|
С(9)–Bi(1)–C(21) |
108,2(2) |
|
C(9)–Bi(1)–O(1) |
85,7(2) |
|
C(9)–Bi(1)–O(3) |
85,8(2) |
|
C(9)–Bi(1)–C(15) |
105,7(2) |
|
C(21)–Bi(1)–O(1) |
90,3(2) |
|
C(21)–Bi(1 –O(3) |
92,2(2) |
|
C(21)–Bi(1)–C(15) |
146,1(2) |
|
O(1)–Bi(1)–O(3) |
171,5(2) |
|
O(1)–Bi(1)–C(15) |
91,5(2) |
|
O(3)–Bi(1)–C(15) |
91,0(2) |
Обсуждение результатов
При изучении ИК-спектра бис (бут-3-еноата) трифенилвисмута было проведено сопоставление данных со спектром известного комплекса сурьмы Ph 3 Sb(O 2 CCH 2 CH=CH 2 ) 2 [22 , 23 ], а также со спектрами аналогичных производных сурьмы и висмута с изомерной бут-2-еновой (кротоновой) кислотой [24, 25 ] .
Как видно из табл. 4, значение волнового числа асимметричных валентных колебаний νaСОO в соединении висмута Ph3Bi(O2CCH2CH=CH2)2 1600 см–1 заметно ниже, чем у соединения сурьмы Ph3Sb(O2CCH2CH=CH2)2 1641 см–1. У симметричных колебаний νsСОО наблюдается сдвиг в противоположную сторону. Это согласуется с данными спектров производных трифенилвисмута(V) и трифенилсурьмы(V) с коричной, сорбиновой и фурилакриловой кислотами [23].
Таблица 4
Валентные колебания группы СОО в диацилатных производных трифенилсурьмы и трифенилвисмута Ph 3 M(O 2 CR) 2 с изомерными бутеновыми кислотами, см–1
|
RСOOH |
Sb |
Bi |
||||
|
ν sСОО |
ν aСОO |
Δν СOO |
ν sСOO |
ν aСOO |
Δν СOO |
|
|
CH 2 =CH-CH 2 -COOH |
1320 |
1641 |
321 |
1362 |
1600 |
238 |
|
CH 3 -CH=CH-СOOH |
1334 |
1632 |
298 |
1355 |
1558 |
203 |
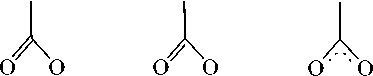
Симметричные и асимметричные валентные колебания могут служить хорошим показателем для определения характера связывания атома металла с карбоксилатными лигандами, поскольку далеко не для всех исследуемых соединений получается вырастить монокристалл хорошего качества и провести структурные исследования. В этих случаях данные ИК-спектроскопии оказываются весьма полезными [23, 26]. Если разница в значениях частот поглощения этих колебаний Δν = νa–νs больше 200 см–1, то характер связывания монодентатный, а если меньше – то бидентат-ный, что подтверждается данными рентгеноструктурного анализа. В случае, если значения Δν очень близки к 200 см–1, однозначно судить о характере связывания сложно, и может наблюдаться как монодентатное, так и бидентатное связывание лигандов с атомом металла или же дополнительная координация атома кислорода карбонильной группы на атом сурьмы или висмута. Основные типы координации лигандов на атом металла, которые могут наблюдаться в диацилатных комплексах Ph3M(O2CR)2, показаны на рис. 1. Тип координации 1 – монодентатный, однако во многих исследуемых соединениях соблюдается тип координации 2, так как расстояние между атомом металла и атомом кислорода карбонильной группы мало (что подтверждается РСА), и он координируется на металл. В этой работе под монодентаным связыванием подразумевается тип 2. Тип координации 3 – бидентатный, он наблюдается в нескольких исследуемых комплексах.
RRR
-
/1Х\\ Ph \ /Л\Х Ph \ Ph
Ph M Ph M Ph M
Ph / V Ph / V Ph
OO OO OO
Y у Y
RRR 123
Рис. 1. Основные типы координации лигандов на атом металла в дикарбоксилатных комплексах Ph 3 M(O 2 CR) 2
Значения Δν представлены в табл. 4. В случае Ph 3 Bi(O 2 CCH 2 CH=CH 2 ) 2 Δν = 238 см–1, что говорит о монодентатном связывании металла с дополнительной координацией одного атома кислорода (2 тип), так же, как у кротоната висмута Δν = 203 см–1. Аналогичные комплексы сурьмы с винилуксусной и кротоновой кислотами характеризуются значительно большими значениями Δν (321 и 298 см–1 соответственно) и большей долей монодентатности. Очевидно, сказывается больший радиус атома висмута и меньшая электроотрицательность.
При изучении данных РСА бис (бут-3-еноата) трифенилвисмута было установлено, что в исследуемом соединении атом висмута окружен двумя винилацетатными и тремя фенильными лигандами (рис. 2).
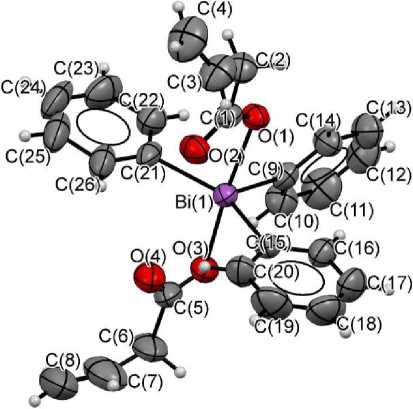
Рис. 2. Строение молекулы бис (бут-3-еноата) трифенилвисмута
Атом висмута имеет искаженную тригонально-бипирамидальную координацию [27], подобно ряду описанных карбоксилатов висмута(V) [28]. В вершинах находятся атомы кислорода, а в основании атомы углерода (см. рис. 2). Аксиальный угол O(3)–Bi(1)–O(1) отличается от идеального значения 180º примерно на 8,5º. Отклонение атома висмута от плоскости основания (экваториальной), образованной атомами C(21), С(15), С(9) (см. рис. 2), составляет около 0,01 Å. Длины экваториальных связей Bi–C одинаковы в пределах погрешности. Разница длин аксиальных связей Bi–O для атома висмута не превышает 2 %.
Химия элементоорганических соединений
Величины расстояний от атома висмута до карбонильных атомов кислорода Bi(1)–O(2) и Bi(1)–O(2) приведены в табл. 5. Эти величины близки друг к другу и значительно отличаются от суммы вандерваальсовых радиусов атомов висмута и углерода (3,7 Å) [29].
Taблица 5 Расстояния до карбонильных атомов кислорода
|
Атомы |
Длина, Å |
|
Bi(1) – O(2) |
2,769 |
|
Bi(1) – O(4) |
2,781 |
Упаковка представляет собой каркас молекул, связанных силами вандерваальса. Центры масс молекул занимают одну общую правильную систему точек пространственной группы P2 1 /c (рис. 3).
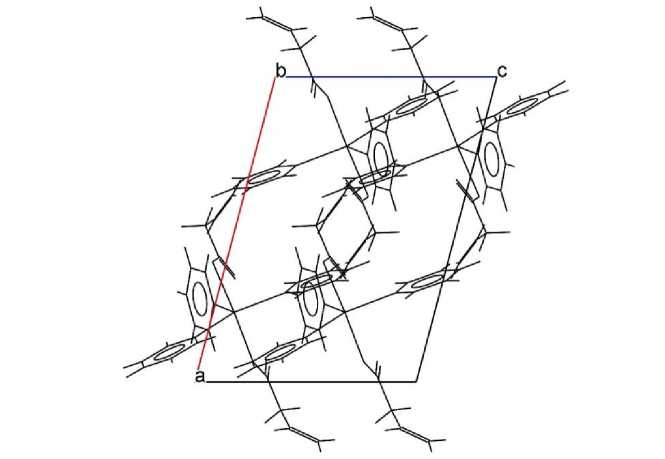
Рис. 3. Упаковка молекул в элементарной ячейке бис (бут-3-еноата) трифенилвисмута
Молекула бис(бут-3-еноата) трифенилвисмута имеет схожее геометрическое строение с молекулой бис(бут-2-еноата) трифенилвисмута [25]. В табл. 6 приведены некоторые параметры для сравнения.
Taблица 6
Сравнение строения бис (бут-3-еноата) трифенилвисмута и бис (бут-2-еноата) трифенилвисмута
|
Параметр сравнения |
Бис (бут-3-еноат) трифенилвисмута |
Бис (бут-2-еноат) трифенилвисмута |
|
Координационный полиэдр атома висмута |
Искаженная тригональная бипирамида |
Искаженная тригональная бипирамида |
|
Аксиальные углы (O–Bi–O), град. |
171,5(2) |
172,6(4) |
|
Расстояние от атома Bi до экват. плоскости (C, C, C), Å |
0,011(2) |
0,034(3) |
|
Длины аксиальных связей, Å |
2,280(3)–2,310(4) |
2,283(3)–2,309(5) |
|
Длины экваториальных связей, Å |
2,197(7)–2,209(6) |
2,204(4)–2,226(6) |
|
Пространственная группа симметрии |
P2 1 /c |
P-1 |
|
Z |
4 |
2 |
При схожей координации атома висмута и схожем строении лигандов наблюдается кристаллизация в разных пространственных группах симметрии, а также различное число формульных единиц.
Выводы
-
1. Впервые был синтезирован бис (бут-3-еноат) трифенилвисмута из трифенилвисмута, винилуксусной кислоты и трет -бутилгидропероксида и с выходом 60 %.
-
2. Изучены ЯМР, ИК-спектры полученного соединения.
-
3. Методом РСА и установлено его молекулярное строение.
Работа выполнена в рамках базовой части государственного задания высшим учебным заведениям и научным организациям в сфере научной деятельности, проект № 3.6502.2017/БЧ (синтез комплекса, РСА) и 0729-2020-0039 (ИК, ЯМР).
Список литературы Синтез и строение бис(бут-3-еноата) трифенилвисмута
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / В.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. хим. - 2020. - Т. 46, № 10. - С. 579648. DOI: 10.31857/S0132344X20100011.
- Молекулярные и кристаллические структуры карбоксилатов три- и тетраарилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Вестник ЮУрГУ. Серия «Химия». -2011. - Вып. 6. - С. 47-60.
- Synthesis, Structural Characterization and in vitro Antitumour Properties of Triorganoantimony(V) Disalicylates: Crystal and Molecular Structures of [5-Y-2-(HO)-C6H3COObSbMe3 (Y = H, Me, MeO) / C. Silvestru, I. Haiduc, R.T. Tiekink et al. // Appl. Organomet. Chem. - 1995. - V. 9, № 7. - P. 597-607. DOI: 10.1002/aoc.590090715.
- Synthesis, Characterization and in vitro Antitumor Activity of Some Arylantimony Ferrocenecarboxylates and Crystal Structures of C5H5FeC5H4CO2SbPh4 and (C5H5FeC5H4CO2)2Sb(4-CH3C6H4)3 / R.C. Liu, Y.Q. Ma, L. Yu et al. // Appl. Organomet. Chem. -2003. - V. 17, № 9. - P. 662-668. DOI: 10.1002/aoc.491.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Derivatives of Analogues of Demethylcantharimide / G. C. Wang, J. Xiao, L. Yu et al. // J. Organomet. Chem. - 2004. - V. 689, № 9. - P. 1631-1638. DOI: 10.1016/j.jorganchem.2004.02.015.
- Mishra, J. Chemotherapy of Leishmaniasis: Past, Present and Future / J. Mishra, A. Saxena, S. Singh // Curr. Med. Chem. - 2007. - V. 14, № 10. - P. 1153-1169. DOI: 10.2174/092986707780362862.
- Novel Triphenylantimony(V) and Triphenylbismuth(V) Complexes with Benzoic Acid Derivatives: Structural Characterization, in vitro Antileishmanial and Antibacterial Activities and Cytotoxicity against Macrophages / A. Islam, J.G. Da Silva, F.M. Berbet et al. // Molecules. - 2014. -V. 19, № 5. - P. 6009-6030. DOI:10.3390/molecules19056009.
- Anti-leishmanial Activity of Heteroleptic Organometallic Sb(V) Compounds / M.I. Ali, M.K. Rauf, A. Badshah et al. // Dalton Trans. - 2013. - V. 42, № 48. - P. 16733-16741. DOI: 10.1039/c3dt51382c.
- High-Sensitivity Molecular Organometallic Resist for EUV (MORE) / J. Passarelli, M. Murphy, R.D. Re et al. //Adwances in Patterning Materials and Processes XXXII. - 2015. - V. 9425, № 94250T. DOI: 10.1117/12.2086599.
- Cardenas-Trivino, G. Synthesis and Molecular Weights of Metal Poly(methyl methacrylates) / G. Cardenas-Trivino, C. Retamal, K.J. Klabunde // Polym. Bull. (Berlin). - 1991. - V. 25, № 3. -P. 315-318. DOI: 10.1007/BF00316900.
- Cardenas-Trivino, G. Thermogravimetric Studies of Metal Poly(Methylmethacrylates) / G. Cardenas-Trivino, C. Retamal, L.H. Tagle // Thermochim. Acta. - 1991. - V. 176. - P. 233-240. DOI: 10.1016/0040-6031(91)80278-Q.
- Naka, K. Ring-Collapsed Radical Alternating Copolymerization of Phenyl-Substituted Cyclooligostibine and Acetylenic Compounds / K. Naka, A. Nakahashi, Y. Chujo // Macromolecules. -2006. - V. 39, № 24. - P. 8257-8262. DOI: 10.1021/ma061220l.
- Naka, K. Periodic Terpolymerization of Cyclooligoarsine, Cyclooligostibine, and Acetylenic Compound / K. Naka, A. Nakahashi, Y. Chujo // Macromolecules. - 2007. - V. 40, № 5. - P. 13721376. DOI: 10.1021/ma0622332.
- Котон, М.М. О реакционной способности металлоорганических соединений. // Металлоорганические соединения и радикалы, под ред. М.И. Кабачника / М.М. Котон. - М.: Наука, 1985. - С. 13-22.
- Карраер, Ч. Металлоорганические полимеры / Ч. Карраер, Дж. Шитс, Ч. Питтмен. - М.: Мир, 1981. - 352 с.
- Диакрилаты трифенилвисмута и трифенилсурьмы в синтезе металлосодержащего полиметилметакрилата / В.А. Додонов, А.В. Гущин, Ю.Л. Кузнецова, В.А Моругова // Вестник ННГУ. Серия химия. - 2004. - Вып. 1(4). - С. 86-94.
- Kensuke, N. Ring-Collapsed Radical Alternating Copolymerization of Phenyl-Substituted Cyclooligostibine and Acetylenic Compounds / N. Kensuke, N. Akiko, C. Yoshiki // Macromolecules. -2006. - V. 39(24). - P. 8257-8262. DOI: 10.1021/ma061220l.
- Agilent Technologies CrysAlisPro Software System / Agilent Technologies // Yarnton, Oxford, UK. - 2014.
- Sheldrick G.M. Crystal Structure Refinement with SHELX / Sheldrick G.M. // Acta Cryst. -2015. - V. C71 - P. 3-8.
- Farrugia L.J. WinGX and ORTEP for Windows: An Update / Farrugia L.J. // J. Appl. Crystal-logr. - 2012. - Vol. 45, № 4 - P. 849-854.
- Hubschle C.B. ShelXle: A Qt Graphical User Interface for SHELXL / Hubschle C.B., Sheldrick G.M., Dittrich B. // J. Appl. Crystallogr. - 2011. - Vol. 44, № 6 - P. 1281-1284.
- Синтез и строение дикротоната трифенилсурьмы // А.В. Гущин, О.С. Калистратова, Р.А. и др. // Вестник ННГУ. Сер. Химия. - 2013. - Вып. 1(1). - С. 86-90.
- Исследование строения производных трифенилсурьмы^) и трифенилвисмута^) с некоторыми непредельными карбоновыми кислотами методом ИК-спектроскопии / А.В. Гущин, А.И. Малеева, О.С. Калистратова др. // Вестник ЮУрГУ. Серия «Химия». - 2021. - Т. 13, № 1. -С. 5-20. DOI: 10.14529/chem210101.
- Синтез и исследование строения органических соединений сурьмы^) с непредельными карбоновыми кислотами Ph3Sb[OC(O)R]2 // А.И. Малеева, А.В. Гущин, О.С. Калистратова и др. // Вестник ЮУрГУ. Серия «Химия». - 2019. - Т. 11, № 3. - С. 66-79. DOI: 10.14529/chem190308.
- 5is(but-2-enoate) triphenylbismuth // P.V. Andreev, N.V. Somov, O.S. Kalistratova et al. // Acta Crystallogr. Section E. - 2013. - V. 69. - P. m 333. DOI: 10.1107/S1600536813013317.
- Synthesis, Characterization and in vitro Antitumor Activity of Some Arylantimony Ferroce-nylcarboxylate Derivatives and the Crystal Structures of [C5H5FeC5H4C(CH3)=CHCOO]2Sb(C6H4F-4)3 and [4-(C5H5FeC5H4)C6H4COO]2Sb(C6H4F-4)3 // Lin Yu, Yong-Qiang Ma, Run-Chang Liu // Polyhedron. - 2004. - V. 23, № 9. - P. 823-829. D0I:10.1016/j.poly.2003.12.002.
- Somov, N.V. On Quantitative Estimation of the Degree of Similarity of Coordination Polyhe-dra / N.V. Somov, P.V. Andreev // Crystallogr. Rep. - 2018. - V. 1, № 63. - P. 32-36.
- Шарутин, В.В. Синтез, строение и применение арильных соединений висмута / В.В. Шарутин, Т.В. Мосунова // Вестник ЮУрГУ. Серия «Химия». - 2020. - Т. 12, № 3. - С. 7-66. DOI: 10.14529/chem200301.
- Batsanov, S.S. Van der Waals Radii of Elements / S.S. Batsanov // Inorg. Mater. - 2001. -V. 37, № 9. - P.871-885.


