Синтез и строение cольвата 2,6-пиридиндикарбоксилата бис(тетрафенилсурьмы) с толуолом
Автор: Губанова Юлия Олеговна, Шарутина Ольга Константиновна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.11, 2019 года.
Бесплатный доступ
Взаимодействием пентафенилсурьмы с 2,6-пиридиндикарбоновой кислотой (мольное соотношение 1:1 или 2:1) в растворе толуола с выходом 72 % впервые синтезирован сольват 2,6-пиридиндикарбоксилата бис (тетрафенилсурьмы) с толуолом (1), который представляет собой бесцветные кристаллы с температурой плавления 170 °С. Соединение охарактеризовано методами ИК-спектроскопии, элементного анализа, рентгеноструктурного анализа. В ИК-спектре имеется полоса поглощения карбонильной группы с частотой 1620 см-1,смещенная в область низкочастотных колебаний по сравнению с ИК-спектром исходной кислоты и справочным значением. По данным рентгеноструктурного анализа, криталлографические параметры элементарной ячейки соединения 1: триклинная сингония, группа симметрии P 1 ; a = 12,494(5), b = 13,788(5); c = 16,684(6) Å; V = 2550.5(16) Å3; Z = 2; r(выч.) = 1,455 г/см3. В молекуле атомы сурьмы Sb(1) и Sb(2) имеют искаженную в различной степени тригонально-бипирамидальную координацию. Аксиальные углы CSb(1)O и CSb(2)O равны 178,41(10)° и 176,75(11)°, экваториальные углы CSb(1)C и CSb(2)C варьируют в интервалах 111,58(14)-125,24(13)°) и 103,44(13)-146,5(11)°. Длины связей Sb(1,2)-O составляют 2,301(2), 2,310(2) Å. Экваториальные связи Sb(1,2)-Cэкв (2,105(3)-2,112(3) Å и 2,140(3)-2,162(3) Å) короче, чем аксиальные связи Sb(1,2)-Cакс (2,177(3), 2,162(3) Å). Бидентатный характер связывания карбоксильных групп проявляется слабо (расстояние Sb(1)∙∙∙O(2) составляет 3,263(4) Å), что подтверждается существенной разницей в значениях одинарных (С-О 1,288(3), 1,261(4) Å) и двойных связей (С=О 1,226(3), 1,236(4) Å). Атом азота пиридинового кольца координирует на атом сурьмы (расcтояние Sb(2)∙∙∙N составляет 2,947(3) Å).
Пентафенилсурьма, молекулярная структура, рентгеноструктурный анализ, 2, 6-пиридиндикарбоновая кислота
Короткий адрес: https://sciup.org/147233130
IDR: 147233130 | УДК: 546.865 | DOI: 10.14529/chem190302
Текст научной статьи Синтез и строение cольвата 2,6-пиридиндикарбоксилата бис(тетрафенилсурьмы) с толуолом
В настоящее время установлены структуры нескольких десятков сурьмаорганических производных карбоновых кислот с алифатическими, ароматическими и элементоорганическими радикалами. Однако производные гетероциклических монокарбоновых кислот представлены только несколькими примерами [1–7]. Особенность строения сурьмаорганических производных, в состав которых входит гетероциклический лиганд, заключается в возможности дополнительной координации гетероатома на атом сурьмы c увеличением координационного числа последнего [5, 8-11]. О производных гетероциклических дикарбоновых кислот информация в литературе отсутствует.
Взаимодействие пентафенилсурьмы с дикарбоновыми кислотами представляет определенный интерес, поскольку может приводить к продуктам различного строения. Первым сурьмаорганическим производным дикарбоновой кислоты был оксалат бис(тетрафенилсурьмы), полученный из оксалата серебра и бромида тетрафенилсурьмы [12]. При взаимодействии пентафенилсурьмы с рядом дикарбоновых кислот часто происходит замещение атомов водорода на фрагмент Ph4Sb в двух карбоксильных группах с образованием карбоксилатов бис(тетрафенилсурьмы) [13], однако в реакции с янтарной кислотой кислый сукцинат тетрафенилсурьмы получить удалось [14]. В некоторых случаях наблюдалось декарбоксилирование одной из карбоксильных групп и образование карбоксилатов тетрафенилсурьмы [13]. Описаны сурьмаорганические производные дикарбоновых кислот,
Органическая химия представляющие собой 24-членные макроциклические соединения, содержащие два атома сурьмы, связанные между собой основаниями Шиффа, выполняющими мостиковую функцию [15].
В продолжение исследования сурьмаорганических производных дикарбоновых кислот нами изучено взаимодействие пентафенилсурьмы с 2,6-пиридиндикарбоновой кислотой в толуоле и установлено строение продукта реакции.
Экспериментальная часть
Синтез сольвата 2,6 пиридиндикарбоксилата бис (тетрафенилсурьмы) с толуолом (1). Смесь 250 мг (0,49 ммоль) пентафенилсурьмы и 44 мг (0,25 ммоль) 2,6-пиридиндикарбоновой кислоты в 5 мл толуола помещали в стеклянную ампулу и запаивали. Смесь нагревали на водяной бане в течение часа, охлаждали до комнатной температуры. Раствор концентрировали. Получили 397 мг (72 %) бесцветных кристаллов с т. пл. 170 °С (с разл). ИК-спектр ( ν , см-1): 3055, 2924, 2853, 2351, 2320, 1620, 1558, 1419, 1338, 1263, 1177, 1067, 997, 731, 691, 652, 459. Для C 62 H 51 NO 4 Sb 2 вычислено, %: С 66,5; H 4,56.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 осуществлен с использованием автоматического четырехкружного дифрактометра D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программы SMART SAINT- Plus [16]. Определение и уточнение структуры кристаллов выполнено c помощью программ SHELX/PC [17] и OLEX2 [18]. Структура расшифрована прямым методом и уточнена методом наименьших квадратов вначале в изотропном, затем в анизотропном приближении для неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение по модели наездника .
Кристаллы соединения 1 бесцветные, призматические, триклинные, C62H51NO4Sb2, М = 1117,54 г/моль; а = 12,494(5), b = 13,788(5), c = 16,684(6) Å, α = 82,892(12)°, β = 82,00(2)°, γ = 63,943(15)°, V = 2550,5(16) Å3, ρвыч = 1,455 г/см3, Z = 2, пространственная группа P1 . Измерено всего 189414 отражений, 24897 независимых отражений, μ = 1,108 мм-1. Окончательные значения факторов расходимости: R1 0,1748 и wR2 0,1413 (по всем рефлексам), R1 0,0582 и wR2 0,1098 (по рефлексам F2> 2σ(F2)). Структуры депонированы в Кембриджской базе кристаллоструктурных данных (CCDC 1898863, .
Геометрические характеристики координационного полиэдра атома сурьмы приведены в таблице.
Основные длины связей ( d ) и валентные углы (ω) в структуре соединения 1
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb(1) – O(1) |
2,301(2) |
C(1)Sb(1)O(1) |
178,41(10) |
|
Sb(1) – C(11) |
2,105(3) |
C(11)Sb(1)C(31) |
125,24(13) |
|
Sb(1) – C(31) |
2,112(3) |
C(11)Sb(1)C(1) |
96,88(13) |
|
Sb(1) – C(1) |
2,177(3) |
C(11)Sb(1)C(21) |
119,02(13) |
|
Sb(1) – C(21) |
2,109(3) |
C(21)Sb(1)C(31) |
111,58(14) |
|
Sb(2) – O(3) |
2,310(2) |
C(21)Sb(1)C(1) |
97,90(12) |
|
Sb(2) – C(51) |
2,134(3) |
C(31)Sb(1)C(1) |
95,61(14) |
|
Sb(2) – C(61) |
2,140(3) |
C(51)Sb(2)C(61) |
146,50(11) |
|
Sb(2) – C(71) |
2,162(3) |
C(51)Sb(2)C(71) |
97,63(12) |
|
Sb(2) – C(81) |
2,146(4) |
C(51)Sb(2)C(81) |
103,11(14) |
|
О(1) – C(46) |
1,288(3) |
C(61)Sb(2)С(71) |
98,89(12) |
|
О(2) – C(46) |
1,226(3) |
C(61)Sb(2)С(81) |
103,44(13) |
|
О(3) – C(47) |
1,261(4) |
C(71)Sb(2)O(3) |
176,75(11) |
|
О(4) – C(47) |
1,236(4) |
C(81)Sb(2)С(71) |
97,98(15) |
Обсуждение результатов
Установлено, что взаимодействие между пентафенилсурьмой и 2,6-пиридиндикарбоновой кислотой в толуоле при нагревании протекает с замещением атомов водорода в двух карбоксильных группах, образуется биядерное соединение – 2,6-пиридиндикарбоксилат бис (тетрафенилсурьмы), который кристаллизуется в форме сольвата с толуолом ( 1 ):
2Ph 5 Sb +
HO(O)C
PhCH 3
C(O)OH Ph4SbO(O)C
. PhCH 3
C(O)OSbPh4
Следует отметить, что строение продукта не зависело от соотношения реагентов, кислый 2,6-пиридиндикарбоксилат тетрафенилсурьмы не удалось выделить даже при проведении реакции при комнатной температуре и мольном соотношении 1:1.
В ИК-спектре соединения 1 полоса поглощения карбонильной группы при 1620 см-1 смещена в область низкочастотных колебаний по сравнению со справочными данными для карбоновых кислот (1700-1680 см-1 [19]) и значением в спектре никотиновой кислоты (1720 см-1 [20]). Полоса поглощения, соответствующая валентным и скелетным колебаниям пиридинового ядра, обнаружена при 1558 см-1 (полоса переменной интенсивности С=N [19]). В спектре 2,6пиридиндикарбоновой кислоты поглощение карбонильной группы наблюдается в области 1701 см-1, полоса поглощения пиридинового ядра соответствует значению 1607 см-1.
По данным РСА, атомы сурьмы Sb(1) и Sb(2) имеют искаженную в различной степени триго-нально-бипирамидальную координацию (см. рисунок). В экваториальных положениях находятся три фенильных лиганда, в аксиальных - четвертый фенильный и мостиковый карбоксилатный лиганд. Атомы Sb(1) и Sb(2) выходят из соответствующих экваториальных плоскостей в сторону аксиально расположенных фенильных лигандов на 0,249 и 0,300 Å. Аксиальные углы O(1)Sb(1)C акс и O(3)Sb(2)C акс равны 178,41(10)° и 176,75(11)° соответственно. Суммы углов в экваториальных плоскостях Sb(1) и Sb(2) составляют 355,84(13)° (111,58(14) - 125,24(13)°) и 353,05(13)° (103,44(13) - 146,5(11)°). Углы C акс Sb(1,2)C экв изменяются в интервалах 95,61(14)–97,90(12)° и 97,28(15)–98,89(12)° соответственно. Аксиальные связи Sb(1,2) – C акс равны 2,177(3) и 2,162(3) Å.
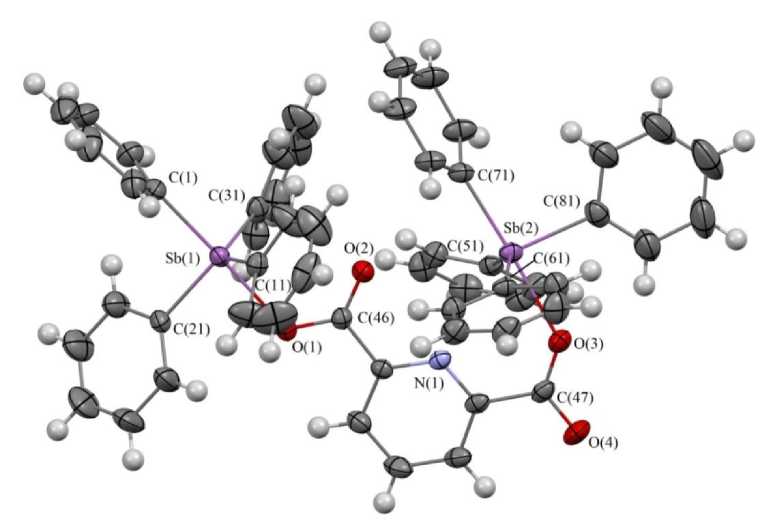
Строение соединения 1 (молекула сольватного толуола не показана)
Органическая химия
Длины экваториальных связей Sb(1,2) – Cэкв значительно различаются между собой и составляют 2,105(3)-2,112(3) Å и 2,134(3)-2,146(4) Å. Связи Sb(1,2) – O(1,3) имеют близкие значения 2,301(2) и 2,310(2) Å. В молекуле карборанилдикарбоксилата бис (тетрафенилсурьмы) аналогичные расстояния равны 2,275(3) и 2,364(3) Å [16], в молекуле 3-пиридинкарбоксилата тетрафенил-сурьмы это расстояние короче и составляет 2,268(2) Å [2].
Внутримолекулярное взаимодействие атома сурьмы с атомом кислорода одной из карбонильных групп проявляется слабо (расстояние Sb(1)∙∙∙O(2) составляет 3,263(4) Å), при этом имеет место внутримолекулярный контакт Sb(2)∙∙∙N (2.947(3) Å). Аналогичный контакт наблюдается в бис (2-пиридинкарбоксилате) трифенилсурьмы (2,602(4) Å) [5].
В молекуле 1 не выровнены одинарные и двойные связи в карбоксильных группах (1,288(3), 1,226(3) и 1,261(4), 1,236(4) Å соответственно).
Структурная организация в кристалле 1 обусловлена межмолекулярными водородными связями С=O∙∙∙ H-С-типа.
Вывод
Таким образом, продуктом реакции пентафенилсурьмы с 2,6-пиридиндикарбоновой кислотой в толуоле независимо от мольного соотношения реагентов является 2,6-пиридиндикарбоксилат бис (тетрафенилсурьмы), в молекуле которого карбоксилатный лиганд выполняет мостиковую функцию. Атомы сурьмы структурно неэквивалентны: их координационные полиэдры искажены в разной степени, а дополнительные внутримолекулярные взаимодействия реализованы с разными атомами (карбонильным атомом кислорода и атомом азота пиридинового кольца).
Выражаем благодарность проф. В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и строение cольвата 2,6-пиридиндикарбоксилата бис(тетрафенилсурьмы) с толуолом
- Синтез и строение ниацината тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, Т.П. Платонова и др. // Журн. общ. химии. - 2004. - Т. 74, № 2. - С. 234-237.
- Domagala, M. Triorganoantimon- und Triorganobismutderivate von Carbonsauren funfgliedriger Heterocyclen Kristall- und Molekulstruktur von (C6H5)3Sb(O2C-2-C4H3S)2 und (CH3)3Sb(O2C-2-C4H3S)2 / M. Domagala, F. Huber, H. Preut // Z. Anorg. Allg. Chem. - 1989. - Bd. 574. - P. 130-142. DOI: 10.1002/zaac.655740114
- Синтез и строение дикарбоксилатов триарилсурьмы Ar3Sb[OC(O)R]2 (Ar = Ph, p-Tol; R =2-C4H3O, 3-C5H4N / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Коорд. химия. - 2003. - Т. 29, № 10. - С. 750-759.
- Domagala, M. Triorganoantimon- und Triorganobismutderivate von 2-Pyridincarbonsaure und 2-Pyridinlessigsaure. Kristall- und Molekulstrukturen von Ph3Sb(O2C-2-C5H4N)2 und Me3Sb(O2CCH2-2-C5H4N)2 / M. Domagala, F. Huber, H. Preut // Z. Anorg. Allg. Chem. - 1990. - Bd. 582. - P. 37-50. DOI: 10.1002/zaac.19905820107
- Syntheses, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Heterocyclic (S,N) Ligand / M. Chunlin, Z. Qingfu, S. Jiafeng et al. // J. Organomet. Chem. - 2006. - V. 691. - P. 2567-2574. DOI: 10.1016/j.jorganchem.2006.01.049
- Triorganoantimony(V) carboxilates: Synthesis, Characterization and Crystal structure of Me3Sb(O2CC3H4N)2 ∙ H2O / K.R. Chaudhari, V.K. Jain, V.S. Sagoria et al. // J. Organomet. Chem. - 2007. - V. 692. - P. 4926-4932.
- DOI: 10.1016/j.jorganchem.2007.07.033
- Preut, H. The Further Geometry of Grain Boundaries in Hexagonal Close-packed Metals / H. Preut, M. Domagala, F. Huber // Acta Crystallogr. - 1987. - B43. - P. 416-422.
- DOI: 10.1107/S0108768187097568
- Synthesis, characterization and crystal structures of tri- and tetraphenylantimony(V) compounds containing arylcarbonyloxy moiety / L. Quan, H. Yin, J. Cui et al. // J. Organomet. chem. - 2009. - V. 694. - P. 3708-3717.
- DOI: 10.1016/j.jorganchem.2009.07.040
- Schmidbaur, H. Synthese, Struktur und Sb-Mosbauer-Spektren Kovalenter und Tetraorganoantimon(V) Verbindungen / H. Schmidbaur, B. Milewski-Mahra, F.E. Wagner // Z. Naturforsch. - 1983. - Bd. 38B. - P. 1477-1483.
- Synthesis of Two Tetraphenylantimony Complexes of Pyridine N-Oxides: Crystal Structure of Tetraphenylantimony (2-Mercapto-Pyridine N-oxide) / G.M. Arvanitis, M.E. Berardini, T.B. Acton et al. // Phosphorus, Sulfur, Silicon Relat. Elem. - 1993. - Vol. 82. - P. 127-135.
- DOI: 10.1007/BF01666088
- Formation and Structure of Cyclic Five-Coordinated Antimony Derivatives. The First Squarepyramidal Geometry for a Bicyclic Stiborane / R.R. Holmes, R.O. Day, V. Chandrasekhar et al. // Inorg. Chem. - 1987. - V. 26, № 1. - P. 157-163
- Millington, P.L. Phenylantimony (V) Oxalates: Isolation and Crystal Structures of [SbPh4][SbPh2(ox)2], [SbPh3(OMe)]2ox and (SbPh4)2ox / P.L. Millington, D.B. Sowerby // J. Chem. Soc., Dalton Trans. - 1992, № 7. - P. 1199-1204.
- Interaction of Pentaphenylantimony with Carboranedicarboxylic acid / V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova et al. // J. Organomet. Chem. - 2015. - V. 798. - P. 41-45.
- DOI: 10.1016/j.jorganchem.2015.09.002
- Шарутин, В.В. Синтез и строение кислого сукцината тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова // Бутлеровские сообщения. - 2014. - Т. 39, № 7. - С. 139-141.
- Highly Symmetrical 24-membered Macrocyclic Organoantimony(V) Complexes Constructed from Schiff Base Ligands Possessing two Terminal Carboxyl Groups / M. Hong, H.-D. Yin, W.-K. Li et al. // Inorg. Chem. Communications. - 2011. - V. 14, № 10. - P. 1616-1621.
- DOI: 10.1016/j.inoche.2011.06.023
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341.
- DOI: 10.1107/S0021889808042726
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений: справочные материалы / Б.Н. Тарасевич. - М.: МГУ имени М.В. Ломоносова, 2012. - 55 с.
- Грандберг, И.И. Практические работы и семинарские занятия по органической химии: учеб. пособие для сельскохозяйственных вузов / И.И. Грандберг. - М.: Высш. школа, 1978. - 225 с.


