Синтез и строение дифторида трис(2-метокси-5-хлорфенил)сурьмы
Автор: Белов Василий Васильевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.14, 2022 года.
Бесплатный доступ
Взаимодействием дибромида трис (2-метокси-5-хлорфенил)сурьмы и фторида натрия в водно-ацетоновом растворе получен с выходом 92 % дифторид трис (2-метокси-5-хлорфенил)сурьмы (1), кристаллизующийся из смеси ацетонитрил-октан. Соединение идентифицировано методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, кристаллы 1 жёлто-коричневого цвета имеют мало искаженную тригонально-бипирамидальную координацию с аксиально расположенными атомами галогена. Согласно данным РСА, проведенного на дифрактометре D8 QUEST фирмы Bruker, кристаллографические параметры элементарной ячейки соединения: пространственная группа Р- 1, а = 12,93(10), b = 14,84(18), c = 15,1(2) Å, α = 64,5(6)°, β = 65,6(4)°, γ = 65,1(3)°, V = 2269(46) Å3, ρвыч = 1,711 г/см3, Z = 2. Длины связей Sb-C равны 2,09(4), 2,08(5) и 2,06(4) Å, валентные углы CSbC составляют 116,99(2), 122,05(2), 120,86(1)°. Значения длин связей Sb-F равны 1,995(3) и 1,936 (3). Атомы кислорода метокси-групп координируются на атом металла [внутримолекулярные расстояния Sb∙∙∙OМе 3,25(5); 3,04(3) и 3,11(5) Å]. Валентные углы Sb∙∙∙O (O(3)-Sb(1)-O(1), O(1)-Sb(1)-O(2), O(2)-Sb(1)-O(3)) равны 108,2(9), 114,4(7) и 115,3(9)° соответственно. Аксиальный угол FSbF равен 179,13(9)°, экваториальные углы имеют значения 114,78(3), 116,01(2) и 113,45(2)°.
Синтез, дифторид трис(2-метокси-5-хлорфенил)сурьмы, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147236625
IDR: 147236625 | УДК: 549.242+547.53.024+548.312.5 | DOI: 10.14529/chem220107
Текст научной статьи Синтез и строение дифторида трис(2-метокси-5-хлорфенил)сурьмы
Органические производные пятивалентной сурьмы достаточно хорошо изучены [1–41], из которых более всего изучены производные пятивалентной сурьмы Ar 3 SbХ 2 (Х – электроотрицательный лиганд) [42–57]. Известны арильные соединения сурьмы, в которых центральный атом координируется с атомами кислорода [58–62]. Настоящая работа посвящена исследованию взаимодействия фторида натрия с дибромидом трис (2-метокси-5-хлорфенил)сурьмы и определению структурных особенностей полученного соединения методом рентгеноструктурного анализа.
Экспериментальная частьСинтез дифторида трис(2-метокси-5-хлорфенил)сурьмы C42H36O6F4Cl6Sb2 (1).
К водному раствору 269 мг (0,640 ммоль) фторида натрия прибавляли 500 мг (0,640 ммоль) трис (2-метокси-5-хлорфенил)дибромид сурьмы в 20 мл ацетона, перемешивали и оставляли на ночь. Выделившийся осадок фильтровали и сушили. После перекристаллизации твердого остатка из смеси ацетонитрил–октан (3:1 объемн.) получили 390 мг (92 %) бледно-желтых кристаллов соединения 1 c t пл = 178,3 °С.
ИК-спектр, ν , см - 1: 3099, 3076, 3005, 2972, 2941, 2895, 2843, 2536, 1762, 1577, 1479, 1463, 1440, 1362, 1286, 1274, 1255, 1236, 1180, 1153, 1141, 1107, 1056, 1024, 997, 885, 808, 742, 709, 682, 640, 545, 522, 487, 445.
Найдено, %: С 43,02; Н 3,19. C 42 H 36 O 6 F 4 Cl 6 Sb 2 . Вычислено, %: С 43,15; Н 3,11.
ИК-спектр соединения 1 записывали на ИК-спектрометре Shimadzu IR Affinity- 1S в таблетке KBr в области 4000–400 см–1.
Элементный анализ на С, Н проведен на анализаторе Carlo-Erba 1106.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 проводили на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [63]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [64], OLEX2 [65]. Струк- тура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1. Основные длины связей и валентные углы – в табл. 2.
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Основные длины связей ( d ) и валентные углы ( ω ) в структуре 1
Таблица 1
|
Параметр |
1 |
|
Формула |
C 42 H 36 O 6 F 4 Cl 6 Sb 2 |
|
М |
1168,91 |
|
Сингония |
Триклинная |
|
Пр. группа |
P– 1 |
|
a , Å |
12,93(10) |
|
b , Å |
14,84(18) |
|
c , Å |
15,1(2) |
|
α, град. |
64,5(6) |
|
β, град. |
65,6(4) |
|
γ, град. |
65,1(3) |
|
V , Å3 |
2269(46) |
|
Z |
2 |
|
ρ (выч.), г/см3 |
1,711 |
|
µ, мм–1 |
1,605 |
|
F (000) |
1152,0 |
|
Размер кристалла, мм |
0,30 × 0,25 × 0,04 |
|
Область сбора данных по 2θ, град. |
5,48–58,72 |
|
Интервалы индексов отражений |
–17 ≤ h ≤ 15, –19 ≤ k ≤ 19, –20 ≤ l ≤ 19 |
|
Измерено отражений |
31322 |
|
Независимых отражений |
10670 ( R int = 0,3695) |
|
Переменных уточнения |
547 |
|
GOOF |
1,113 |
|
R -факторы по I>2σ (I) |
R 1 = 0,1997, wR 2 = 0,4098 |
|
R -факторы по все отражениям |
R 1 = 0,4352, wR 2 = 0,5320 |
|
Остаточная электронная плотность (max/min), e/Å3 |
2,07/–3,06 |
Таблица 2
|
Связь |
d, Å |
Угол |
ω , град |
|
Sb(1)–F(1) |
1,93(3) |
F(1)Sb(1)C(11) |
85,3(16) |
|
Sb(1)–C(11) |
2,08(5) |
F(1)Sb(1)C(3) |
88,4(12) |
|
Sb(1)–C(3) |
2,09(2) |
F(1)Sb(1)C(21) |
92,9(13) |
|
Sb(1)–O(21) |
2,07(4) |
F(1)Sb(1)F(2) |
179,1(8) |
|
Sb(1)–F(2) |
1,99(3) |
C(11)Sb(1)C(3) |
116,7(14) |
|
Sb(2)–F(3) |
1,99(3) |
C(21)Sb(1)C(11) |
122,2(14) |
|
Sb(2)–F(4) |
1,93(3) |
C(21)Sb(1)C(3) |
121,0(12) |
|
Sb(2)–C(51) |
2,04(3) |
F(2)Sb(1)C(11) |
94,4(16) |
|
Sb(2)–C(61) |
2,18(4) |
F(2)Sb(1)C(3) |
91,0(12) |
|
Sb(2)–C(41) |
2,09(5) |
F(2)Sb(1)C(21) |
88,8(17) |
|
Cl(6)–C(65) |
1,62(6) |
F(3)Sb(2)C(51) |
88,8(17) |
|
Cl(4)–C(45) |
1,57(4) |
F(3)Sb(2)C(61) |
82,0(15) |
Обсуждение результатов
Известно несколько эффективных способов получения соединений типа Ar3SbХ2, среди которых следует выделить реакции замещения атомов галогена на иные группы. Это прежде всего реакции замещения с участием дигалогенидов триарилсурьмы с натриевыми, калиевыми или се- ребряными солями кислот. Данный метод синтеза является одностадийным и характеризуется мягкими условиями протекания реакций, высоким выходом и чистотой целевого продукта.
Синтез дифторида трис (2-метокси-5-хлорфенил)сурьмы осуществлен по реакции обмена между дибромидом трис (2-метокси-5-хлорфенил)сурьмы и фторидом натрия в водно-ацетоновом растворе при комнатной температуре. Последующая перекристаллизация твердого остатка из смеси ацетонитрил–октан позволила выделить кристаллы, пригодные для РСА.
[(2-MeO)(5-Cl)C 6 H 5 ] 3 SbBr 2 + 2NaF → [(2-MeO)(5-Cl)C 6 H 5 ] 3 SbF 2 + 2NaBr
Соединение 1 представляет собой кристаллы жёлто-коричневого цвета с четкой температурой плавления, хорошо растворимые в ароматических углеводородах и полярных растворителях. Строение комплекса подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектре соединения 1 наблюдаются характеристические полосы колебаний [66, 67] при ∼ 450 см–1 (Sb–C), 1255 см–1 (О–C), 1480 см–1 (Ar), 2843 см–1 (H–C Alk ), 3076 см–1 (H–C Ar ) .
По данным РСА, атом сурьмы в молекуле соединения 1 имеет мало искаженную тригональ-но-бипирамидальную координацию с аксиально расположенными атомами галогена (рис. 1).
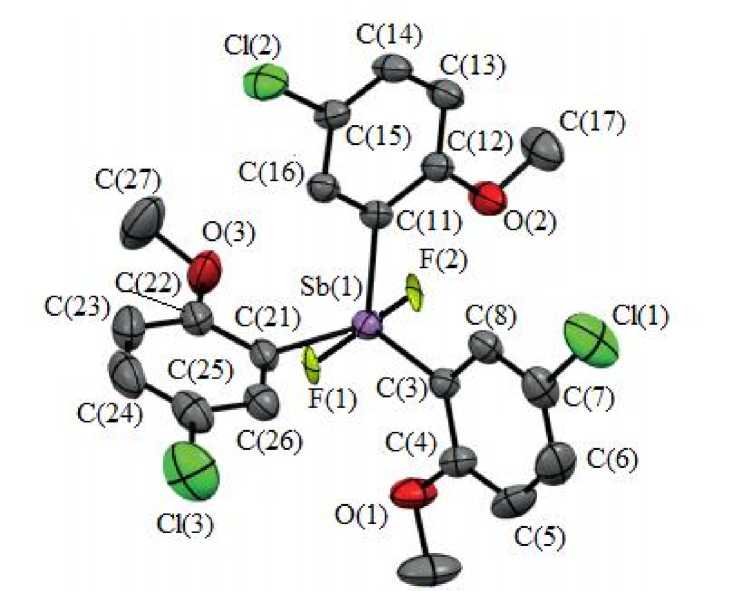
С(9)
Рис. 1. Общий вид молекулы дифторида трис (2-метокси-5-хлорфенил)сурьмы (атомы водорода не показаны)
Длины связей Sb–C равны 2,09(4), 2,08(5) и 2,06(4) Å, а валентные углы CSbC составляют 116,99(2), 122,05(2), 120,86(1)°. Значения длин связей Sb–F равны 1,995(3) и 1,936 (3) Å. Атомы кислорода метоксигрупп координированы на атом металла [внутримолекулярные расстояния Sb∙∙∙OМе составляют 3,25(5); 3,04(3) и 3,11(5) Å]. Аксиальный угол FSbF равен 179,13(9)°. Данные контакты структурируют молекулы соединения 1 в кристалле в слои, расположенные перпендикулярно кристаллографической оси b (рис. 2).
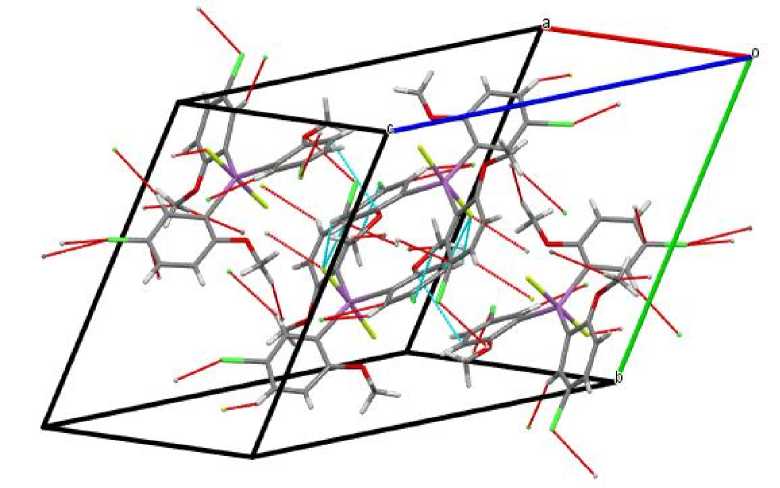
Рис. 2. Упаковка ионов комплекса 1 в кристалле (показан только один слой)
Выводы
Таким образом, по реакции ионного обмена фторида натрия с дибромидом трис (2-метокси-5-хлорфенил)сурьмы получен и структурно охарактеризован дифторид трис (2-метокси-5-хлорфенил)сурьмы. Соединение 1 имеет мало искаженную тригонально-бипирамидальную координацию с аксиально расположенными атомами фтора.
Выражаю благодарность профессору В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Синтез и строение дифторида трис(2-метокси-5-хлорфенил)сурьмы
- Cambridge Crystallografic Datebase. Release 2020. Cambridge.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Deriva-tives of Analogues of Demethylcantharimide / G.-C. Wang, J. Xiao, L. Yu et al. // J. Organomet. Chem. – 2004. – V. 689, № 9. – P. 1631–1638. DOI: 10.1016/j.jorganchem.2004.02.015.
- Синтез и строение цианамида тетрафенилсурьмы / И.В. Егорова, В.В. Жидков, И.П. Гри-нишак и др. // Журн. общ. химии. – 2014. – Т. 84, № 7. – С. 1176–1178.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Organoantimony Aryl-hydroxamates / G.-C. Wang, Y.-N. Lu, J. Xiao et al. // J. Organomet. Chem. – 2005. – V. 690, № 1. – P. 151–156. DOI: 10.1016/j.jorganchem.2004.09.002.
- Spectroscopic and Crystal Structure Data of the Alkali-, Thallium (I) and Onic-salts of Dime-thyl-N-trichloracetylamidophosphate / V.A. Trush, K.E. Gubina, V.M. Amirkhanov et al. // Polyhedron. – 2005. – V. 24, № 9. – P. 1007–1014. DOI: 10.1016/j.poly.2005.01.023.
- Structure and Dynamic Behavior of Neutral Hexacoordinate Antimony Compounds with Intra-molecular Coordination / H. Yamamichi, S. Matsukawa, S. Kojima et al. // Heteroat. Chem. – 2011. – V. 22, № 3–4. – P. 553–561. DOI: 10.1002/hc.20721.
- Synthesis, Characterization and Structure of Some Arylantimony Ferrocenylacrylates / J.-S. Li, R.-C. Liu, X.-B. Chi et al. // Inorg. Chim. Acta. – 2004. – V. 357, № 7. – P. 2176–2180. DOI: 10.1016/j.ica.2003.12.012.
- Синтез, структурное и MAS ЯМР (13С, 15N) спектральное исследование комплексов тетрафенилсурьмы с N,N-диалкилдитиокарбаматными лигандами: проявление канформационной изо-мерии / А.В. Иванов, А.П. Пакусина, М.А. Иванов и др. // Докл. акад. наук СССР. – 2005. – Т. 401, № 5. – С. 643–647.
- Establishing the Coordination Chemistry of Antimony(V) Cations: Systematic Assessment of Ph4Sb(OTf) and Ph3Sb(OTf)2 as Lewis Acceptors / A.P.M. Robertson, S.S. Chitnis, H.A. Jenkins et al. // Chem. – Eur. J. – 2015. – V. 21, № 21. – P. 7902–7913. DOI:10.1002/chem.201406469.
- Influence of the Catalyst Structure in the Cycloaddition of Isocyanates to Oxiranes Promoted by Tetraarylstibonium Cations / M. Yang, N. Pati, G. Belanger-Chabot et al. // Dalton Trans. – 2018. – V. 47. – P. 11843–11850. DOI:10.1039/C8DT00702K.
- Tetraphenylantimony(V) 2-Isonitroso-2-(4-methylthiazolyl-2)acetamide: Synthesis, Crystal Structure, and Molecular Structure / K.V. Domasevich, V.V. Skopenko, R. Kempe et al. // Russ. J. Inorg. Chem. – 1998. – V. 43, № 2. – P. 192–195.
- Шарутин, В.В. Синтез и строение сольвата 1,2-дифенилэтандиондиоксимата бис(тетрафенилсурьмы) с толуолом Ph4SbONC(Ph)С(Ph)ONSbPh4 · 2PhCH3и 1,2-дифенил(2-окси)этаноноксимататетрафенилсурьмы Ph4SbONC(Ph)CH(Ph)OH / В.В. Шарутин, О.В. Молоко-ва, О.К. Шарутина //Журн. неорг. химии. – 2013. – Т. 58, № 4. – С. 460–467. DOI:10.7868/S0044457X13040181.
- Syntheses, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Heterocyclic (S, N) Ligand / C. Ma, Q. Zhang, J. Sun et al. // J. Organomet. Chem. – 2006. – V. 691, № 11. – P. 2567–2574. DOI: 10.1016/j.jorganchem.2006.01.049.
- Synthesis of Two Tetraphenylantimony Complexes of Pyridine-N-oxides; Crystal Structure of Tetraphenylantimony (2-Mercaptopyridine-N-oxide) / G.M. Arvanitis, M.E. Berardini, T.B. Acton et al. // Phosphorus, Sulfur Silicon, Relat. Elem. – 1993. – V. 82, № 1–4. – P. 127–135. DOI: 10.1080/10426509308047416.
- Ortho-metallation of a Phenyl Ring with Antimony(V) / N. Dinsdale, J.C. Jeffrey, R.J. Kilby et al. // Inorg. Chim. Acta. – 2007. – V. 360, № 1. – P. 418–420. DOI: 10.1016/j.ica.2006.07.091.
- Perrin, C.L. Symmetry of Metal Chelates / C.L. Perrin, Y.-J. Kim // Inorg. Chem. – 2000. – V. 39, № 17. – P. 3902–3910. DOI:10.1021/ic000382+.
- Pan, B. [Sb(C6F5)4][B(C6F5)4]: An Air Stable, Lewis Acidic Stibonium Salt That Activates Strong Element-Fluorine Bonds / B. Pan, F.P. Gabbai // J. Am. Chem. Soc. – 2014. – V. 136, № 27. – P. 9564–9567. DOI:10.1021/ja505214m.
- Шарутин, В.В. Синтез и строение пропиолатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. – 2014. – Т. 40, № 2. – С. 108–112. DOI: 10.7868/S0132344X14020108.
- Domasevitch, K.V. Organoantimony(V) Cyanoximates: Synthesis, Spectra and Crystal Struc-tures / K.V. Domasevitch, N.N. Gerasimchuk, A. Mokhir // Inorg. Chem. – 2000. – V. 39, № 6. – P. 1227–1237. DOI: 10.1021/ic9906048.
- Шарутин, В.В. Синтез и строение ароксидов тетрафенисурьмы Ph4SbOAr (Ar = C6H4C6H7, C6H2(Br2-2,6)(трет-Bu-4), C6H3(NO2)2-2,4, C6H2(Br2-2,6)(NO2-4)) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорг. химии. – 2017. – Т. 62, № 3. – С. 290–295. DOI: 10.7868/S0044457X17030151.
- Шарутин, В.В. Новый способ получения ароксидов хлоротрифенилсурьмы Ph3SbCl(OAr) / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. – 2016. – Т. 42, № 1. – С. 34–38. DOI: 10.7868/S0132344X15120075.
- Dihydroxybenzoic Acids as Polydentate Ligands in Phenylantimony (V) Complexes / V.V. Sharutin, O.K. Sharutina, Y.O. Gubanova et al. // Inorg. Chim. Acta. – 2019. – V. 494. – P. 211–215. DOI: 10.1016/j.ica.2019.05.029.
- Bone, S.P. The Crystal Structures of Tetraphenylantimony Acetate and Its / S.P. Bone, D.B. Sowerby // Phosphorus, Sulfur Silicon, Relat. Elem. – 1989. – V. 45, № 1–2. – P. 23–29. DOI:10.1080/10426508908046072.
- Синтез и строение ниацината тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, Т.П. Платонова и др. // Журн. общ. химии. – 2004. – Т. 74, № 2. – С. 234–237.
- Synthesis, Characterizations and Crystal Structures of New Organoantimony(V) Complexes with Various Isomers of Fluoromethylbenzoate Ligands / H.-D. Yin, L.-Y. Wen, J.-C. Cui et al. // Polyhedron. – 2009. – V. 28, № 14. – P. 2919–2926. DOI: 10.1016/j.poly.2009.06.065.
- Synthesis, Characterization and Crystal Structures of Tri- and Tetraphenylantimony(V) Com-pounds Containing Arylcarbonyloxy Moiety / L. Quan, H.-D. Yin, J.-C. Cui et al. // J. Organomet. Chem. – 2009. – V. 694, № 23. – P. 3708–3717. DOI: 10.1016/j.jorganchem.2009.07.040.
- New Organoantimony Complexes with the Isomers of Chlorophenylacetic Acid: Syntheses, Characterizations and Crystal Structures of 1D Polymeric Chain, 2D Network Structure and 3D Frame-work / L.-Y. Wen, H.-D. Yin, W.-K. Li et al. // Inorg. Chim. Acta. – 2010. – V. 363, № 4. – P. 676–684. DOI: 10.1016/j.ica.2009.11.022.
- Synthesis, Characterization and in vitro Antitumor Activity of Some Arylantimony Ferrocene-carboxylates and Crystal Structures of C5H5FeC5H4CO2SbPh4 and (C5H5FeC5H4CO2)2Sb(4‐CH3C6H4)3 / R.-C. Liu, Y.-Q. Ma, L. Yu et al. // Appl. Organomet. Chem. – 2003. – V. 17, № 9. – P. 662–668. DOI:10.1002/aoc.491.
- Synthesis and in vitro Antitumor Activity of Some Tetraphenylantimony Derivatives of exo-7-Oxa-bicyclo[2,2,1]heptane(ene)-3-arylamide-2-acid / J.-S. Li, Y.-Q. Ma, J.-R. Cui et al. //Appl. Orga-nomet. Chem. – 2001. – V. 15, № 7. – P. 639–645. DOI: 10.1002/aoc.200.
- Synthesis and Crystal Structure of Dinuclear Tetraphenylantimony Carboxylate Derivatives Based on Different Coordination Modes / L. Quan, H. Yin, J. Cui, et al. // J. Organomet. Chem. – 2009. – V. 694, № 23. – P. 3683–3687. DOI: 10.1016/j.jorganchem.2009.07.041.
- Millington, P.M. Phenylantimony(V) Oxalates: Isolation and Crystal Structures of [SbPh4][SbPh2(ox)2], [SbPh3(OMe)]2ox and (SbPh4)2ox / P.M. Millington, D.B. Sowerby // J. Chem. Soc., Dalton Trans. – 1992. – V. 7. – P. 1199–1204. DOI: 10.1039/DT9920001199.
- Термохимические свойства Ph4Sb(OC(O)C10H15) и Ph3Sb(OC(O)C10H15)2 / Д.В. Лякаев, А.В. Маркина, Е.В. Хабарова и др. // Журн. физ. химии. – 2018. – Т. 92, № 9. – С. 1384–1389. DOI 10.1134/S0044453718090170.
- Синтез и строение 3,3,3-трифторпропанатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов и др. // Журн. неорг. химии. – 2019. – Т.64, № 10. – С. 1051–1056. DOI:10.1134/S0044457X19100131.
- Фторсодержащие карбоксилаты тетраарилсурьмы. Синтез и строение / В.В. Шарутин, О.К. Шарутина, А. Н. Ефремов и др. // Журн. неорг. химии. – 2020. – Т. 65, № 4. – С. 482–486. DOI: 10.31857/S0044457X20040170.
- Синтез фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. общ. химии. – 2002. – Т. 72, № 3. – С. 419–420.
- Синтез и строение пентафторбензоата тетрафенилсурьмы и нитрата тетра-п-толилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Коорд. химия. – 2001. – Т. 27, № 6. – С. 423–427.
- Синтез и строение фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь, А.П. Пакусина и др. // Коорд. химия. – 2002. – Т. 28, № 5. – С. 356–363.
- Синтез и строение феноксиацетата и этилмалоната тетрафенилсурьмы Ph4SbOC(O)R [R = CH2OPh, CH2C(O)OC2H5] / В.В. Шарутин, А.П. Пакусина, О.П. Задачина и др. // Коорд. хи-мия. – 2004. – Т. 30, № 6. – С. 426–431.
- Синтез и строение 1-адамантанкарбоксилата тетрафенилсурьмы и бис(1-адамантанкарбоксилата) трифенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. – 2009. – Т. 79, № 10. – С. 1636–1643.
- Кочешков, К.А. Методы элементоорганической химии. Сурьма, висмут / К.А. Кочешков, А.П. Сколдинов, Н.Н. Землянский. – М.: Наука, 1976. – 483 с.
- Синтез и строение дихлорида и дибромида трис(4- этилфенил)сурьмы (4-EtC6H4)3SbCl2 и (4-EtC6H4)3SbBr2 / П.В. Андреев, В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Вестник ЮУр-ГУ. Серия «Химия». – 2017. – Т. 9, № 3. – С. 59–64. DOI: 10.14529/chem170307.
- Mahalakshmi, H. X-ray Structures of Dichlorotri(pentafluorophenyl)antimony(V) and Dibromo-tri(pentafluorophenyl)antimony (V) / H. Mahalakshmi, V.K. Jain, E.R.T. Tiekink // Main Group Met. Chem. – 2001. – V. 24. – P. 391. DOI: 10.1515/MGMC.2001.24.6.391.
- Qiao, Y. Trans-tris(4-bromophenyl)dichloridoantimony(V) / Y. Qiao, J. Jiang, J. Cui // Act Crystallogr. Sect. E: Struct. Rep. Online. – 2012. – V. 68. – m1552. DOI: 10.1107/S160053681204809X.
- Yang, M. Synthesis and Properties of Triarylhalostibonium Cations / M. Yang, F.P. Gabbai // Inorg. Chem. – 2017. – V. 56. – P. 8644-8650. DOI: 10.1021/acs.inorgchem.7b00293.
- Чехлов, A.Н. Кристаллическая структура дифтортрифенилсурьмы с необычными внутримолекулярными водородными связями С-НF / A.Н. Чехлов // Докл. АН СССР. – 1993. – Т. 328, № 2. – С. 205–208.
- Substituent-dependent Reactivity of Triarylantimony(III) Toward I2: Isolation of [R3SbI]+ Salt / V.V. Sharutin, O.K. Sharutina, S.A. Adonin, A.S. Novikov // New J. Chem. – 2020. – V. 44. – P. 14339–14342. DOI: 10.1039/D0NJ02774J.
- Begley, M.J. Structures of Triphenylantimony(V) Dibromide and Dichloride / M.J. Begley, D.B. Sowerby // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. – 1993. – V. 49. – P. 1044-1046. DOI: 10.1107/S0108270192011958.
- Реакции транс-[OsO2Cl2L2] (L = PPh3, AsPh3, SbPh3) с уксусной кислотой / А.Н. Беляев, А.В. Еремин, С.А. Симонова и др. // Журнал прикладной химии. – 2002. – Т. 75, № 12. – С. 1947– 1950.
- MacDonald, D.J. A New Polymorph of Dichloridotriphenylantimony / D.J. MacDonald, M.C. Jennings, K.E. Preuss // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. – 2010. – V. 66. – m137-m140. DOI: 10.1107/S010827011001437X.
- Synthesis and Structure of Tri-m-tolylantimony Dichloride / V.V. Sharutin, O.K. Sharutina, I.I. Pavlushkina et al. // Russ. J. Gen. Chem. – 2000. – V. 70, № 8. – P. 1227-1228.
- Синтез и строение дифторида, дихлорида и дибензоата трис(4-N,N-диметил-аминофенил)сурьмы(V) / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 2008. -Т. 78, № 12. - С. 1999-2006.
- Novel Tetranuclear Triarylantimony(V) Complexes with (±)-Mandelic Acid Ligands: Synthesis, Characterization, in vitro Cytotoxicity and DNA Binding Properties / J. Jiang, H. Yin, F. Wang et al. // Dalton Trans. – 2013. – V. 42. – P. 8563-8566. DOI: 10.1039/C3DT50221J.
- Webster, M. Dibromotriphenylantimony(V), a Second Polymorph / M. Webster // Acta Crystal-logr., Sect. C: Cryst. Struct. Commun. – 1998. – V. 54. – P. 570-572. DOI: 10.1107/S0108270197018040.
- Solid-state Structures of Triarylantimony Dihalides; the Isolation of Some Mixed-halide Species and Crystal Structures of Ph3SbI2 and [Ph4Sb]I3 / N. Bricklebank, S.M. Godfrey, H.P. Lane et al. // J. Chem. Soc. Dalton Trans. – 1994. – P. 1759–1763. DOI: 10.1039/DT9940001759.
- Baker, L.-J. Structural Investigations of the Organoantimony(V) Halides Ph4SbX and Ph3SbX2 (X = Cl, Br or I) in the Solid State and in Solution / L.-J. Baker, C.E.F. Rickard, M.J. Taylor // J. Chem. Soc. Dalton Trans. – 1995. – P. 2895–2899. DOI: 10.1039/DT9950002895.
- Синтез и строение дибромида три(пара-толил)сурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Коорд. химия. – 2002. – Т. 28, № 12. – С. 887–889.
- Diverse Structures and Remarkable Oxidizing Ability of Triarylbismuthane Oxides. Compara-tive Study on the Structure and Reactivity of a Series of Triarylpnictogen Oxides / Y. Matano, H. Nomu-ra, T. Hisanaga et al. // Organometallics. - 2004. - V. 23, № 23. - P. 5471-5480.
- Синтез и особенности строения бис(2-нитробензоата) трис(5-бром-2-метоксифенил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Координационная химия. – 2011. – Т. 37, № 10. – С. 782–785.
- 2-Метокси-5-бромфенильные соединения сурьмы. Синтез и строение / В. В. Шарутин, В.С. Сенчурин, О. К. Шарутина и др. // Журнал общей химии. – 2011. – Т. 81, № 10. – С. 1649–1652.
- Matano, Y. Synthesis and Structural Comparison of Triaryl(sulfonylimino)pnictoranes / Y. Ma-tano, H. Nomura, H. Suzuki // Inorg. Chem. – 2002. – V. 41, № 7. – P. 1940–1948. DOI: 10.1021/ic0110575.
- Синтез и особенности строения бис(циклопропанкарбоксилата) трис(5-бром-2-метоксифенил)сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Журнал общей химии. – 2012. – Т. 82, № 10. – С. 1646–1649.
- Шарутин, В.В. Синтез и особенности строения дикарбоксилатов трис(5-бром,2-метоксифенил)сурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журнал неорганической химии. – 2014. – Т. 59, № 4. – С. 481. DOI 10.7868/S0044457X14040217.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Display-ing Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. – 2009. – V. 42. – P. 339–341. DOI: 10.1107/S0021889808042726.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. – М.: МГУ, 2012. – 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин и др. – СПб.: СПбГЛТА, 2007. – 54 с.


