Синтез и строение гидрата 1-нафталинсульфоната тетрафенилсурьмы
Автор: Шарутина Ольга Константиновна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.14, 2022 года.
Бесплатный доступ
Взаимодействием эквимолярных количеств пентафенилсурьмы и 1-нафталинсульфоновой кислоты в бензоле получен и структурно охарактеризован гидрат 1-нафталинсульфоната тетрафенилсурьмы Ph4SbOSO2Naft-1∙H2O (1). По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо К α-излучение, λ = 0,71073 Å, графитовый монохроматор), кристалла 1 [C34H29O4SSb, M 655,38; сингония триклинная, группа симметрии Р -1; параметры ячейки: a = 9,456(3), b = 12,541(4), c = 13,980(6) Å; α = 74,151(15) град., β = 79,979(19) град., γ = 68,178(12) град.; V = 1475,7(9) Å3; размер кристалла 0,5×0,5×0,23 мм; интервалы индексов отражений -12 ≤ h ≤ 12, -16 ≤ k ≤ 16, -18 ≤ l ≤ 18; всего отражений 20654; независимых отражений 5934; Rint 0,0385; GOOF 1,202; R 1 = 0,1215, wR 2 = 0,3556; остаточная электронная плотность 1,98/-2,53 e/Å3] атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами углерода и кислорода в аксиальных положениях (угол СSbO 172,3(6)°, расстояние Sb∙∙∙O составляет 2,84(1) Å). Длины связей Sb-C и S-O в 1 изменяются в узком интервале значений (2,000(13)-2,132(13) Å и 1,441(4)-1,456(4) Å). Структурная организация в кристалле 1 обусловлена слабыми межмолекулярными контактами типа S=О···Н-C 2,50-2,71 Å. Полные таблицы координат атомов, длин связей и валентных углов для структуры 1 депонированы в Кембриджском банке структурных данных (№ 2115624; deposit@ccdc.cam.ac.uk; https://www.ccdc.cam.ac.uk).
1-нафталинсульфоновая кислота, пентафенилсурьма, 1-нафталинсульфонат тетрафенилсурьмы, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147236620
IDR: 147236620 | УДК: 546.865+547.47+548.312.5 | DOI: 10.14529/chem220103
Текст научной статьи Синтез и строение гидрата 1-нафталинсульфоната тетрафенилсурьмы
Методы синтеза и особенности строения арильных соединений сурьмы систематизированы и описаны в обзоре [1] и монографии [2]. Из органических производных сурьмы(V), безусловно, наиболее распространены и разнообразны соединения общей формулы Ar 3 SbX 2 . Соединения Ar4SbX не столь многочисленны, но со структурной точки зрения интересны тем, что характер связывания сурьмы с группой Х может сильно различаться. Так, в гидрокситетрафенилсурьме Ph 4 SbOH длина связи Sb - O равна 2,048 Å [3], в метокситетрафенилсурьме Ph 4 SbOСH 3 - 2,061 Å [4], в бензилокситетрафенилсурьме Ph 4 SbOСH 2 Ph - 2,092 Å [ 5 ], что близко к сумме ковалентных радиусов атомов-партнеров связи. В других соединениях подобного состава связь Sb - X характеризуется как координационная, поскольку указанное расстояние существенно превышает сумму ковалентных радиусов атомов, например, в нитрате тетра( пара -толил)сурьмы p -Tol 4 SbNO 3 оно составляет 2,680 Å [6], в бензоилцианамиде тетрафенилсурьмы Ph 4 SbN(CN)C(O)Ph расстояние Sb - N равно 2,67 Å [7]. И наконец, существуют ионные соединения, состоящие из катионов [Ar4Sb]+ и анионов X - , в которых отрицательный заряд делокализован (например, кислый сульфат тетрафенилсурьмы, хлорат тетрафенилсурьмы, перхлорат тетрафенилсурьмы и др. [2]).
Аренсульфоновые кислоты относятся к сильным кислотам (по кислотности сравнимы с серной кислотой). Неплоское тетраэдрическое строение сульфогруппы исключает π , π -сопряжение с бензольным ядром. Взаимодействие является индукционным и приводит к тому, что электрофильная сульфогруппа вызывает смещение электронов ароматического ядра. Наличие трех атомов кислорода обеспечивает эффективную делокализацию заряда в группе SO 3 и стабилизацию аниона, поэтому связь Sb - О в аренсульфонатах тетраарилсурьмы Ar 4 SbOSO 2 R имеет ионный характер. Расположение катиона и аниона в кристаллической ячейке, а также расстояние Sb ⋅⋅⋅ O (при наличии координации аниона и катиона) определяется влиянием факторов, обеспечивающих минимум энергии кристаллической решетки в целом [8 - 18].
Настоящая работа посвящена синтезу и установлению строения гидрата 1-нафталин-сульфоната тетрафенилсурьмы.
Экспериментальная часть
Элементный анализ на C и H выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108.
Температура плавления измерена на синхронном термоанализаторе Netzsch 449C Jupiter.
ИК-спектр соединения 1 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-lS в таблетке KBr в области 4000 - 400 см - 1.
Рентгеноструктурный анализ (РСА) кристалла 1 проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [19]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [20] OLEX2 [21]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Кристаллографические данные и результаты уточнения структур приведены в табл. 1, геометрические характеристики координационного полиэдра атома сурьмы – в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2115624; ; .
Синтез гидрата 1-нафталинсульфоната тетрафенилсурьмы (1) . Смесь 0,253 г (0,5 ммоль) пентафенилсурьмы и 0,104 г (0,5 ммоль) 1-нафталинсульфоновой кислоты в 15 мл бензола нагревали до образования прозрачного раствора, добавляли 2 мл октана и выдерживали 24 ч при комнатной температуре. Получили 0,27 г (82 %) неокрашенных кристаллов 1 с т. разл. 115 °С.
ИК-спектр, ( ν , см - 1): 3559, 3489, 3053, 1628, 1437, 1335, 1265, 1240, 1200, 1180, 1159, 1146, 1070, 1043, 1030, 1022, 997, 970, 922, 826, 802, 775, 745, 694, 685, 611, 565, 519, 461, 447, 420.
Найдено, %: C 61,09; H 4,1. Для C 34 H 29 O 4 SSb. Вычислено, %: C 61,25; H 4,42.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
Соединение 1 |
|
Формула |
C 34 H 29 O 4 SSb |
|
М |
655,38 |
|
Т , К |
293 |
|
Сингония |
Триклинная |
|
Пр. группа |
Р– 1 |
|
a , Å |
9,456(3) |
|
b, Å |
12,541(4) |
|
c, Å |
13,980(6) |
|
α , град. |
74,151(15) |
|
β, град. |
79,979(19) |
|
γ , град. |
68,178(12) |
|
V , Å3 |
1475,7(9) |
|
Z |
2 |
|
ρ (выч.), г/см3 |
1,475 |
|
µ , мм–1 |
1,042 |
|
F (000) |
664,0 |
|
Размер кристалла, мм |
0,5 × 0,5 × 0,23 |
|
Область сбора данных по 2 θ , град. |
6,3 - 58,52 |
|
Интервалы индексов отражений |
- 12 ≤ h ≤ 12, - 16 ≤ k ≤ 16, - 18 ≤ l ≤ 18 |
|
Измерено отражений |
20654 |
|
Независимых отражений |
5934 |
|
R int |
0,0385 |
|
Переменных уточнения |
364 |
|
GOOF |
1,203 |
|
R -факторы по F2 > 2 σ (F2) |
R 1 = 0,1215, wR 2 = 0,3556 |
|
R-факторы по всем oтражениям |
R 1 = 0,1383, wR 2 = 0,3729 |
|
Остаточная электронная плотность (min/max), e/A3 |
1,98/ - 2,53 |
Таблица 2
Длины связей и валентные углы в соединении 1
|
Связь |
d , Å |
Угол |
co, град. |
|
Sb(1) - С(1) |
2,11(2) |
O(1)Sb(1)С(1) |
172,3(8) |
|
Sb(1) - C(11) |
2,100(13) |
C(1)Sb(1)C(11) |
101,1(6) |
|
8Ь(1) - С(31) |
2,106(12) |
C(31)Sb(1)C(11) |
119,0(5) |
|
8Ь(1) - С(21) |
2,132(13) |
C(11)Sb(1)C(21) |
116,6(6) |
|
Sb(1)∙∙∙О(2) |
2,839(8) |
C(31)Sb(1)С(1) |
103,5(6) |
|
S(1) - O(1) |
1,456(11) |
C(31)Sb(1)С(21) |
112,1(5) |
|
S(1) - O(2) |
1,441(11) |
О(1)S(1)С(41) |
105,6(7) |
|
S(1) - O(3) |
1,443(10) |
О(2)S(1)O(1) |
112,3(8) |
|
S(1) — C(41) |
1,782(16) |
О(2)S(1)O(3) |
113,2(7) |
Обсуждение результатов
Найдено, что продуктом реакции пентафенилсурьмы с 1-нафталинсульфоновой кислотой в бензоле является 1-нафталинсульфонат тетрафенилсурьмы, который выделен из реакции в форме гидрата Ph 4 SbOSO 2 C 10 H 8 ∙ H 2 O ( 1 ) с выходом 82 %:
Ph 5 Sb + HOSO 2 C 10 H ^ Ph 4 SbOSO 2 C io H 8 + PhH
Бесцветные прозрачные кристаллы, устойчивые к действию влаги и кислорода воздуха, растворимые в ацетоне, ароматических углеводородах, хлороформе и диоксане, выделялись из реакционной смеси в течение 24 ч.
По данным РСА, в 1 атомы сурьмы имеют сильно искаженную тригонально-бипирамидальную координацию за счет координации атома кислорода (рис. 1). Расстояние Sb(1)∙∙∙О(2) (2,84(1) Å) значительно больше суммы ковалентных радиусов атомов кислорода и сурьмы (2,14 Å [22]), но меньше суммы соответствующих ван-дер-ваальсовых радиусов (3,7 Å [23]).
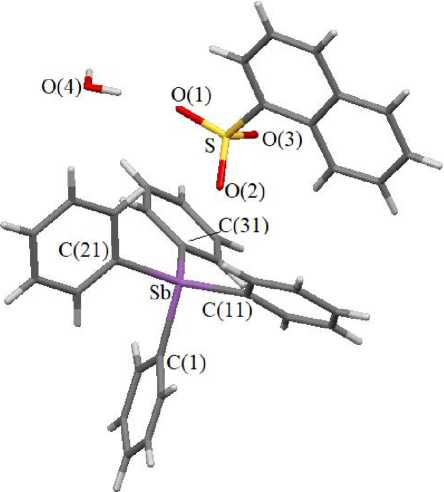
Рис. 1. Строение соединения 1
Искажение тригонально-бипирамидального полиэдра атома сурьмы в 1 подтверждается значительным отклонением валентных углов от теоретических значений. Так, все углы CSbC в экваториальной плоскости меньше 120° (сумма экваториальных углов составляет 347,4(5)°). Атом сурьмы выходит из экваториальной плоскости в направлении аксиально расположенного атома углерода на 0,432 Å. В связи с этим валентные углы между аксиальными и экваториальными заместителями существенно отличаются от 90°: значения углов C(1)SbC(11, 21, 31) равны 100,8(7)103,5(6)°, углов O(2)SbC(11, 21, 31) - 71,7(5)-85,1(5)°. Аксиальный угол O(2)SbC(1) равен 172,3(6)°.
Расстояние Sb–C(1) составляет 2,11(2) Å, среднее значение длин экваториальных связей Sb– C(11, 21, 31) - 2,11(1) А. Отношение длины аксиальной связи Sb-C к среднему значению экваториальных связей Sb–C равно 1. Расстояние Sb(1)∙∙∙О(2) (2,84(1) Å) значительно превосходит сумму ковалентных радиусов атомов.
Можно считать, что в кристалле присутствуют тесные ионные пары: катионы [Ph4Sb]+ и координированные нафталинсульфонатные анионы.
Анионы гидратированы молекулами воды, которые являются «мостиковыми» между сульфонатными группами, образуя восьмичленный цикл (6 атомов кислорода и 2 атома серы) (рис. 2). Расстояния между атомами кислорода молекул воды и сульфонатных групп О(4)∙∙∙О(1) и О(4)∙∙∙О(3) составляют 2,82(2) и 2,89(2) Å, что свидетельствует о существовании слабых водородных связей. Аналогичные «димеры» имеют место в кристаллах гидрата бензолсульфоната тетрафенилсурьмы [3]. Кроме того, молекулы воды имеют короткие контакты (О—Н - С) с катионами.
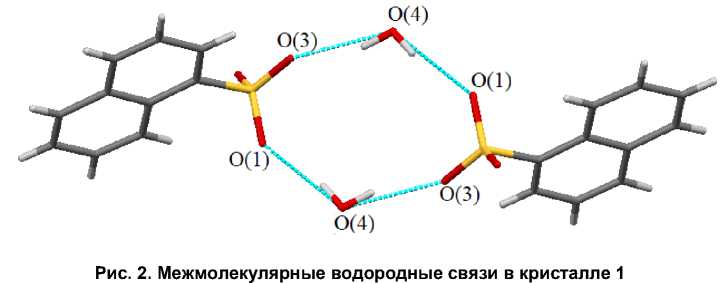
В аренсульфонатных группах расстояния S–O близки: 1,441(11), 1,443(10), 1,456(11) и соответствуют двойной связи S=O (1,43 Å [24]. Длина связи S–C равна 1,782(16) Å) и близка к справочным данным (1,817 Å [24]). Атом серы имеет искаженное тетраэдрическое окружение, о чем свидетельствуют величины валентных углов (105,0(6) - 113,7(7) ° ), которые незначительно отклоняются от 109,5 ° .
Комплекс 1 изоструктурен полученному ранее гидрату 1-нафталинсульфонату тетрафенилвисмута [25].
Выводы
Установлено, что взаимодействие эквимолярных количеств пентафенилсурьмы с 1нафталинсульфоновой кислотой в присутствии влаги воздуха приводит к образованию гидрата 1-нафталинсульфоната тетрафенилсурьмы, в кристалле которого имеются тесные ионные пары. Тетраэдрическая координация атома сурьмы в катионе сильно искажена, и ее можно рассматривать как искаженную тригонально-бипирамидальную, за счет взаимодействия Sb∙∙∙О. Особенностью структуры является наличие межмолекулярных водородных связей с участием молекул воды.
Выражаю признательность профессору В.В. Шарутину за рентгеноструктурный анализ кристалла соединения 1 .
Список литературы Синтез и строение гидрата 1-нафталинсульфоната тетрафенилсурьмы
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / В.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. химия. – 2020. – Т. 46, № 10. – С. 579–648. DOI: 10.31857/S0132344X20100011.
- Шарутина, О.К. Молекулярные структуры органических соединений сурьмы (V) / О.К. Шарутина, В.В. Шарутин. – Челябинск: Издательский центр ЮУрГУ, 2012. – 395 с.
- Beauchamp, A.L. Molecular Structure of Tetraphenylantimony Hydroxide / A.L. Beauchamp, M.J. Bennett, F.A. Cotton // J. Amer. Chem. Soc. - 1969. - V. 91, № 2. - P. 297 – 301. DOI: org/10.1021/ja01030a015.
- Crystal and Molecular Structures of Methoxytetraphenylantimony and Dimethoxytriphenylanti-mony / K. Shen, W.E. McEwen, S.J. La Placa et al. // J. Amer. Chem. Soc. - 1968. - V. 90, № 7. - P. 1718–1723. DOI: org/10.1021/ja01009a009.
- Взаимодействие пентафенилфосфорана с параформом / В.В. Жидков, В.В. Шарутин, В.К. Бельский и др. // Журн. общ. химии. - 1995. - Т. 65, вып. 2. - С. 251–256.
- Синтез и строение пентафторбензоата тетрафенилсурьмы и нитрата тетра-п-толилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Коорд. химия. - 2001. - Т. 27, № 6. - С. 423–427.
- Пономарева, В.В. Бензоилцианамиды органических производных олова(IV) и сурьмы(V) / В.В. Пономарева, К.В. Домасевич, В.В. Скопенко // Журн. неорг. химии. - 1995. - Т. 40, № 11. - С. 1863–1868.
- Ruther, R. Synthesis of Tetraphenylstiboniium Alkyl- and Arylsulfonates. Crysttal Structure of Tetraphenylstibonium Benzenesulfonate Hydrate / R. Ruther, F. Huber, H. Preut // J. Organomet. Chem. - 1985.- V. 295, iss. 1. - P. 21-28. DOI: org/10.1016/0022-328X(85)88068-2.
- Сульфонаты тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Л.П. Панова и др. // Журн. общ. хим. - 1997.- Т. 67, вып. 9. - С. 1531-1535.
- Синтез и строение 4-метилбензолсульфоната тетра-п-толилсурьмы / В.В. Шарутин, О.К. Шарутина, Т.А. Тарасова и др. // Журн. общ. хим.- 1999. - Т. 69, вып. 12. - С. 1979-1981.
- Синтез и строение 2,4-диметилбензолсульфоната тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, Т.А. Тарасова и др. // Журн. общ. хим. - 2000. - Т. 70, вып. 8. - С. 1311-1314.
- Синтез и строение новой кристаллической модификации 4-метилбензолсульфоната тет-рафенилсурьмы / В.В. Шарутин, А.П. Пакусина, В.С. Сенчурин и др. // Коорд. химия. - 2002. - Т. 28, № 8. - С. 577-580.
- Синтез и строение 4-метилбензолсульфоната тетра-n-толилсурьмы / В.В. Шарутин, А.П. Пакусина, И.В. Егорова и др. // Коорд. химия. - 2003. - Т. 29, № 5. - С. 336-340. 14. Синтез и строение органосульфонатов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Коорд. химия. – 2004. – Т. 30, № 1. – С. 15–24.
- Синтез и строение сурьма- и висмуторганических производных 4-сульфофенола и 2,4-дисульфофенола / В.В. Шарутин, И.В. Егорова, А.П. Пакусина и др. // Коорд. химия. - 2007. - Т. 33, № 3. - С. 176-183.
- Шарутин, В.В. Кристаллические модификации бензолсульфоната тетра-пара-толилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журн. неорган. химии. - 2013. - Т. 58, № 11. - С. 1454-1457. DOI: 10.7868/S0044457X13110196.
- Pan, B. [Sb(C6F5)4][B(C6F5)4]: An Air Stable, Lewis Acidic Stibonium Salt that Activates Strong Element-Fluorine Bonds / B. Pan, F.P. Gabbai // J. Am. Chem. Soc. - 2014. - V. 136, № 27. - Р. 9564-9567. DOI: 10.1021/ja505214m.
- Establishing the Coordination Chemistry of Antimony(V) Cations: Systematic Assessment of Ph4Sb(OTf) and Ph3Sb(OTf)2 as Lewis Acceptors / A.P.M. Robertson, S.S. Chitnis, H.A. Jenkins et al. // Chem.-Eur. J. – 2015. – V. 21, № 21. – P. 7902–7912. DOI: org/10.1002/chem.201406469.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. – 2009. – V. 42. – P. 339–341. DOI: 10.1107/S0021889808042726.
- Covalent Radii Revisited / B. Cordero, V. Gómez, A.E. Platero-Prats et al. // Dalton Trans. – 2008. – Iss. 21. – P. 2832–2838. DOI: 10.1039/B801115J.
- Consistent Van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero et al. // J. Phys. Chem. A. – 2009. – Vol. 113, № 19. – P. 5806–5812. DOI: 10.1021/jp8111556.
- Tables of Bond Lengths Determined by X-ray and Neutron Diffraction. Part. 1. Bond Lengths in Organic Compounds / F.H. Allen, O. Kennard, D.G. Watson et al. // J. Chem. Soc. Perkin Trans. II. - 1987. - № 12, pt. 2. - P. S1-S19. DOI: org/10.1039/P298700000S1. 25. The Cambridge Crystallographic Database. Release. 2018. Cambridge. http://www.ccdc.cam.ac.uk.


